Chapitre 2 Chimie Organique
1/67
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
68 Terms
nomme la priorité des groupes fonctionnels
acide, anhydride, ester, halogénure d’acyle, amide, nitrile, aldéhyde, cétone, alcool, thiol, amine
définition d’alcène
squelette issue d’assemblage d’atomes de carbones et d’hydrogènes portant au moins une double liaison C-C (groupe caractéristique).
• Les alcènes répondent à la formule générale CnH2n (même que pour les cycloalcanes).
définition d’alcyne
squelette issue d’assemblage d’atomes de carbones et d’hydrogènes portant au moins une triple liaison C-C (groupe caractéristique).
• Les alcynes répondent à la formule générale CnH2n-2 (même que pour les cycloalcènes)
les propriétés des alcènes et des alcynes se ______?
ressemblent
définition d’alcényle
substituant portant une liaison double.
définition alcynyle
substituant portant une liaison triple
définition alcényle
un hydrocarbure contenant à la fois une double et une triple liaison
définition alcynol
alcyne contenant une fonction hydroxyle
définition anion alcényle
composé correspondant à un alcène terminal déprotoné
alcènes sont caractérisés par quoi?
une liaison pi
une liaison pi est composé de quoi?
une composante pi, une composante sigma
longueur d’une liaison double
environ 1,330 Å
longueur d’une liaison simple
environ 1,54 Å
dans les carbones hybridés sp2, on observe une déviation de l’angle de 109,5 à _____?
120
pourquoi est-ce que les liaisons trans des alcènes sont plus stables?
liaisons trans libère le moins d’énergie, encombrement stérique, moins de chaleur d’hydrogénation
l’exception de la stabilité cis/trans des alcènes
les cycloalcènes cis sont plus stables que cycloalcènes trans, en raison de la tension du cycle
le propène cède plus facilement son _____?
proton terminale
états physiques de alcènes (C2 à C>18)
gazeux: C2, C3, C4
liquide: C5-C7
solide: C18-C>18
qu’est ce qui affecte la densité électronique des alcènes?
caractéristique s
retient les électrons plus près du noyau, donc tire la densité électronique vers la liaison double
ceci est la raison pour laquelle les alcènes ont une polarisation
pourquoi est-ce que la configuration cis a toujours un point de fusion inférieure a son homologue trans?
configuration cis induit une courbure U chez le composé, qui va perturbé l’empilement de ces molécules, donc point de fusion diminue
point d’ébullition en cis seront _____ à trans, pourquoi?
supérieure, car configuration cis est davantage polaire, donc on a besoin de romper les forces de london(intermoléculaires) pour passer de l’état liquide à l’état gazeux.
alcynes sont caractérisés par quoi? (2 choses)
2 liaisons pi, C hybridés en sp
longueur d’une liaison triple
environ 1,203 Å
états physiques des alcynes (C2-C>12)
gaz incolore: C2, C3
liquide: C4-C12
solide: C>12
qu’est ce que explique le contenu énergétique élevée chez les alcynes?
triple liaison caractérisée par concentration de 4 électrins pi dans une espace restreint, donc répulsion à pour conséquence de rendre 2 liaisons pi fragiles ce qui confère aux alcynes un contenu énergétique important
temperature d’ébullition des alcynes est…….?
généralement de 10 à 20 degrées celcius plus haute que leurs homologues alcènes/alcanes
chaleur d’hydrogenation est plus _____ chez alcyne terminale
haute
explique pourquoi les alcynes terminaux sont acides
électronégativité varie selon l’hybridation, électrons dans orbitales s sont plus fortements attirés par un noyau atomique. chaque atome sp est donc plus électronégatif (légerement) que l’atome sp3.
nomme les alcanes, alcynes, et alcènes en ordre croissant de l’acidité relative
alcane, alcènes, alcynes
définition d’un composé aromatique (aromate, arène)
squelette cyclique (molécule/ion) issue d’assemblage d’atomes de carbones & d’hydrogènes à géométrie plane et doté d’un système conjugué (satisfait la règle de Hückel).
-Tout polyène cyclique conjugué est aromatique si le nombre de ses électrons p = 4n + 2, où n est un nombre entier.
propriétés du benzène (5)
est le composé parental des aromates
formule (C6H6)
forme hexagonale symétrique
anormalement inerte à la température ordinaire en raison de son énergie de résonance
particulièrement stable
caractéristiques d’une composée aromatique
Stabilisé par la délocalisation d’électrons pi (résonance).
nombre de ses électrons pi = 4n + 2 où n est un nombre entier
certains benzènes substitués dégagent d’odeurs
définition d’un groupe aryle(Ar):
substituant arène
définition d’un aromate
molécule ou ion cyclique à géométrie plane et doté d’un système conjugué (qui satisfait la règle de Hückel).
-Tout polyène cyclique conjugué est aromatique si le nombre de ses électrons p = 4n + 2, où n est un nombre entier.
définition d’un anti aromate
si soit pi= 4n + 2 n’est pas un chiffre entier ou si le composé est non-planaire
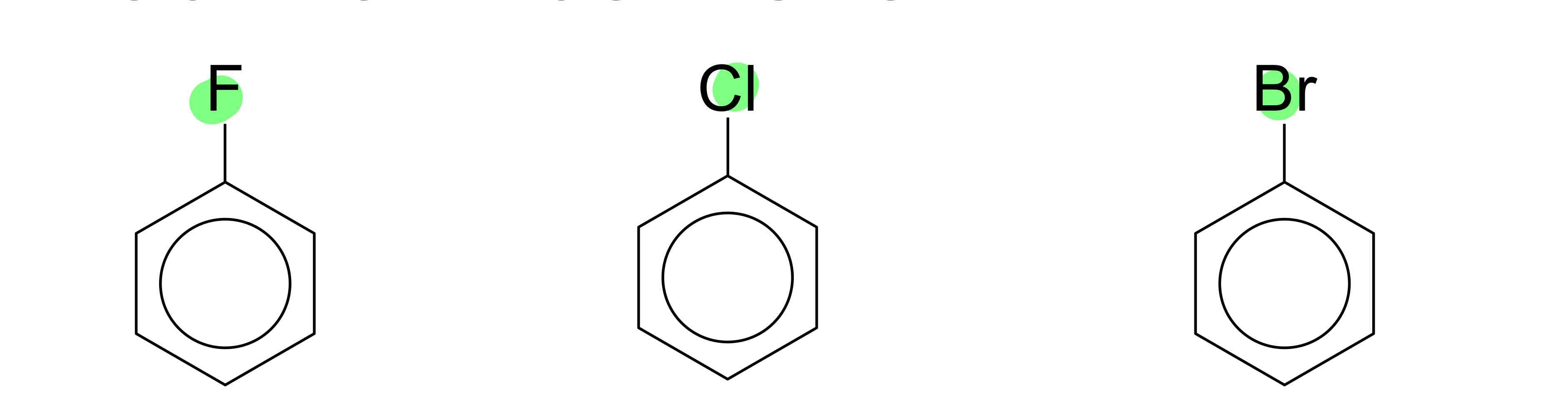
nomme ces composées
fluorobenzène, chlorobenzène, bromobenzène
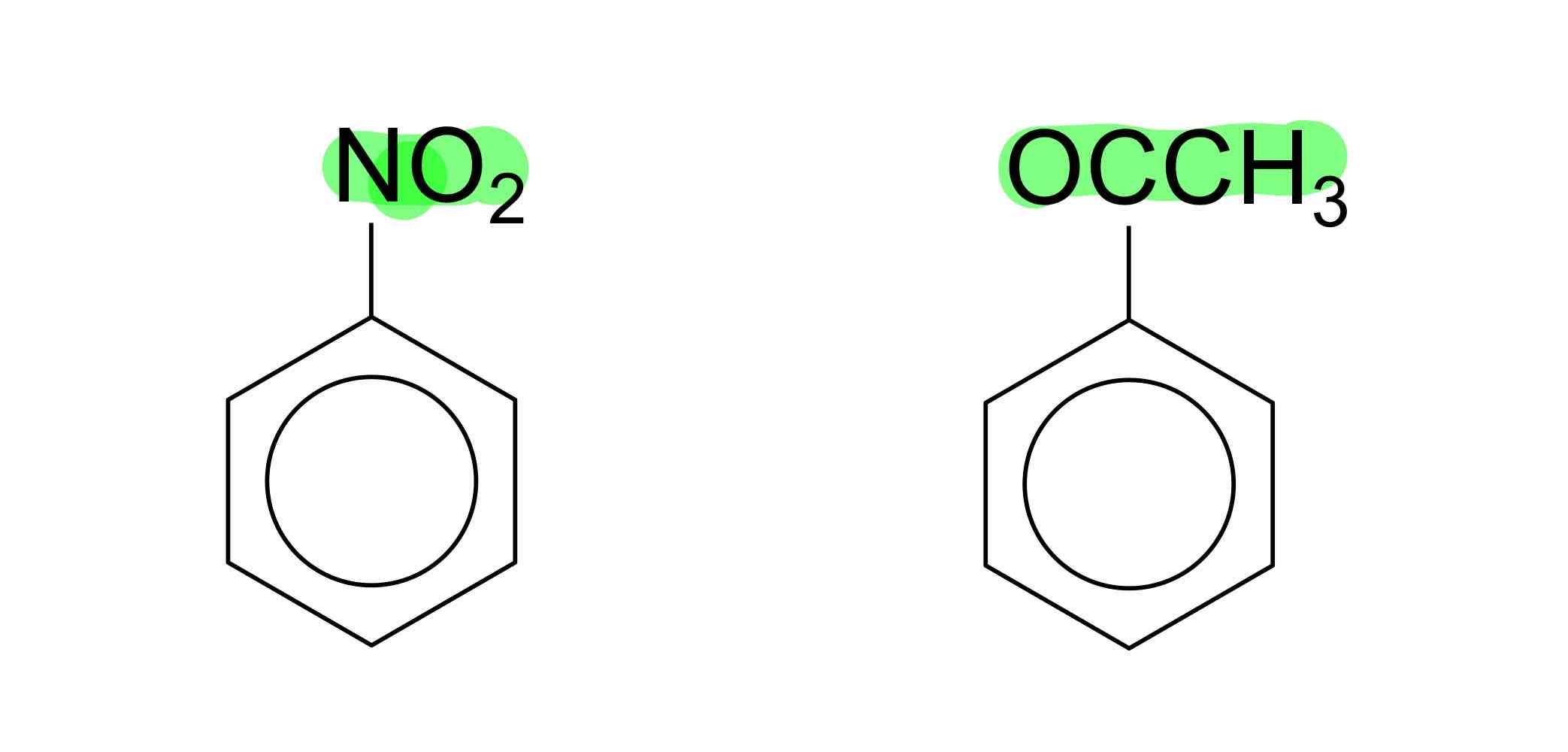
nomme ces composées
nitrobenzène, métoxybenzène
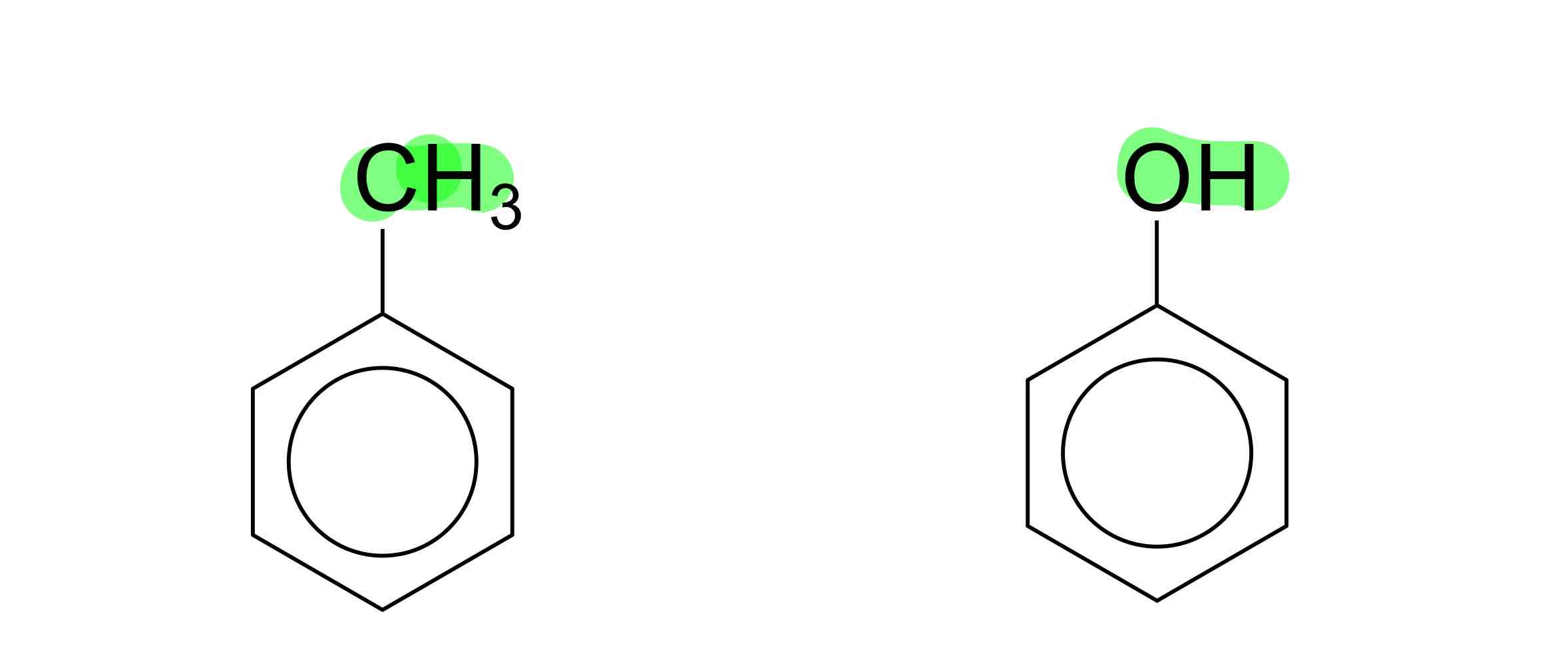
nomme ces composées
méthylbenzène, benzénol
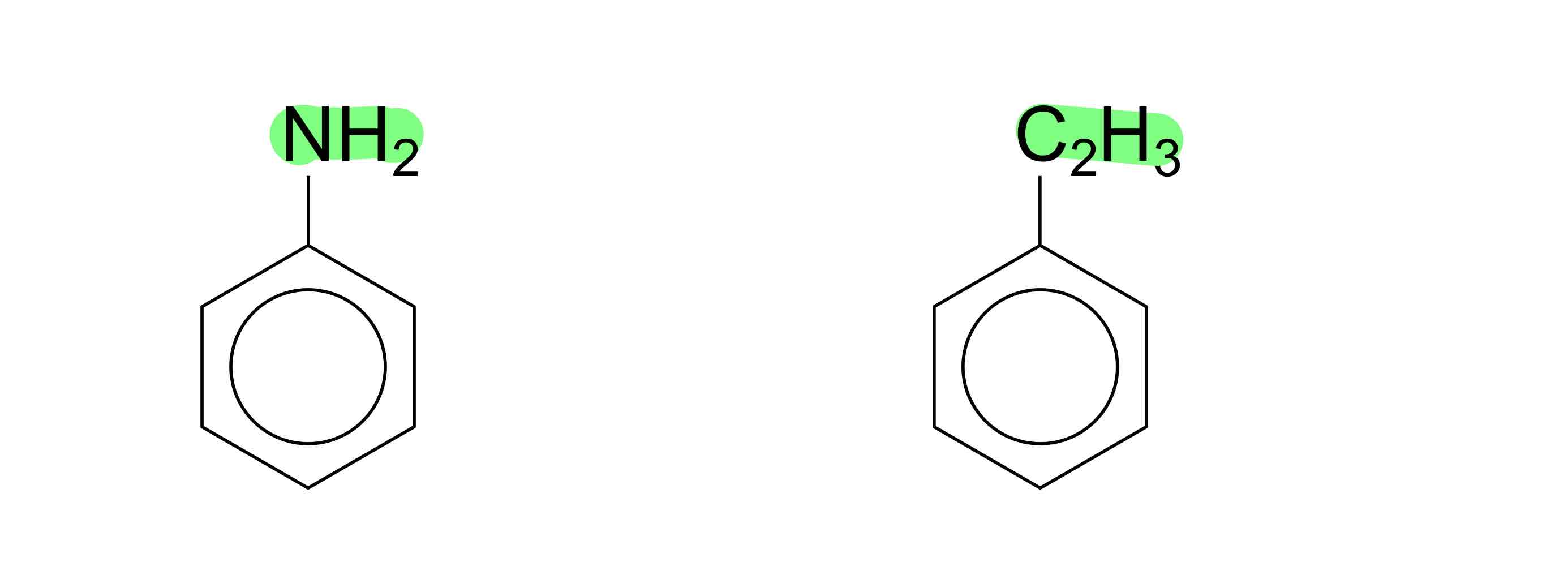
nomme ces composées
benzèneamine, éthénylbenzène
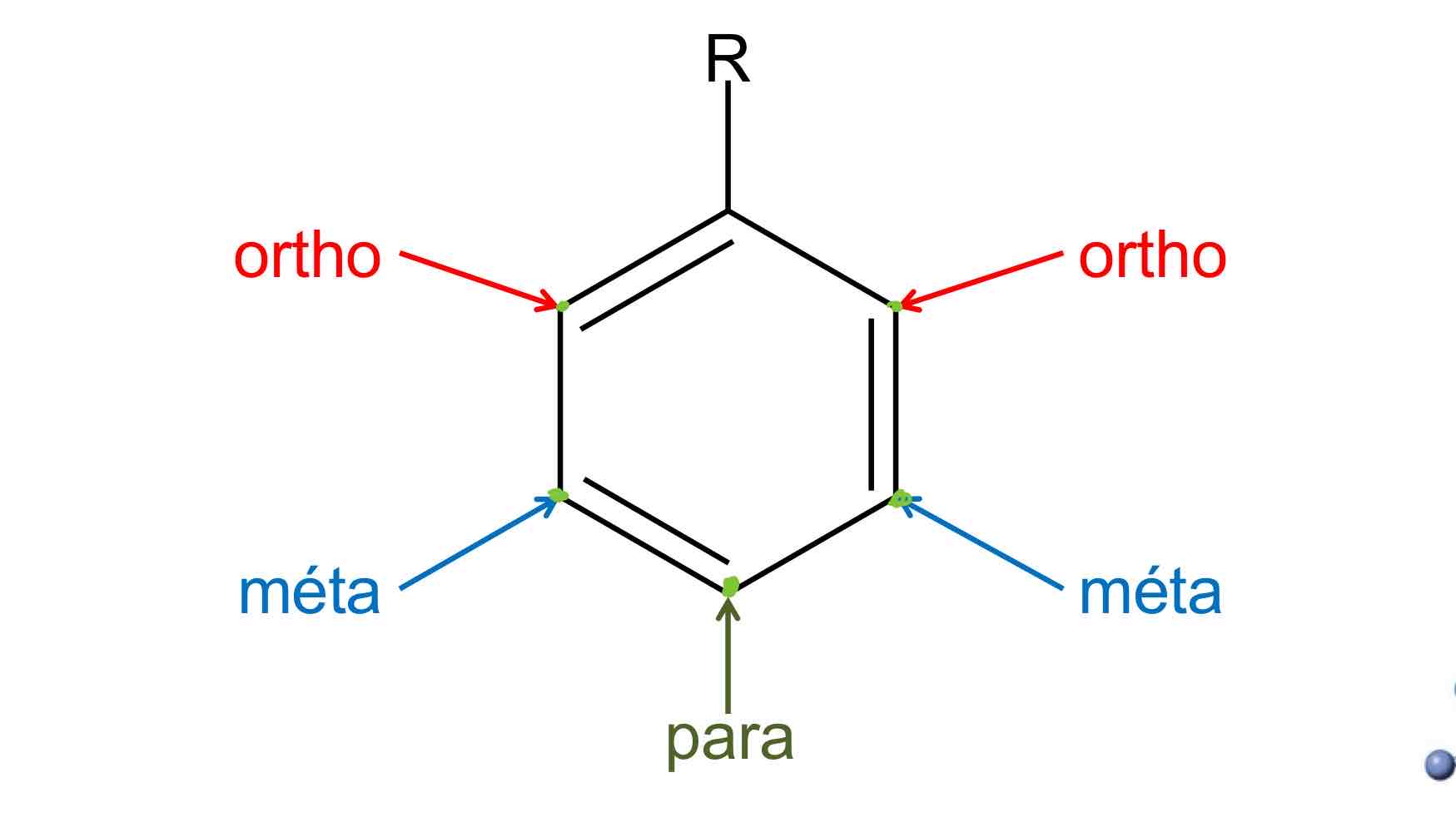
nomme et dessine les 3 arrangements possibles (relatif aux 2 substituants)
1 – adjacents (préfixe 1,2- ; ou ortho- ; ou o-)
2 – transposés (préfixe 1,3- ; ou méta- ; ou m-)
3 – opposé (préfixe 1,4- ; ou para- ; ou p-)
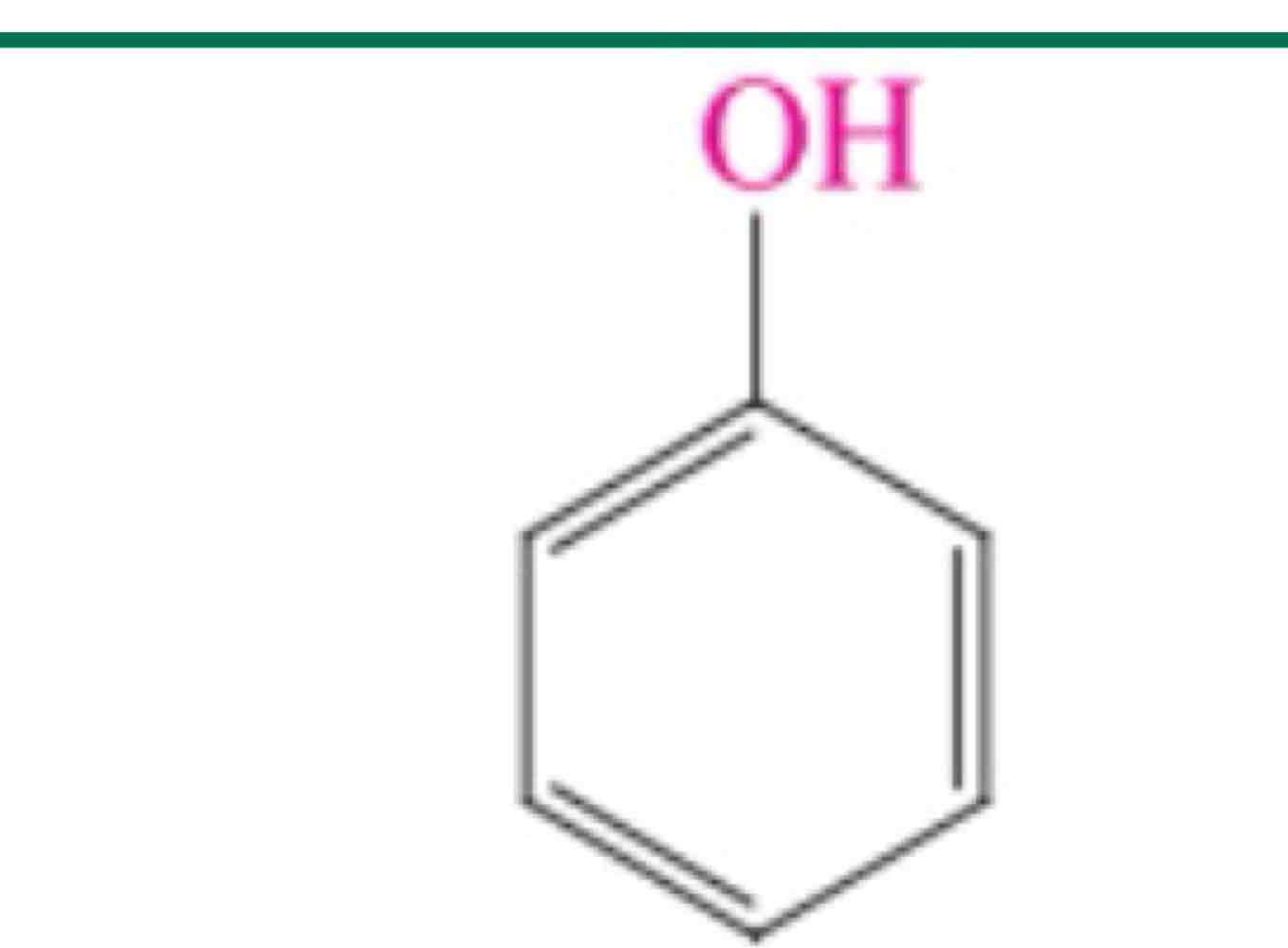
nomme cette composée (nom courant + systématique)
nc: phénol
ns: benzénol
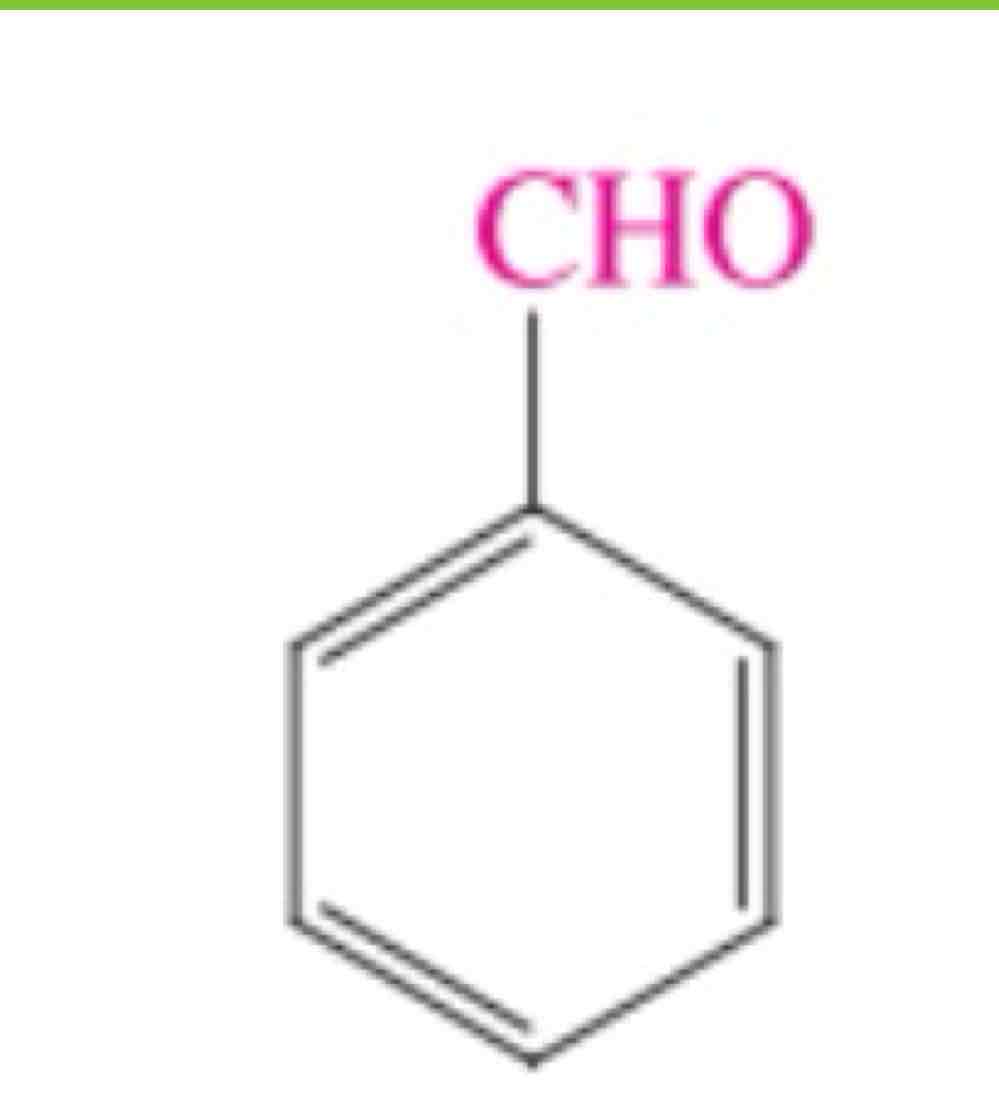
nomme cette composée (nom courant + systématique)
nc: benzaldéhyde
ns: benzènecarbaldéhyde
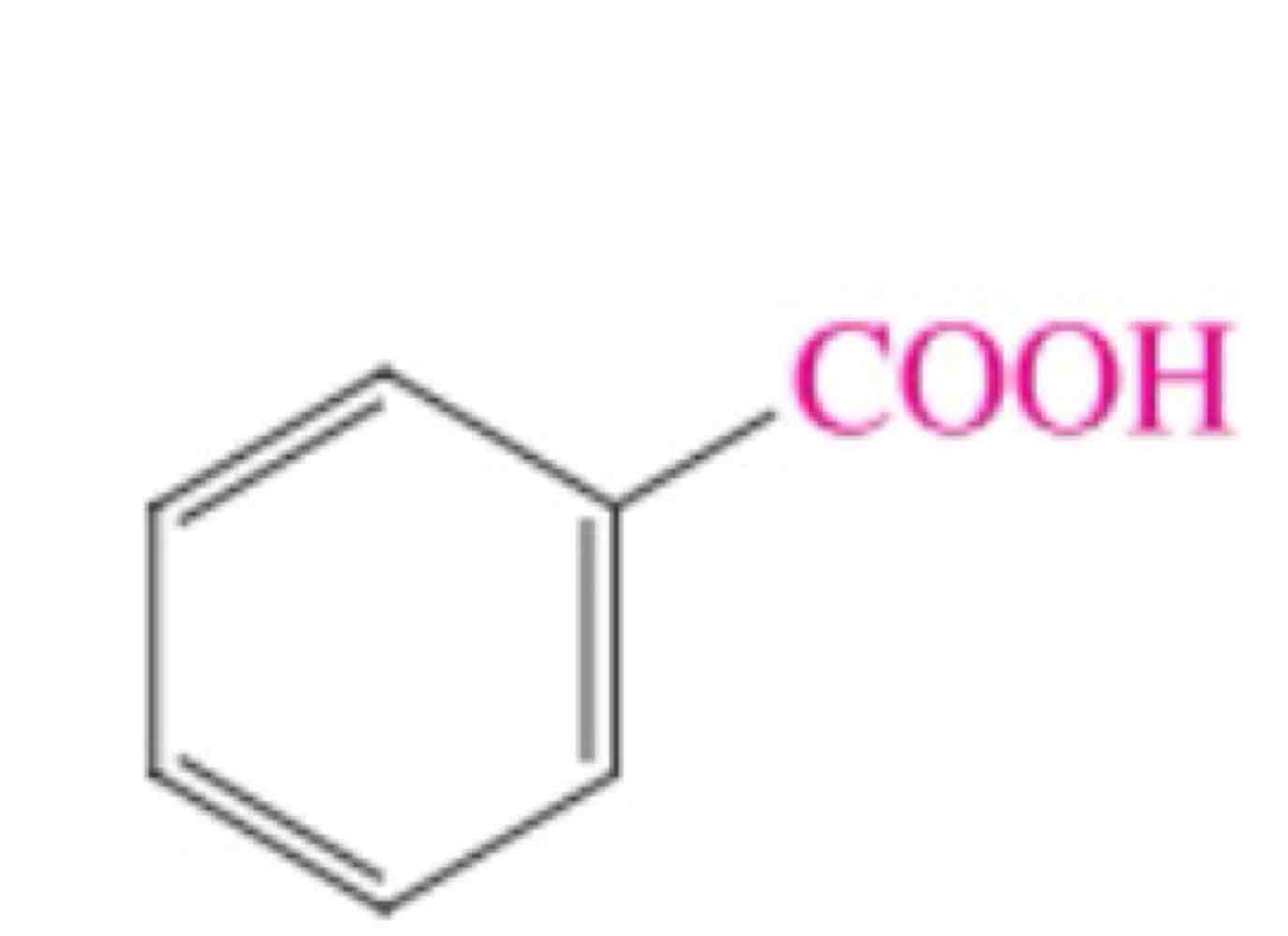
nomme cette composée (nom courant + nom systématique)
nc: acide benzoïque
ns: acide benzènecarboxylique
définition d’alcool
un composé organique qui comporte un groupe hydroxyle (R–OH)
caractéristiques des alcools
existe 3 sous classes d’alcool
alcools dérivent de la molécule d’eau et des éthers
nomme les 3 sous classes d’alcool
alcool primaire, alcool secondaire, alcool tertiaire
structure des alcools ressemblent à ____. Pourquoi?
l’eau
due à un effet de polarisation: électronégativité d’oxygènes provoque distribution dissymétrique de la charge au sein des alcools, qui se traduit par une polarisation de la liaisons O-H. Hydrogène est porteur d’une charge positive partielle.
definition d’un fonction carbonyle:
une double-liaison carbone-oxygène.
definition d’un aldehyde
un composé organique dans lequel le carbone carbonylique est lié à au moins un atome d’hydrogène.
definition d’un cetone
un composé organique dans lequel le carbone carbonylique est lié à deux atomes de carbone.
definition d’un acide carboxylique
un composé organique caractérisé par la présence du groupe carboxyle (groupe fonctionnel contenant une entité hydroxyle attachée à un carbone carbonylique).
groupe carbonyle contient une liaison….?
courte, forte et tres polaire
définition d’ampholyte
composé qui peut agir comme un acide ou comme une base (dependant de leur environnement)
alcools peuvent accepter un H ou peuvent céder(donner) un H (proton).
acidité des alcools dans l’eau est régie par quoi?
par la K(reflète force de l’acide)
Ka= K[H2O] = [H3O+] [RO-] / [ROH] => pKa = -log10 Ka
comment est-ce que la fonction carboxylique s’accocie en dimères?
grâce à des liaisons H
nomme les 3 centres réactionnels des aldéhydes et des cétones
oxygène (basique au sens de lewis) - attaque par les électrophiles
carbone électrophile - attaque par les nucléophiles
carbone en alpha
liaison O-H des alcools est______?
polarisée
qu’est ce qui explique la solubilité des alcools en l’eau?
les liaisons H des alcools
les points de fusion et ébullition des alcools et acides carboxyliques sont plus bas/hautes que leurs alcanes correspondantes, pourquoi?
hautes, car les alcools et acides carboxyliques peuvent intéragir avec des autres molécules avec liaisons H, et la sommation de ces liaisons H à pour conséquence que ça devient difficile aux molécules d’échapper la phase liquide, donc point d’ébullition (et fusion) plus élevé.
alcools peuvent se comporter comme des bases très faibles, si…..?
des acides très fortes intervient pour protoner groupe OH.
nommme et explique les 2 facteurs qui explique l’acidité relative chez les alcools
1- encombrement stérique affecte le degré de solvatation
formation d’une couche de molécules (espèce - solvant) autour d’un soluté. les substituants volumineux interfèrent avec la solvatation (stabiliseur de la charge -).
2- effet inductif
causé par présence d’un atome électronégatif, l’effet électroattracteur de cette atome amène les atomes plus distants à porter une charge légèrement +, qui stabilise charge - de l’oxygène
acides carboxyliques et leur capacité de dissocié facilement
les acides carboxyliques (RCOOH)ont des pka inférieures a celles des alcools (ROH)
↳ acides forts
↳ H+ vient de (-OH)dans les 2 cas.
↳ RCOOH est plus acide, car (-OH) est attaché a C carbonylique
↳ C sp2 est électroattracteur (stabiliseur de la charge - sur oxygène chez ion carboxylate)
↳ ion carboxylate est aussi stabilisé davantage (vs. RO-ion alkoxyde)
2e facteur: facteur de resonance
composés carbonylés ayant _____ sont _____ dans l’eau, tandis que composés carbonylés ayant _____ sont _____ dans l’eau.
<6 C, miscibles
>6 C (ou égale à 6), insolubles
longueur de liaison de N-H et N-C
N-H: 1,01 Å
N-C: 1,47 Å
pourquoi est ce que les amines sont des acides faibles et des bases fortes?
N n’est pas aussi électronégatif que O.
N contient une paire d’électrons libres, qui fait qu’il ets très aptent à recevoir un H+.
quand on augmente le nombre de groupes additionnels qui sont liées au N, est ce que le pKa augmente ou descend? pourquoi?
ça augmente jusqu’à un certain point. quand on arrive a ajouté 3 groupes additionnels, l’azote à atteint son limite.
le pKa descend à cause d’un certain encombrement stérique qui fait qu’un H+ n’a pas d’accès au N.
(l’eau, acides carboxyliques, alcools, cétones/aldéhydes, amines)
organise ces composées en ordre croissant de pKa.
acides carboxyliques (4-5), amines (10) , alcools (15) , l’eau (16), cétones/aldéhydes (15-18).
tous les valeurs sont approximatives
tout facteur qui _____ densité électronique autour de N….?
augmente, augmente basicité (pka augmente)