PG 76-101
1/72
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
73 Terms
functies eiwitten
opbouw + herstel lichaam, bloed, organen, zenuwstelsel
groei + weerstand van lichaam
reserve brandstof in uitzonderlijke situaties
aminozuren
=monomeren van eiwitten (dus de bouwstenen)
uit hoeveel aminozuren bestaat een eiwit?
30
hoeveel aminozuren hebben de zelfde chemische formule?
20, alleen maar de restgroep (R) is anders
wat bepaalt de restgroep
eigenschap van de aminozuur dus ook de eigenschap van de eiwit
hoe ontstaat een zwitterionische structuur?
carboxylgroep bij een neutrake pH waarde die gaat een proton (H+) afstaan, waardoor een aminogroep die opneemt en zo een zwitterionische structuur ontstaat
Essentiële aminozuren
aminozuren die het menselijk lichaam niet zelf kan aanmaken en dus van voeding moet krijgen
wat gebeurt er als je aminozuren in een bepaalde volgorde en hoeveelheid aan elkaar bindt?
\infty veel eiwitten worden gebouwd maar hiervoor heb je peptidebindingen nodig die worden gemaakt door condensatiereacties tussen de aminogroep van een aminozuur en de carboxylgroep van het andere
peptidebindingen
CO-NH bindingen die worden gemaakt door condensatie reacties tussen de ene aminogroep van een aminozuur en de carboxylgroep van de andere aminozuur
dipeptide
2 aminozuren samen
tripeptide
3 aminozuren samen
groter dan 3 aminozuren zijn
polypeptide (makkelijk uit 100-2000 aminozuren, met 20 aminozuren kan je bijna \infty veel polypeptiden maken)
bij welke kant worden aminozuren steeds toegevoegd?
COOH-kant → duidelijk begin en einde: N-C-C-N-C-C

hoe worden aminozuren aan elkaar gekoppeld?
door een peptide binding
hoe vormt een peptidebinding?
door een condensatie reactie, zuurgroep (-COOH) van het ene aminozuur reageert met aminogroep (NH2) van het andere aminozuur. hierbij wordt een watermolecuul afgesplitst
Peptiden:
Dipeptide: 2 aminozuren.
Polypeptide: Een keten > 10 aminozuren.
Eiwit: Een eiwit is een of meer lange polypeptideketens die een specifieke, functionele ruimtelijke structuur hebben aangenomen.
4 structuurniveaus van eiwitten
Primaire structuur
Secundaire structuur
Tertiaire structuur
Quaternaire structuur
functioneel proteïne
ketens worden stapsgewijs opgevouwen totdat ze ongeveer bolvormig worden en hun taak kunnen uitvoeren
eigenschappen van restgroepen
kunnen geladen zijn
sommige polair andere apolair → bepaalt interactie met omringende waterige milieu
sommige groepen hebben -OH groepen → waterstofbruggen vormen
Cysteïne bezit een SH-groep → samen met een 2de Cysteïne-molecuul zwavelbruggen vormen (S-S)
Primaire structuur
Een streng aan elkaar gekoppelde aminozuren in een bepaalde volgorde, wordt bepaald door de genetische code (DNA)
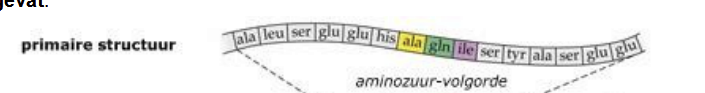
Secundaire structuur
kan een spiraal hebben => α-helix
of kan ook een glooiend vlak zijn β-sheet → ontstaat omdat de polypeptideketen evenwijdige lussen vormen
stabilserende krachten/bindingen = waterstofbruggen
Tertiaire structuur
De α-helixen en β-sheets worden verder opgevouwen → ontstaan tertiare structuur
vezelstructuur (langwerpig)
kluwstructuur (ongeveer bolvormig)
vorming van H-bruggen, andere chemische eigenschappen van de restgroep (hydrofobe/hydrofiele karakters) → elektrostatische interacties en zwavelbruggen

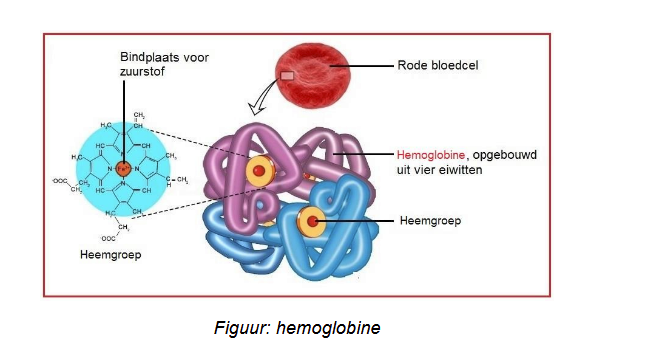
Quaternaire structuur
als een eiwit uit 2 of meer subeenheden bestaat (bv: hemoglobine bestaat uit 4)

figuur hemoglobine
Denaturatie def
verlies van de ruimtelijke structuur (secundaire, tertiaire en quaternaire structuren) van een eiwit
Denaturatie oorzaak
blootstelling aan extreme temperaturen of pH-waarden
Denaturatie gevolg
eiwit verliest zijn functie, is meestal omkeerbaar (bv: koken ei)
is de volgorde van een peptideketen belangrijk?zo ja geef een voorbeeld dat aantoont waarom
Ja, heel belangrijk omdat die de eigenschappen van een groep bepaalt → dus ook het eigenschap van de hele eiwit/peptide, er zijn zeer grote gevolgen als er maar 1 aminozuur fout zit bv: sikkel-cel anemie er is maar 1 verkeerde aminozuur in het hemoglobine-eiwit en het ontstaat al (vorm van bloedarmoede)
enzymen
zijn een groep eiwitten die werken als katalysator inde cel, ze zorgen ervoor dat de nodige reacties kunnen plaats vinden in milde fysiologische omdstandigheden (lage temperatuur, neutrale pH)
wat doen de enzymen dus?
activeren de reacties
substraten
de verbindingen die door de enzymen worden omgezet
eigenschappen van enzymen
ze zijn biokatalysatoren, eigenschappen:
slechts in kleine hoeveelheden nodig
versnellen de reactie maar geen invloed op hoeveelheid geproduceerde stof(1-10K omzettingen/seconde per enzymmolecule)
specifieke werking
na de reactie vind je ze onveranderd terug
hoe kan je de snelheid van de enzymatische reactie versnellen?
door meer hoeveelheid actief enzym. het neemt toe met de hoeveelheid actief enzym maar de totale omgezette stof hangt af van de hoeveelheid substraat
door wat wordt de fysiologische eigenschappen van de cel bepaald?
door de aanwezige enzymen, wat voortkomt uit de genen die in een gedifferentieerde cel actief zijn
indeling van enzymen
ze zijn heel specifiek (elke substraat heeft een apart enzym nodig)
Proteïnase: werkt in op proteïn
lipase: werkt in op lipiden
Sacharase: werkt in op sacharose
naamgeving = meestal de naam van het substraat + de uitgang '-ase'.
Katabole/dissimilatiereacties
enzymen breken stoffen af
anabole/assimilatiereacties
enzymen bouwen stoffen op
cofactor
naast het nodige eiwitgedeelte van een emzyn heet het ook een niet-eiwitgedeelte(=)
apoënzym
het eiwitgedeelde
prosthetische groep
een cofactor die nooit van het enzym loskomt (Fe in hemoglobine)
coënzym
cofactor die ongeveer los op het enzym zit
voorstadia van coënzymen
Vitamines (vooral de in water oplosbare)
werking van enzymen;
Temperatuurafhankelijk: werkt het best bij het temperatuur optimum (mens = 37°C), daarboven worden de eiwitten gedenatureerd
pH-afhankelijk: pH-optimum hang af van welke enzym het is(laag pH-optimum in de maag)
Specifiek: elke enzym werkt in op 1 specifieke stof = substraat
heeft de specificiteit te maken met de ruimtelijk vorm?
ja:
de binding tussen substraat en enzym gebeurt in he actief centrum
actief centrum past precies op het substraat (sleutel-slot-principe)
door denaturatie wordt de structuur van het eiwit gewijzigd → actief centrum past niet meer op het substraat → verlies biologische activiteit
inhibitoren
remmers, stoffen die de enzymwerking vertragen of stoppen
2 soorten inhibitoren
competitieve inhibitie de inhibitor lijkt op het substraat en bind aan het actief centrum → substraat wordt geblokkeerd → omkeerbaar door de substraatconcentratie te verhogen
niet-competitieve inhibitie: de inhibitor bindt aan een ander plaats dan in het actief centrum waardoor de ruimtelijke structuur van het enzym verandert en het actief centrum niet meer past op het substraat, niet omkeerbaar
nucleïnezuren
organische macromoleculen die in celkern (nucleus) werden ontdekt, er zijn 2 soort
nucleïnezuren 2 soorten
Chromatine: lange DNA (desoxyriibonucleïnezuur) die rond de eiwitten is opgerold tot een compact geheel
RNA: (ribonucleïnezuur), enkelstrengige kope van een stukje DNA die meestal wordt vertaal door een ribosoom naar een eiwit
nucleotiden
monomeren van nucleïnezuren (DNA, RNA), 3 delen
nucleotiden 3 delen:
base: Adenine (A), guanine (G), cytosine (C), Thymine(T), uracil (U), gekoppeld aan C1
suiker: aan C2 desoxyribose bij DNA en ribose bij RNA
fosfaatgroep: gekoppeld aan C3 ,de 2 andere fosfaatgroepen worden eraf geknipt bij de bouw van het DNA-molecule
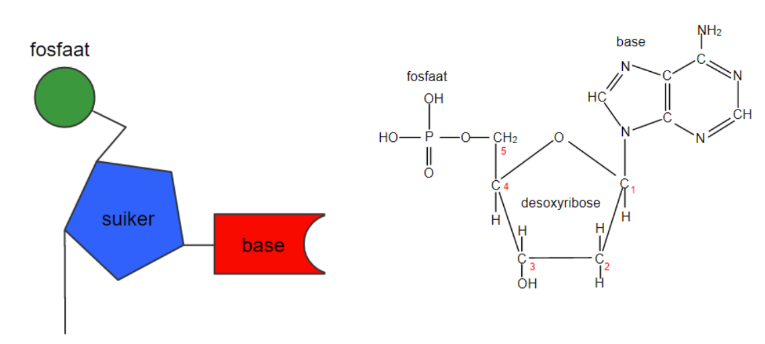
uit welke 4 nucleotiden bestaan DNA en RNA
adenosine
cytidine
guanosine
thymidine (RNA = Uracil)
complementaire basenparen
basen die via waterstofbruggen met een 2de streng samenkomen
Hoe ontstaan lange DNA-strengen?
nucleotiden verbinden met elkaar door de fosfaatgroep van de vorige nucleotide te verbinden met C3 van de volgende
A-T + C-G → ontstaan dubbele streng DNA → helix
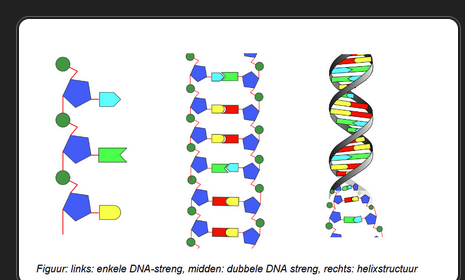
Hoe kan je de teken van nucleotiden als een dik boek voorstellen?
Nucleotiden volgen elkaar in 1 lange keten (komt voor in elke cel van het menselijk lichaam) → = dik boek, elke letter = volgorde nucleotiden, genen geven specifieke opdrachten (aanmaak eiwitten), soms zijn het korte zinnen (amper 100 nucleotiden) soms heel lange zinnen (miljoenen nucleotiden)
DNA is in de celkern maar de info moet ook daarbuiten worden gebruikt, hoe?
DNA is te groot om door kernporiën te gaan, dus gaan RNA die een kleine kopie van een stukje DNA dat wel door de kernporiën kan gaan naar het cytoplasma waar andere eiwitten de instructies lezen en nieuwe eiwitten maken
Waarom zijn DNA en RNA makkelijk uit elkaar te houden?
omdat bij RNA de T van DNA (Thymine) vervangen is door U (Uracil)
voorbeeld van eiwitten die zo zijn bestaan:
structuur eiwitten
hormonen
bloedeiwitten (hemoglobine)
eiwitten die een rol spelen bij de afweer (imuunsysteem)
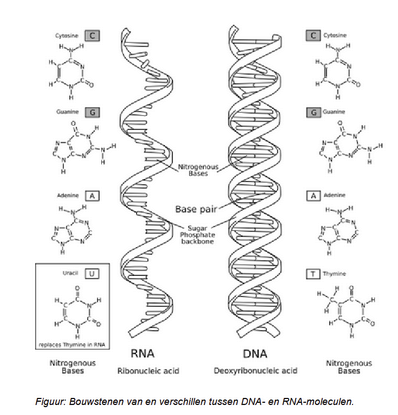
Verschillen tussen DNA en RNA
aantal strengen
nucleotiden
locatie in de cel
suikers
lengte
functie
verschil strengen
DNA = 2(dubbele helix), RNA = 1
verschil nucleotiden
DNA = Adenosine, Cytidine, Guanosine, Thymidine
RNA = Adenosine, Cytidine, Guanosine, Uracil
verschil suikers
DNA = dexoxyribose, RNA = ribose
verschil lengte
langer (veel genen), korter (1 gen)
verschil functie
DNA = drager van erfelijk materiaal
RNA = eiwitten aanmaak
Zon
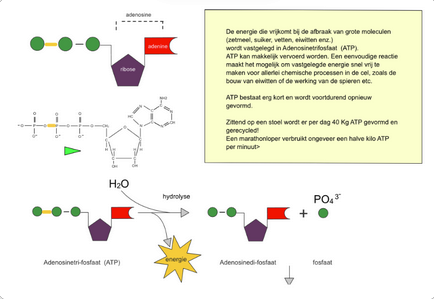
primaire leverancier van energie op aarde, planten zetten deze energie door fotosynthese vast in glucose, maar glucose is niet geschikt om rechtstreeks als energiebron te dienen voor celprocessen dus wordt er in de mitochondriën glucose geoxideerd naar CO2 + H2O → Vrijkoming van energie → aanmaak ATP (adenosinetrifosfaat)
ATP bestaat uit
organische base → adenine
pentose suiker (5C) → ribose
3 fosfaatgroepen
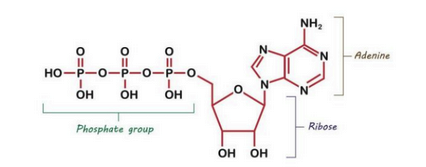
Waarom is ATP een universele energiedrager?
Maakt niet uit welke organisme. dit is het molecule waarin energie van glucose wordt opgeslagen en waar energie ook terug vrijkomt bij afbraak
Wat gebeurt er bij de afbraak van ATP
afbraak ATP → vrijkoming energie → opbouw eiwitten, contractie van spieren, geleiden zenuwimpulsen mogelijk
door wat wordt ATP gevormd?
ADP (adeninedifosfaat) door een extra vinding met een fosfaat groep, de energie die hiervoor nodig is wordt gekregen door oxidatiereacties in de cel of door licht in de fotosynthese
Reacte ADP → ATP
ADP + P + ENERGIE → ATP
ADP werd hier gefosforyleerd (+1 fosfaatgroep)
wat gebeurt er als je ergens in de cel energie nodig hebt?
ATP ondergaat hydrolyse (splitsing reactie met water), fosfaatgroep wordt afgesplitst en energie komt vrij
Reactie ATP → energie
ATP + H2O → ADP + P + ENERGIE (30,6kJ/mol)
→ fosfaat groep komt vrij dus er moet ook een verbinding aanwezig zijn om deze fosfaatgroep op te nemen en gefosforyleerd te worden
Moet een organismen altijd ATP vanaf het begin opbouwen?
Nee, het vrijgekomen ADP bindt snel een P-groep, maar hiervoor is energie die bij de afbraak opnieuw vrijkomt
Legt de cel een grote voorraar ATP?
Nee:
geen grote ATP want de omzettingen van ADP → ATP(en omgekeerd) gebeuren zeer snel. Je hebt heel veel ATP nodig voor normale celgroei, een mens verbruikt per dag 45kg ATP maar heeft een vooraad van amper 1g, elke cel in ons lichaam maakt en verbruikt ongeveer 10.106 ATP moleculen per seconde