thermodynamique
0.0(0)
Card Sorting
1/41
Earn XP
Study Analytics
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
42 Terms
1
New cards
qu’est-ce qu’un système ?
ce que l’on étudie
2
New cards
système isolé
ni échange de matière ni d’énergie
3
New cards
système fermé
pas d’échange de matière mais échange Energie
4
New cards
transformation isochore
à V cste
5
New cards
transformation isobare
à P cste
6
New cards
transformation isotherme a
a T cste
7
New cards
adiabatique ?
pas d’échange thermique avec l’extérieur δQ = 0
8
New cards
variable d’état ?
variable qui décrit l’état thermodynamique du sys
9
New cards
grandeur extensifs
dépend de la taille du sys comme V,m,n
10
New cards
grandeurs intensifs
Ne dépend pas de la taille du sys comme P,T
11
New cards
système thermodynamique
système entièrement décrit par seulement 3 variables f(T,V,P) = 0
12
New cards
coef de dilation thermique à P cste

13
New cards
coef de dilation linéaire à P cste

14
New cards
coef de compressibilité isotherme
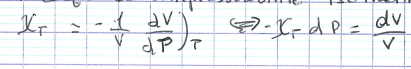
15
New cards
énergie interne U
* fonction d’état
* extensive
* correspond à ts les énergies cinétiques et potentielles au n° microscopique
* extensive
* correspond à ts les énergies cinétiques et potentielles au n° microscopique
16
New cards
loi des gaz parfaits
PV = nRT
17
New cards
1er loi de Joules
énergie interne du gaz parfait ne dépend que de T°
18
New cards
csq 1er loi de Joules (formule)
dU = Cv x dT où Cv est la capacité calorifique
19
New cards
1er principe énoncé
pour un sys fermé, il est possible d’associer une fonction d’état extensive, l’énergie interne, telle qu’entre 2 états d’éq
20
New cards
formule du 1er principe
ΔE = ΔEm + ΔU = W + Q
dE = dEm + dU = δW + δQ
où W = travail fourni par les forces extérieurs non conservatrices
Q = transfert thermique
dE = dEm + dU = δW + δQ
où W = travail fourni par les forces extérieurs non conservatrices
Q = transfert thermique
21
New cards
1er principe : le sys est au repos
\n ΔEm = 0
\n ΔU = W + Q
dU = δ W + δQ => δW = -PdV
\n ΔU = W + Q
dU = δ W + δQ => δW = -PdV
22
New cards
2nd principe énoncé
à tt sys fermé, on peut associer une fonction d’état, extensive appelés entropie telle que
Δ S = Se + Sc
dS = δSe + δSc où δSe = δQ / T surf et δSc > 0 → entropie crée sauf δSe = 0 si réversible
Δ S = Se + Sc
dS = δSe + δSc où δSe = δQ / T surf et δSc > 0 → entropie crée sauf δSe = 0 si réversible
23
New cards
enthalpie énoncé
fonction d’état extensive tel que H = U +PV
dH = dU + VdP + PdV or dU = δW + δQ
=> dH = δW + δQ + VdP + PdV à P=cste, dP= 0
dH = dU + VdP + PdV or dU = δW + δQ
=> dH = δW + δQ + VdP + PdV à P=cste, dP= 0
24
New cards
si le travail → forces de pression δW = -PdV
dH = (-PdV) + δQ + VdP + PdV = vQ à P= cste dH =δQ
25
New cards
Cp = ?
dH/dT )P
26
New cards
ΔrH
exothermique
27
New cards
ΔrH > 0
endothermique
28
New cards
ΔrH = 0
athermique
29
New cards
enthalpie libre
G = H -TS
à T =cste, drG = drH -TΔrS
à T =cste, drG = drH -TΔrS
30
New cards
ΔdG
sens direct
31
New cards
ΔrG > 0
sens indirect
32
New cards
ΔrG = 0
à l’équilibre
33
New cards
diagramme PT pr un corps pur

34
New cards
relation de Clapeyron
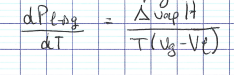
35
New cards
pour un gaz parfait, EQUATION DE CLAUSIUS-CLAPEYRON
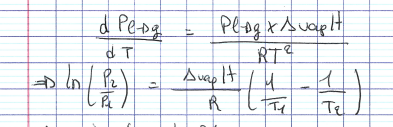
36
New cards
approximation de Magnus pour l’eau
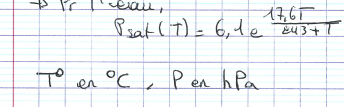
37
New cards
pression osmotique
perméable au solvant
imperméable aux solutés
imperméable aux solutés
38
New cards
expression de pression osmotique
π= i (n/V) RT => π= iCRT
où i: nb d’ions diff qui ne passent pas
C en mol.m^3 \\n π en Pa
T en K
où i: nb d’ions diff qui ne passent pas
C en mol.m^3 \\n π en Pa
T en K
39
New cards
quels sont les diff transferts d’énergie ?
* convection
* conduction
* rayonnement
* conduction
* rayonnement
40
New cards
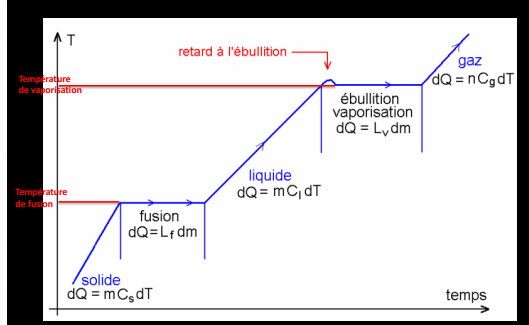
la température en fonction du temps
41
New cards
humidité relative
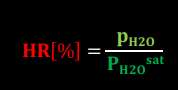
42
New cards
csq humidité relative
