Embryologie
1/154
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
155 Terms
celdood tijdens de embryologische ontwikkeling van de mens
→ speelt een paradoxale rol die betrokken is bij het vormgeven van verschillende structuren & organen
→ celdood is een onderdeel van ons leven
overzicht van de lessen
gametogenese
van fertilisatie tot bilaminaire kiemschijf
van bilaminaire kiemschijf tot primitieve lichaamsvorm
speciële embryologie van het bewegingsstelsel
Wat is embryologie?
in het Grieks: ongeboren vrucht
embryologie bestudeert:
gametogenese
ontwikkeling van bevruchte eicel tot geboorte
teratogenese
teratogenen:
niet alle congenitale afwijkingen zijn erfelijk
vaak ontwikkelingsstoornissen o.i.v. teratogenen (Grieks: monster voortbrengen)
teratogenen zorgen voor afwijkingen
meeste invloed tijdens d embryonale ontwikkeling
voorbeelden van teratogenen:
thalidomide (= Softenon) → vroeger gebruikt voor ochtendmisselijkheid
di-ethylstilbestrol (DES) → vroeger gebruikt om miskramen te voorkomen
embryologie: nut voor toekomstige artsen
studie van eigen prenatale oorsprong & ervaring
bij 3-4% van alle levend geboren kinderen: significante misvorming
beste manier om menselijke anatomie te vatten
kanker: ziekte waarbij mutaties betrokken zijn in genen die belangrijke cellulaire gebeurtenissen in de ontwikkeling reguleren (bv. deling & celdood)
Wnt (Wingless) familie signaalmoleculen: functies in embryo & volwassenen
in embryo: Wnt signalering controleert de specificatie van het ‘cell fate’
in volwassenen: Wnt signalering zorgt voor behoud van homeostase in weefsels die zichzelf herzien
mutaties van leden van Wnt signalering resulteert in kwaadaardige transformatie
embryologie als brug tussen basiswetenschappen & klinische wetenschappen, voor verloskunde & kindergeneeskunde
kennis van embryologie: patiënten nauwkeurig adviseren over veel zaken, zoals voortplanting, aangeboren afwijkingen, prenatale ontwikkeling, in-vitrofertilisatie, & stamcellen
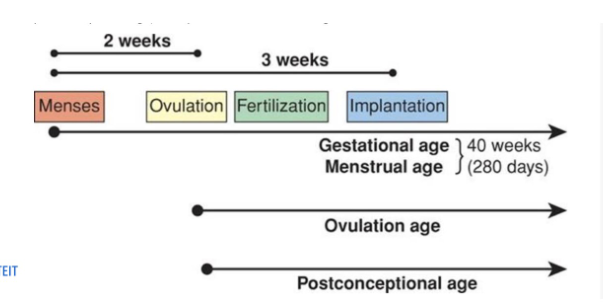
embryologie: timing in de ontwikkeling van de mens → 2 manieren om te benoemen
zwangerschapsduur (gestational age)
40 weken
gerekend vanaf de 1e dag van de laatste menstruatie als de vrouw regelmatig menstrueert
ontwikkelingsleeftijd (fertilization age)
38 weken
neem de datum van bevruchting als begindatum van de gestatie
gestatie = dragen van een embryo
(postconceptional age)
embryologie: timing in de ontwikkeling van de mens → opgedeeld in weken
0-2wk: bevruchting tot bilaminaire kiemschijf
(pre-organogenese)
embryonale periode
3-4wk: bilaminaire kiemschijf tot primitieve lichaamsvorm
3-8wk: organogenese
foetale periode
9-38wk: voornamelijk groei
embryologie: primitieve lichaamsvorm bij de vertebraten
1e stadia: heel gelijkaardig, bijna niet van elkaar te onderscheiden
→ wet van Baer
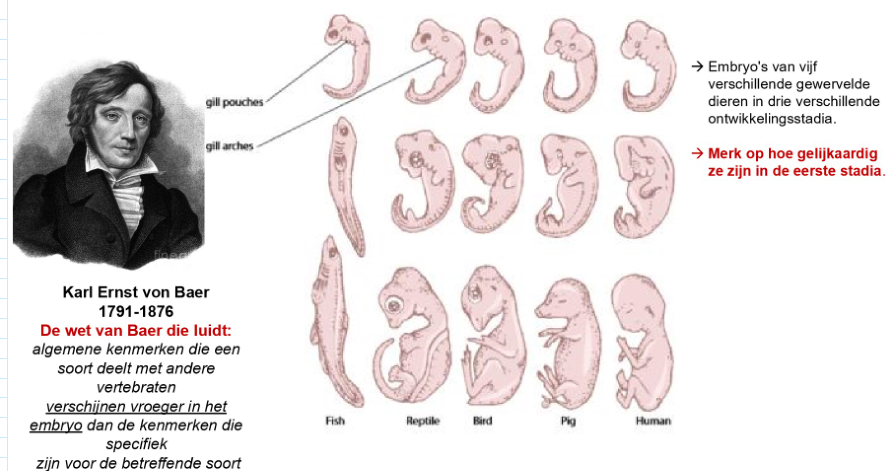
wet van Baer:
= algemene kenmerken die een soort deelt met andere vertebraten verschijnen vroeger in het embryo dan de kenmerken die specifiek zijn voor de betreffende soort
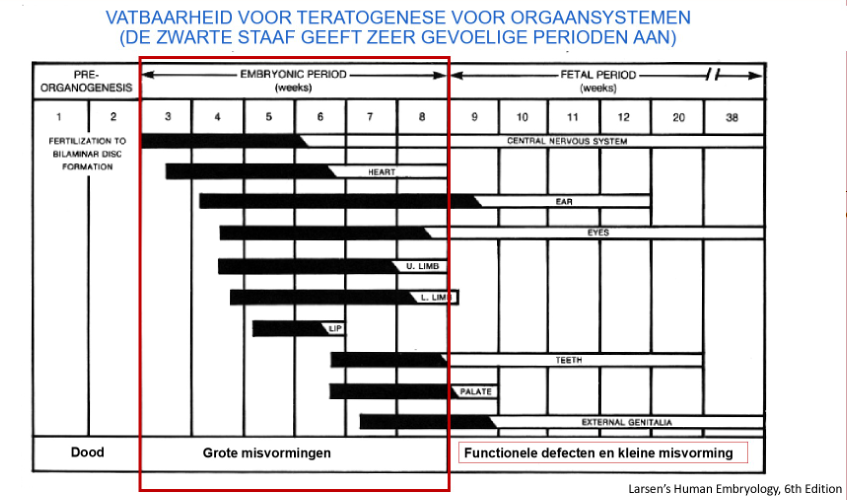
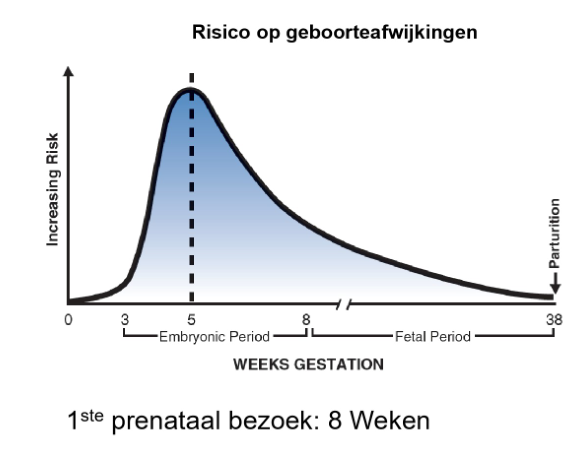
teratogenen: vatbaarheid voor teratogenese voor orgaansystemen
→ zwarte staaf: zeer gevoelige perioden
ontwikkeling van de verschillende stelsel: gebeurt in de embryonale periode
embryonale periode is dus de meest gevoelige
teratogenen: voorbeelden
teratogenen = schadelijke omgevingsfactoren
pharmaca
alcohol
nicotine
virussen (na invoering van universele rubellavaccinatie is congenitale rubella zeer zeldzaam geworden)
RX stralen → röntgen
cocaïne
hormonen
arseen, kwik, cyanide
tekort aan foliumzuur tijdens de zwangerschap
kan aanleg van zenuwstelsel verstoren
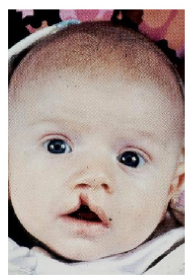
pasgeborene met middellijn gespleten lip
negatieve invloeden van roken & alcoholgebruik
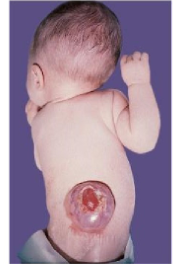
pasgeborene met myelomenigocèle
= neurale buisdefecten door foliumzuur tekort
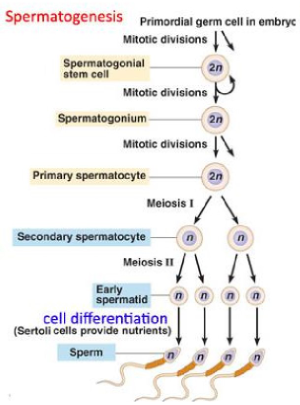
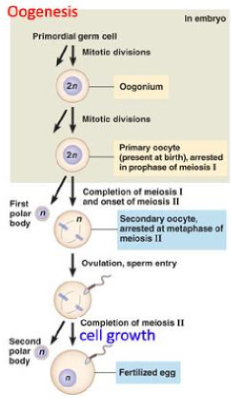
spermatogenese & oögenese:
= differentiatie van primordiale geslachtscellen (PCG) tot spermatozoa & rijpe oöcyten
gametogenese: spermatogenese
primordiale kiemcellen (PGC’s) blijven slapend tot de puberteit
vanaf puberteit: differentiatie tot spermatogonia & mitose begint
bij volwassen man: spermatogonia produceren primaire spermatocyten → deze ondergaan meiose & spermatogenese
elke primaire spermatocyt deelt zich en vormt 2 secundaire spermatocyten → deze vormen elk 2 spermatozoën
→ elke primaire spermatocyt levert 4 functionele gameten
(ploidie = aantal kopies van ieder chromosoom)
(N = aantal kopijen van een bepaalde DNA molecule of chromatide)
gametogenese: oögenese
PGC’s differentiëren zich tot oogonia
ondergaan mitose & beginnen meiose tijdens het foetale leven als primaire oöcyten
primaire oöcyten blijven in profase I totdat ze tijdens menstruatiecyclus worden gestimuleerd om meiose te hervatten
elke primaire oöcyt heeft potentie om een secundaire oöcyt & eerste poollichaam te vormen
elke secundaire oöcyt heeft potentie om een definitieve oöcyt & een ander polair lichaam te vormen
→ elke primaire oöcyt kan dus 1 functionele gameet voortbrengen
(ploidie = aantal kopies van ieder chromosoom)
(N = aantal kopijen van een bepaalde DNA molecule of chromatide)
proliferatieve kiemcellen die productie van oöcyten & follikels in postnatale zoogdierovarium ondersteunen
definitieve voorraad oöcyten
(= centraal dogma van de reproductiebiologie)
verloopt zeer geleidelijk & in fasen (met ‘rust’periode)
primaire oocyte ‘in rust’ tot aan ovariële cyclus
meiose 1 wordt afgewerkt tijdens de ovariële cyclus
meiose II wordt afgewerkt indien bevruchting
per ovariële cyclus: 10 à 15 follikels worden geactiveerd, uiteindelijk slechts 1 rijpe follikel (follikelatresie)
rijpe eicel is een grote, immobiele cel
gametogenese: primordiale geslachtcellen (‘germ cells’)
→ ontstaan ± 4 weken na de bevruchting als een groepje cellen in extra-embryonale mesoderm op het achterste deel van de dooierzak
tijdens migratie van dooierzakwand naar urogenitale plooi: primordiale geslachtscellen delen zich (bij de muis) 8-9 maal
SACROCOCCYGEALE TERATOMEN:
meest voorkomende tumoren bij pasgeborenen
komen voor bij 1 op 20.000 tot 70.000 geboorten
tumoren groeien uit PGCs
komen 4x vaker voor bij vrouwelijke pasgeborenen dan bij mannelijke
gametogenese: belangrijkste verschillen tussen oögenese & spermatogenese
efficiëntie spermatogenese tov oögenese
timing meiose 1
gelimiteerde stock eicellen bij vrouw vs. blijvende mitose bij man gezien spermatogonia blijven delen

gametogenese: ontwikkeling in het ovarium van primordiale follikels tot Graafse follikel & de ovulatie & luteale fase
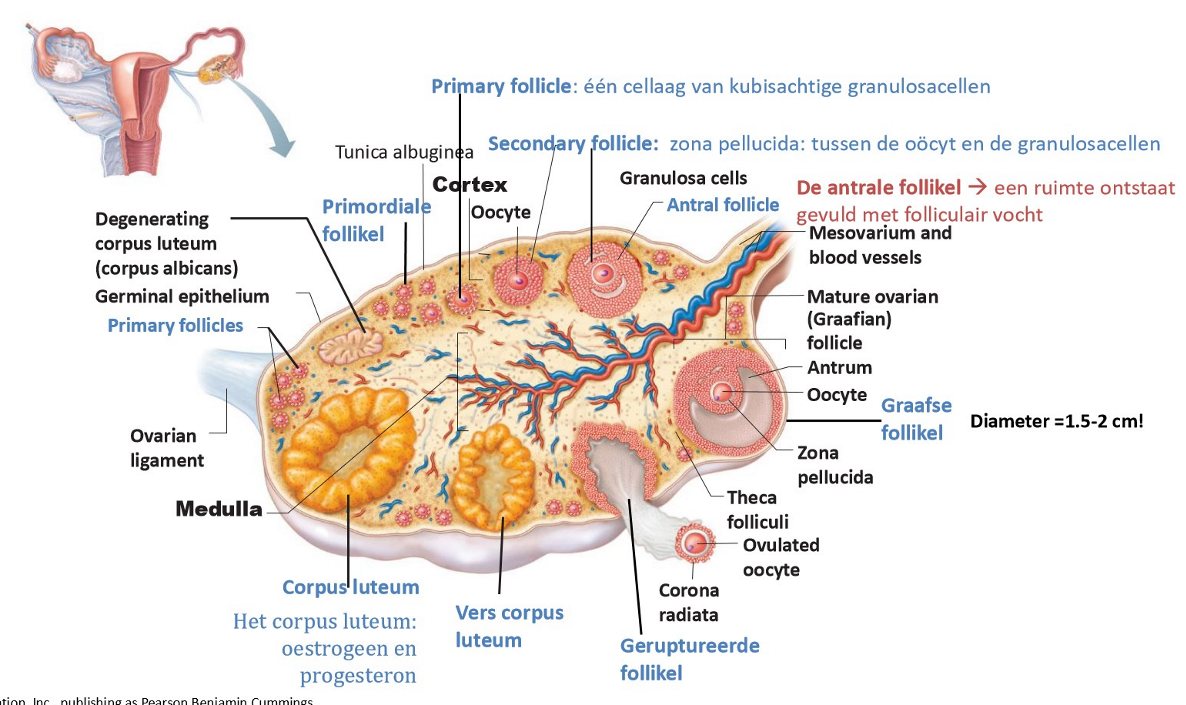
de antrale follikel & de Graafse follikel
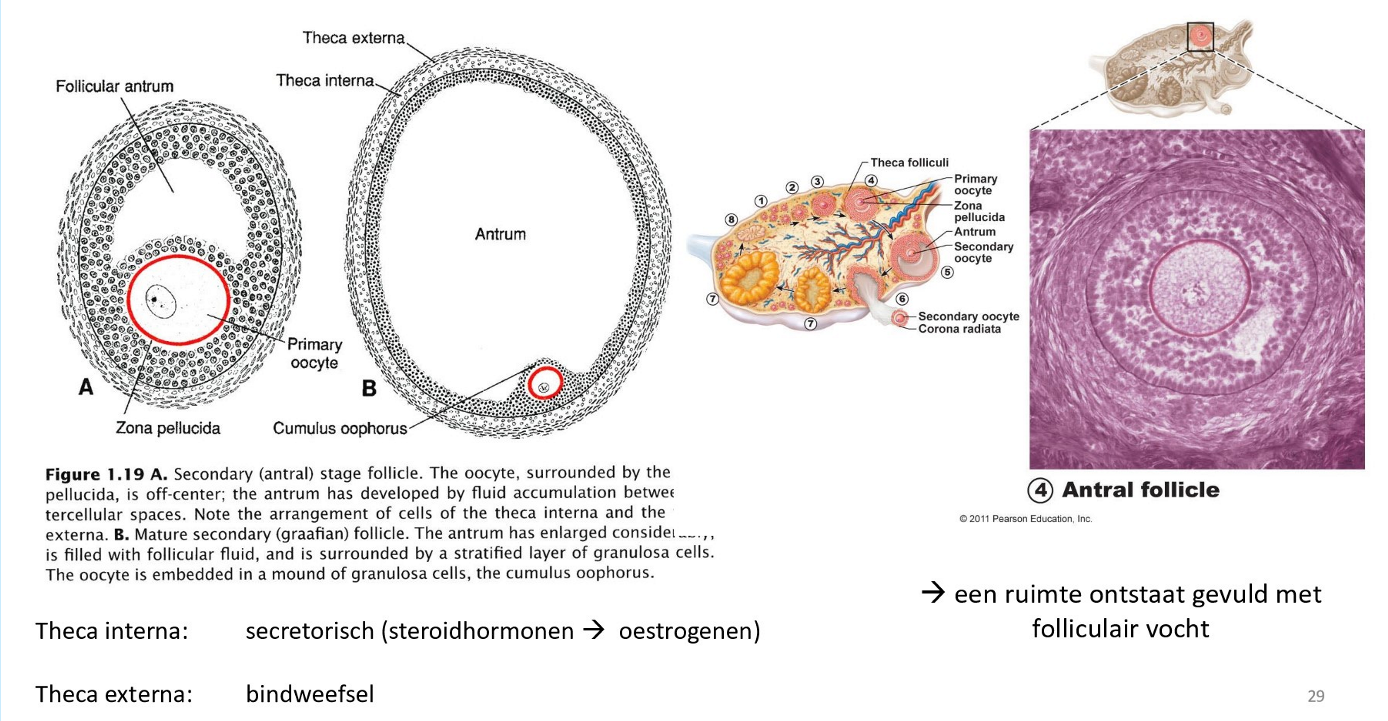
gametogenese: meiotische gebeurtenissen & follikelontwikkeling in de eiertstok
vóór de geboorte:
mitose in oogonium (stamcel) → °primaire oocyt
primaire oocyt groeit & ontwikkelt zich tot een primordiale follikel
tijdens kindertijd (met inactieve eierstokken):
primaire oocyt blijft gearresteerd in de profase I & is aanwezig bij de geboorte
elke maand vanaf de puberteit tot de menopauze:
primaire oocyt blijft gearresteerd in de profase I
door stimulatie van LH-piek:
1 primaire oocyt voltooit de meiose I → °secundaire oocyt & 1e poollichaampje
secundaire oocyt wordt gearresteerd in metafase II & wordt vrijgegeven tijdens de ovulatie
bij bevruchting:
fertilisatie door spermacel → meiose II wordt voltooid → °ovum & 2e poollichaampje
gescheurd follikel wordt corpus luteum → degenereert
→ ± 5 tot 12 primaire follikels hervatten elke maand de ontwikkeling
→ 1 follikel wordt dominant & rest degeneert door folliculaire atresie
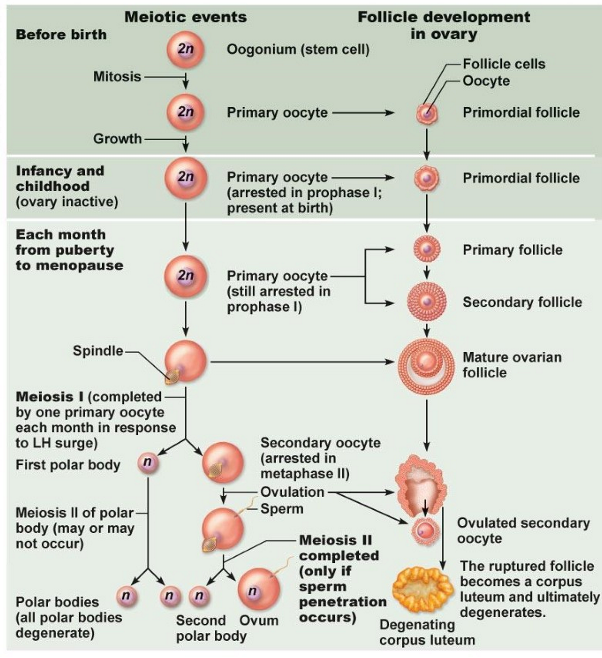
gametogenese: waarom wordt folliculogenese selectief gestimuleerd in slechts enkele follikels elke maand?
→ geen antwoord voor, wel 2 hypotheses:
als follikels zich verder ontwikkelen, worden ze progressief gevoeliger voor stimulerende effecten van FSH
daarom zouden follikels die obv toeval iets verder gevorderd zijn, scherper reageren op FSH & worden voorgetrokken
selectieproces wordt gereguleerd door complex systeem van feedback tussen hypofyse- & ovariumhormonen en groeifactoren
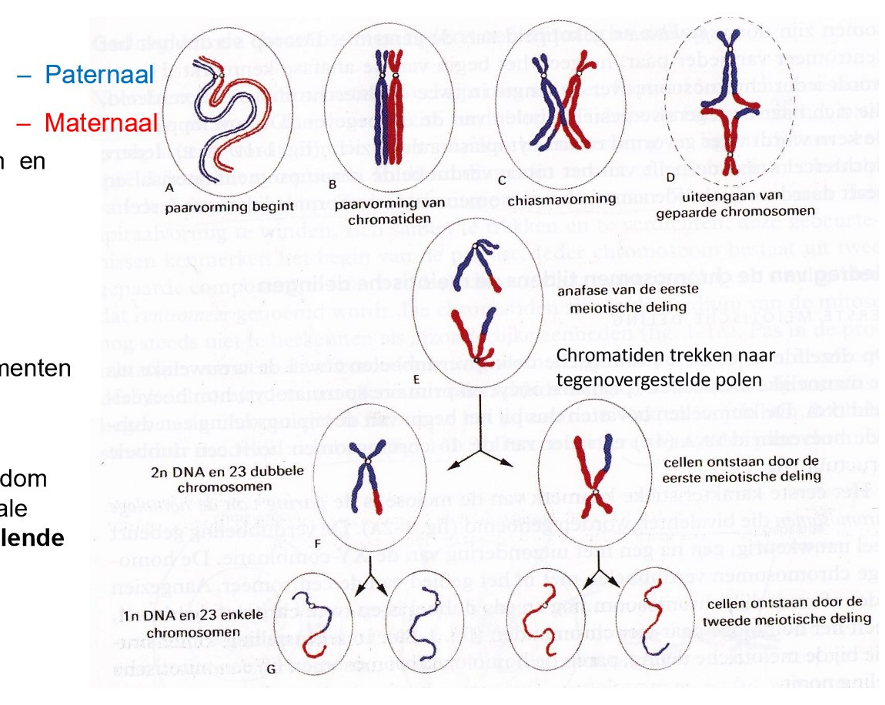
gametogenese: doel van meiose
halveren van aantal chromosomen & helft van hoeveelheid DNA ivg met somatische lichaamscel
vorming van een uniek genoom
→ door cross-over: vorming nieuwe chromosomen omdat chromatide segmenten worden uitgewisseld
→ als gevolg van random verdeling van paternale & maternale chromosomen: 223 genetisch verschillende gameten
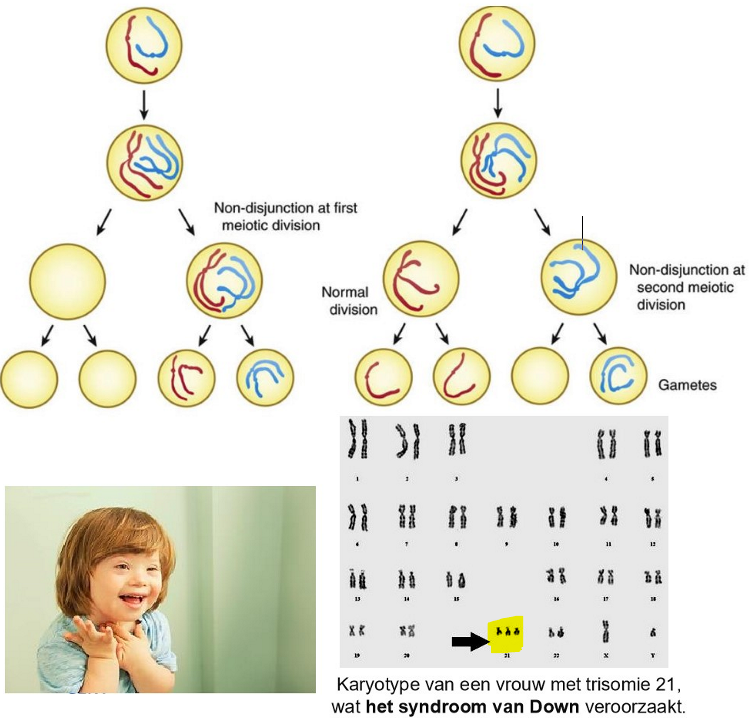
gametogenese: non-disjunctie tijdens de meiose & mitose
non-disjunctie
= tijdens 1e of 2e rijpingsdeling wijkt een chromosomenpaar niet uiteen
nondisjunctie van homologe chromosomenparen tijdens meiose I
nondisjunctie in meiose II ten gevolge van mislukte scheiding van zusterchromatiden
→ rijpe gameet heeft n+1 of n-1 chromosomen
algemeen: monosomie van een autosoom is niet levensvatbaar
Down-syndroom: trisomie van chromosoom 21
Klinefelter syndroom: 47, XXY (man)
gynecomastie, onderontwikkelde gonaden
Turner syndroom: 45, X (vrouw)
tijdens mitose: non-disjunctie kan ook optreden tijdens mitose (celdeling die plaatsvindt na bevruchting in somatische cellen)
kan resulteren in mosaïcisme = sommige cellen van het lichaam hebben dan een ander chromosomenaantal dan andere
→ naarmate een vrouw ouder wordt, neemt het risico op niet-disjunctie toe => vergroot de kans op chromosomale afwijkingen in de nakomeling, bv. Downsyndroom
gametogenese: spermatogenese
verloopt relatief snel, geen tussenperioden
spermatogonia blijven delen door mitose; gaan niet als groep in hun geheel in meiose
spermatozoïde = kleine, mobiele cel
1013 zaadcellen
elke cyclus van spermatogenese: duurt ± 64 dagen
spermatogoniale mitose: ± 16 dagen
1e meiotische deling: ± 8 dagen
2e meiotische deling: ± 16 dagen
spermiogenese: ± 24 dagen
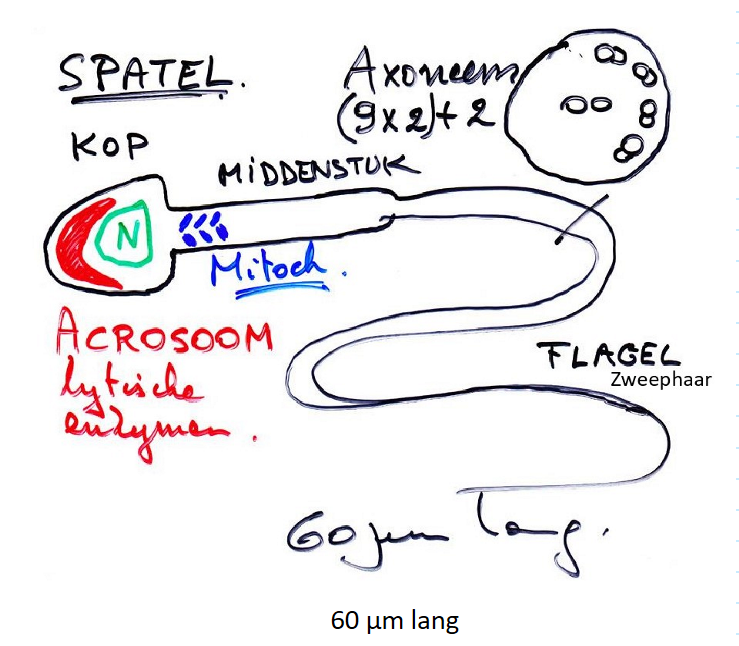
spermatogenese vs. spermiogenese
spermatogenese
= overkoepelende proces van spermavorming, start vanuit ongedifferentieerd spermatogoniale stamcellen & leidt tot productie van spermatiden
spermiogenese
= specifieke fase binnen spermatogenese die laatste transformatie van spermatiden naar volledig gevormde spermacellen omvat
samenvatting: spermatogenese vs. oogenese
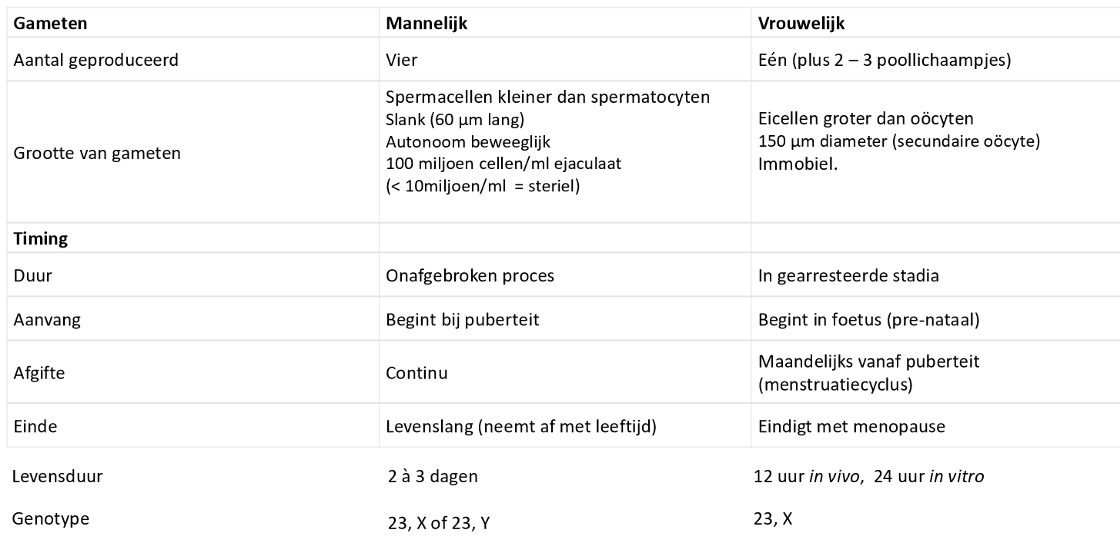
fertilisatie: meiotische gebeurtenissen tijdens de ovariële cyclus
proces van ovulatie (uitstoting van secundaire oöcyt uit follikel) → vergeleken met ontstekingsreactie
cascade van gebeurtenissen die uitmondt in ovulatie zou geïnitieerd worden door de afscheiding van histamine & prostaglandinen = ontstekingsmediatoren
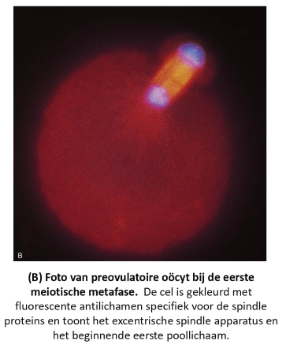
fertilisatie: de bevruchting
capacitatie
acrosoomreactie
fusie van membranen
afwerken meiose II oöcyte
vorming van pronuclei & versmelting van pronuclei
mitose = begin van klieving
capacitatie
= finale maturatie van spermatozoa (cAMP stijging) in vivo in eileider, in vitro door ‘wassen’ & verblijf in cultuurmedium
spermatozoa worden snel hypermobiel vanwege de zure omgeving van het vrouwelijke voortplantingskanaal → ze stijgen op richting de ampulla van de eileider
als levensvatbare sperma een geovuleerde eicel in de ampulla tegenkomen, omringen ze deze & beginnen ze zich een weg te banen door de cumulusmassa
in vitro bewijs suggereert dat de geovuleerde follikel een onbekende spermochemotropische factor bevat & dat alleen gecapaciteerde spermatozoïden in staat zijn om op deze factor te reageren door gericht te zwemmen richting het ei
→ menselijke sperma vindt het menselijke ei ‘aantrekkelijk’
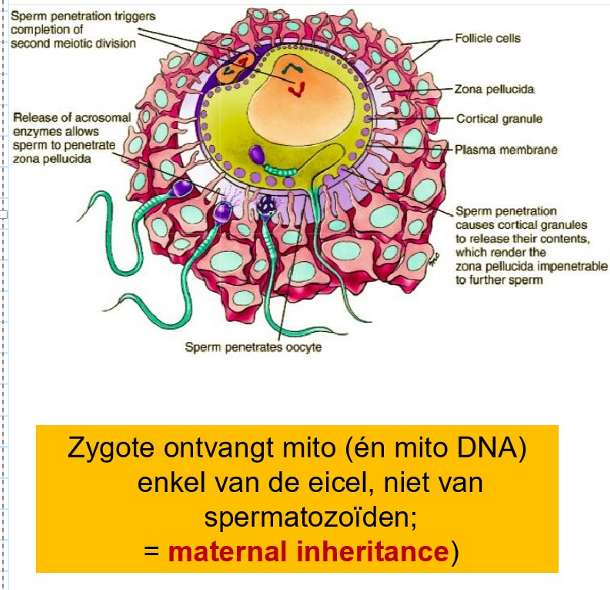
acrosoomreactie
= vrijkomen van degraderende enzymen (als resultaat van een soort specifieke interactie met een glycoproteïne spermareceptromolecuul in de zona = ZP2)
fusie van membranen
fusie van membranen veroorzaakt 2 gebeurtenissen:
vorming van een calciumgolf die zich over het oppervlak van het ei verspreidt vanaf het contactpunt met het sperma
vrijgave van de inhoud van duizenden kleine corticale granules (liggen net onder celmembraan van de oöcyt) in de perivitelline ruimte tussen oöcyt & zona pellucida
→ zona pellucida wordt ondoordringbaar (zona reactie) voor extra spermatozoa (om polyspermie te voorkomen)
afwerken meiose II oöcyte
(3e & 4e poollichaampje)
vorming van pronuclei & versmelting van pronuclei
→ diploïde zygote (2n, 2C)
mitose
= begin van klieving
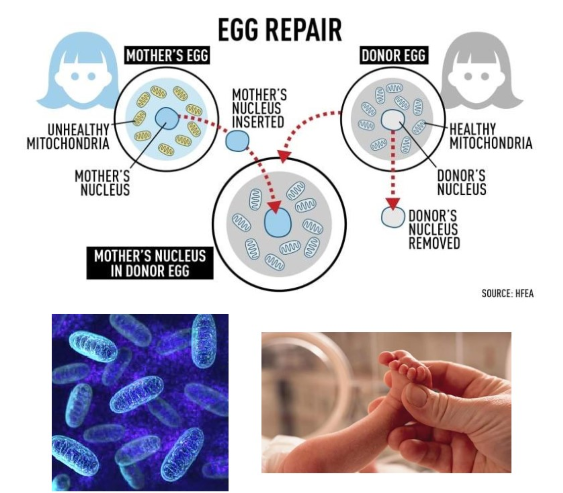
fertilisatie: 1e baby geboren met DNA van 3 mensen
Leigh-syndroom → zou fataal zijn voor elke baby
ernstige stofwisselingsziekte waarbij hersencellen beschadigd raken omdat ze onvoldoende energie krijgen
fout in DNA kan zowel in DNA van chromosomen zitten als in het DNA dat in de energiefabriekjes (mitochondriën) zelf zit
→ gewerkt met donor-ei:
resultaat: baby met 0,1% DNA van de donor (mitochondriaal DNA) & alle andere genetische informatie (zoals haarkleur, oogkleur & dergelijke) van de moeder & vader
fertilisatie: levensduur van gameten: natuurlijke anticonceptie

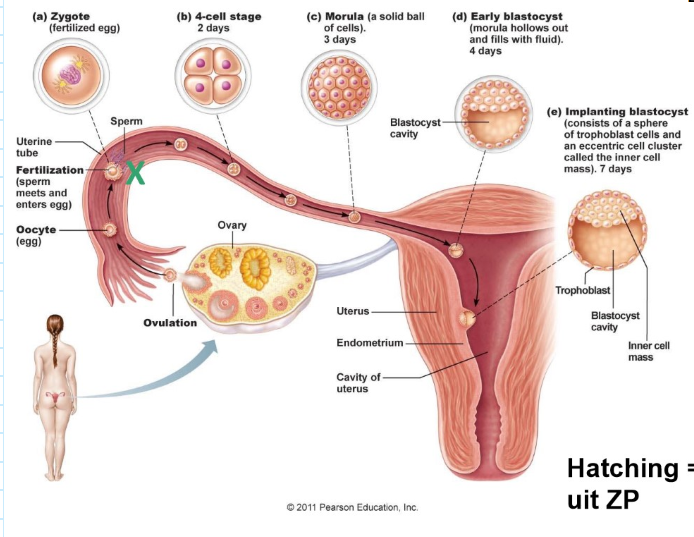
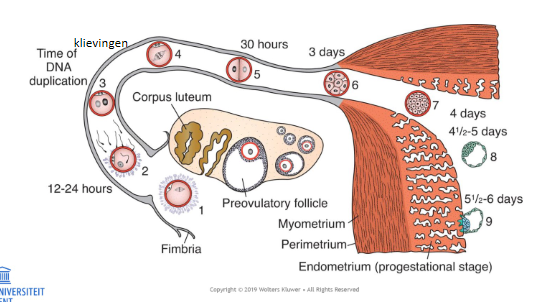
de klievingen: follikelontwikkeling, bevruchting & ontwikkeling van de zygote in de 1e week na de bevruchting
transport van de gameten:
spermatozoïden: sommige na 70 min aan het uiteinde van de eileider:
actief + contracties baarmoeder & eileider + chemoattractie
eicel: passief, peristaltiek eileider → in uterus na 4-5 dagen
X (op de foto): plaats van bevruchting
hatching = vrijkomen uit zona pellucida
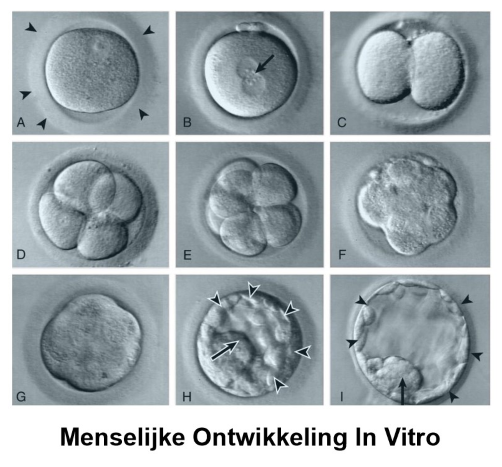
de klievingen: van zygote tot blastocyste
A) ovulerende secundaire eicel voor de introductie van sperma & bevruchting
eicel bevat zona pellucida (pijlpunten)
B) kort na in vitro fertilisatie (IVF) → vorming van mannelijke & vrouwelijke pronuclei (pijl)
C) tweecellig stadium
D) viercellig stadium
E) achtcellig stadium
F) start van de ontwikkeling van morula = initiatie van de compactie
G) morula
H) vroege blastocyst, met trofoblast (pijlpunten) & binnenste celmassa (pijl)
vrijkomen uit de zona pellucida heeft niet plaatsgevonden
I) ‘hatched’ blastocyst, met trofoblast (pijlpunten) & binnenste celmassa (pijl)
zona pellucida is verdwenen
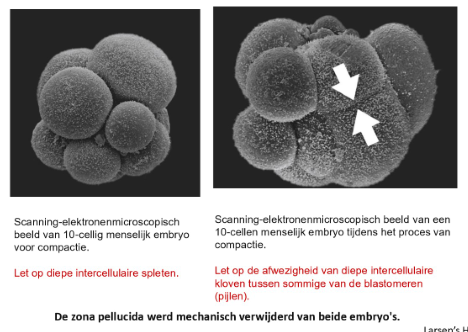
van morula stadium naar compactie
definitie: proces waarbij ronde blastomeren zich schikken in een veel dichter opeengepakte groep met tight junctions tussen de buitenste cellen & gap junctions tussen de binnenste cellen
→ hechting is het resultaat van de afzetting van E-cadherine, een calciumafhankelijke celadhesiemolecuul, op de laterale celoppervlakken
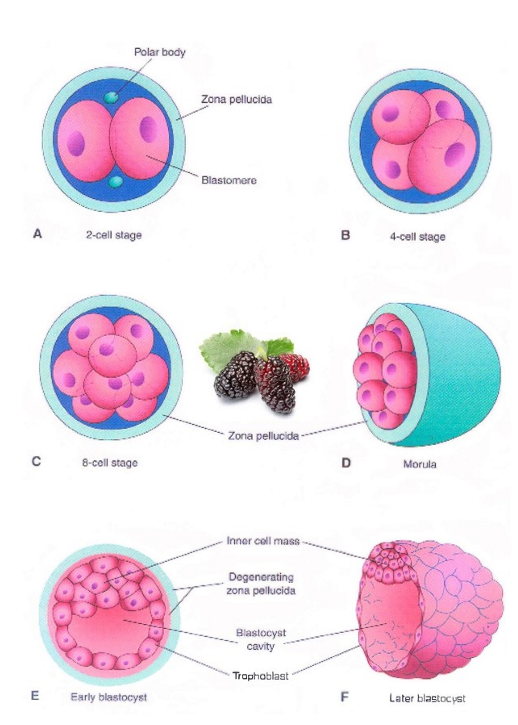
de klievingen: samenvatting
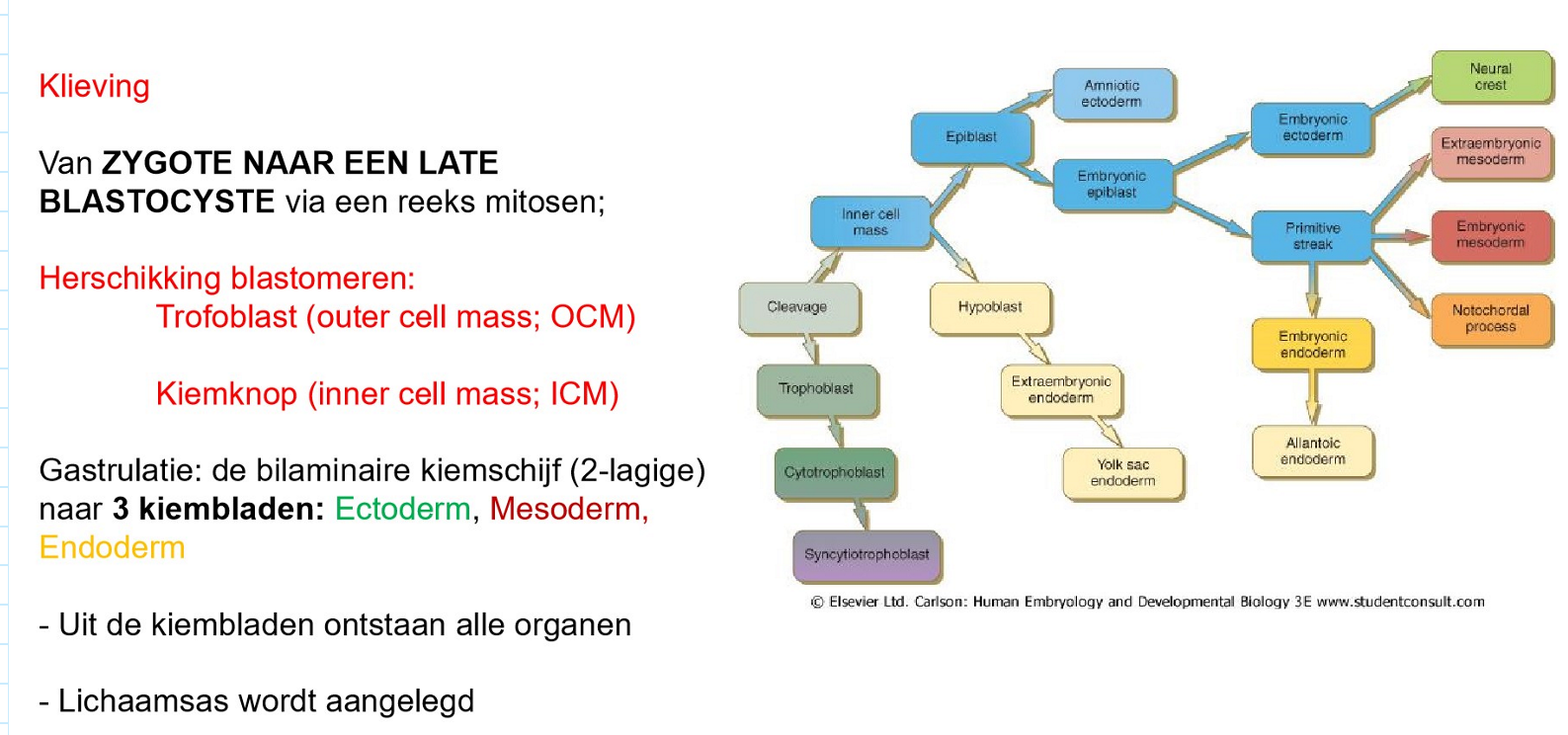
van zygote naar een late blastocyste → via reeks mitosen
dochtercellen van zygote = blastomeren
zygote → morula → vroege & late blastocyste
gebeurt in eileider & uterus
→ kenmerken:
blastomeren worden kleiner
compactie: blastomeren sluiten tegen elkaar aan door celcommunicatie
desintegratie van de zona pellucida (hatched blastocyst)
=> herschikking blastomeren:
trofoblast (outer cell mass; OCM)
kiemknop (embryoblast, inner cell mass; ICM)
Wat bepaalt of een blastomeer de embryoblast of trofoblast zal vormen?
inside-outside hypothese: differentiatie van blastomeren obv hun positie in ofwel embryoblast of trofoblast
→ meer centrale cellen van de morula worden inner cell mass, & cellen aan de buitenkant van de morula worden trofoblast
→ experimenten met functieverlies (loss-of-function) hebben aangetoond:
morula stadium:
uniforme expressie van 2 transcriptiefactoren in alle blastomeren:
Oct4
Nanog
=> behoud van expressie van Oct4 & Nanog in inner cell mass (ICM)
=> uitschakeling van expressie van Oct4 & Nanog in de trofoblast
trofoblast:
expressie van andere transcriptiefactoren:
Cdx2
T-box bevattende transcriptiefactor eomes
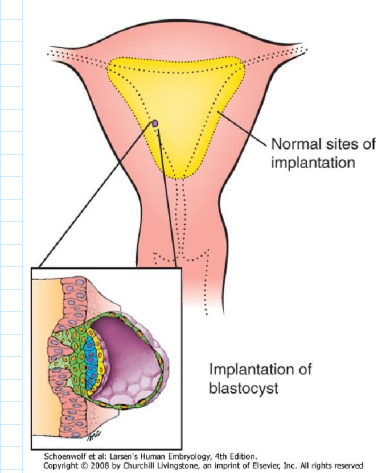
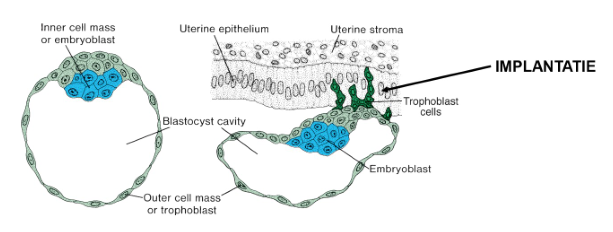
normale implantatie plaats
tijdens implantatie/ innesteling
differentiatie trofoblast
differentiatie endometrium (decidua-reactie)
vorming lacunen (= toekomstige intervilleuze ruimte)
ontwikkeling tot 2-lagige kiemschijf
epiblast (blauw) & hypoblast (geel)
vastlegging van de dorso-ventrale as
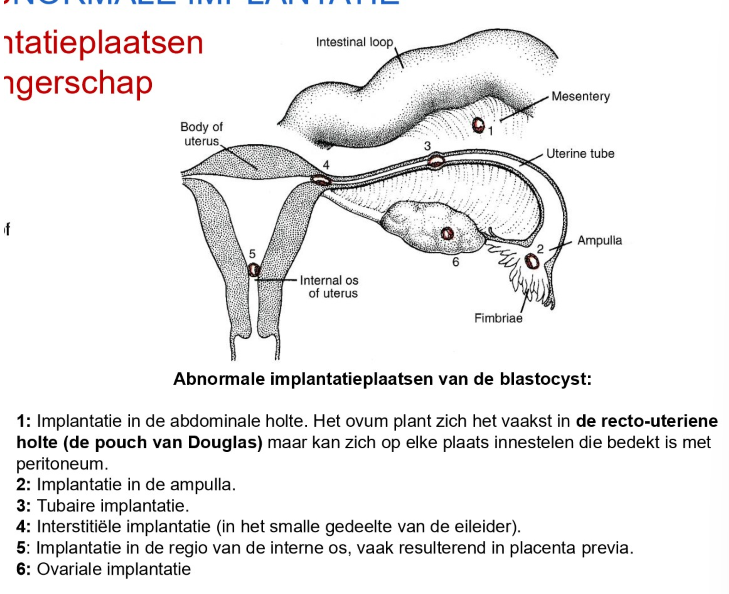
abnormale implantatie
= extra-uteriene zwangerschap
einde 1e week implantatie
blastocyst-blastula
5e dag: oplossen van zona pellucida = hatching
6-7e dag: implantatie
samenvatting: een overzicht van de processen die plaatsvinden tijdens de 1e week na de bevruchting
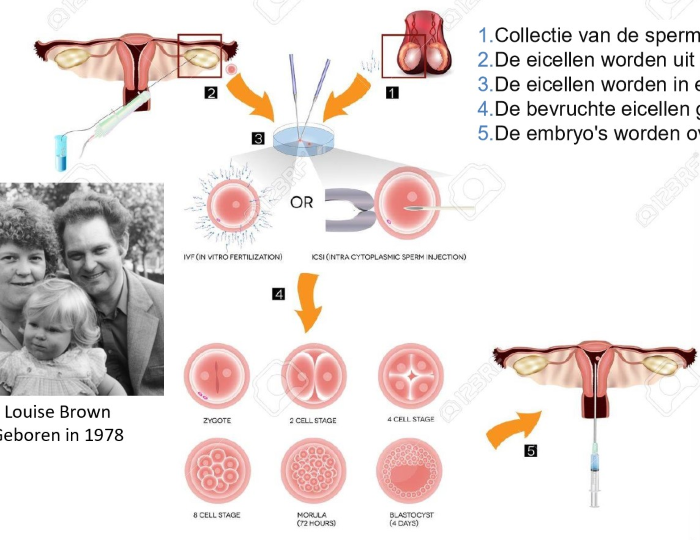
biomedische toepassingen: in vitro fertilisatie
collectie van de sperma cellen
eicellen worden uit de eierstok verwijderd
eicellen worden in een laboratorium bevrucht met sperma
bevruchte eicellen groeien
embryo’s worden overgebracht naar de baarmoeder
→ hormonale inductie van een ‘super-ovulatie’: meerdere rijpe follikels
fusie van gameten in vitro
(ICSI: injectiebevruchting, IntaCytoplasmic Sperm Injection)
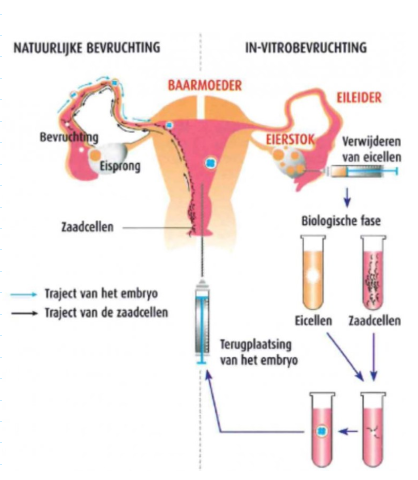
biomedische toepassingen: vergelijking van het proces van natuurlijke bevruchting vs. in vitro fertilisatie
natuurlijke bevruchting:
vrijkomen van een eicel uit de eierstok
bevruchting van de eicel door sperma
in vitro fertilizatie:
verwijderen van eicellen uit de eierstok
biologische fase waarin eicellen & zaadcellen in vitro gecombineerd worden
inplanting van het embryo in de baarmoeder
biomedische toepassingen: PGD
= prenatale genetische diagnostiek:
bij risico voor een aangeboren afwijking (beide ouders zijn heterozygoot)
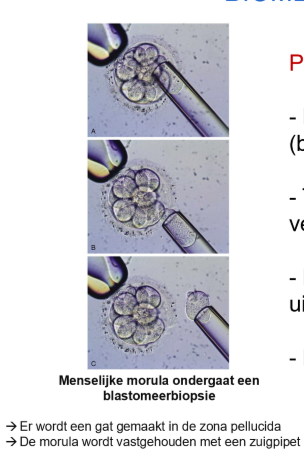
tijdens IVF worden per embryo enkele blastomeren verwijderd
DNA onderzoek van de blastomeren wordt uitgevoerd
normale kiemen worden ingeplant
samenvatting les 1

implantatie: stadia van implantatie → dag 7
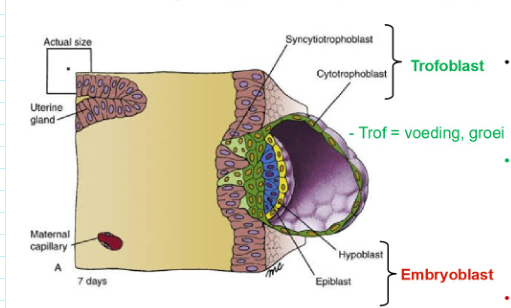
op dag 7: net uitgekomen blastocyst maakt contact met uteriene endometrium & begint te implanteren
trofoblast op embryonale pool van blastocyst
vermenigvuldigt zich om invasieve syncytiotrofoblast te vormen → begint blastocyst in uteriene wand te trekken
embryoblast = bilaminair → bestaat uit:
epiblast
hypoblast
→ bilaminaire kiemschijf
syncytium
= massa cytoplasma die talrijke verspreide kernen bevat
kernen = syncytiotrofoblast
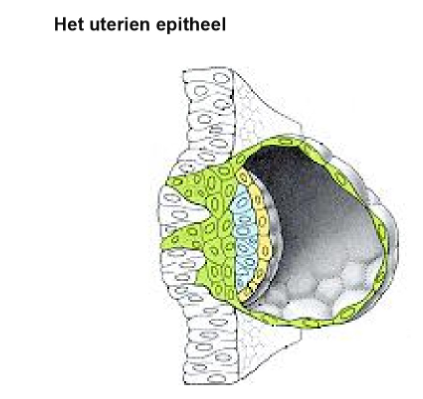
decidua-reactie: decidua
= reactie van baarmoederslijmvlies op een beginnende zwangerschap
endometrium-laag wordt breder
endometrium = baarmoederslijmvlies, bestaat uit eenlagig epitheel met diep daarvan het stroma
klieren van endometrium worden actiever
stromacellen slaan glycogeen & lipiden op en zullen opgenomen worden in uitbreidende syncytiotrofoblast = vroege energiebron voor de zich ontwikkelende kiem
stroma = bindweefsel
arteriën gaan in endometrium dilateren & zich spiralig kronkelen
(placenta = extra-embryonair orgaan met maternale component (decidua) & embryonale component (het chorion))
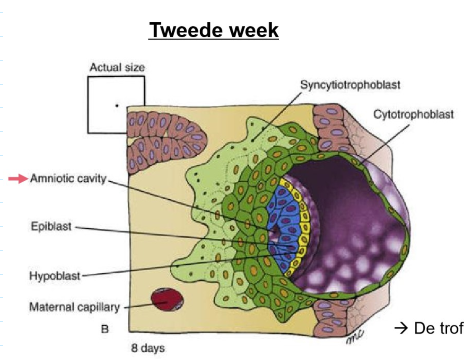
implantatie: stadia van implantatie → dag 8
dag 8: vorming van amnionholte binnen de epiblast
implantatie gaat door & groeiende syncytiotrofoblast breidt zich uit om meer van blastocyst te bedekken
proteolytische enzymen (bv. metalloproteïnasen) → worden afgescheiden door cytotrofoblast
om extracellulaire matrix tussen endometrium af te breken
→ trofoblast invadeert endometrium & trekt kiemknop mee
‘gecontroleerde invasie’ <> kanker (niet gecontroleerde invasie)
implantatie: stadia van implantatie → dag 9
op dag 9: embryo volledig geïmplanteerd in uteriene endometrium
amnionholte breidt zich uit & cellen van hypoblast beginnen te migreren → vormen Heuser’s membraan
trofoblastische lacunes vormen zich in syncytiotrofoblast
syncytiotrofoblast → omringen nu het embryo volledig
punt van implantatie → gemarkeerd door tijdelijke coagulatieplug in oppervlak van endometrium

implantatie: wat reguleert de initiële fase van implantatie → blastocyst aanhechting aan baarmoederepitheel?
voor ongeveer 6 of 7 dagen na bevruchting: zowel blastocyst als apicale oppervlak van uterien epitheel zijn niet-hechtend
baarmoeder doorloopt ontvankelijke & niet-ontvankelijke fasen
gedurende relatief korte periode = implantatievenster
baarmoeder open voor implantatie
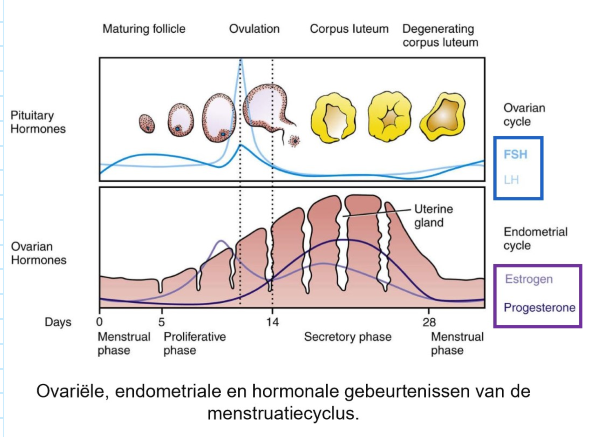
ovariële cyclus:
hypofyse follikelstimulerend hormoon (FSH) & luteïniserend hormoon (LH) → regelen productie van oestrogeen & progesteron door reagerende follikels & corpus luteum van eierstok
ovariële hormonen beheersen cyclus van uteriene endometrium
het baarmoederslijmvlies:
oestrogeen: (werkend via oestrogeenreceptor) stimuleert uteriene endometrium om te prolifereren door productie van groeifactoren zoals insulin-like growth factor 1 te induceren
voorkomt geprogrammeerde celdood binnen uterien epitheel
progesteron: (werkend via progesteronreceptor) induceert transcriptiefactor hand-2 → blokkeert doorgaande endometriale groei & maakt implantatie mogelijk
naarmate baarmoeder de ontvankelijke fase ingaat → hoeveelheid apicale glycocalyx neemt af (= polysacharide matrix oppervlaktecoating van uteriene epitheelcellen → overvloedige hoogmoleculaire mucine glycoproteïnen)
de blastocyst:
ondergaat een rijping van hechtingsincompetente fase naar hechtingscompetente fase (expressie van perlecan, heparaansulfaat proteoglycaan, op zijn oppervlak)
aanwezigheid van niet-hechtende zona pellucida vóór uitkomen van blastocyst voorkomt hechting van blastocyst
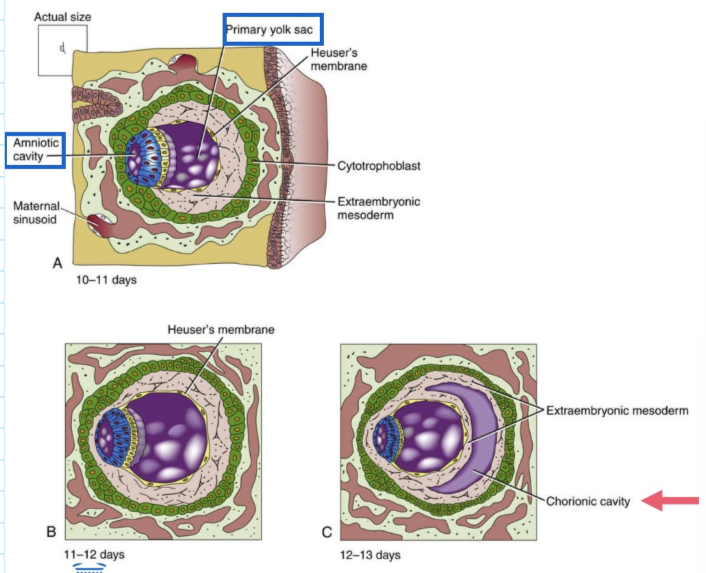
implantatie: ontwikkeling van chorionholte → ontwikkeling van extra-embryonaal mesoderm: midden van de 2e week
tussen dag 10 & 11:
ruimte tussen Heuser’s membraan & cytotrofoblast wordt gevuld met los geassocieerde extra-embryonale mesodermale cellen
trofoblastische lacunes verbinden zich met moederlijke haarvaten & raken gevuld met bloed
tussen dag 11 & 12:
extra-embryonale mesoderm breidt zich uit tussen amnion & cytotrofoblast
tussen dag 12 & 13:
extra-embryonale mesoderm splitst in 2 lagen:
1 die buitenkant van Heuser’s membraan bedekt
1 die binnenkant van cytotrofoblast bekleedt
→ ruimte tussen de 2 lagen = chorionholte
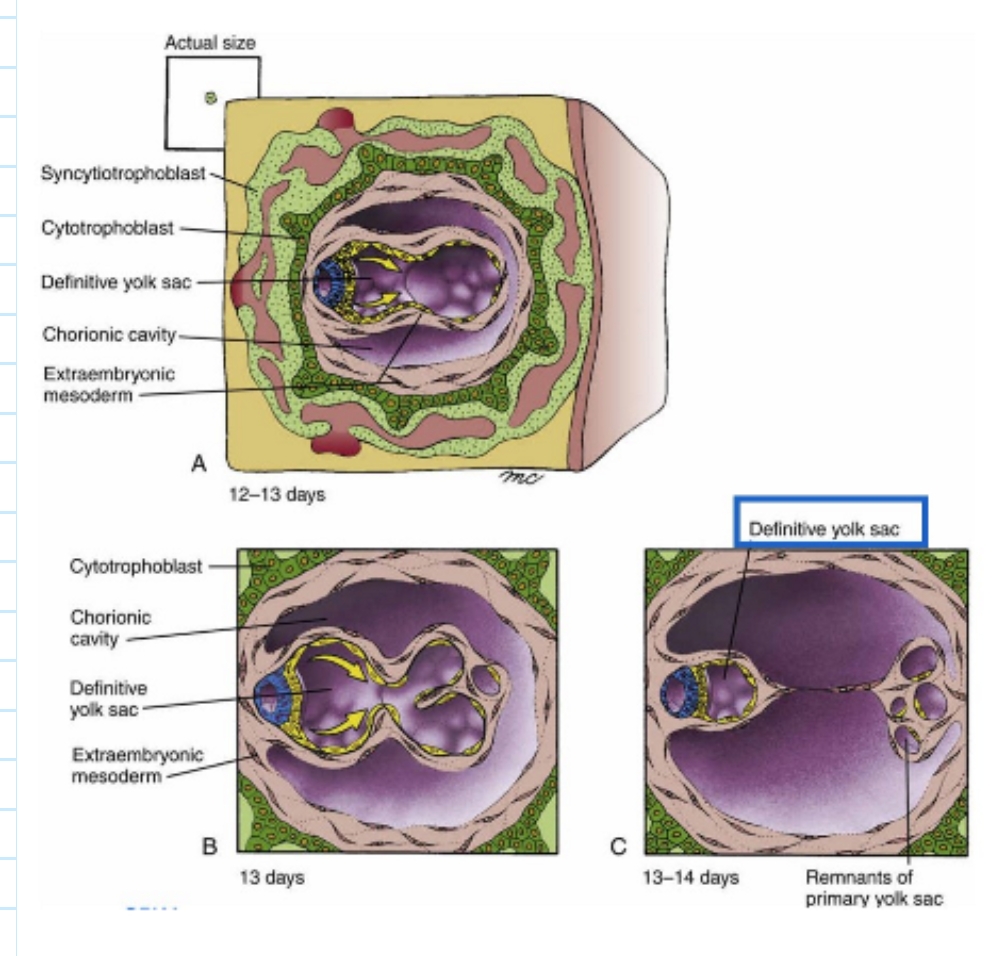
overzicht: ontstaan van chorionholte/ extra-embryonaal coeloom
nieuwe ruimte (= extra-embryonale coeloom/ chorionholte) wordt gevormd door splitsen van extra-embryonale mesoderm in 2 lagen
met het splitsen van het extra-embryonale mesoderm in 2 lagen, worden amnion, dooierzak & chorion allemaal structuren met 2 lagen:
amnion & chorion → uit extra-embryonaal ectoderm & mesoderm
dooierzak → uit extra-embryonaal endoderm & mesoderm
implantatie: ontwikkeling definitieve (secundaire) dooierzak + degeneratie van primaire dooierzak → functie van de definitieve dooierzak gedurende de 4e week:
extra-embryonaal mesoderm dat buitenlaag van dooierzak vormt, is belangrijke plaats van hematopoëse (bloedvorming) → mesoderm
primordiale geslachtscellen worden voor het eerste geïdentificeerd in wand van dooierzak → endoderm
→ na 4e week: dooierzak wordt snel overgroeid door zich ontwikkelende embryonale schijf
→ dooierzak verdwijnt voor de geboorte, maar zeldzaam blijft deze bestaan in vorm van: Meckel’s divertikel
implantatie: ontwikkeling definitieve (secundaire) dooierzak + degeneratie van primaire dooierzak
tussen dag 12 & 13:
2e migratiegolf van hypoblastcellen zorgen voor nieuw membraan dat zich uitstrekt over binnenkant van extra-embryonale mesoderm → primaire dooierzak wordt voor zich uitgeduwd
nieuwe laag = endodermale bekleding van de secundaire (definitieve) dooierzak
dag 13:
definitieve dooierzak ontwikkelt zich & primaire dooierzak valt uiteen
exocoeloomkysten worden afgesnoerd
→ holten: amnionholte - definitieve dooierzak - chorionholte
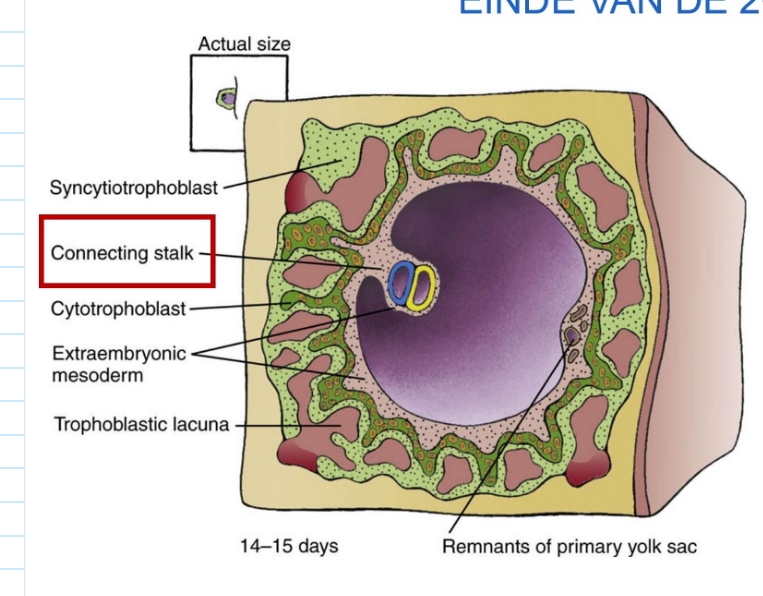
implantatie: einde van 2e week
definitieve dooierzak verliest contact met restanten van primaire dooierzak
bilaminaire embryonale schijf met dorsale amnion & ventrale dooierzak hangt in chorionholte, opgehangen aan een dikke verbindingssteel
→ connecting stalk = hechtsteel = voorloper van navelstreng
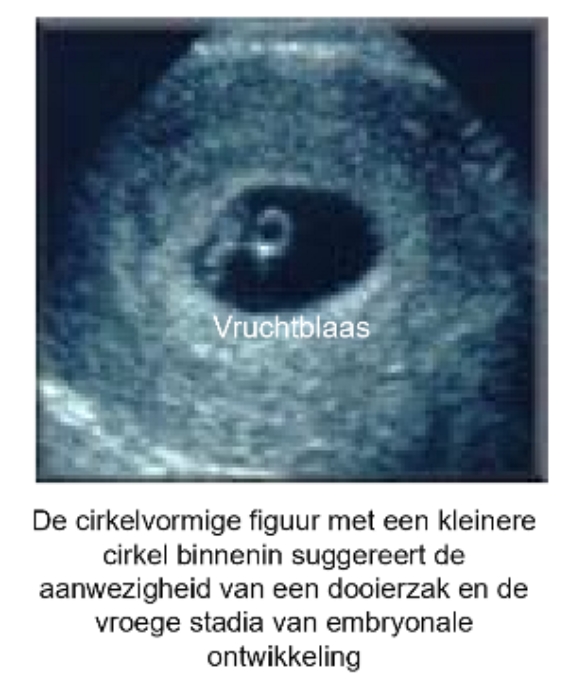
implantatie: transvaginale ultrasonography: einde 2e week
zeer vroege prenatale echografie, vaak aangeduid als vruchtblaas (gestational sac) → in 1e trimester van zwangerschap
echobeelden worden gebruikt om:
zwangerschap te bevestigen
gezondheid & ontwikkeling van embryo te controleren
om zwangerschap te dateren
samenvatting: ontwikkeling van holtes
1e nieuwe holte die zich vormt tijdens 2e week = amnionholte
verschijnt op dag 8 als vocht begint te verzamelen tussen cellen van epiblast & overliggende trofoblast
1e migratiegolf begint op dag 8 → vormt primaire dooierzak (exocoelomische membraan/ Heuser’s membraan)
rond dag 12 of 13: primaire dooierzak verplaatst (& uiteindelijk afgebroken) door 2e golf van migrerende hypoblastcellen → vormt secundaire dooierzak
tegen dag 13: embryonale schijf hangt met dorsale amnion & ventrale dooierzak uitsluitend door een dikke steel van extra-embryonaal mesoderm (= verbindingssteel) in de chorionholte
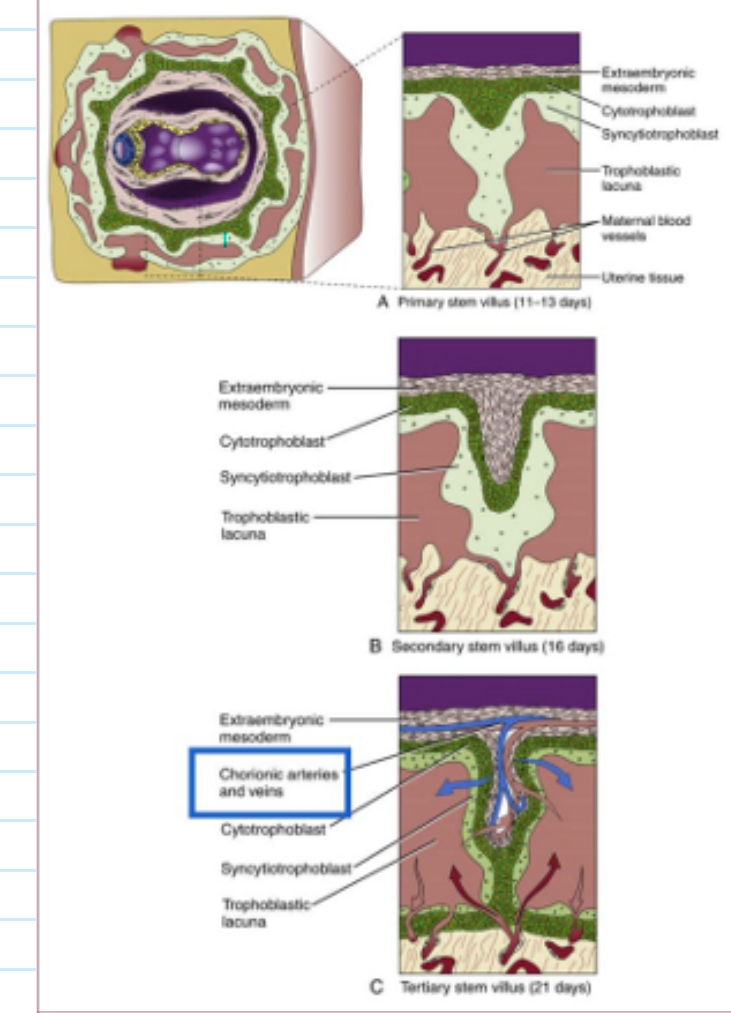
implantatie: ontwikkeling van de chorionvilli
primaire villi
op dagen 11 tot 13
cytotrofoblastische proliferaties die uitbotten in bovenliggende syncytiotrofoblast
→ primaire: cytotrofoblast & syncytiotrofoblast
secundaire villi
tegen dag 16
extra-embryonale mesoderm begint te prolifereren & dringt midden van elke primaire villi binnen
→ secundaire: met ingroei extraembryonaal mesoblast
tertiaire villi
tegen dag 21
mesodermale kern differentieert tot bindweefsel & bloedvaten
→ tertiaire: met ingroei van embryonale bloedvaten
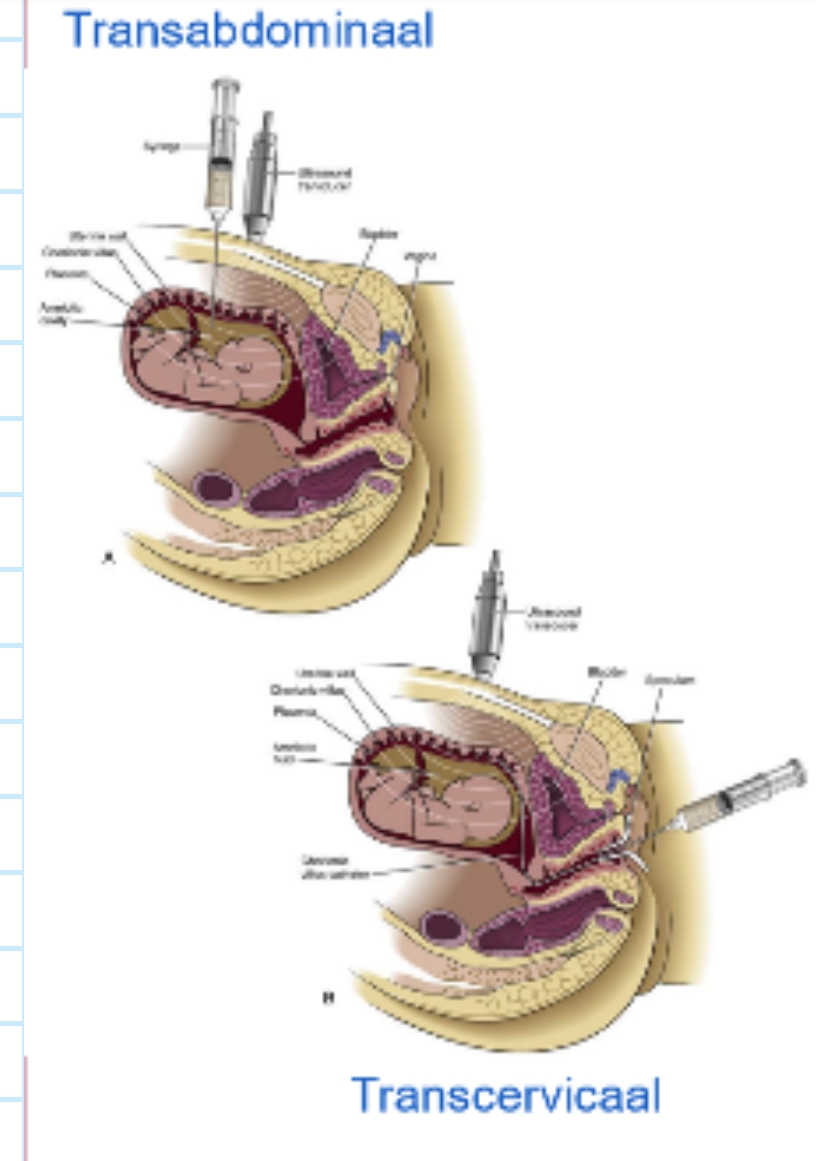
implantatie: biomedische toepassingen → chorion biopsie
Vlokkentest (CVS = Chorionic Villus Sampling)
prenatale diagnostische procedure: om bepaalde genetische & chromosomale afwijkingen bij de foetus op te sporen
staalname van chorionvlokken
cellen bevatten hetzelfde genetische materiaal als cellen van de foetus → waardevolle bron voor genetisch onderzoek
genetisch, morfologisch, biochemisch onderzoek
doorgaans uitgevoerd tussen 10e & 12e week van de zwangerschap
op 2 manieren:
via de cervix → transcervicaal
door de buikwand → transabdominaal
belangrijkste voordeel van CVS tov andere prenatale tests (bv. amniocentese = vruchtwaterpunctie): kan eerder in zwangerschap uitgevoerd worden
→ chorion & trofoblast delen dezelfde genetische informatie omdat ze beide afkomstig zijn van dezelfde bevruchte eicel & dus hetzelfde DNA delen
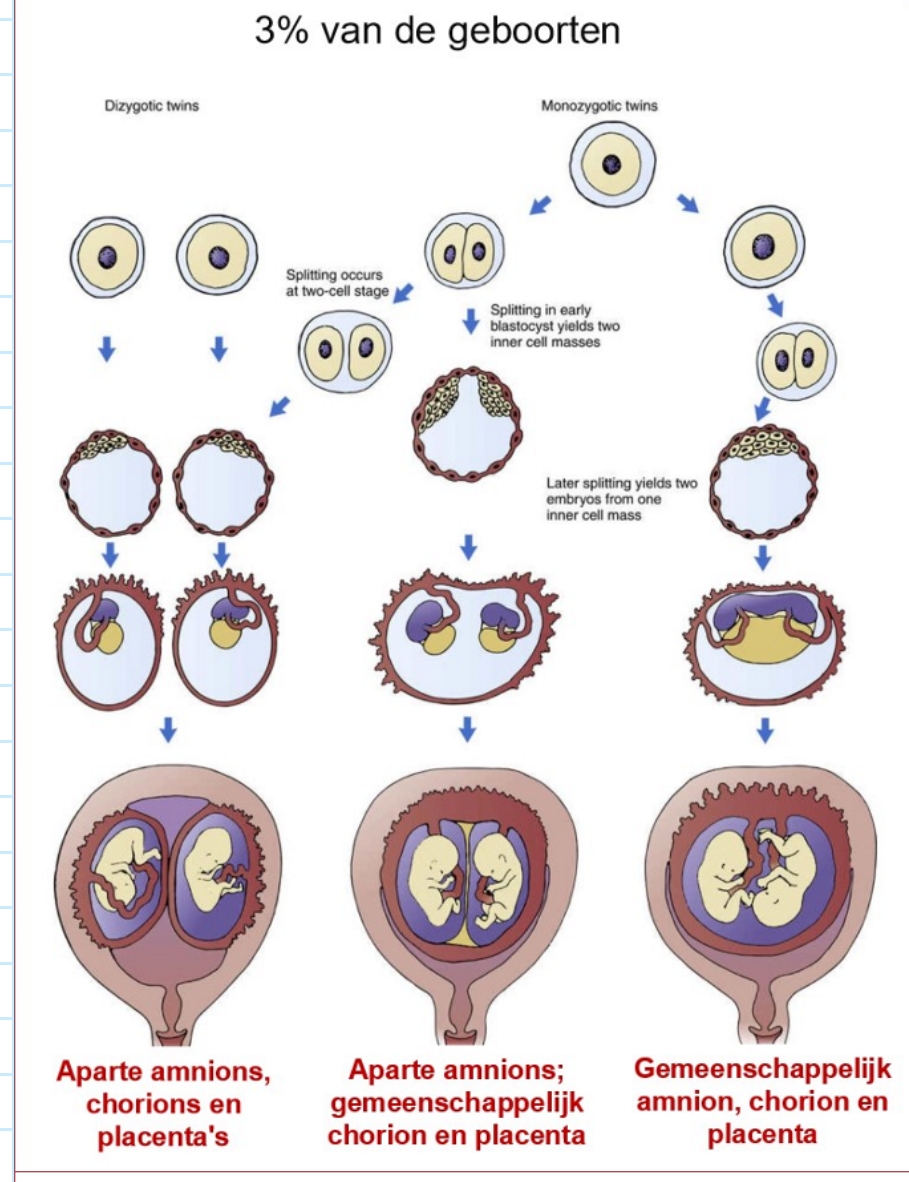
implantatie: tweelingen → soorten (+ holten)
mate waarin monozygote tweelingen membranen delen, hangt af van stadium van ontwikkeling waarin oorspronkelijk enkele embryo zich scheidt in 2 embryo’s:
splitsing in tweecellige stadium van celdeling:
tweelingen zullen zich net zo afzonderlijk ontwikkelen als dizygote tweelingen
splitsing resulteert in blastocyst met 2 binnenste celmassa’s:
embryo’s delen chorion & placenta, maar bevinden zich in aparte amnions
splitsing na vorming van binnenste celmassa:
embryo’s zullen zich in een enkel amnion bevinden
implantatie: tweelingen
bij tweelingzwangerschappen kunnen anastomosen vormen tussen vaten die 2 placenta’s voorzien van bloed
gedeelde circulatie vormt meestal geen probleem, tenzij 1 van de tweelingen laat in de zwangerschap overlijdt of als bloeddruk van 1 tweeling significant daalt → overgebleven tweeling loopt dan risico
als 1 tweeling overlijdt → andere tweeling kan gedood worden door embolie (= geblokkeerd bloedvat) veroorzaakt door stukjes weefsel die loskomen in overleden tweeling & in gedeelde circulatie terechtkomen
als bloeddruk van 1 tweeling scherp daalt → andere tweeling kan aan hartfalen lijden omdat hart probeert beide circulatiesystemen tegelijkertijd te vullen
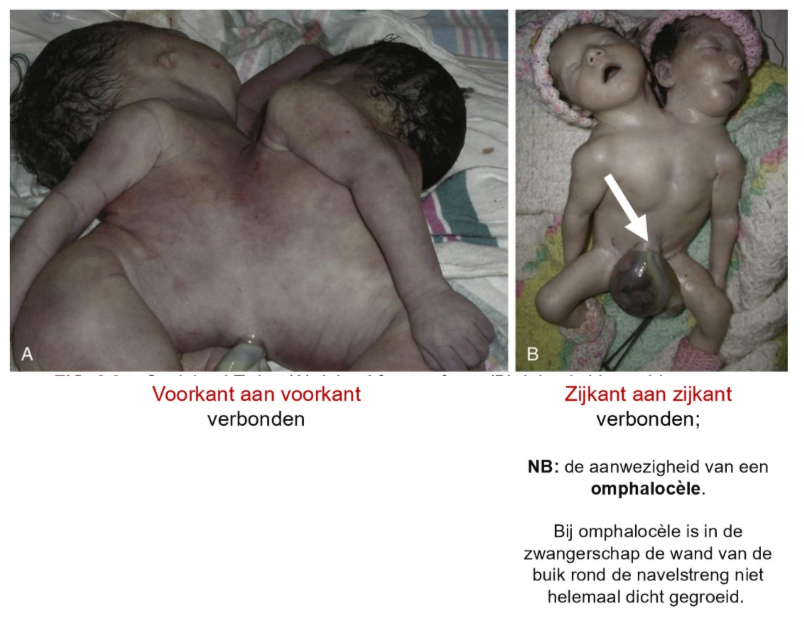
implantatie: Siamese tweelingen
in zeldzame gevallen kunnen zulke tweelingen niet volledig van elkaar scheiden
→ resulteert in geboorte van Siamese tweelingen
Siamese tweelingen ontstaan wanneer splitsing van een bevruchte eicel niet volledig plaatsvindt
splitsing gebeurt meestal tussen 13e & 15e dag na bevruchting → als splitsing later dan dit tijdstip plaatsvindt, kan dit resulteren in Siamese tweelingen
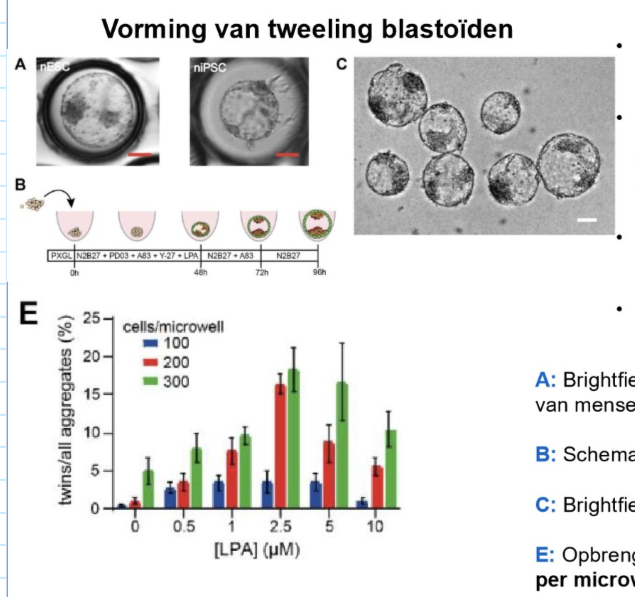
implantatie: 1e synthetische menselijk tweeling-embryo
¾ van identieke tweelingen deelt eenzelfde placenta tijdens zwangerschap
wetenschappers van MERLN-instituut van Universiteit Maastricht & van Maastricht UMC → hebben embryostructuur van een menselijke eeneiige tweeling gemaakt uit stamcellen, zonder eicel of spermacel te gebruiken
wetenschappers zien dus voor het eerste hoe tweeling wordt gevormd → was tot nu toe onduidelijk maar vinding werpt daar licht op
A) Brightfield-afbeelding van tweeling blastoïde gegenereerd in microwellen van menselijke naïeve embryonale cel lijnen
B) schematische weergave van tweelingsvormingsproces
C) Brightfield-afbeelding van representatieve set tweeling blastoïden
E) opbrengst van tweeling blastoïden gemeten als percentage blastoïden per microwell bij verschillende concentraties van lysophosphatidic acid & met verschillende start cel zaai dichtheden
→ synthetische embryo uit stamcellen blijkt voldoende werkelijkheidsgetrouw te zijn om bruikbare effectieve kennis over biologische embryo’s te verhogen
huidige onderzoek richt zich op praktische toepassingen: verhoogt kennis over miskramen & onvruchtbaarheid en kan helpen bij succesvolle vervulling van kinderwens of juist bij verbeterde contraceptie
tweelingzwangerschappen gaan vaker gepaard met complicaties die ontstaan tijdens vroege innesteling → kunnen nu in kaart worden gebracht & mogelijk worden voorkomen of behandeld
techniek zoomt in op ontstaan, diagnose, behandeling & voorkomen van talloze (vroege) menselijke ziektebeelden
implantatie: ontwikkeling van uteroplacentaire circulatie
tijdens 1e week van ontwikkeling:
embryo krijgt voedingsstoffen & verwijdert afvalstoffen door eenvoudige diffusie
→ snelle groei van embryo maakt efficiëntere methode van uitwisseling noodzakelijk
→ vervuld door uteroplacentaire circulatie
maternaal & foetaal bloed stroomt door placenta → komt dicht bij elkaar & kan gassen en metabolieten uitwisselen door diffusie
→ systeem vormt zich op dag 9 = wanneer vacuolen (= trofoblastische lacunes) zich openen binnen syncytiotrofoblast
samenvatting van de implantatie
tijdens implantatie/ innesteling:
ontwikkeling tot 2-lagige kiemschijf
vorming van amnionholte & primitieve dooierzak
vorming van chorionholte
differentiatie trofoblast
differentiatie endometrium (decidua-reactie)
vorming lacunen (= toekomstige intervilleuze ruimte)
gastrulatie
= dag 15 tot 21 na bevruchting
gastrulatie: ingressie van epiblastcellen
3e week
gastrulatie
= proces waarbij bilaminaire kiemschijf (2-lagige) wordt omgevormd in embryo met 3 kiembladen:
ectoderm
mesoderm
endoderm
→ via ingressie (= migratie) van epiblastcellen langs primitieve streep
uit kiembladen ontstaan alle organen
lichaams-as wordt aangelegd
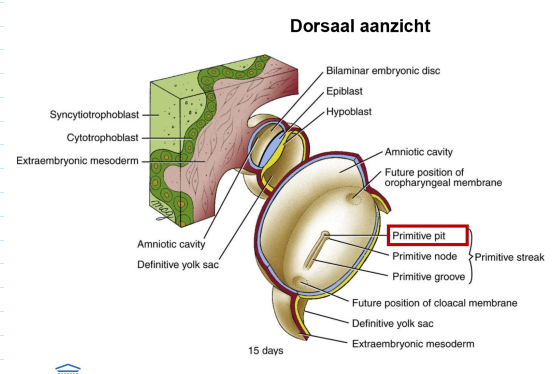
gastrulatie: 3e week (dag 15 tot 21) → dag 15
rond dag 15:
vorming van verdikking met middellijnsgroef langs midsagittale vlak van embryonale schijf
in de loop van dag 16:
verdikking verlengt zich = primitieve streep → instrumenteel voor gastrulatie
primitieve groef → wordt dieper & meer gedefinieerd
craniale einde van primitieve streep = primitieve knoop
depressie, caudaal continu met de primitieve groef = primitieve put
→ 3e week: organogenese start
hart & bloedvaten
neurale buis, chorda dorsalis, allantois
→ vastleggen cephalocaudale-as
→ vastleggen linker/ rechter-as
gastrulatie: ingressie van epiblastcellen tijdens de gastrulatie
op dag 16:
epiblastcellen naast de primitieve streep verplaatsen zich naar de primitieve streep → ondergaan epitheliaal-naar-mesenchymale transitie (EMT)
tijdens EMT: epiblastcellen rekken zich vaak uit & maken hun los van hun buren → migreren dan naar ruimte tussen epiblast & hypoblast (of in hypoblast zelf)
gastrulatie = collectieve beweging van cellen door de primitieve streep & naar interieur van embryo
dit proces vormt 3 primaire kiemlagen
→ 1e binnendringende epiblastcellen vallen hypoblast binnen & verplaatsen deze cellen
hypoblast uiteindelijk volledig vervangen door nieuwe laag cellen = definitieve endoderm
definitieve endoderm: geeft aanleiding tot bekleding van toekomstige darm & darmderivaten (longen)
epiblast die op dag 16 binnendringt migreert tussen endoderm & epiblastlagen → vormt intra-embryonaal mesoderm
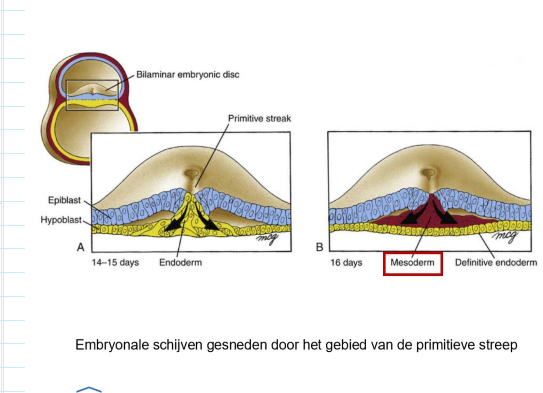
gastrulatie: migratiepaden van mesoderm tijdens gastrulatie
cellen die meer caudaal door primitieve streep binnendringen → migreren om mesoderm te vormen dat aan weerszijden van middenlijn ligt
meest craniaal migrerende van deze cellen → cardiogene mesoderm
beweegt craniaal naar toekomstige positie van orofaryngeale membraan (craniale ovale structuur)
meer lateraal migrerende van deze cellen → vormt paraxiale, intermediaire & laterale plaat mesoderm
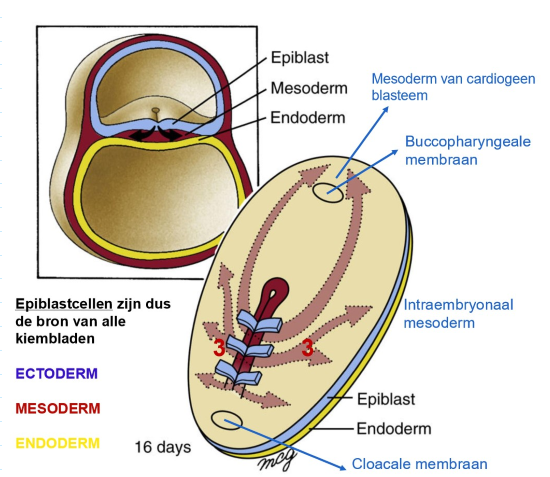
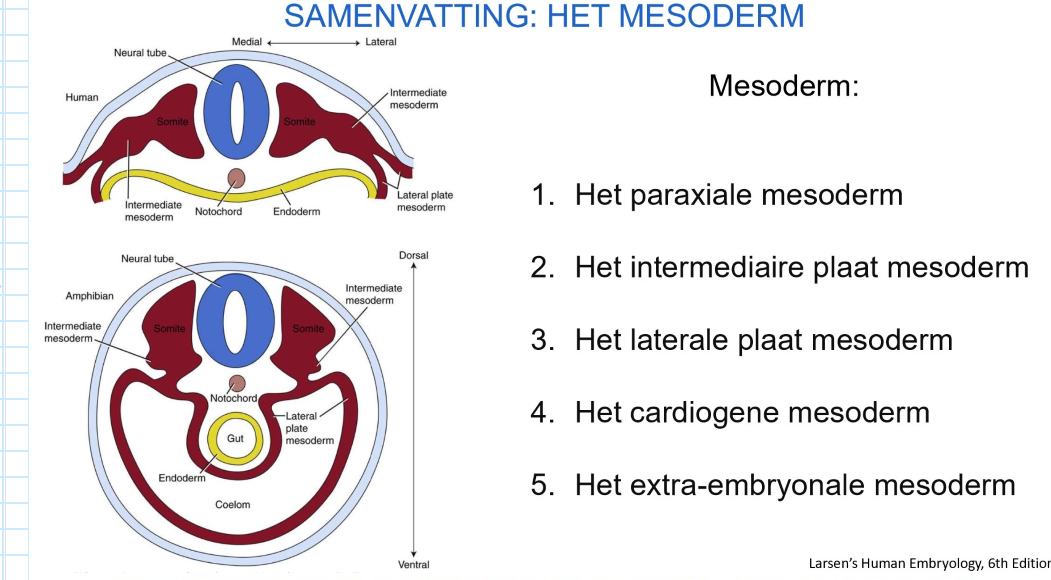
samenvatting: het mesoderm
paraxiale mesoderm
intermediaire plaat mesoderm
laterale plaat mesoderm
cardiogene mesoderm
extra-embryonale mesoderm
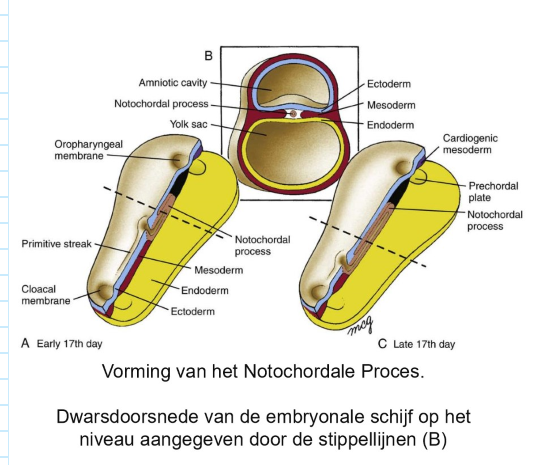
gastrulatie: omvorming chorda uitsteeksel
groeiende holle notochordale proces craniaal vanuit primitieve knoop (ontleed in midsagittale vlak)
veranderingen in relatieve lengte van notochordale proces & primitieve streep naarmate embryo groeit
fusie van ectoderm & endoderm in orofaryngeale & cloacale membranen
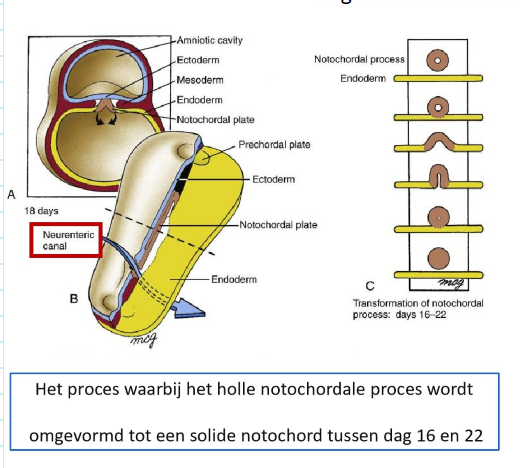
gastrulatie: omvorming chorda uitsteeksel → notochordale plaat
holle notochordale proces naar solide notochord → tussen dag 16 & 22
eerst fuseert ventrale wand van notochordale proces met endoderm → 2 lagen breken af, waardoor afgeplatte notochordale plaat achterblijft
proces begint aan caudale einde van notochordale proces (B) & vordert craniaal (stippellijn markeert niveau van A)
→ open neuraal kanaal wordt tijdelijk gecreëerd tussen amniotische holte & dooierzakholte (neurenterisch kanaal)
→ reeks gebeurtenissen waardoor notochordale proces notochordale plaat wordt & vervolgens het notochord (C)
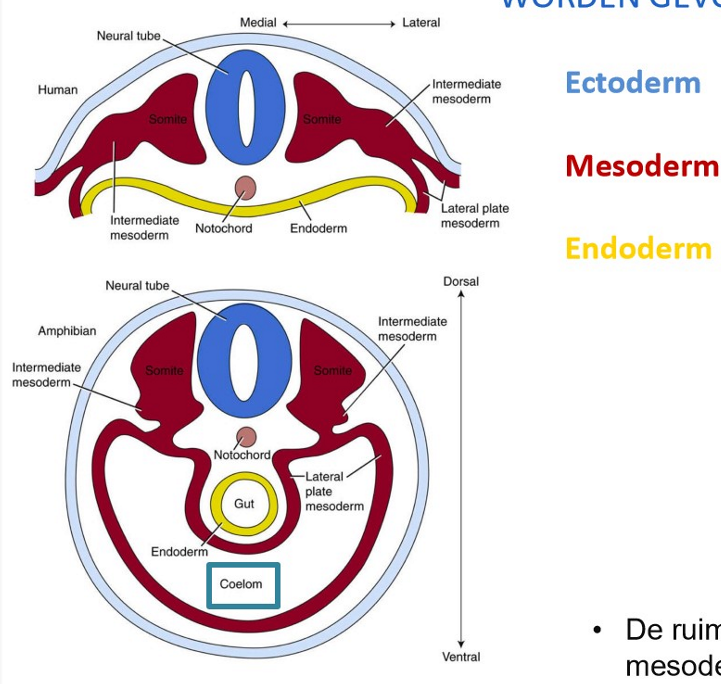
bestemming van de 3 kiembladen: differentiatie van het mesoderm
de buitenste ectodermale buis (huid) & binnenste endodermale buis (darm) worden gevormd door ‘body folding’
vroeg op dag 17: mesoderm begint zich te differentiëren:
paraxiaal (somieten)
intermediair (urinewegsysteem & delen van geslachtssysteem)
laterale plaat mesoderm
→ ruimte tussen de 2 buizen wordt voornamelijk opgevuld met mesoderm
deel van laterale plaat mesoderm splitst zich om lichaamsholte (= coeloom) te vormen
bestemming van de 3 kiembladen: differentiatie van het mesoderm → dag 17 tot 21
neurale buis → geïnternaliseerd tijdens proces van neurulatie
van buitenste ectodermale buis
op dag 18: laterale plaat begint te splitsen:
intra-embryonale coeloom
somatisch & splanchnisch mesoderm
→ laterale plaat mesoderm geeft aanleiding tot sereuze membranen die het coeloom bekleden
somatische mesoderm bedekt binnenste oppervlakte van lichaamswand
splanchnische mesoderm omhult darmbuis
op dag 21:
notochord, somieten & intermediaire mesoderm goed gevormd, splitsing van laterale plaatmesoderm is voltooid
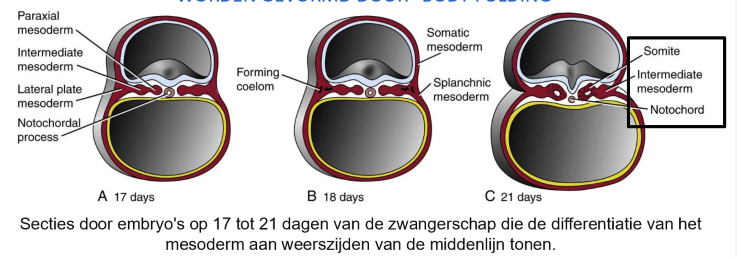
samenvatting: dag 17 → differentiatie mesoderm
paraxiaal (somieten)
intermediair (urinewegsysteem & delen van geslachtssysteem)
laterale plaat mesoderm
somatische mesoderm
splanchnische mesoderm
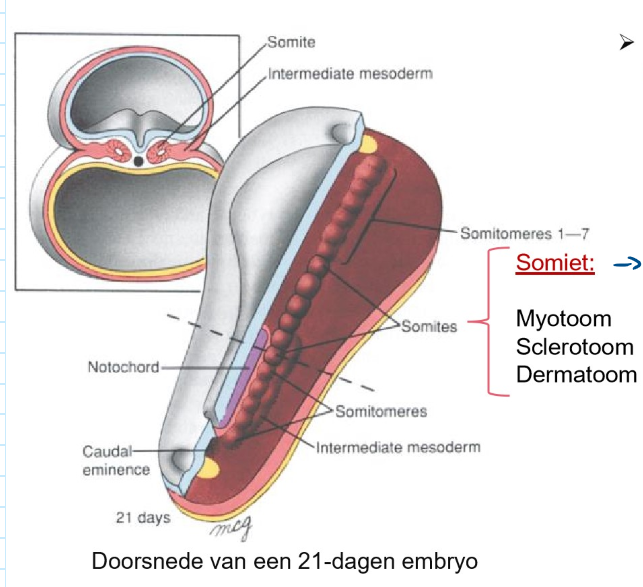
bestemming van de 3 kiembladen: differentiatie van het mesoderm → craniale & caudale delen van het paraxiale mesoderm zijn georganiseerd in somitomeren
7 meest craniale somitomeren → worden nooit somieten
4 occipitale & eerste 2 cervicale somitomeren → gedifferentieerd tot somieten
elke somiet bestaat uit:
myotoom
sclerotoom
dermatoom
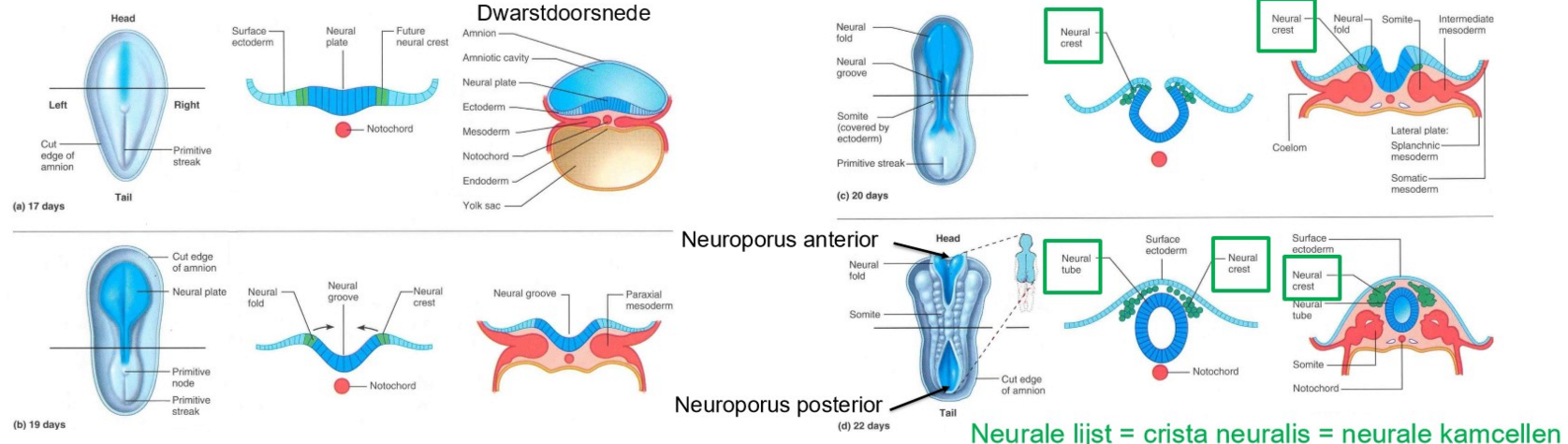
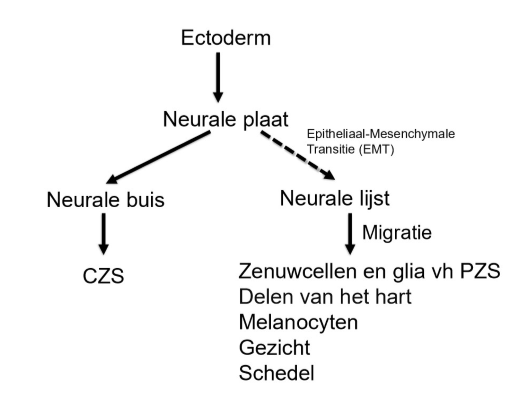
bestemming van de 3 kiembladen: differentiatie van het ectoderm (neurulatie)
tussen dag 17 & dag 19 → regressie van de primitieve streep
dag 19: vorming van verdikte neurale plaat in ectoderm
net craniaal tov primitieve knoop
vorming van neurale plaat → geïnduceerd door chorda dorsalis (= notochord)
als gevolg van neurale inductie: ectodermale cellen differentiëren in een dikke plaat van neuro-epitheliale cellen (neuroectoderm)
neurale plaat vormt zich eerst aan craniale einde van embryo & differentieert vervolgens in craniaal-naar-caudaal richting
neurale plaat vouwt tijdens 4e week om een neurale buis te vormen → voorloper van centrale zenuwstelsel
laterale randen van neurale plaat geven aanleiding tot neurale kamcellen
maken zich los tijdens vorming van neurale buis & migreren in embryo om structuren te vormen
chorda dorsalis = notochord
kenmerkende structuur van chordadieren
speelt essentiële rollen in ontwikkeling van gewervelden
dient als bron van middellijn signalen die omliggende weefsels ordenen & als belangrijk skeletelement van zich ontwikkelende embryo
genetische & embryologische studies hebben ons geïnformeerd over de ontwikkeling & functie van het notochord
samenvatting: het ectoderm → neurulatie: dag 19-22
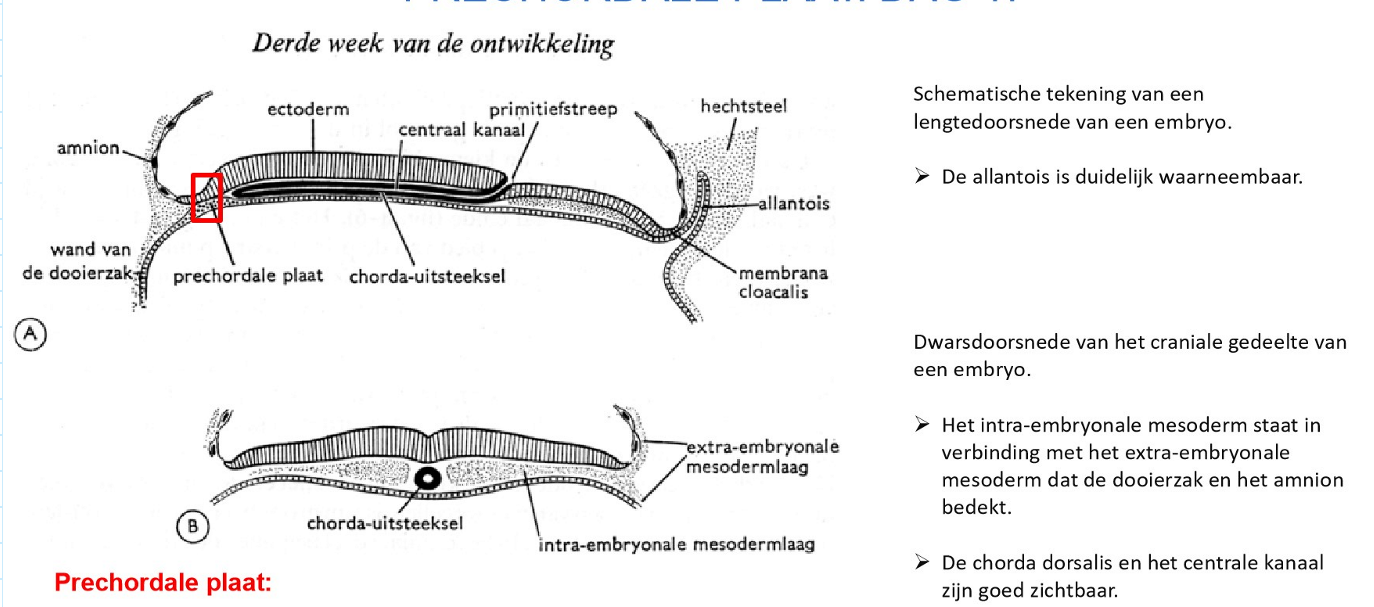
bestemming van de 3 kiembladen: differentiatie van de prechordale plaat → dag 17
prechordale plaat
= zone van mesoderm tussen buccopharyngeale membraan cephaal & chorda dorsalis caudaal
→ rol: inductie van cephale deel van het centrale zenuwstelsel
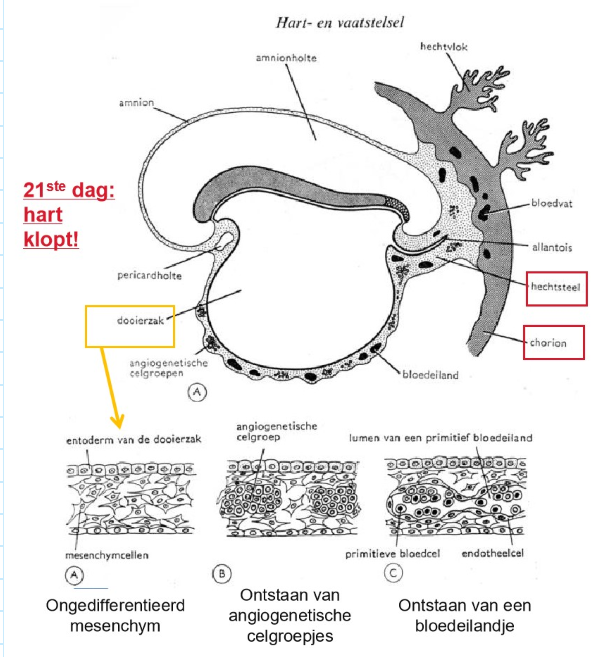
bestemming van de 3 kiembladen: differentiatie van het extra-embryonaal mesoderm
dag 19: op 3 plaatsen worden extra-embryonale bloedvaten gevormd:
chorion
hechtsteel
wand van de dooierzak
intra-embryonale bloedcellen ontwikkelen zich eerst in de dooierzak
daarna: intra-embryonale bloedcellen in de lever → week 5:
lever speelt belangrijke rol in vorming van bloedcellen = hematopoëse
intra-embryonale hematopoëtische cellen (= voorlopers van bloedcellen) koloniseren in de lever, die een van de eerste organen is die bloedcellen produceert
levert wordt dus tijdelijk het primaire centrum voor hematopoëse
plooivorming: 4e week
(van een platte kiemschijf naar de primitieve lichaamsvorm)
kiembladen omgevormd naar buisvormige structuren
bouwplan van ‘cilinders in een cilinder’ → 2 types van plooien:
laterale plooien
kop- & staartplooi
positiewijzigingen van:
cardiogeen mesoderm
allantois
→ aan einde van 3e week: embryo is een platte, ovaalvormige, drielagige kiemschijf
→ gedurende 4e week: embryo groeit snel, vooral in lengte, en ondergaat plooivorming
= proces dat herkenare lichaamsvorm van gewervelden genereert
plooivorming: oorzaken voor het vouwen van het embryo
gedurende 4e week: embryonale schijf & amnion groeien krachtig, maar dooierzak groeit nauwelijks → disproportionele groei
omdat dooierzak vastzit aan ventrale rand van embryonale schijf, stuurt differentiële expansie de uitbolling van de embryonale schijf naar een driedimensionale & cilindrische vorm
plooivorming: het proces van vouwing dat het embryo transformeert van een plat embryonaal schijfje naar een driedimensionaal buis-in-een-buis lichaamsplan
als gevolg van vouwen van het embryo: midden van de darm wordt geleidelijk omgezet in een buis
hals van dooierzak wordt tot slanke ductus vitellinius gereduceerd (= verbinding tussen darm & dooierzak)
allantois & verbindingssteel combineren met dooierzak & dooierzakgang door vouwen van caudale einde van het embryo
ALLANTOIS:
groeit in hechtsteel
opgenomen in primitieve darm (cfr. de staartplooi)
overblijfsel ervan is urachus (= ophanging van urineblaas aan ventrale buikwand)
functie:
bij vogels: opslag toxische stoffen
bij mens: geen functie (→ placenta neemt de functie hiervan over)
→ kop- & staartplooi liggen in het mediaan vlak
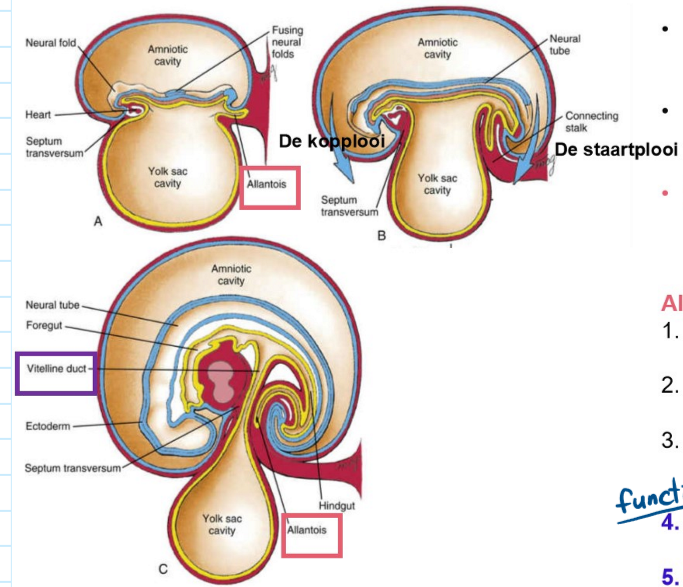
plooivorming: gevolgen van de cephalocaudale plooien
hart naar distaal
hechtsteel naar ventraal
vorming primitieve darm → resultaat van plooiing
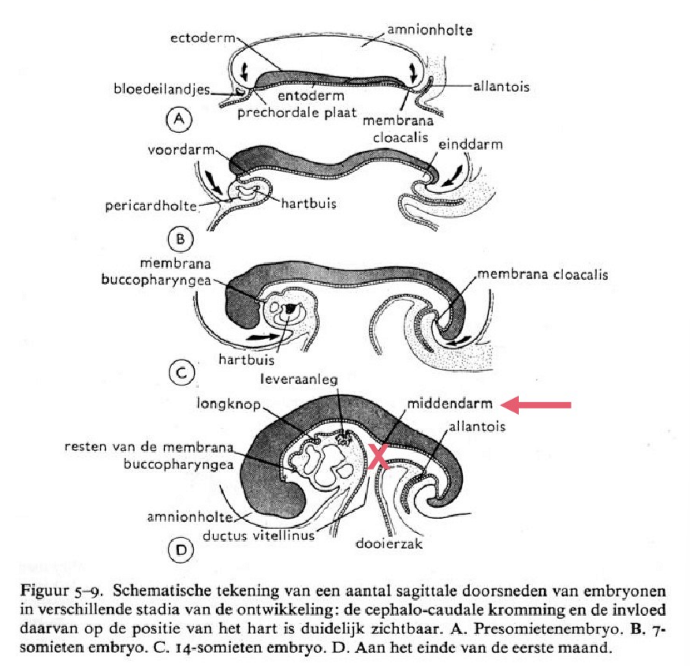
samenvatting: plooivorming
kiembladen omgevormd naar buisvormige structuren
bouwplan van ‘cilinders in een cilinder’
laterale plooien
kop- & staartplooi
positiewijzigingen van:
cardiogeen mesoderm
allantois
→ naarmate de vouwing plaatsvindt, groeit het embryo sneller dan de dooierzak, waarvan de holte via de vernauwende dooierzakgang continu verbonden blijft met de zich ontwikkelende darmbuis
plooivorming: laterolaterale plooien
A: septum transversum & cardiogene gebied worden naar toekomstige thoracale regio verplaatst door het vouwen van het craniale einde van het embryo
fusie van ectoderm, mesoderm, toekomstige coeloomholtes & endoderm van tegenovergestelde zijden vindt niet plaats in directe omgeving van de dooierzakgang (D,F) maar wel in de meer craniale & caudale regio’s (E,F)
resultaat: buis-in-een-buis lichaamsplan
laterolaterale plooien: liggen in transversaal vlak
cephalocaudale plooien: liggen in het mediaan vlak
→ buitenste ectodermale buis (huid) & binnenste endodermale buis (darm) worden gevormd door lichaamsvouwing (E,F)
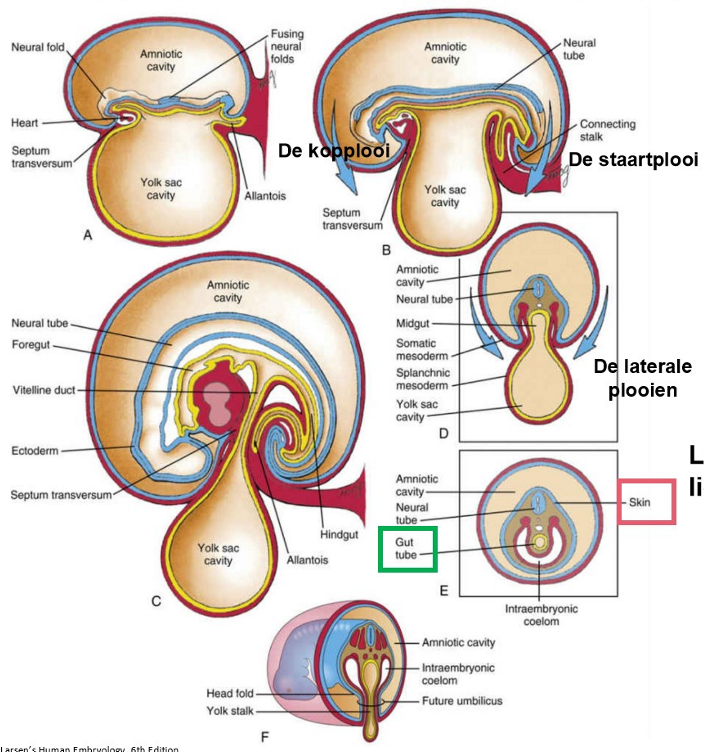
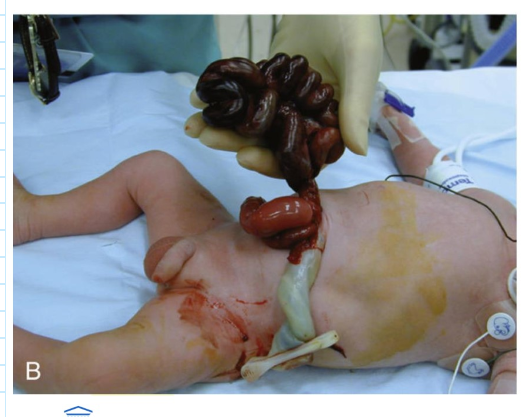
gastroschisis: defecten van voorste lichaamswand
1 op 1,953 pasgeborene
niet goed vormen van voorste (ventrale) lichaamswand tijdens het vouwen van het lichaam
defecten van de voorste lichaamswand kunnen voorkomen in de buikstreek (vaak) of de borststreek (zeldzaam)
darm puilt uit door opening in lichaamswand aan rechterkant van navelstreng
darm niet omsloten door membraanachtige zak
darmen niet bedekt met beschermend vlies, kunnen blootgesteld worden aan vruchtwater → kunnen geïrriteerd raken → kan ertoe leiden dat ze korter worden, draaien of opzwellen
exacte oorzaken van gastroschisis zijn vaak onbekend
behandeling: operatie
samenvatting: van zygote naar embryo
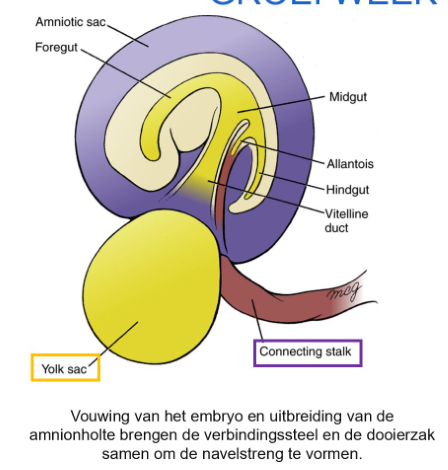
groei week 4 tot week 8: ontstaan van de navelstreng
ontstaan van navelstreng:
lichaamsvouwing scheidt het zich vormende embryo van zijn extra-embryonale membranen
proces vindt plaats & embryo groeit → amnion houdt gelijke tred, breidt uit totdat het het gehele embryo omsluit, behalve het navelgebied
verbindingssteel & dooierzak komen tevoorschijn
tussen 4e & 8e week: toename in productie van vruchtwater zorgt dat amnion opzwelt totdat het volledig de chorionische ruimte overneemt
snel uitbreidende amnionholte vult zich met vocht & doet chorionholte tussen week 4 & 8 verdwijnen
nadat embryonale vouwing voltooid is, ontstaat het amnion uit de navelring die de wortels van de vitellijnkanaal & de verbindingssteel omringt
progressieve uitbreiding van amnion zorgt voor een buis van amniotische membraan die de verbindingssteel & het vitellijnkanaal omsluit
→ samengestelde structuur = navelstreng
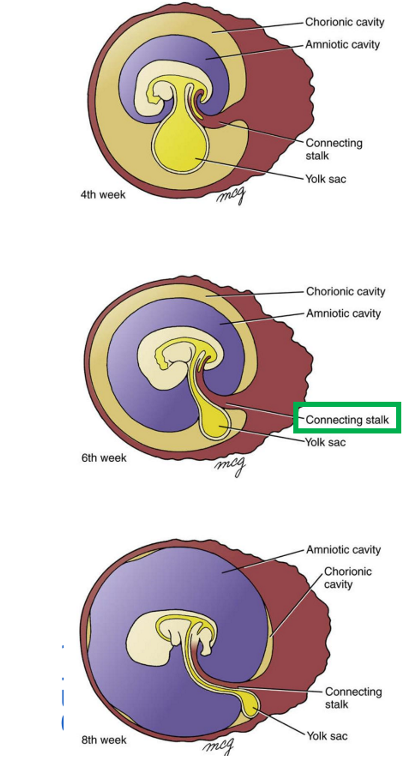
groei week 4 tot week 8: een embryo van 4-5 weken zwangerschapsduur
aan de bovenkant van het embryo: labyrinthplacode → referentie naar plaats waar het labyrint van het oor zich zal ontwikkelen
net daaronder: kieuwbogen → structuren die essentieel zijn voor ontwikkeling van gezicht & nek
aan voorkant van embryo: lensplacode → duidt aan waar lens van het oog zich zal vormen
pericardzwelling: locatie van zich ontwikkelende hart
aan onderkant van embryo: navelstreng te zien, die embryo verbindt met placentale structuren
→ weergave is typisch voor een stadium van embryonale ontwikkeling bij veel gewervelde dieren
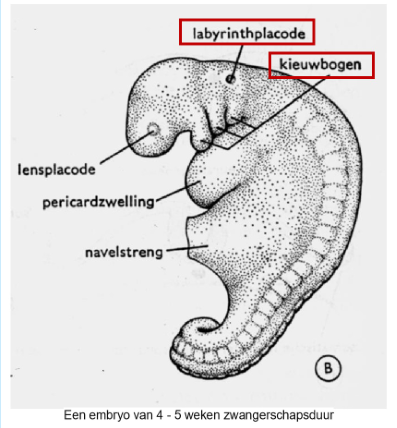
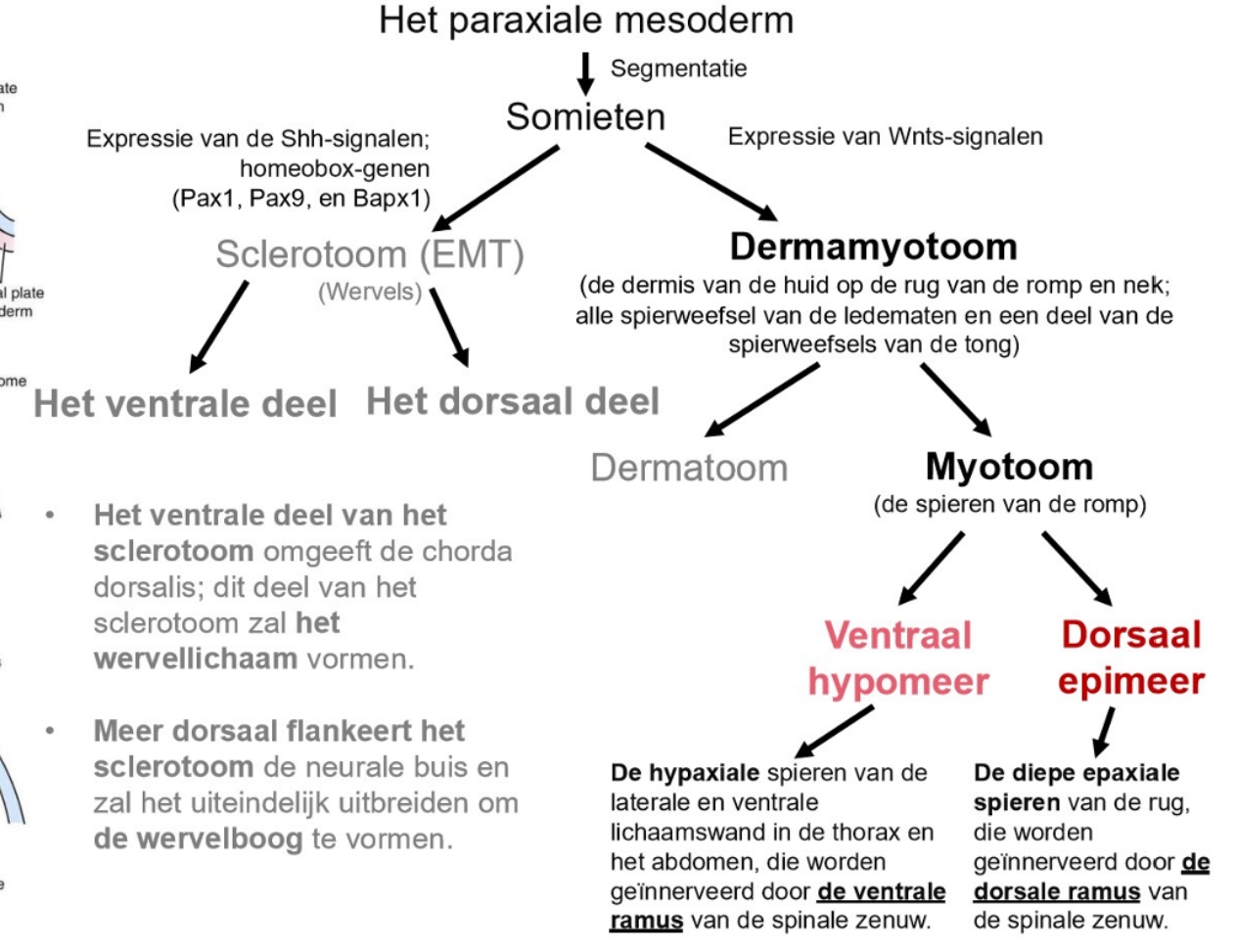
het paraxiale mesoderm:
paraxiale mesoderm
hieruit worden somieten gevormd
intermediaire mesoderm
laterale plaat mesoderm
cardiogene mesoderm
extra-embryonale mesoderm
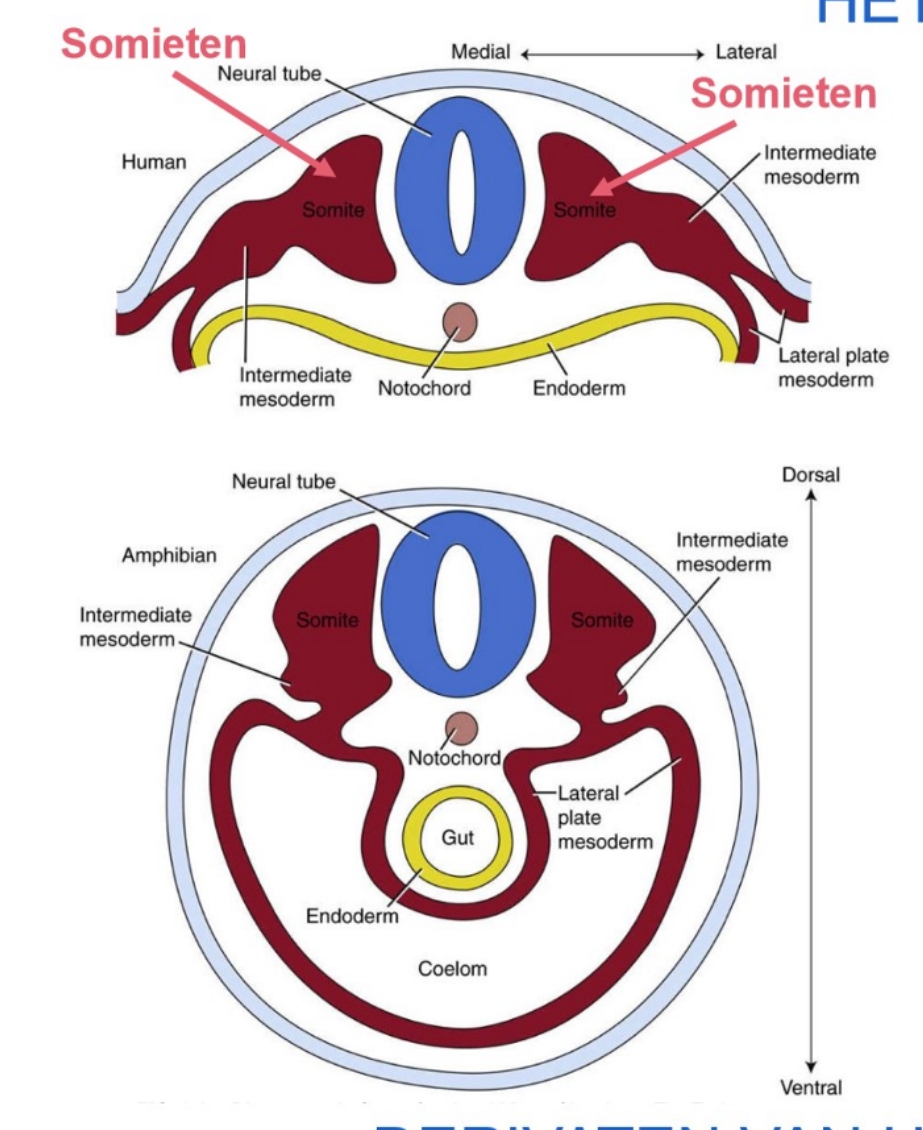
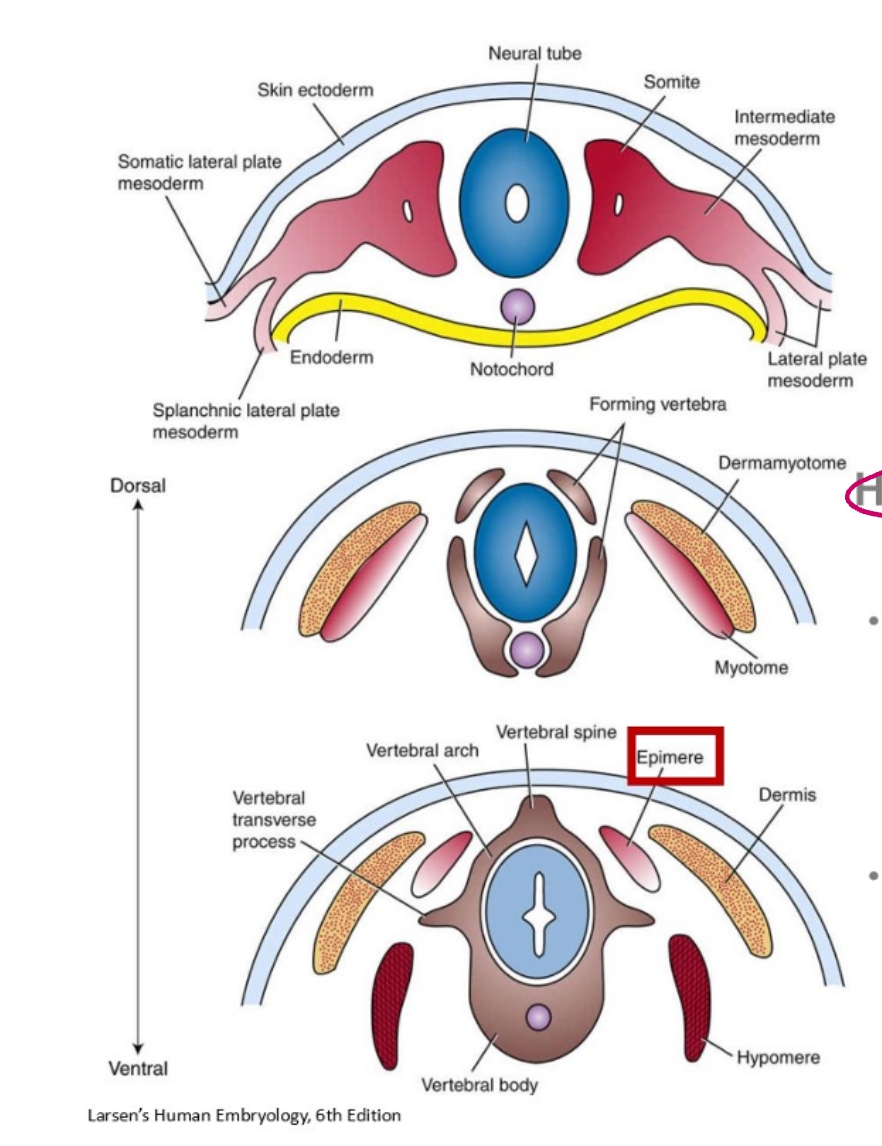
derivaten van het paraxiale mesoderm: