Kemi 2 - kursprov
1/129
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
130 Terms
Aldos vs ketos
Karbonyl på olika platser i kedjan
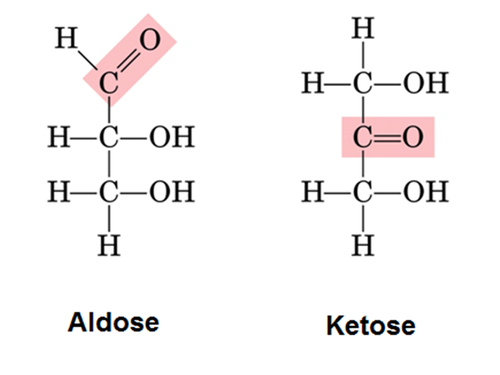
Aldoser
Reduktionsmedel. Oxideras till karboxylsyror. Testas mha Trommers prov

Ringslutning av glukos
OH gruppen i kol 1 & 5 kopplas ihop
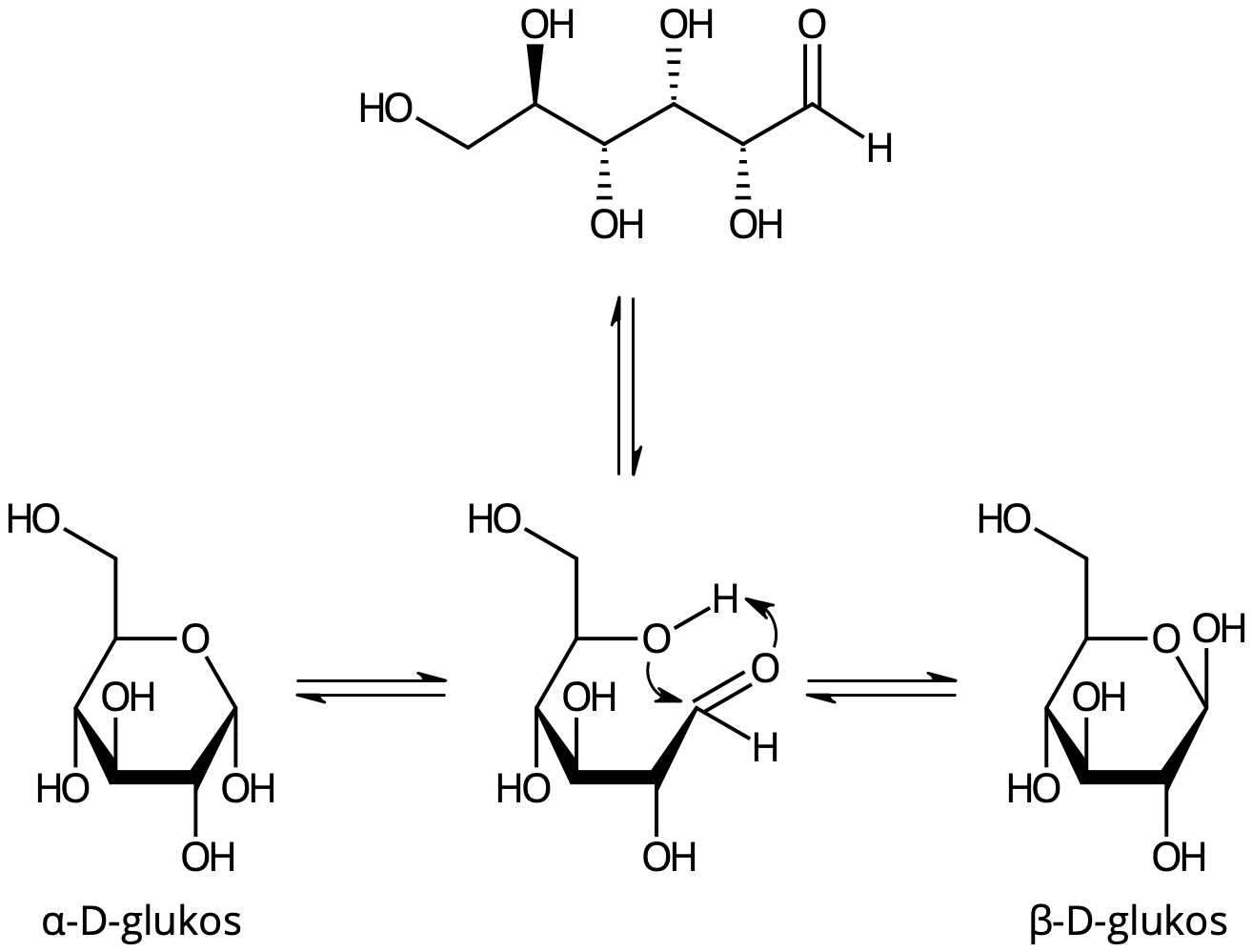
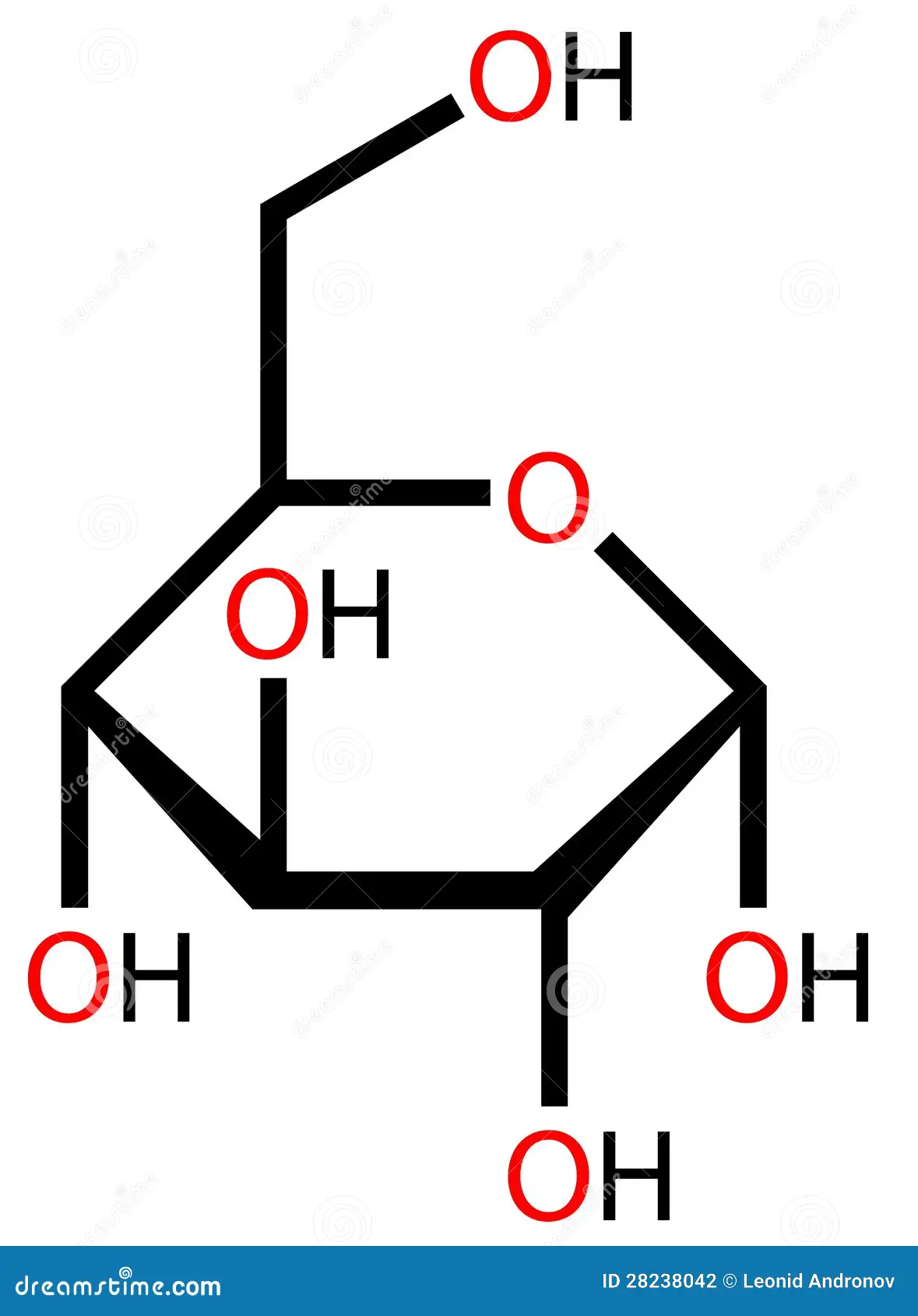
α-D…
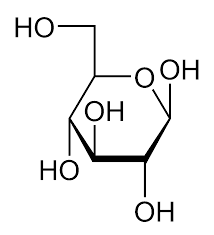
β-D….
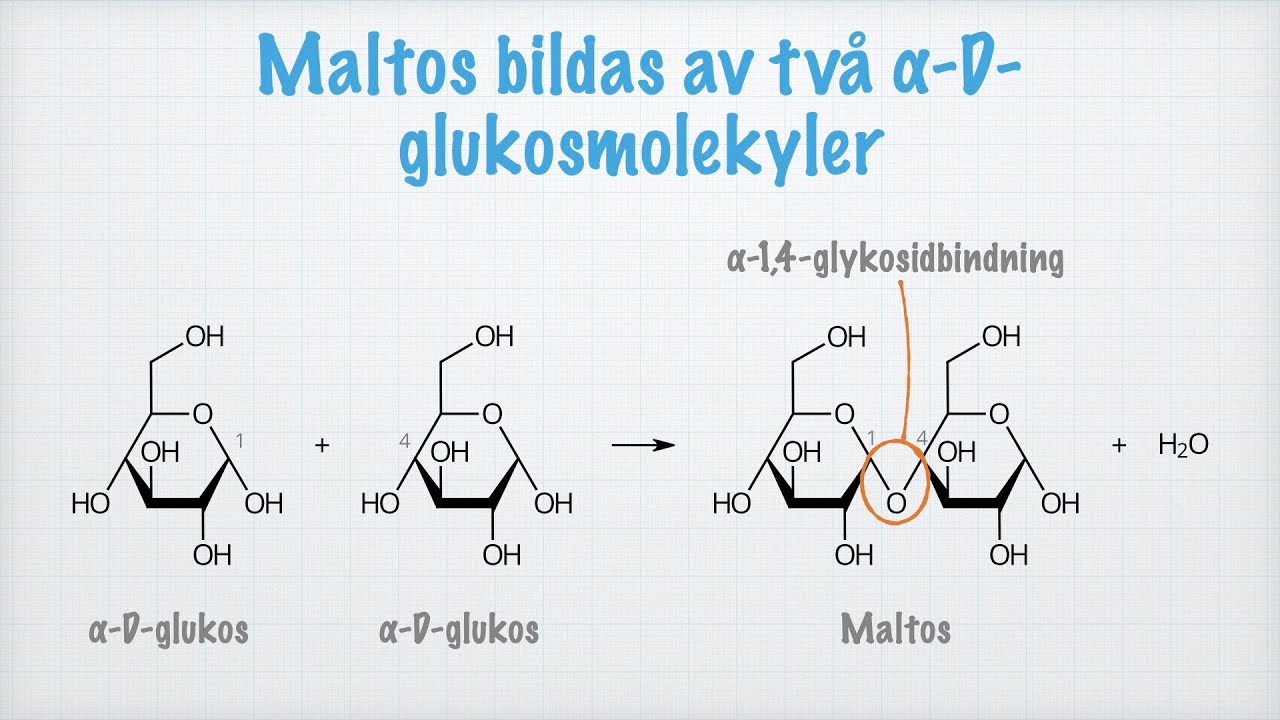
α: Monosackarider → disackarid
+ H₂O
Kol 1 och 4 bilder till varandra med en α-1,4-glykosidbindning
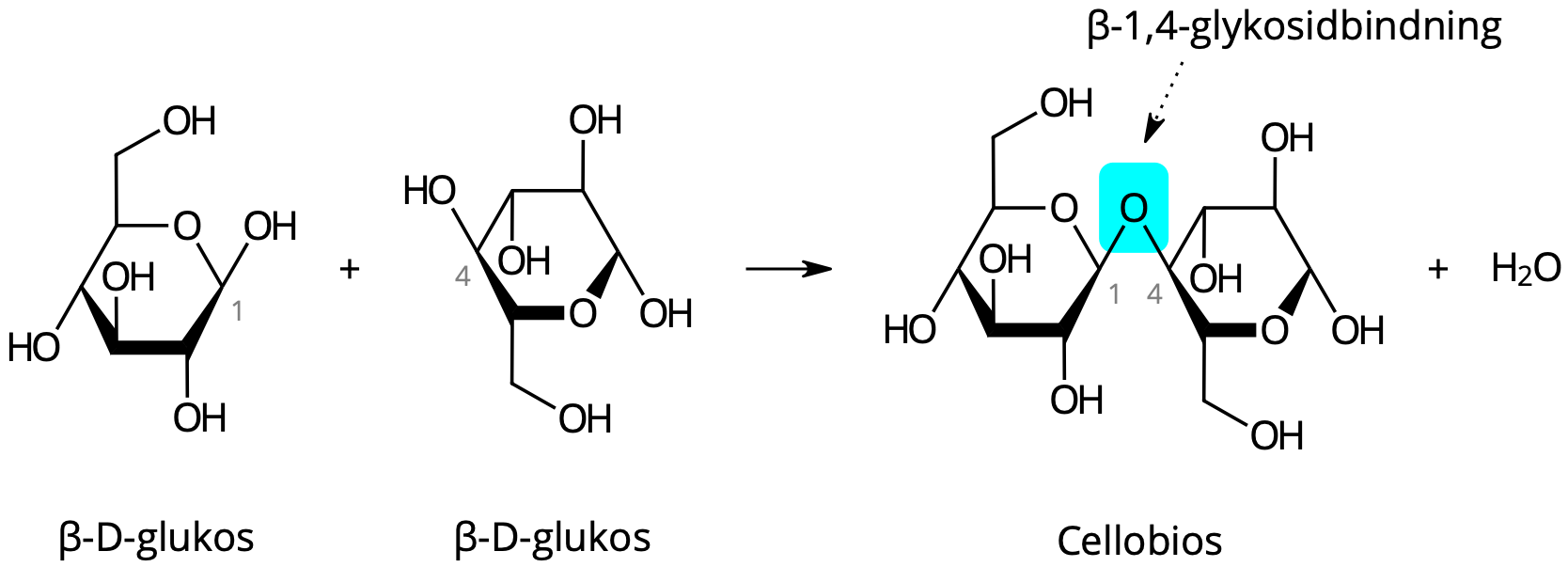
β: monosackarid → disackarid
+ H2O
Kol 1 och 4 binder till varandra med en β-1,4-glykosidbinding
Gubbe nr 2 vrids “upp och ner”
Proteiner: uppbyggnad
Aminosyra: amingr (N-terminal) + karboxylsyra (C-terminal)
Mellan 2 aa; Peptidbindning
Bindning i proteinets sekundärbindning
Vätebindning
Tetriär struktur: sidokedjor opolär - opolär
Van deer Waal
Tetriär struktur: sidokedjor sura - basisk
joninteraktion, pga båda protolyserade
Tetriär struktur: sidokedjor polär - polär
Dipol-dipol eller vätebinding
Tetriär struktur: sidokedjor cystenin - cystenin (cys)
Svavelbrygga
R-S-S-R
Denaturering av proteiner
Ändrar strukturen i protein; bryter bindningar i tetriärstruktur
Vad kan proteiner denatureras av?
Värme; Van Deer Waal & vätebindningar bryts
Sur/basisk lösning; jon-interaktionen förändras
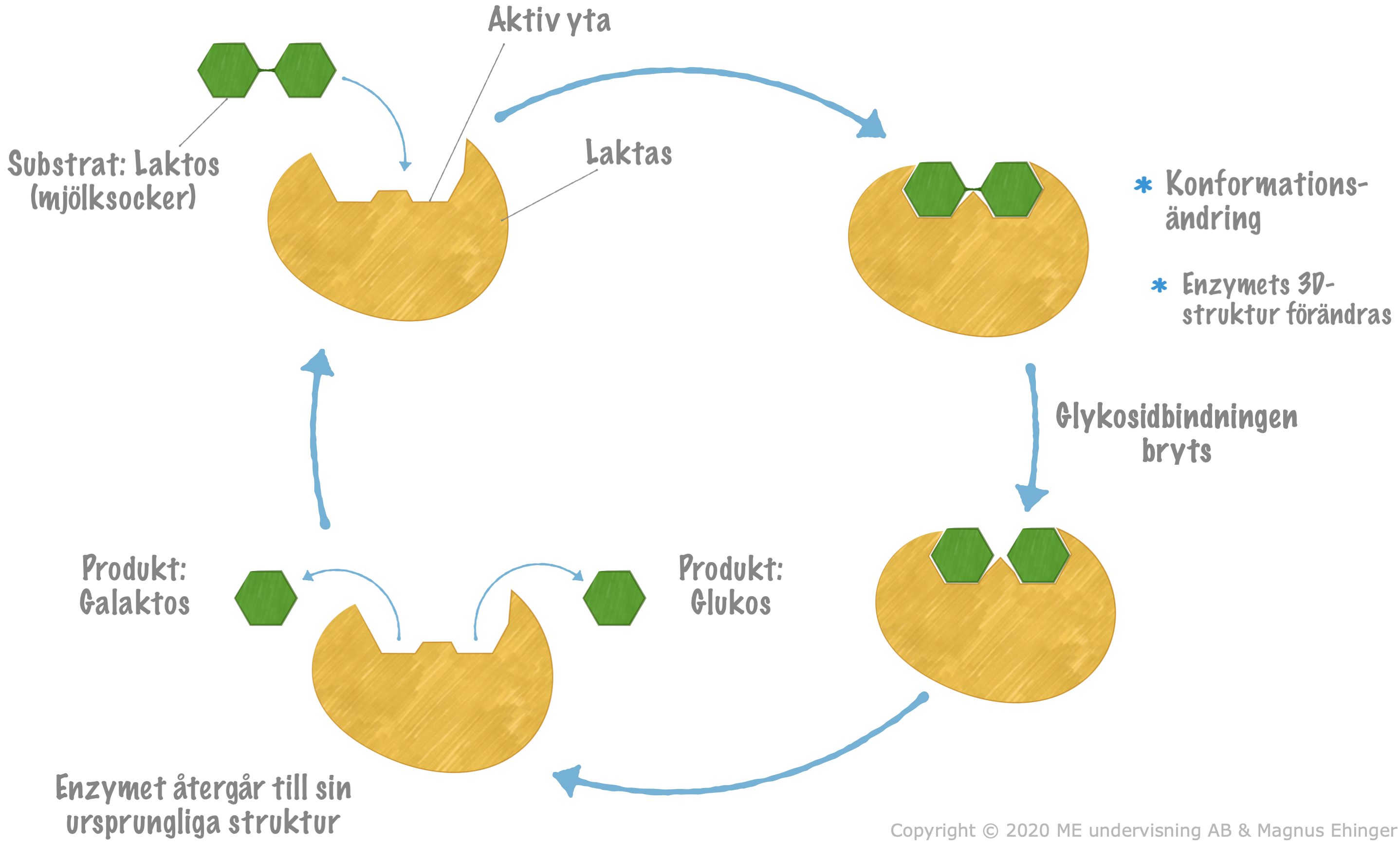
Enzymers funktion
Substrat binder in till aktiv yta
Binding bildas mellan substrat & aktiv yta => energi frigörs
Energin som frigjorts används till:
a. Bryta glykosidbindning
b. Omkomformera protein (byta form på proteiner = enzymet)När energin använts frigörs produkterna och enzymet är redo för nästa
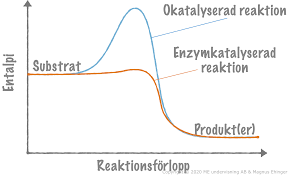
Enzymers katalyserande förmåga
Sänker aktiveringsenergin i biokemiska processer
Påverkar inte K
Inhibitor
Molekyl/jon som förhindrar enzymkatalys
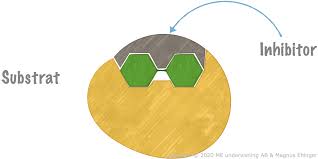
Kompetitiv inhibitor
Lägger sig som ett logg på den aktiva ytaan och hindrar substrat att binda in
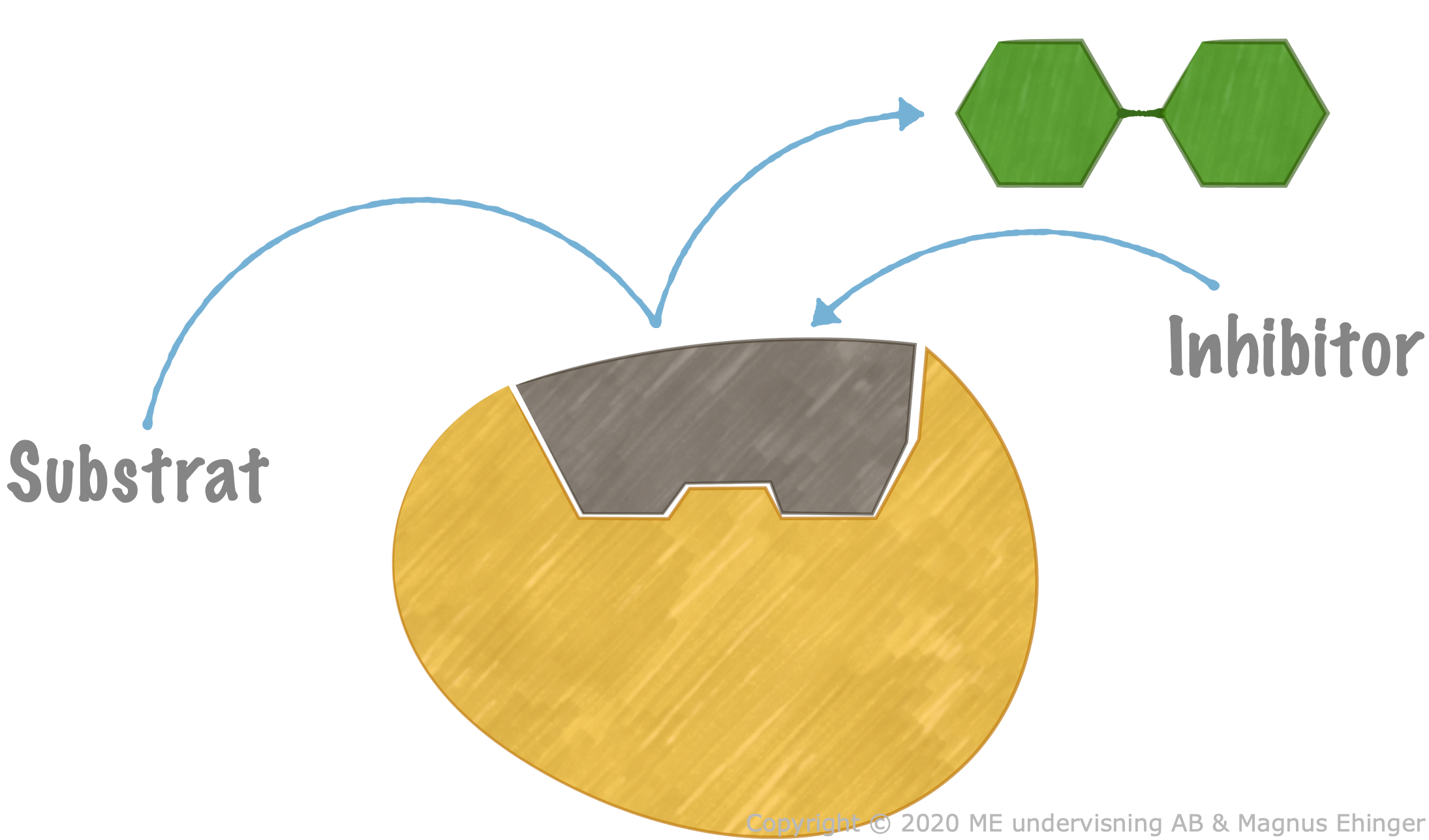
Ickekompetitiv inhibitor
Inhibitorn binder sig till annan del av enzymet vilket ändrar form på den aktiva ytan
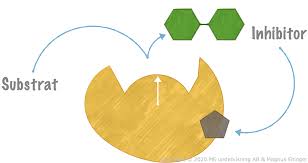
Antikompetitiv inhibitor
Blockerar substrat från att lämna enzymet
Isoelektrisk punkt
aa har specifikt pH där de är helt oladdade. Detta pH avgörs av sidokedjan tsm m N & C terminal
Specifik för att 20 aa
Generellt om isoelektrisk punkt
Sura sidokedjor = lågt Ip
Basiska sidokedjor = högt Ip
Polära/opolära = något under 7
Aminosyra i sur lösning
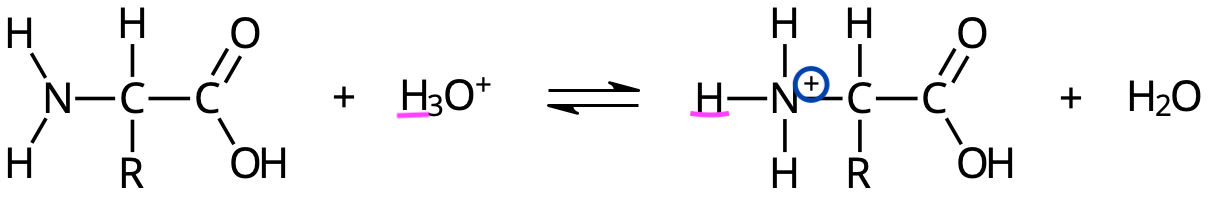
Aminosyra i basisk lösning
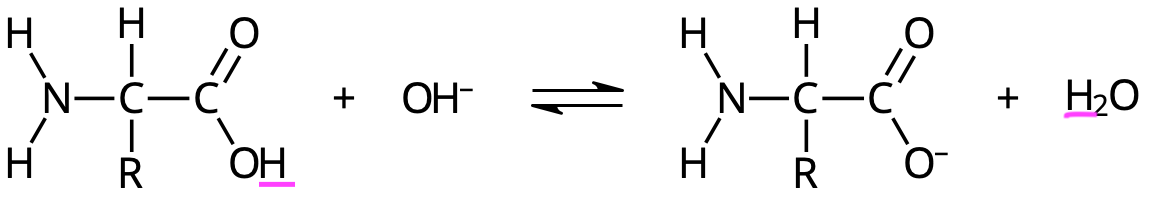
Ko enzym
Organisk eller oorganisk molekyl som tillsätts till icke aktivt (apoenzym) f.a. aktivera enzymet & där med skapa holoenzym
Prostetiska grupper
Hårt bundna till enzymet, ofta metalljoner
Nukleotiders uppbyggnad
Kvävdebaser:
Puriner - A & G, 5&6-kolring
Pyrimidiner - T, C & U, 6-kolringSockerart
Deoxiribos / ribos1-3 fosfatgrupper
Glukolysen
Sker i cytoplasman h. celler
Glykos spjälkas + 2 pyruvat skapas
Innehåller 10 steg, varje steg initieras av eget enzym
Huvudstegen:
Glukos fosfoleras → fruktos s klyvs => 2 pyruvat
Glukolysens 2 huvudsteg
Fosforylering av glukosmolekylen = fosfatgrupper tillförs till molekylen
Fosfat adderas till glukosmolekylen mha ATP
Omlagring av glukos t fruktos + ytterligare 1 fosfatgrupp tillförs. FRUKTOS-1,6-BISFOSFAT
Fruktosmolekylen klyvs
Energi frigörs (TOT. 4ATP bildas)
e⁻ frigörs (2NADH + 2H⁺)
2 pyruvat bildas
Totalreaktion glykolysen
Glukos + 2NAD⁺ + 2ADP + 1pi → 2 pyruvat ? 2NADH + 2H⁺ + 2ATP + 2H₂O
Officer Can I Keep Selling S.. For Money
Citronsyracykeln
Oxalacenat
Citrat
Isocitrar
α-ketglutarat
Succinyl-CoA
Succnat
Fumarat
Malat
Citronsyracykelns steg
Acetyl-CoA reagerar m oxalacetat & bildar citrar (från 2 karboxylsyragr t. 3 st)
Citrar omlagrar & bildar Isocitrar
Isocitrar oxideras mha NAD⁺ & bildar NADH + H⁺ & CO₂. α-ketoglutarat har bildats
α-ketoglutarat oxideras & HS-CoA binder in, NADH + H⁺ bildas & CO₂ avgår. Succinyl-CoA har bildats
1 energibärare bildas, h människor GDP + pi → GTP. CoA släpper & bildar HS-CoA, Succinat har bildats
Katalyseras av Succinatdehydrogenas, FAD reduceras t FADH₂ & Fumarat bildas
- 8. Succesiv oxidering via malat f.a. återställa oxalacetat
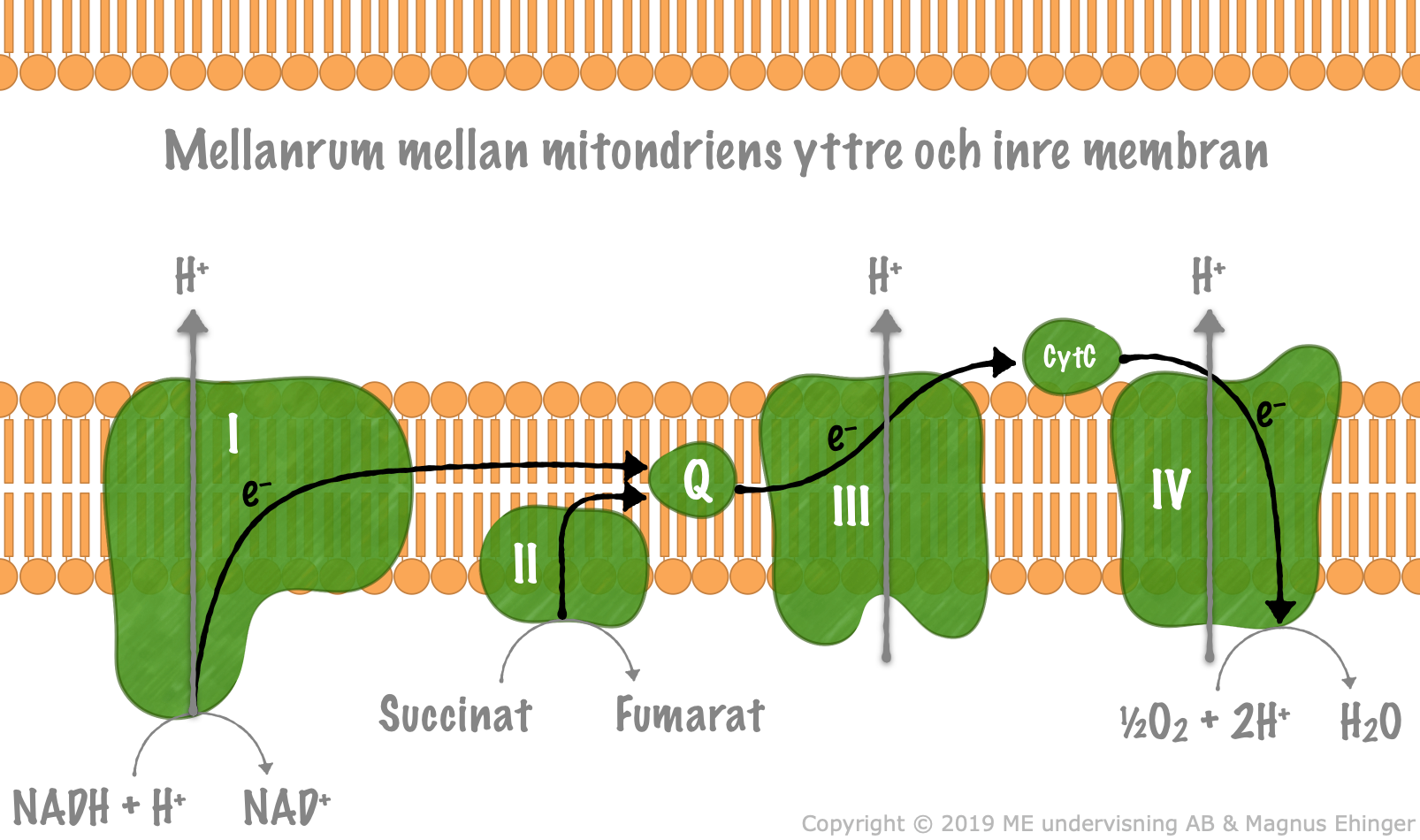
Elektrontransportkedjan
NADH + H⁺ oxideras i komplex I
Frigör e⁻
Pumpar H⁺ t mellanrummet
e⁻ bärs ubukinon till komplex II
Succinat bildar fumarat i komplex II
Frigör e⁻ som bärs ubikonon t komplex III
e⁻ pumpas genom komplex III & H⁺ pumpas till mellanrummet
Cytokrom C transporterar e⁻ till komplex IV där den används f.a. spjälka O₂ & reagerar med 2H f.a. bilda 2H₂O
APT-syntas/komplex V använder koncentrationsgradienten av H⁺ f.a. bilda ATP av ADP + pi
β-oxidation, allmänt
Process där fettsyror bryts ner t. energigivande molekyler
Sker i mitokondriens matrix (innanför inre membranet)
β-oxidation produkter
FADH₂ & NADH+H⁺ som används i ETK
Acetyl-CoA som används i citronsyracykeln
Skillnad på mättad & omättad fettsyra
mättad fettsyra har dubbelbindning mellan α & β kol och genererar inte FADH₂ i β-oxidationens andra steg och är därav mindre energirik
Omega 3
Esentiell
Sista produkten i β -oxidationen och innehåller 1 CoA +CH₂ + CH₂ + CH₃ & kan inte bildas av kroppen
Omega 6
Sista produkten i β -oxidation som innehåller 1CoA + “6” kol, kan inte bildas av kroppen
β-oxidation steg
CoA binder till fettsyran, vatten bildas
2H⁺ tar bort mha FAD, eliminationsreaktion
H₂O adderas, hydroxid adderas t β-kol, sekundär alkohol bildas
Reduceras mha NAD⁺, NADH + H⁺ bildas samt karbonylkol
CoA adderas, 2 produkter bildas: Acetyl-CoA & en produkt som går vidare i β-oxidation
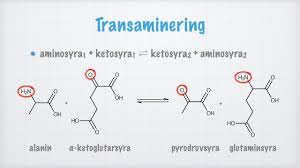
Transaminering
AA kan byggas om till andra aa mha ketosyror.
aa₁ + ketosyra₁ ⇌ aa₂ + ketosyra₂
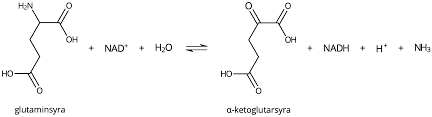
Deaminering
Energi från proteiner. När aminogr spjälkas f aa bildas NADH + H⁺ som kan använda i ETK
Ammoniak bildas (giftigt för kroppen). Omvandlas till mindre farliga produkten urea i några reaktionssteg
Glukoneogenes
Initieras av insulin
Glukos bildas ur pyruvatjoner
Pyruvat blir glukos via fruktos-1,6-bisfosfat
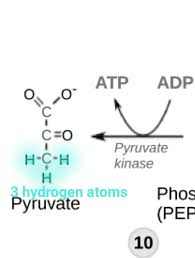
Pyruvat
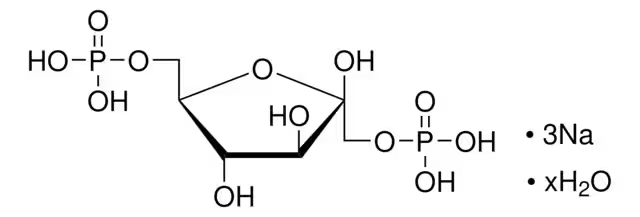
Fruktos-1,6-bisfosfat
Fettsyrasyntes
Sker framförallt i levern
Flera Acetyl-CoA molekyler binds samman & bildar långa kolkedjor; tillslut fettsyror
Energigivande, ju mer energi som krävs - desto mer energi kan utvinnas
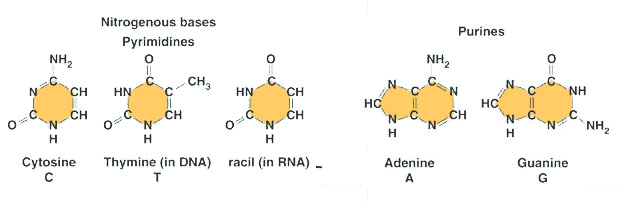
Puriner
A & G
5&6-kol kedja
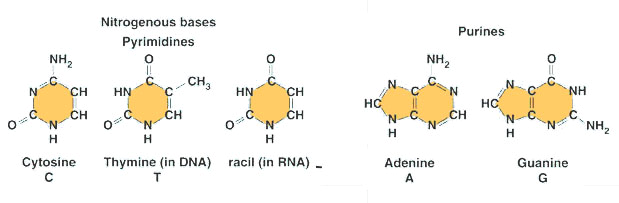
Pyrimidiner
T,C & U
6 kolskedja
Vad “krävs” för en reaktion?
Krock mellan reaktanterna som måste ske i en specifik vinkel och fart
Faktorer som påverkar reaktionshastigheten
Temperatur - rör sig snabbare => fler krockar
Katalysator - underlättar “krocksteget”
Koncentration - ökat antal reaktanter ger ökad sannolikhet för krock
Ämnets inneboende egenskaper - reaktivitet, elektronegativitet & joniseringsenergi
Reaktionshastighet hos fasta ämnen - påverkningar
Påverkas av hur finfördelat ämnet är. Mer finfördelade har större yta som kan reaktanter kan komma åt → högre reaktionshastighet
Aktiveringsenergi
Energin som krävs för att aktivera klomplexet. Större i endoterm reaktion
Inhibitor
Stoppar katalysator
Vilken reaktionstyp har högre aktiveringsenergi?
Endoterm
Jämnvikt
När reaktionshastigheten för reaktionen åt höger har samma hastighet som reaktionen åt vänster samt att koncentrationen stabiliseras.
Jämnviktskonstanten K, formel
aA + bB ⇌ cC + dD
K = Produkter/reaktanter
K = [C]c*[D]d/[A]a[B]b
K-värde
Tabellvärde; experimentellt framtaget utifrån tester av reaktioner
Vänsterförskjuktning
Större andel reaktanter
Högerförskjutning
Större andel produkter
K < 1
vid jämnvikt; [reaktanter]>[produkter], vänsterförskjuten
K = 1
vid jämnvikt; [reaktanter]=[produkter]
K > 1
vid jämnvikt; [reaktanter]<[produkter], högerförskjuten
Q
Används för att avgöra om reaktionen är i jämvikt eller för att jämföra Q m K
Q < K
tillverkar produkter, går åt höger → vänsterförskjutning
Q = K
jämnvikt
Q > K
Tillverkar reaktanter; reaktionen går åt vänster → högerförskjuten
Metod för att lösa Jämnviktsreaktioner
R - reaktion
I - start (M)
C - förändring (M)
E - jämnvikt, “slut” (M)
Le Chateliers princip
När ett system i jämnvikt rummas kommer reaktionshastigheten öka för den reaktant som återställer jämnvikten
Le Chateliers “ex”
Öka/minska koncentration av reaktant/produkt
Ändra temperatur
Ändra tryck
Korresponderande syra-bas par
Svag syra + stark bas
Stark syra + svag bas
Formel Ka
Ka = [A⁻][H₃O⁺]/[HA]
Vad säger Ka värdet om en syras styrkhet?
Ju högre Ka desto starkare syra
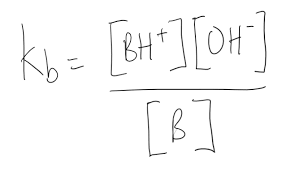
Kb formel
pKb
-log Kb
pKa
-logKa
p
-log
Kw vid 25°C
10⁻¹⁴
Samband Kw, Ka, Kb
Kw = Ka * Kb
pKw vid 25 °C (rumstemperatur)
14
pKa + pKb
14
pH + pOH
14
pH = 7
[H₃O⁺] = [OH⁻]
pH > 7
[H₃O⁺] < [OH⁻]
pH < 7
[H₃O⁺] > [OH⁻]
pOH = 7
[H₃O⁺] = [OH⁻]
pOH > 7
[H₃O⁺] > [OH⁻]
pOH < 7
[H₃O⁺] < [OH⁻]
Basisk lösning
överskott hydroxidjoner, OH⁻
Alkan
Enkelbindningar
Alken
Dubbelbindning, ändelse en
Alkyn
Trippelbindning, ändelse yn
Prefix
Substituent; alla andra delar av molekylen som bidrar till kemin
Suffix
Funktionell grupp; den molekylen som har störst påverkan på molekylens kemi
Olika sätt att rita
Namngivning substituent
yl
Reaktionsmekanismen
Utvecklad reaktionsformel där alla stegen för bildad produkt skrivs ut
- Pilar ritas för att indikera förflyttning av e⁻
- Alla steg skrivs ner, fria e⁻ par & strukturformler ritas ut
Elektrofil
Dras mot e⁻ täta området i en molekyl och kan ta emot e⁻.
positiv eller område med få elektroner
Nukleofil
Dras till positiv laddning eller kärnor
Själv negativt laddad eller elektrontätt område
Alkoholer
Funktionell grupp, suffix -ol
Polär
Ju längre alkoholen är….
…desto mindre kommer OH-gruppen påverka kemin