H1: Atomen en moleculen
1/34
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
35 Terms
Verschil natuurlijke en radioactieve elementen +
betekenis radioactiviteit
-Natuurlijke elementen:
°lichtere atoommassa
°stabiele kern: kern blijft altijd zelfde, element blijft zelfde
-Radioactieve elementen:
°zwaardere atoommassa
°onstabiele kern: kern vervalt, element verandert
-Radioactiviteit:
veranderingen in de kern: van stabiele kern naar onstabiele kern (kern vervalt)
Verschil kationen en anionen
-Kationen: metalen: geven e- af → + geladen
-Anionen: niet metalen: nemen e- op→ - geladen
Structuur atoom
-Kern: nucleonen: #protonen + #neutronen → atoommassa A
-E- wolk: elektronen → rol bij chemische reacties (geen massa)
-#Protonen → atoomnummer Z
Verschil nuclide en isotopen
-Nuclide: individueel atoom met bepaalde A en Z
-Isotopen: nucliden met zelfde Z maar met verschillende A
→zelfde Z = zelfde #protonen
→verschillende A = in kern: zelfde #protonen, verschillende #neutronen
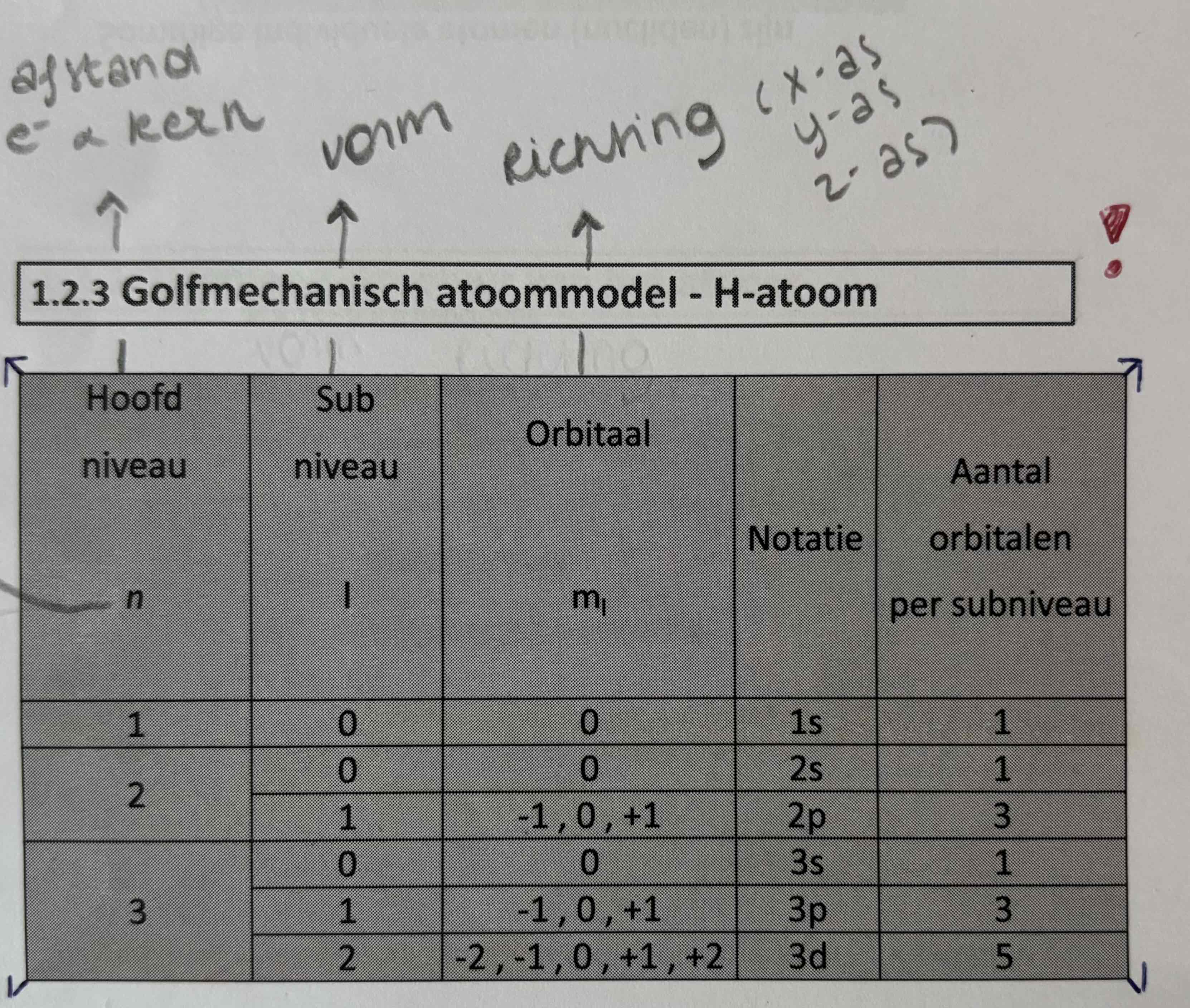
Golfmechanische atoommodel (positie atoom)
Hoe dichter afstand van kern en e-,
Hoe lager kwantumgetal n,
Hoe sterker de aantrekking tussen positieve kern en negatieve e-,
Hoe lager de energie van e-,
Hoe stabieler e-
→e- met lage energie zijn sterker aan de kern gebonden, daarom zijn ze minder geneigd om te reageren/weg te gaan.
(indien energieniveau van e- verhoogt wordt: e- in geexiteerd toestand)
→Als een atoom volledig gevulde laagste energieniveaus heeft (zoals bij edelgassen), is het stabieler en minder reactief.
→ Hoe lager energie, hoe lager n, hoe stabieler
Energievolgorde van orbitalen
Orbitalen zijn afhankelijk van atoomkernen: hoe hogere kernlading, hoe lager orbitaal energie
Opvullen van orbitalen: Hund
Wat: in een subniveau worden de e- zo over de orbitalen verdeeld zodat een maximaal elektronen met parallele spin (spin up = +1/2) aanwezig is
Waarom: 2 e- in zelfde orbitaal ondergaan meer repulsie (afstoting) dan 2 e- in verschillend orbitaal
Hoe: p orbitaal: hokjes zo vullen: eerst deze, dan deze: ↑↓↑↓↑↓
Max #elektronen per niveau
s: 2
p: 6
d: 10
f: 14
→ e- configuratie aflezen op PS
Opvullen van orbitalen: uitzonderingen: gans en half gevulde subniveau’s
Cr, Mo: s2 d4 wordt s1 d5
Cu, Ag, Au: s2 d9 wordt s1 d10
→ doel van halfgevuld: lagere subniveau maar stabieler
edelgassen: meest opgevuld, meest stabiel
Elektronenconfiguratie van positieve ionen
Eerst normale elektronenconfiguratie/voorgaande stabiele edelgas (Ar), dan elektronen verwijderen uit het niveau met het hoogste kwantumgetal (dus minst stabiele niveau), omdat dat niveau niet volledig bezet is en minst stabiel is.
→ Streven naar de stabiele edelgasconfiguratie (= 8 VE-): elektronen uit niveau met hoogste kwantumgetal verwijderen
Eigenschap VE-
Liggen verste van de kern en worden minst aangetrokken door de kern, dus daarom zijn zij meest reactief
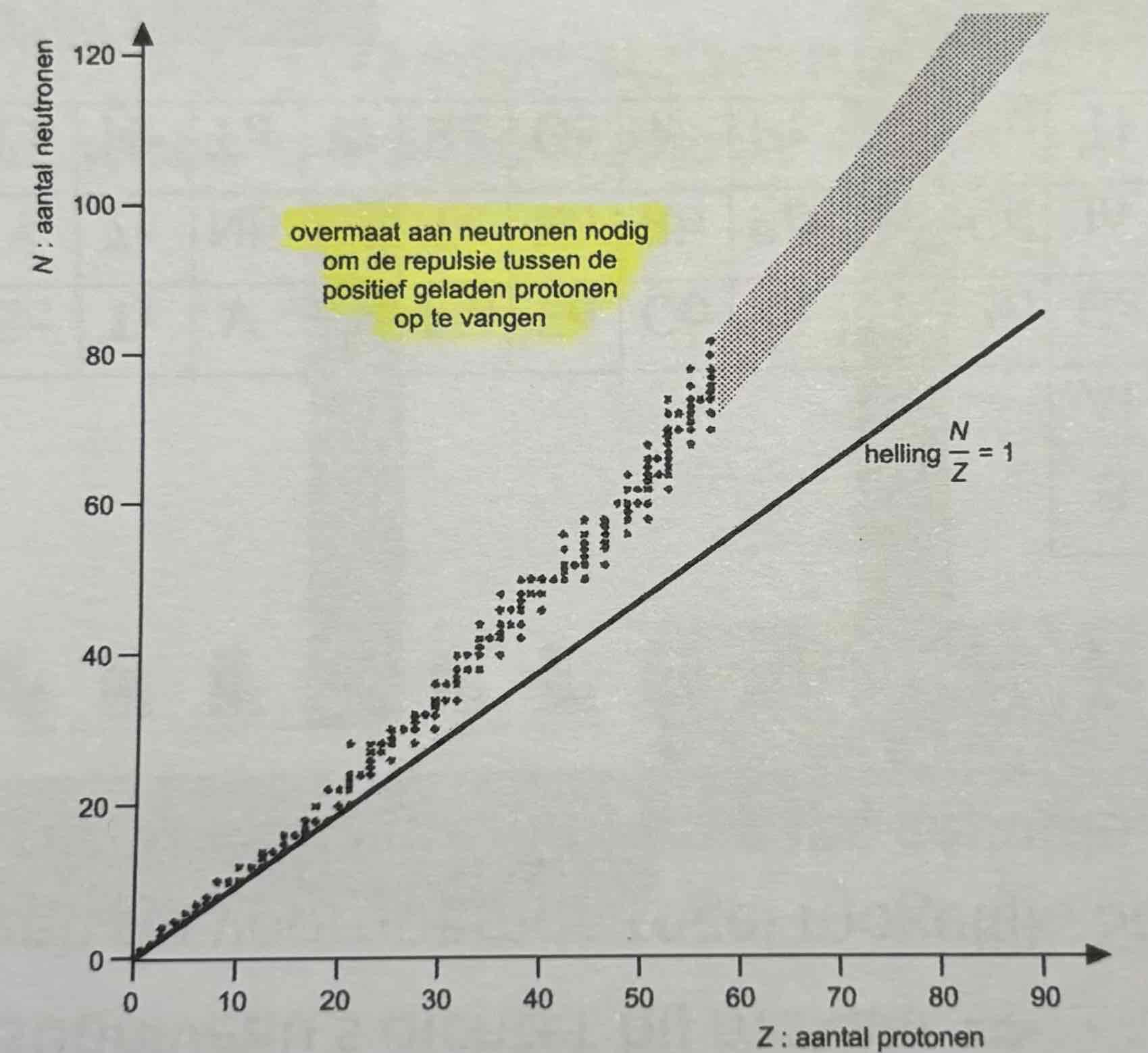
Conclusie grafiek
Radioactieve atomen hebben een grote massagetal A:
hoe groter massagetal A, hoe meer p+ (verstrooide protonen en neutronen ratio), hoe meer afstoting (repulsie), hoe meer het atoom wil ontpoffen dus hoe meer neutronen nodig
Kernreacties
= Zware kernen zijn niet stabiel en radioactief
alpha: He: A:4 ; Z:2
beta: e-
gamma: hoogenergetisch licht (atoombom)
Effectieve kernlading formule
Z* = Z - sigma
sigma:
afschermingsfactor kern (e- tussen kern en VE-): is groter naarmate e- dichter bij de kern zitten
Elektronenaffiniteit
Hoe makkelijk/moeilijk e- opgenomen worden:
doel: hoe groter affiniteit, hoe negatiever (anion)
-Kationen (metalen: geven e- af → + geladen):
lage affiniteit: nemen moeilijk e- op
-Anionen( niet metalen: nemen e- op→ - geladen):
hoge affiniteit: nemen makkelijk e- op
Eigenschappen van ionverbindingen
-Metaal + niet metaal
-Atomen met grote verschil EN- (>2) → e- afstaan
-Elektronenoverdracht: vorming ionladingen (+ en -)
Eigenschappen covalente binding
-Niet metaal + niet metaal
-Atomen met gelijke EN-/verschillende EN- (polair covalent) → dipoolmoment
-Gemeensch delen van e- (geen e- overdracht): vorming polarisatie: dipoolmoment: vorming delta - en delta +)
Verband ionaire en covalente bindingen
Hoe grotere afmeting van atoom, hoe afnemende ionaire karakter, hoe toenemende covalente karakter
Lewisstructuur: methode 1:
elementen die voldoen aan de edelgasconfiguratie
→ rij 1 + 2 (incl F)
(1) Skeletstructuren:
°minst EN- : centrum
°meest EN- : buiten
°H of F: steeds buiten
2) #VE-
3) #e- nodig voor edelgasconfiguratie
4) e- die gemeensch gedeeld moeten worden = (#e- nodig voor edelgasconfiguratie) - (#VE-)
5) #bindingen =
(e- die gemeensch gedeeld moeten worden) / 2
6) vrije e- paren =
( (#VE-) - (e- die gemeensch gedeeld moeten worden) ) / 2
Lewisstructuur: methode 2
elementen die niet voldoen aan de edelgasconfiguratie
(vanaf rij 3, vanaf F)
1) #VE-
2) skeletstructuur
3) e- plaatsen eerst op buitenste dan binnenste atoom:
1e- van elk element, 2e- van zelfde element
Formele lading
Lading van elk atoom alsof de binding 100% covalent zou zijn:
binding in 2 delen en kijken hoeveel e- een atoom heeft, kijken of er een verandering is
(Touw)
Oxidatiegetal
Lading van elk atoom aslof de binding 100% ionair zou zijn:
kijken of een atoom verandert (op basis van EN-)
Eigenschappen goede resonantiestructuur
-Kleinst aantal FL
-Laagste waarde FL
-FL in zelfde teken verste uit elkaar
-FL overeenkomstig met EN-
Hoe elektronenpaarrepulsie tegengaan?
Op basis van Valentie schaal elektronen paar repulsie theorie (VSEPR): geometrische rangschikking van atomen met doel dat atomen (e- wolk) zo ver mogelijk uit elkaar geplaatst zijn
→ Plaats opname van e-:
bindend < gedeeld < vrij
enkele binding < dubbele binding

Geometrie + hybrideorbitaal
lineair, sp

Geometrie + hybrideorbitaal
vlakke driehoek, sp2

Geometrie + hybrideorbitaal
tetraedrisch, sp3
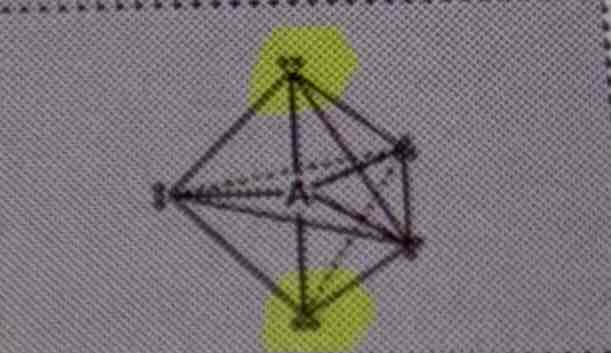
Geometrie + hybrideorbitaal
trigonaal bipiramidaal, sp3d

Geometrie + hybrideorbitaal
octaedrisch, sp3d2

Geometrie van 2 e- paren
AB2 : Lineaire structuur
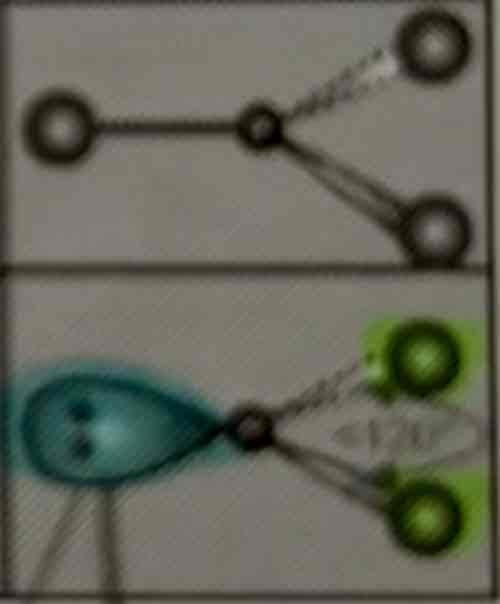
Geometrie van 3 e- paren
AB3: Driehoekig planair
AB2E: Hoekstructuur
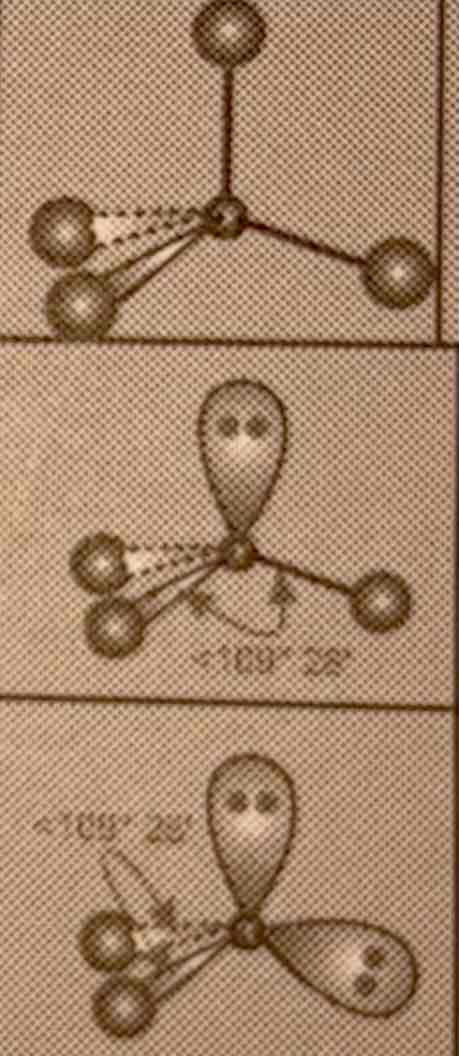
Geometrie van 4 e- paren
AB4: tetraederstructuur
AB3E: trigonaal piramidaal
AB2E2: hoekstructuur
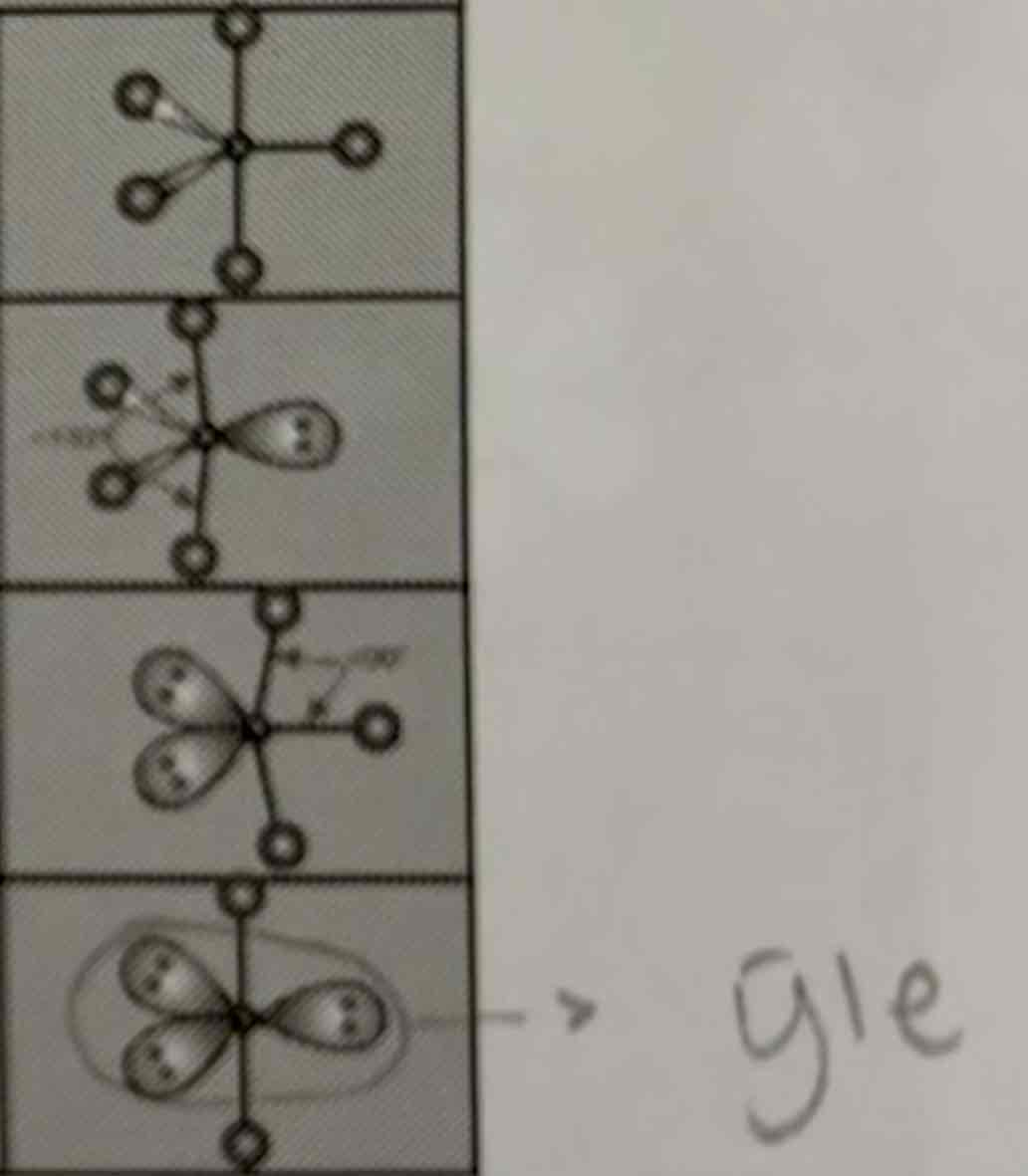
Geometrie van 5 e- paren
AB5: trigonaal bipiramidaal
AB4E: onregelmatige tetraeder
AB3E2: T vorm
AB2E2: lineair
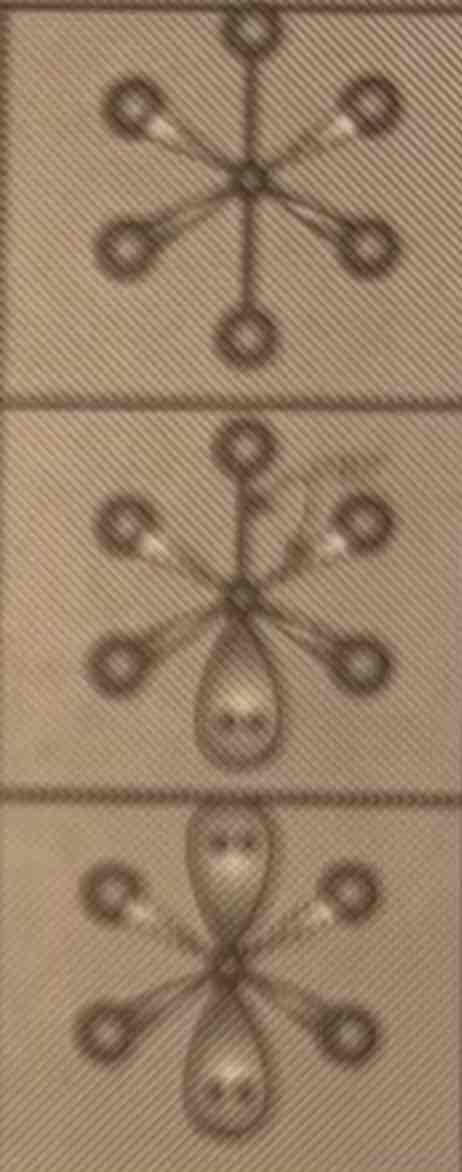
Geometrie van 6 e- paren
AB6: octaeder
AB5E: vierkant piramidaal
AB4E2: vierkant planair
oef: abundantie ab
isotoop 1 = x
isotoop 2 = y
x + y = 100
( (x . atoommassa x) + (y. atoommassa y) )/100 = atoommassa