Kinetyka reakcji enzymatycznej
1/27
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
28 Terms
szybkość reakcji enzymatycznej jest
wyznacznikiem aktywności enzymu
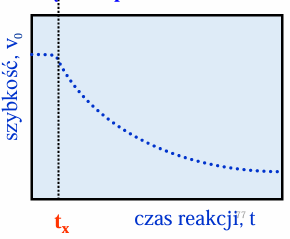
wykres szybkości reakcji od czasu
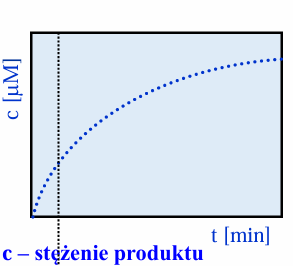
wykres stężenia produktu od czasu
kiedy szybkość reakcji osiąga wartość max
gdy wszystkie miejsca enzymu są wysycone
czy jeszcze większe początkowe stężenie substratu wpływa na szybkość reakcji enzymatycznej
nieeee
przy (1)…. początkowym [S] szybkość reakcji v0 jest (2)….. do [S]
niskim
proporcjonalna
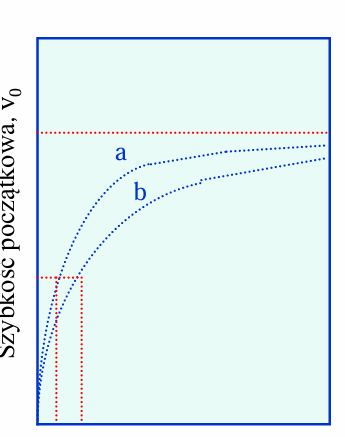
co przedstawia wykres
pokazuje że enzym a ma większe powinowactwo do substratu niż b
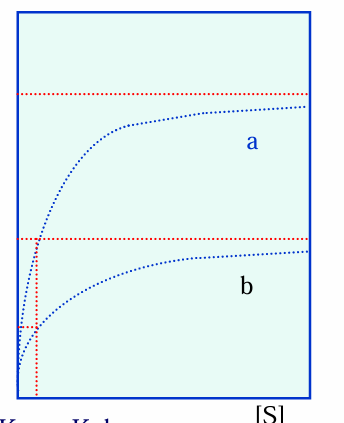
co przedstawia wykres
enzymy a i b o jednakowym powinowactwie do substratu, lecz o różnych stężeniach
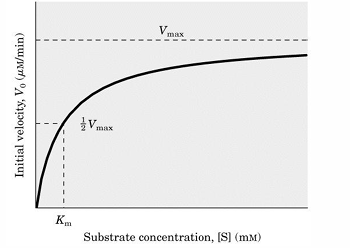
jaki to wykres
Krzywa Michaelisa-Menten
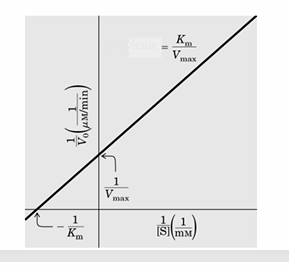
jaki to wykres
Wykres Lineweavera-Burka
gdy Km jest wysokie to (1)…… wiązanie substratu a powinowactwo substratu jest (2)…….
słabe
niskie
definicja Km
Jest miarą stabilności kompleksu ES, stanowiąc iloraz sumy szybkości rozkładu i szybkości powstawania
Informuje o sile wiązania substratu z enzymem
czynniki wpływające na szybkość reakcji enzymatycznej
stężenie substratu/ produktu/ enzymu
temperatura
pH
obecność inhibitorów i aktywatorów
jak stężenie substratu wpływa na szybkość reakcji enzymu
zwiększa się liczba cząstek mających dostateczną energię
zwiększenie prawdopodobieństwa zderzeń efektywnych
wzrasta prędkość reakcji do momentu wysycenia wszystkich cząsteczek enzymu
jak wzrost temperatury układu wpływa na aktywność enzymu
szybkość reakcji rośnie
wzrasta częstość i energia zderzeń międzycząsteczkowych
wzrasta energia kinetyczna układu
Zbyt duża ilość ciepła dostarczana do układu powoduje
spadek szybkości reakcji enzymatycznej, ponieważ enzym lub substrat ulegają denaturacji i inaktywacji
jak zmiana pH wpływa na aktywność enzymu
zmiana pH powoduje spadek aktywności enzymu i zwolnienie szybkości reakcji
wartość (1)…… pH odzwierciedla pH środowiska, w którym ten enzym znaleziono
optymalnego
jaki jest zakres pH dla optymalnej aktywności enzymu
wąski przedział pH
Typy hamowania reakcji enzymatycznych
nieodwracalne
odwracalne
kompetycyjne
niekompetycyjne
akompetycyjne
Inhibitory nieodwracalne
Inhibitor wiąże się kowalencyjnie z enzymem lub tworzą się tak silne wiązania, że dysocjacja tego kompleksu jest bardzo powolna
Przykłady inhibitorów nieodwracalnych
penicylina
aspiryna
gazy paraliżujące układ nerwowy
Penicylina
wiąże się z centrum aktywnym transpeptydazy hamując syntezę bakteryjnych ścian komórkowych (peptydyloglikanów)
Aspiryna
kowalencyjnie modyfikuje cyklooksygenazę i zmniejsza syntezę cząsteczek sygnałowych stanu zapalnego (prostaglandyn)
Gazy paraliżujące układ nerwowy
zatrucie acetylocholinoesterazy, enzymu pełniącego ważna rolę w przekazywaniu impulsów nerwowych
Inhibicja kompetycyjna przykład:
substratem dla dehydrogenazy bursztynianowej jest bursztynian, a jej inhibitorem kompetycyjnym malonian
Inhibicja niekompetycyjna przykład
działanie siarkowodoru na enzymy zawierające w centrum aktywnym atom metalu, np. żelaza lub miedzi
Inhibicja akompetycyjna przykład
działanie soli litu na monofosfatazę inozytolu hamuje działanie enzymu i uniemożliwia włączenie inozytolu do ścieżki sygnałowej komórki