Química: Teoría de Repulsión de Pares de la Capa de Valencia (VSEPR) - Vocabulario
1/26
Earn XP
Description and Tags
Conjunto de tarjetas de vocabulario sobre VSEPR: términos clave y sus definiciones para identificar geometría electrónica y molecular y sus ángulos.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
27 Terms
Teoría VSEPR (Repulsión de pares de la capa de Valencia)
Modelo que predice la geometría molecular al considerar la repulsión entre pares de electrones enlazantes y pares no enlazantes alrededor del átomo central para minimizar esas repulsiones.
Regiones electrónicas
Áreas alrededor del átomo central donde se agrupan electrones; pueden ser pares enlazantes o pares no enlazantes.
Pares enlazantes
Pares de electrones que participan en enlaces entre el átomo central y otros átomos.
Pares no enlazantes (lone pairs)
Pares de electrones que no forman enlaces y ocupan espacio alrededor del átomo central.
Geometría electrónica
Disposición espacial de todas las regiones electrónicas alrededor del átomo central (incluye pares enlazantes y pares libres).
Geometría molecular
Disposición de los átomos alrededor del átomo central; derivada de la geometría electrónica pero enfocada en la posición de los átomos.
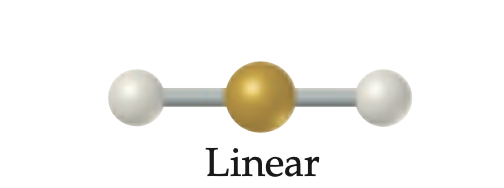
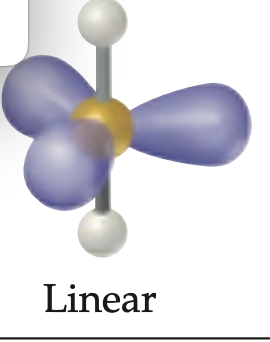
Geometría molecular y electronica lineal
Geometría molecular y electronica para dos regiones electrónicas; ángulo de enlace de 180°.
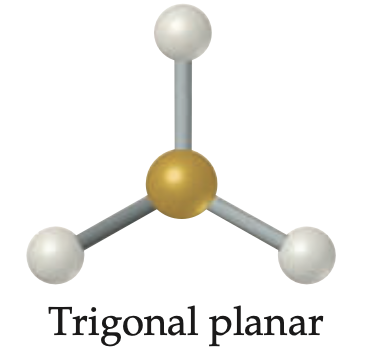
Geometría molecular trigonal plana
tres regiones electrónicas sin pares libres; ángulo de enlace alrededor de 120°; EJEMPLO
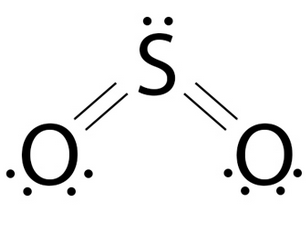
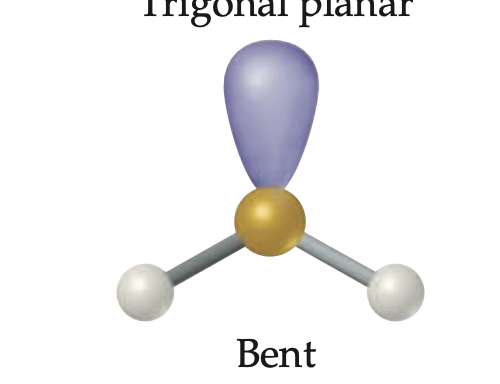
Geometría molecular angular (Bent)
Geometría para tres regiones electrónicas con 2 pares enlazados y un par libre; ángulo menor a 120°; ejemplo SO2
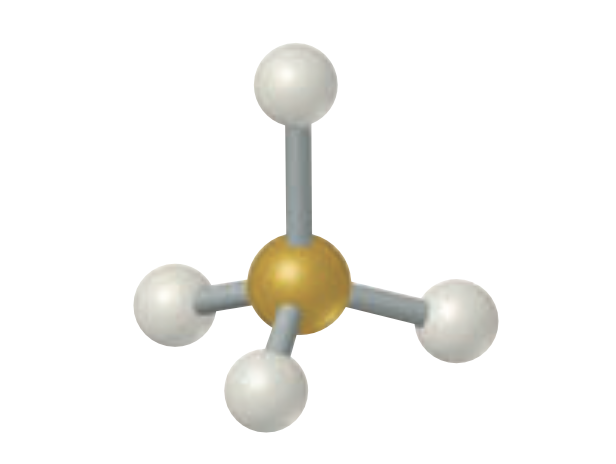
Geometría molecular y electronica tetrahetradal
Geometría para cuatro regiones electronicas, 4 pares enlazantes, 0 pares libres ángulo de enlace = 109.5°; ejemplo CH4.
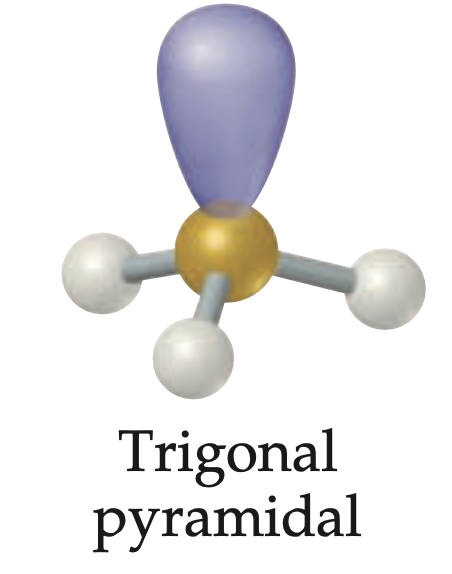
Geometría molecular y electronica trigonal piramidal
Geometría para cuatro regiones electrónicas con 3 pares enlazantes y un par libre; ángulo de enlace menor de 109.5
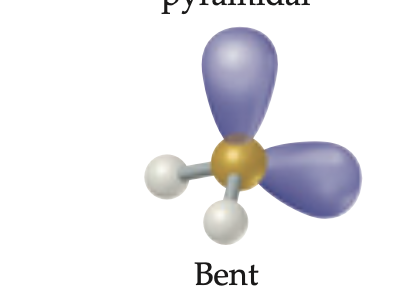
Geometria angular de tetrahetradal
Geometria para cuatro regiones electronicas con 2 pares enlazantes, 2 pares libres y un angulo de enlace menor de 109.5
Geometria molecular sube y baja
Geometria electronia 5, tiene 4 pares enlazantes y 1 par libre; angulo de enlace:menor de 120 ecuatoria y 90 axial
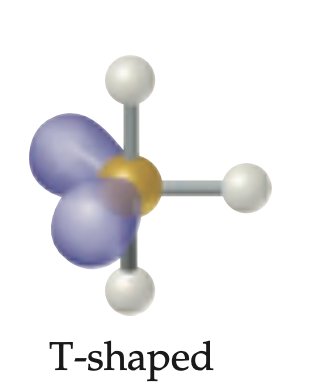
Geometria molecular forma T
5 regiones electronicas con 3 pares enlazantes y 2 pares libres; anulo de enlace menor de 90 grados.
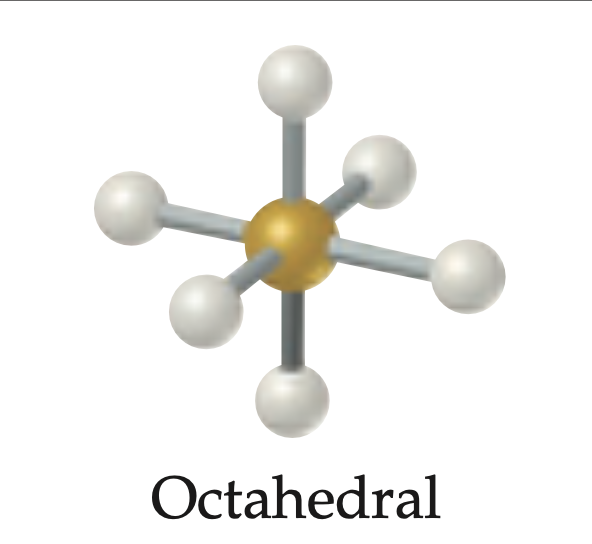
Octahedral puro
Geometría para seis regiones electrónicas; 6 pares de enlaces y 0 pares libres GM = octaédrica; ángulo de enlace 90°
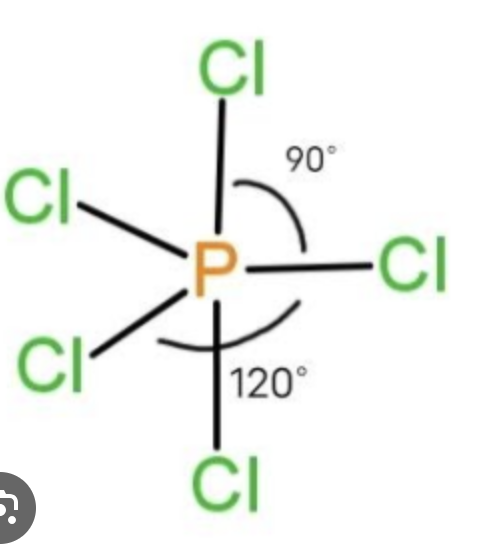
Trigonal bipiramidal
Geometría para cinco regiones electrónicas; 5 pares enlazantes y 0 pares libres; ángulos 90° y 120° entre posiciones correspondientes.
Geometria molecular lineal de trigonal bipiramidal
geometria electronica de 5 regiones, 2 pares enlazantes y 3 pares libres; angulo de enlace 180 grados
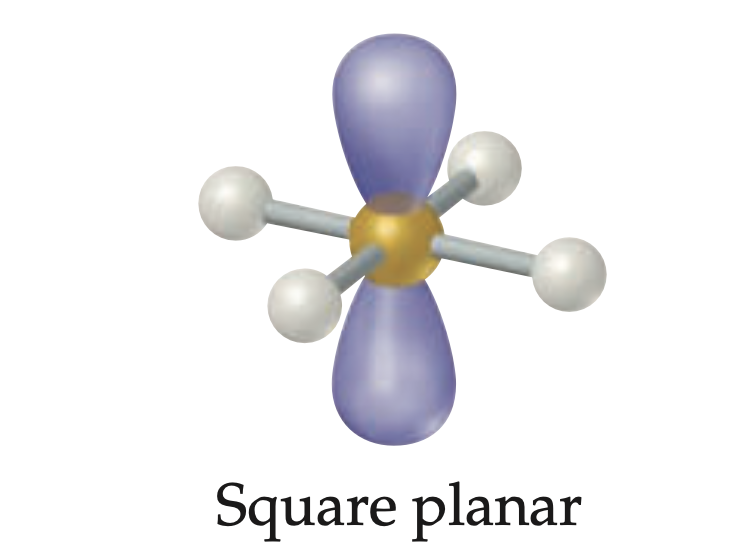
Geometría cuadrado planar
Geometría molecular para seis regiones electronicas; 4 pares enlazantes y 2 pares libres ; ángulo de enlaxe es 90°.
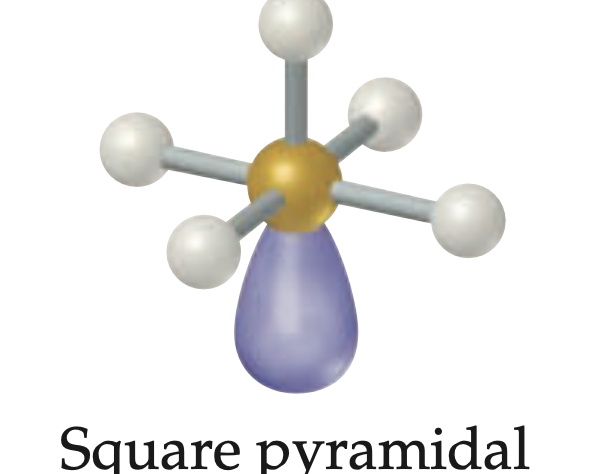
Geometría piramidal cuadrada
Geometría molecular para seis regiones; 5 pares enlazantes y 1 par libre, angulo de enlace es menor de 90°.
CO2
Geometría electrónica y molecular lineal; ángulo de enlace 180°.
H2O
Geometría electrónica tetraédrica; GM angular; 2 enlaces O–H y 2 pares no enlazantes; ángulo ≈ 104.5°.
NH3
Geometría electrónica tetraédrica; GM trigonal piramidal; 3 enlaces N–H y 1 par libre; ángulo ≈ 107°.
CH4
Geometría electrónica tetraédrica; GM tetraédrica; 4 enlaces y 0 pares libres; ángulo ≈ 109.5°.
PF5
Geometría electrónica trigonal bipiramidal; GM trigonal bipiramidal; 5 enlaces y 0 pares libres.
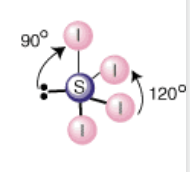
BrF3
Geometría electrónica trigonal bipiramidal; GM forma de T; 3 enlaces y 2 pares no enlazantes.
XeF4
Geometría electrónica octaédrica; GM cuadrada planar; 4 enlaces y 2 pares no enlazantes.