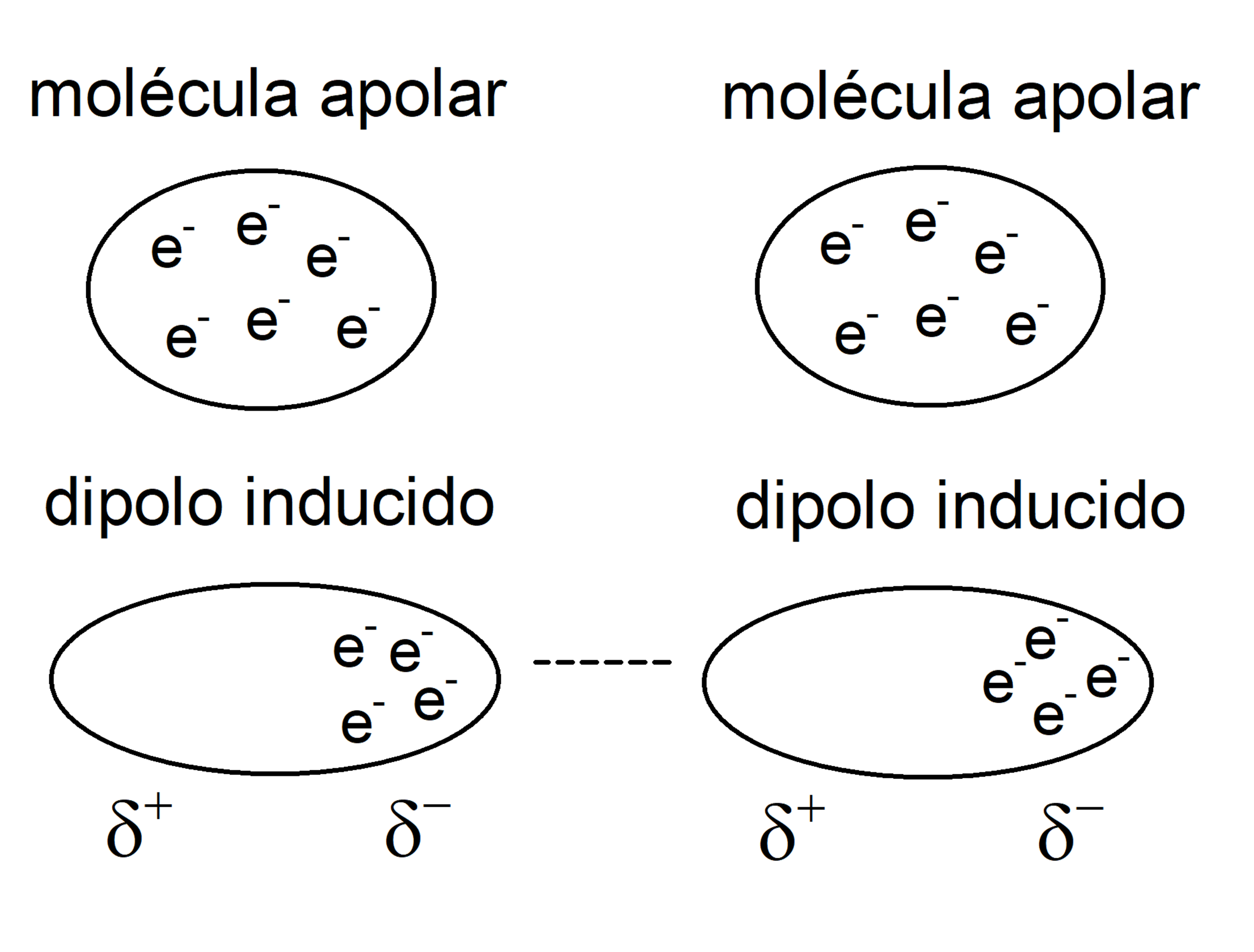Tipos de interacciones intermoleculares
1/6
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
7 Terms
Ion-Ion
Entre iones con cargas iguales o distintas, iguales repelen y distintas atraen (Ley de Coulomb).
Son fuertes.
También llamados “puentes salinos”.

Ion-Dipolo
Entre Ion y molécula polar.
Puede romper interacciones Ion-Ion.
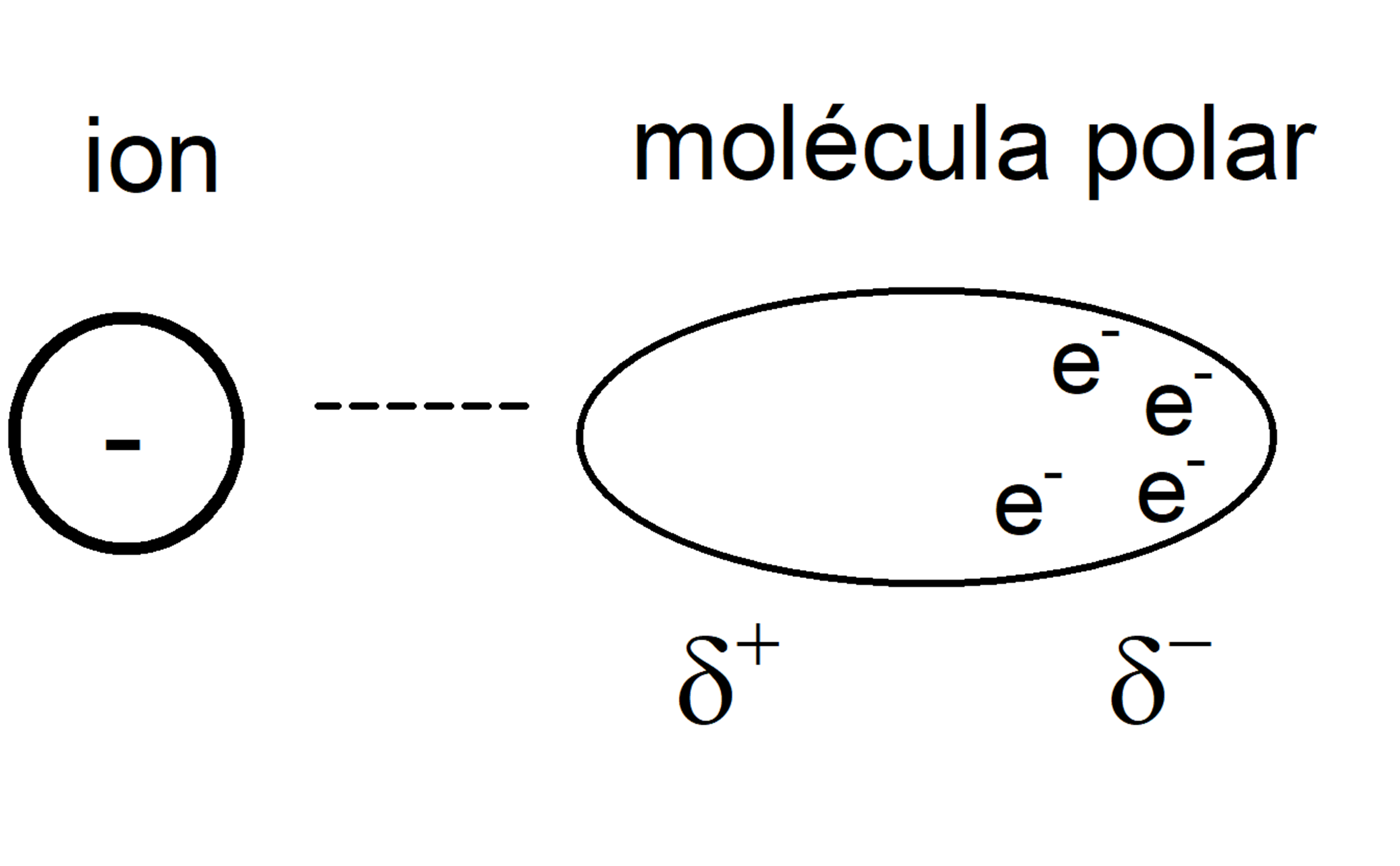
Ion-Dipolo inducido
Entre Ion y molécula apolar.
La proximidad del Ion deforma la nube electrónica de la molécula apolar, volviéndola polar y produciendo atracción.
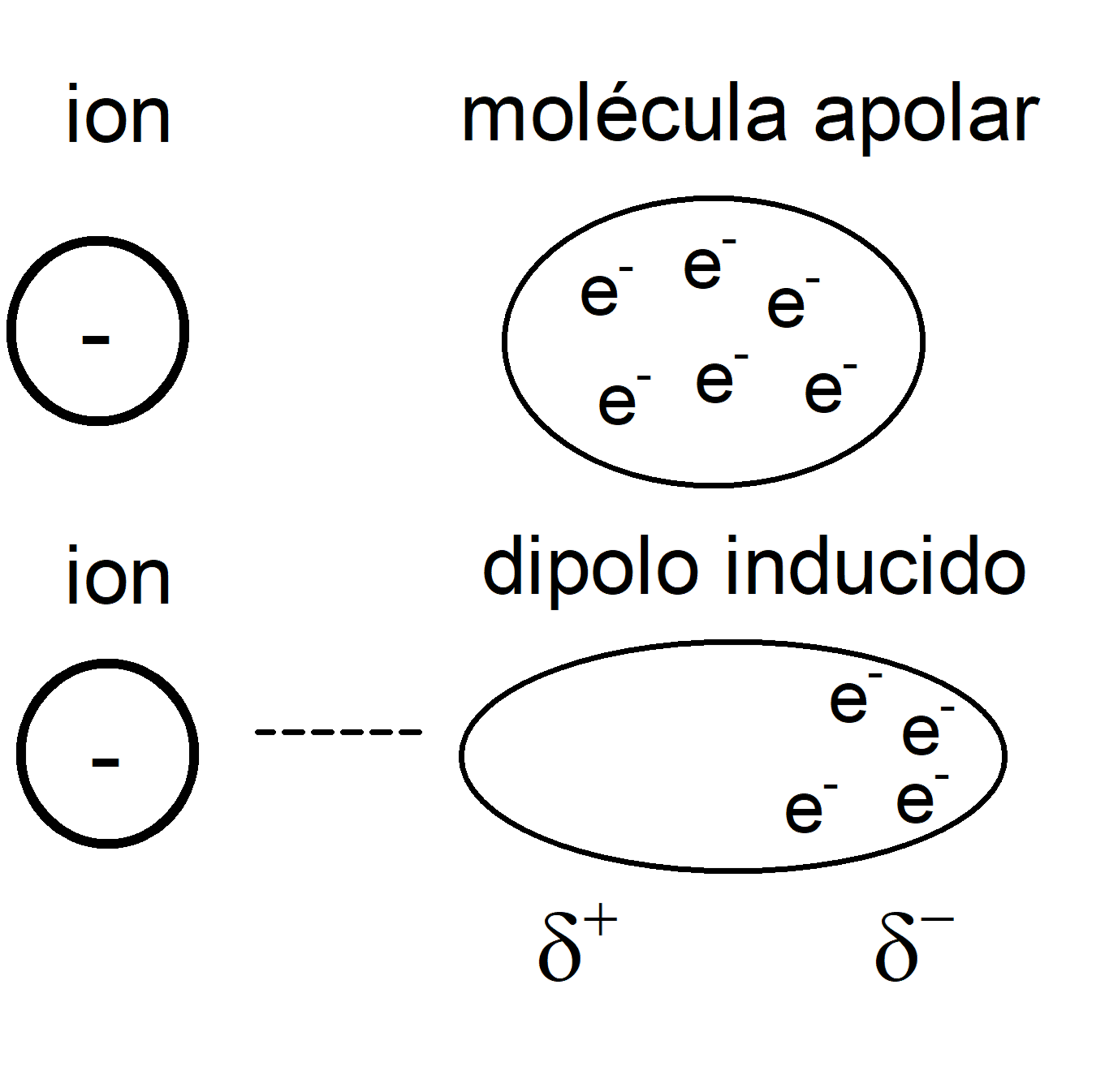
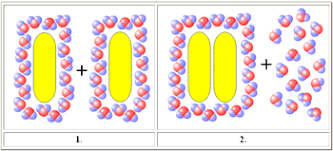
Hidrofóbicas
Con tal de evitar interactuar con el agua, moléculas tienden a asociarse para reducir la superficie en cual tocan agua.
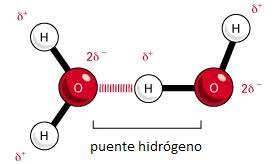
Dipolo-Dipolo Puente de Hidrógeno
Enlace entre hidrógeno y moléculas altamente E.N como N, O y F.
Además producto del enlace, el hidrógeno queda cargado parcialmente (tiene una pequeña carga positiva y negativa), llevando a que interactúe con otras moléculas E.N vecinas, dejando al hidrógeno como puente entre ambos átomos.
Un buen ejemplo de estos enlaces es el agua. Explicando su punto de ebullición elevado y porque su estado sólido es menos denso.
Dipolo-Dipolo Inducido
Entre moléculas polares y no polares.
La carga de la molécula polar distorsiona la nube electronica de la molécula apolar, convirtiéndola en un dipolo.
Este tipo de interacción explica cómo el agua puede levemente disolver moléculas no polares como el O₂ o CO₂.
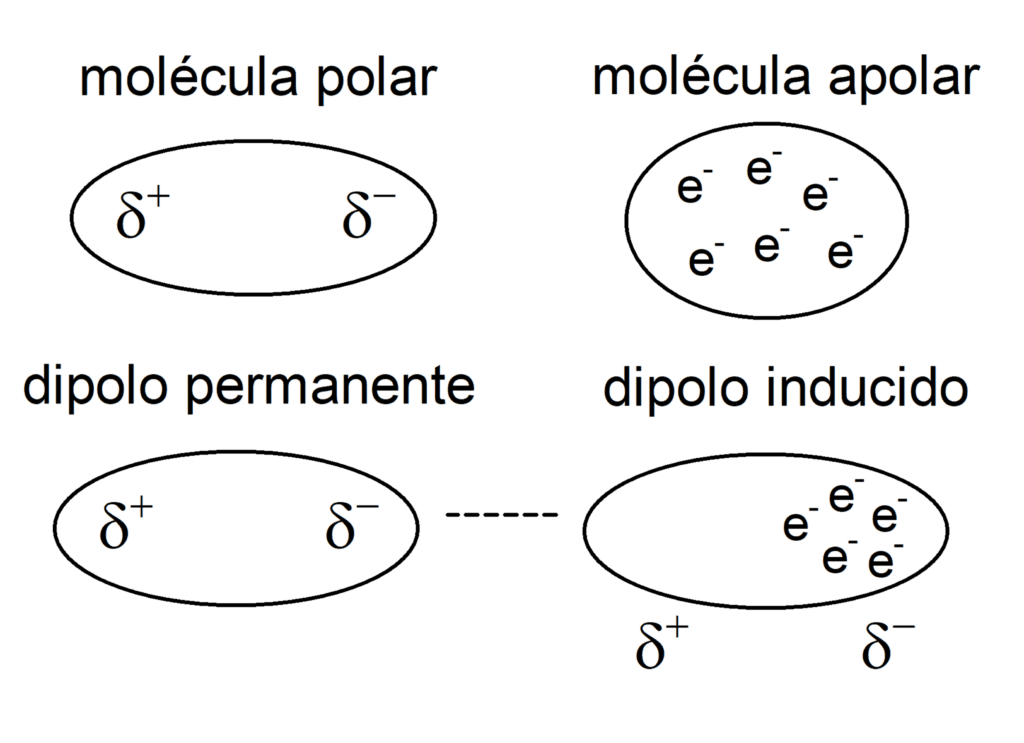
Dipolo Inducido-Dipolo Inducido
Entre moléculas no polares.
Explica porque es posible que los gases nobles pueden existir en estado líquido, como el nitrógeno líquido. Sin embargo ocurre muy pocas veces y en condiciones extremas.