DF_1Interacción Fármaco-Diana
1/18
Earn XP
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
19 Terms
¿Qué es un fármaco?
Un compuesto que interactúa con un sistema biológico para producir una respuesta biológica. Es el principio activo de un medicamento.
¿Qué es el IC₅₀?
La concentración de un compuesto necesaria para inhibir el 50% de la actividad de una enzima, receptor u otra diana biológica.
¿Qué indica un IC₅₀ más bajo?
Indica mayor potencia; se necesita menos fármaco para obtener el efecto deseado.
¿Qué son los compuestos "Hit"?
Compuestos con potencia farmacológica entre 1 y 10 µM.
¿Qué son los compuestos "Lead" (Líderes)?
Compuestos con potencia en el rango nanomolar (< 1000 nM).
¿Cuáles son los principales blancos moleculares de los fármacos?
Proteínas (enzimas, receptores, transportadoras) y ácidos nucleicos (ADN, ARN).
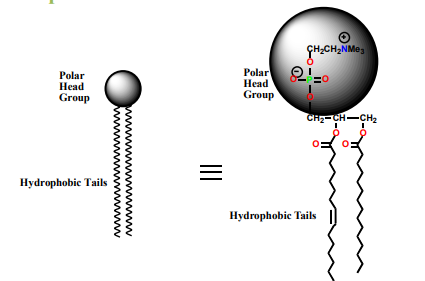
¿Qué forma la membrana plasmática?
Una bicapa de fosfolípidos.
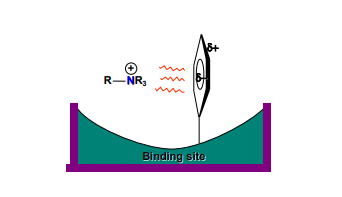
¿Qué tipo de interacción es la más fuerte entre las fuerzas intermoleculares?
Las interacciones electrostáticas (iónicas).
Blancos terapéuticos
Moléculas del cuerpo humano (o de un patógeno) con las que un fármaco interacciona para producir un efecto terapéutico.
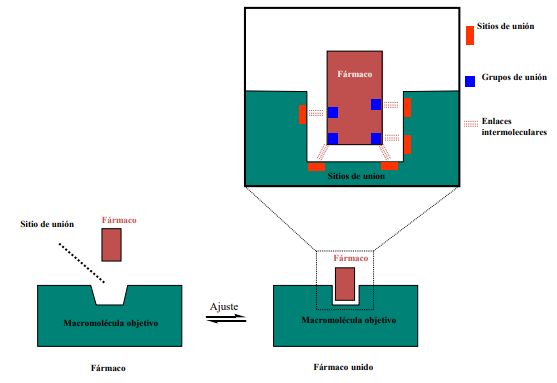
¿Qué son las fuerzas intermoleculares?
son interacciones físicas que ocurren entre moléculas diferentes y que no implican enlaces covalentes. Estas fuerzas determinan cómo las moléculas se reconocen, se unen y se estabilizan entre sí.
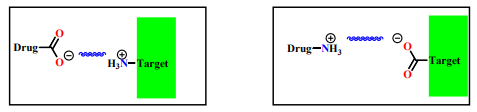
Fuerzas Electrostáticas (Iónicas)
Ocurren entre grupos con cargas opuestas (ej: NH₃⁺ en el fármaco y COO⁻ en el blanco).
Son las más fuertes (20–40 kJ/mol).
Más fuertes en ambientes hidrofóbicos.
Interacciones Ion-Dipolo
Ocurren entre una carga iónica y el momento dipolar de otra molécula.
Más fuertes que las interacciones dipolo-dipolo.
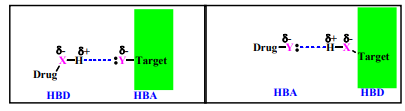
Interacciones por Puente de Hidrógeno
Entre un hidrógeno deficiente en electrones (donador) y un heteroátomo rico en electrones (aceptor: N, O).
Más débiles que las iónicas, pero más fuertes que Van der Waals.
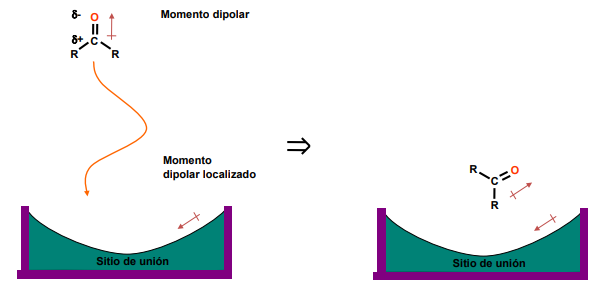
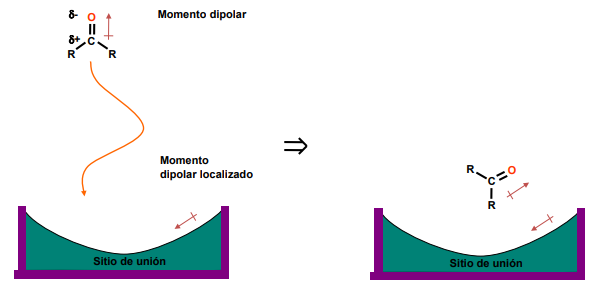
Interacciones Dipolo-Dipolo
Ocurren cuando tanto el fármaco como el blanco tienen momentos dipolares permanentes.
Los dipolos se alinean al interactuar.
Interacciones de Van der Waals
Muy débiles (2–4 kJ/mol).
Ocurren entre regiones hidrofóbicas debido a dipolos transitorios.
Disminuyen rápidamente con la distancia.
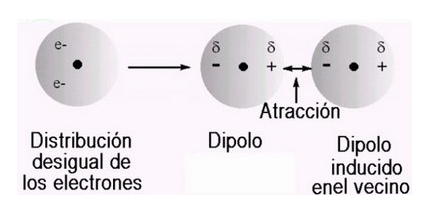
Interacciones de Dipolo Inducido
Ocurren cuando una molécula cargada induce un dipolo temporal en otra (ej: ion amonio cuaternario y anillo aromático).