hcs
1/59
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
60 Terms
Targeted nanomedicatie
Geneessmiddelen ingekapseld in nanodeeltjes om werkzaamheid te verbeteren en bijwerkingen te verminderen.
Als farmacon door nanodeeltje op plek van werking wordt gebracht: drug carrier effect
Routes drug targeting
Lokale toediening op plek van ziekte: injecties, implanten of cremes. Aanpak beperkt tot gevallen waar ziekte zeer gelokaliseerd is en toediening mogelijk is.
Systemische toediening: in hele lichaam. Injecties die direct in bloedbaan komen. Nanodeeltjes gaan naar ziekte plaats door receptoren of kenmerken van zieke cel.
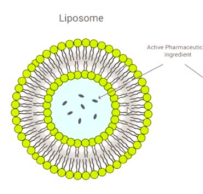
Nanoliposomen
Lipide buitenlaag en waterige binnenlaag
Geschikt voor kleine hydrofiele geneesmiddelen. Lipide laag beschermt tegen externe omgeving. Goed voor kleine moleculen zoals chemotherapeutica, want moeilijk oplosbaar en beter getransporteerd en afgegeven door liposomale dragers.
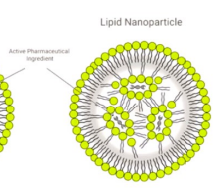
Lipide nanoparticles
Vaste kern van lipide nanokristallen, omgeven door een laag van oppervlakte actieve stoffen.
Geschikt voor afgifte nucleinezuren, zoals dna en rna. Stabiele kern zorgt voor bescherming.
Toepassing: gebruikt bij vaccins en genetische therapieen
MPS (mononuclear phacyte system)
fagocytische cellen zoals macrofagen in lever milt en andere organen. Als nanodeeltjes worden toegedient kunnen ze opgenomen worden door MPS → verwijdering in circulatie.
Dit zorgt voor uitdaging voor ontwerpen nanodeeltjes voor geneesmiddelafgifte, waardoor korte halfwaarde tijd en verminderde therapeutische efficientie.
Kan wel gebruikt worden bij oncologie door tumor antigenen in liposomen te stoppen waardoor meer in contact met T-cellen en dus meer aanmaak van T-cellen.
Hoe kun je liposomen langer laten circuleren
PEG laag. Remt opsonisatie (markering voor fagocytose). Dit heet ook wel stealthing. Hierdoor langere circulatie tijd nanodeeltjes → effectiever om bij correcte locatie aan te komen voor fagocytose.
Hoe kan je stabiliteit van ingekapselde geneesmiddel in bloedbaan vergroten en dus afgifte ervan in tumor omgeving bevorderen?
Micellen: emulgator in waterige omgeving zorgt voor micellen → staarten naar midden en koppen naar buiten.
Pi-Pi stacking: niet-covalente interactie tussen aromatische ringen in moleculen → vorming van stabiele structuren. Hierdoor geneesmiddel minder snel vrij in bloedbaan.
Door micellen te ontwerpen met pipi-stacking eigenschappen meer geneesmiddel afgifte op tumorcel locatie → minder afgifte in bloedbaan en meer in tumorcel
Extravasatie nanodeeltjes
Nanodeeltjes kunnen niet tussen endotheelcellen heen. Ze kunnen wel in de lever en milt via fenestriene gaatjes.
Bij ziektes in organen wordt endotheel permeabel → targeting makkelijker (EPR effect). Als ze lang genoeg in bloedbaan blijven kunnen ze binnen komen
EPR effect: Enhanced permeanilty and retention
Tumoren hebben abnormale bloedvaten met lekkages en verminderde lymfatische drainage. Nanodeeltjes kunnen hierdoor bloedvaten wel passeren en dus in tumoromgeving ophopen.
PEGylering helpt bij EPR effect: door langere circulatie tijd meer tijd voor extravasatie van nanodeeltjes en dus meer tijd om in tumoromgeving te komen.
EPR effect vereisten voor medicijn:
• Nanogrootte
• Lange circulatie
• Geen/beperkte drug afgifte in de bloedbaan
Targeting technieken
Passieve targeting: nanodeeltjes maken gebruik van EPR. Door kleine grootte kunnen door beschadigde bloedvaten en tumor binnendringen.
Actieve targeting: maakt gebruik van specifieke moleculaire interacties tussen nanodeeltjes en doelwitten op de oppervlakte van doelcel. Kan door koppelen doelgerichte ligand(antilichaam, peptide etc.) aan nanodeeltje. Bindt aan receptor doelcel → hogere nauwkeurigheid geneesmiddelafgifte
Triggered targeting: afgifte op een specifieke locatie door bepaalde omstandigheden. Licht, warmte, ultrasone golven of magnetische velden extern toepassen, waardoor geneesmiddel selectief vrij wordt gegeven op de gewenste locatie → hogere effectiviteit en minder bijwerkingen
Thermodox en HIFU
Thermodox: afgifte van geneesmiddel door temperatuur verhoging → triggered release vanaf bepaalde temperatuur en heel veel geneesmiddel afgifte als werkelijk bereikt
High-intensisty Focused Ultrasound
Kan gericht worden op tumorweefsel → verwarming tumorweefsel. Samen met MRI gekeken of tumor ook werkelijk op locatie komt. Ook temperatuur gemeten want je wilt niet warmer dan 40 graden, gezonde cellen gaan dan dood.
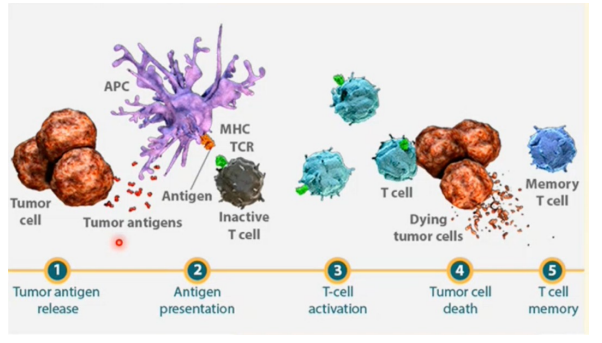
Basis principe van kanker immunotherapie
Het in staat stellen van immuunsysteem om specifieke tumoren te herkennen en aan te vallen.
tumor antigeen afgifte
antigeen presentatie door MHC op APC
Herkenning door T-cel en activatie
Tumor cel dood door T-cel
aanmaak van memory T-cellen
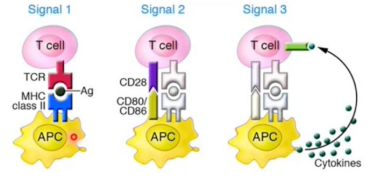
Drie signalen T-cel activatie
TCR en MHCI/II
B7 en CD28
Cytokine afgifte
Tumor-geassocieerde antigenen (TAA)
Antigenen die zowel op kanker cellen en normale cellen zitten. In kanker cellen overexpressie van TAA’s of op andere manier geproduceerd, waardoor abnormale hoeveelheid.
Tumor-specifiek antigenen(TSA) (neo-antigenen)
Expressie in tumoren. Niet te vinden in normale cellen. Komt door oncogenische driver mutaties waardoor neoantigenen ontstaan.
Specifiek voor individuele patienten en ontstaan als gevolg voor mutaties in tumor DNA. Hierdoor unieke eiwitsequentie niet te vinden in normale cellen.
Kanker Immuno-editing/immuunbewerking
Bevat drie fasen die dynamische relatie tussen immuunsysteem en kankercellen weerspiegelen. Immuunsysteem niet alleen capaciteit om kanker te elimineren, maar kanker kunnen ook adaptaties ondergaan om immuunrespons te ontstnappen.
eliminatie: herkennen en vernietigen kankercellen → actieve eliminatie van abnormale cellen voordat ze tumoren worden. Zowel aangeboren als adaptief immuunsysteem speelt een rol.
Evenwicht: resterende kankercellen vormen dynamisch evenwicht, kankercellen minder vatbaar voor immuunherkenning en minder eliminatie. Co-existentie tussen immuunsysteem en tumor.
Ontsnapping: overlevende kankercellen ontwikkelen mechanismen om detectie en eliminatie te voorkomen. Kan door expressie van dingen zoals PD-L1 of afgifte van TGF-beta
Dit leidt uiteindelijk tot immunosuppresieve tumoren
Immunosuppresie
Deactivatie van T-cellen in plaats van activatie.
Status van tumor ook wel hot of cold genoemd.
Hot: tumor met actieve immuunrespons, immunsysteem kan herkennen en aanvallen. Veel immuuncellen aanwezig in tumor omgeving.
Cold: tumor met immuunrespons die beperkt is. Weinig tot geen infiltratie immuuncellen in tumor omgeving, moelijker voor immuunsysteem om te herkennen en aan te vallen. Minder gevoelig voor immuuntherapie.
Adoptieve T-cel Therapie
T-cellen worden geisoleerd, gemodificeerd of versterkt in lab en vervolgens terug in patient geplaatst om kanker te bestrijden. 3 typen.
TIL
TCR Therapie
CAR-T cel therapie
TIL (Tumor-infiltrating Lymphocytes)
TIL (Tumor-infiltrating Lymphocytes): Tumor weefsel wordt verwijderd en immuuncellen in weefsel wordt geisoleerd, geactiveerd en gekweekt. Patient geconditioneerd voor ontvangst geactiveerde TIL met chemo. Via infusie teruggegeven → TIL capaciteit om tumor te herkennen en aan te vallen
Gedachte achter TIL: immuuncellen al in staat om tumor te herkennen, maar onvoldoende aanwezig/verzakt in natuurlijke omgeving. Door buiten te vermenigvuldigen en activeren, worden ze versterkt teruggegeven (cold → hot)
TCR Therapie
Isolatie T-cellen uit bloed
Identificatie tumorantigenen, eiwitten specifiek aanwezig op tumoroppervlak
T-cellen gemodificeerd om geidentificeerde antigenen te herkennen door gesynthetiseerde TCR in T-cellen te introduceren.
gemodificeerde t-cellen gekweekt en vermenigvuldigd
Soms conditionering patient met chemo om ruimte te maken voor T-cellen
Infusie T-cellen
T-cellen zoeken naar tumorcellen met de eerder geidentificeerde tumor antigenen → vernietiging tumor door T-cellen
Deze behandeling is gepersonaliseerd, want is ontworpen om te reageren op specifieke antigenen van individu, hierdoor sterk en gerichte immunrespons tegen kanker
CAR-T cel therapie (chimeric antigen receptor)
Isolatie T-cellen uit bloed
Genetische modificatie van T-cellen → in lab gemodificeerd om synthetische receptor CAR tot expressie te brengen. Deze is specifiek ontworpen om te binden aan een bepaald antigen op oppervlak van kankercel
kweken en vermeningvuldigen
Infusie
Doolgericht aanval op kanker
Belangrijkste voordeel van CAR-T celtherapie is gebruikt van T-cellen met synthetische receptor die effectief zijn bij kankercellen die normaal moeilijk te behandelen zijn.
Ze werken door antigenen te targeten en zijn niet afhankelijk van MHC moleculen zoals TIL en TCR therapie. Dus effectievf bij kanker cellen met lage of geen expressie van MHC.
Gevaar bij CAR-T. TCR van CAR T-cellen kunnen reageren op normale weefsels als deze weefsel antigene structuren delen als die van de doelcellen → cytotoxisciteit van gezonde cellen.
Vijfde generatie CAR-T cellen kunnen deze TCR uitschakelen mbv CRISPR-Cas9-technologie → T-cel meer gericht op expressie en activiteit van CAR → gunstig voor antitumor respons.
Beperkingen CAR-T Therapie
Verlies doelantigenen: evolutie van tumor kan doelantigenen verliezen/verminderen die worden herkend door CAR-T cellen. Hierdoor minder effectief
CAR-T: kunnen zorgen voor cytokine release syndrome(CRS), overmatig immuunrespons kan leiden tot koorts, hypotensie en misschien zelfs orgaanfalen.
CAR-T cellen hebben moeite om specifieke locaties van tumoren te bereiken. tumormicro omgeving barrieres zoals tumorextracellulaire matrix kunnen CAR-T belemmeren
CAR-T kan een selectieve druk uitoefenen op tumor → opkomst van subpopulaties met minder gevoeligheid therapie
Dendritische cel therapie
DC geoogst, geactiveerd en beladen met tumorantigenen. Terug geplaatst in patient. Dienen als APCs waardoor naive t-cellen kunnen activeren.
Therapeutische kanker vaccins
ontworpen om immuunsysteem te stimuleren, inclusief naive t-cellen om gericht op tumorantigenen te reageren. Bevatten tumor antigenen of delen ervan.
mRNA vaccins
gebruik van mRNA om immuunsysteem te activeren en immuunrespons tegen specifieke ziekte verwekkers op te wekken.
identificatie antigen.
Maken mRNA: genetische code voor antigen wordt geisoleerd en geintregeerd in mRNA. Dient als blauwdruk voor antigen
Levering van mRNA: ijectie van mRNA vaak met lipide nanodeeltjes om effectiviteit en levering te vergroten
Als mRNA cellen binnen komen, gaan cellen zelf antigen produceren
immuunrespons: immuunsysteem herkend als lichaamsvreemd en gaat immuuncellen (b- en t-cellen) activeren om specifieke respons te genereren tegen antigen
geheugen respons: antigen wordt onthouden door immuunsysteem, bij volgende blootstelling kan lichaam sneller en krachtiger reageren.
Welke modificaties voor minder afbraak en immuun herkenning via bijv TLRs voor mRNA vaccins
nucleotide modificaties
cap-structuur: toevoeging van cap aan 5’ zeide van mRNA → meer stabilisatie een voorkomen afbraak
polyadenylatie: toevoegen poly-A-staart aan 3’ zeide om stabiliteit te verhogen
Methylatie: methylering van specifieke nucleotieden om mRNA immuunherkenning te verminderen.
Oncolytische virussen als medicijn
Kunnen alleen repliceren in tumoren. Komt omdat tumorcellen systeem voor virusverwijdering hebben uitgeschakeld. Hierdoor dood tumor en grote vrijkomst tumor antigenen → handig voor immuunrespons
Immuntherpie met bacterieën
Tumoren hebben vaak gebieden met laag zuurstofgehalte (hypoxie). Aneorobe bacterieen kunnen hier groeien. Ze kunnen dus specifiek overleven in tumor en richten op hypoxische gedeelten.
Deze bacterien kunnen:
direct tumor aanvallen of doden, repliceren in tumoromgeving en schadige stoffen afgeven die tumor beschadigd
pro-drugs omzetten met enzymen in bacterie
immuunsysteem stimuleren door afgifte van immuunstimulerende moleculen → lokaal immuunrespons en activiteit immuuncellen stimuleren,
verbeterde medicijen afgifte, ze kunnen functioneren als dragers van medicijn en dus gericht naar tumor gaan → efficientie van medicijn afgifte hoger en bijwerkingen minder
Cytotoxische T-cellen (CTL)/CD8+ T-cellen
Specifiek betrokken bij bescherming tegen tumorgroei.
Antigennen herkennen door presentie van MHCI door APC
Activering: MHC-I herkenning
Celdoding: perforines/granzymes
Geheugenrespons: bij volgende blootstelling, sneller en krachtiger
Samenwerking: dendritische cellen en T-helpercellen
Antilichamen
IgG: doet weinig
IgA: als tumor tegenkomt, trekt ander antilichamen aan om te doden
NK-cellen
Kunnen gezonde cellen herkennen door MHCI op oppervlak. Hierdoor gaan ze deze cellen niet aanvallen. Tumorcellen zorgen voor verminderde expressie van MHCI om T-cellen te ontsnappen.
Hierdoor NK-cellen minder geremd en dus dood maken tumor.
Tumorcellen die wel MHCI expressie hebben, maar ook specifieke tumorantigenen hebben kunnen ook gedood worden door NK, als het signaal van de tumorantigenen sterker is dan het remmende signaal van MHCI.
Hoe ontsnappen tumoren immuunsysteem?
Vermindering van MHC-I expressie
Afgifte van immuunsupressieve cytokinen: IL-10 en TGF-beta ⇒ activatie Treg
Activatie PD-L1 en CTLA-4 "checkpoint moleculen" stoppen activatie van T-cellen.
mutaties maken herkennen van tumoren moeilijker
fysieke barriere ⇒ tumoren worden moeilijker om aan te binden
Macrofagen
M1: proimflammetior, bevorderen immuunrespons door tumoren aan te vallen en elimineren door cytotoxische activiteit en productie ontstekingsmediatoren.
M2: anti-inflammatior en immunosupressief. Tumoren ondersteunen door angiogenese, weefselherstel en onderdrukking immuunrespons.
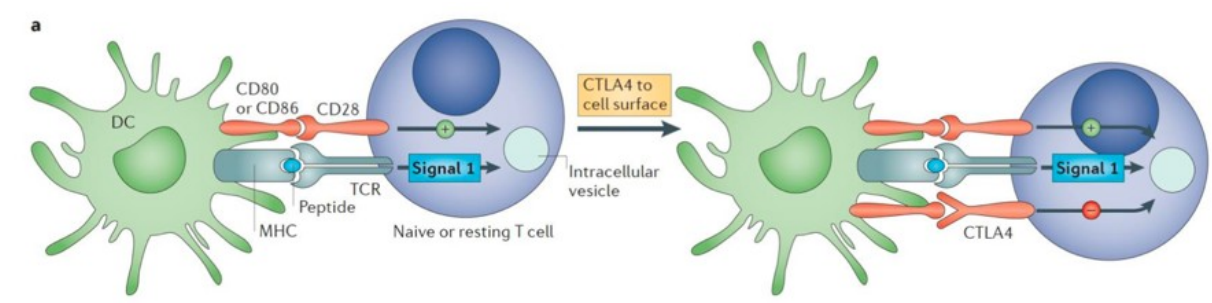
CTLA-4
Normale T-celactivatie:
Wanneer een antigeen wordt herkend door een T-cel, begint een proces van T-celactivatie. Tcellen drukken een oppervlakte-eiwit uit genaamd CD28, dat bindt aan het CD80-molecuul
op antigeenpresenterende cellen (APC's). Deze binding geeft een signaal dat de T-cel
activeert.
• CTLA-4-remming van T-celactivatie
CTLA-4 is een molecule dat structureel vergelijkbaar is met CD28 en bindt ook aan b7 (CD80/86) op APC's. Echter, in tegenstelling tot CD28, heeft CTLA-4 een remmende functie. Wanneer CTLA4 bindt aan B7, remt het de signaaloverdracht die nodig is voor volledige T-celactivatie.
• Remming van T-celproliferatie en activatie
De binding van CTLA-4 aan B7 leidt tot remming van T-celproliferatie en activatie. Dit Dremmende signaal helpt de immuunrespons te onderdrukken om overmatige immuun activiteit en mogelijke aanvallen op gezond weefsel te voorkomen.
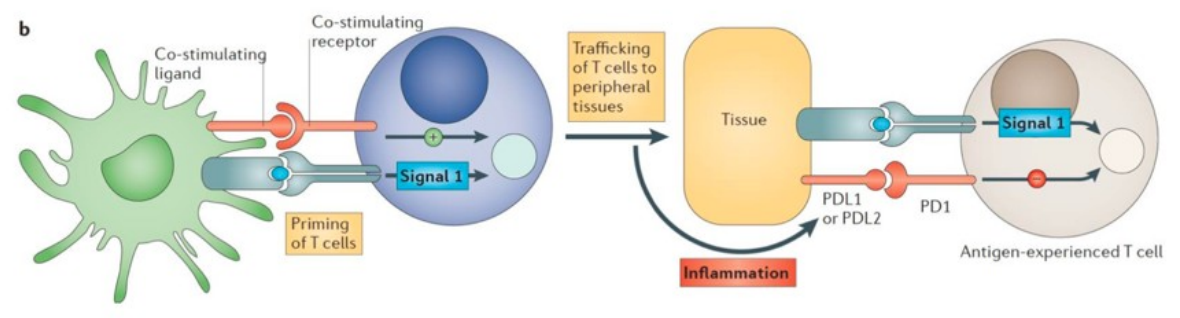
PD1
PD-1 is een remmend molecuul dat bindt aan PD-L1 of PD-L2, wat zorgt voor remming van de T-cel. Dit is normaal nodig voor onnodige immunreacties/autoimmunreacties.
Tumoren maken gerbuik van dit mechanisme om aanvallen van immuunsysteem te vermijden.
Genoom instabiliteit bij kanker
Ontstaat door constanste druk in lichaam door processen die bezig zijn: replicatie, metabolieten en enzymatische modificatie etc. Ook buiten lichaam zoals UV, straling, chemische stoffen zoals asbest.
CIN: meer oncogenen, heterogeniteit etc.
Puntmutaties
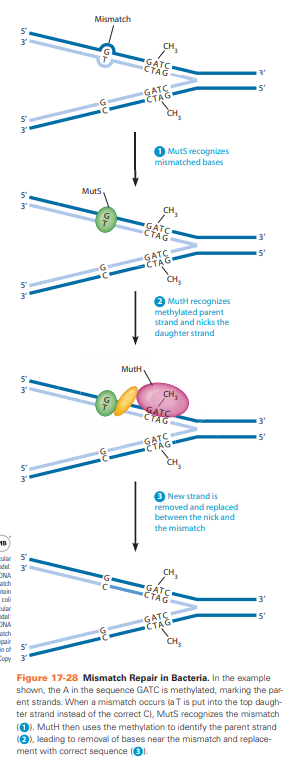
MMR: Mismatch repair
Bij fouten bij replicatie
MutS herkent mismatch
MutH herkent gemetyleerde parent strand en maakt een gat in dochterstreng
Exonuclease verwijdert nucleotiden in dochterstreng en vervangt het door de juiste sequentie
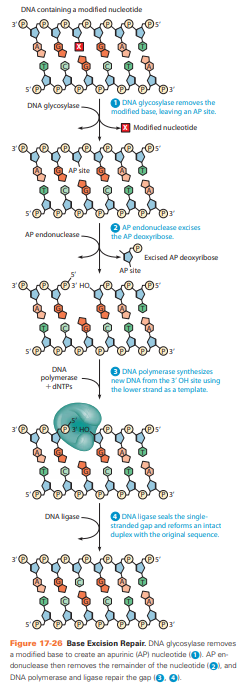
BER: Base excision repair
bij schade door: oxidatie, alkylatie of spontane depurinatie/depyrmidinatie
Schade herkenning door DNA-glycosylase en verwijderd beschadigde base door binding tussen suiker en base the splitsen.
Ontbrekende base herkend door AP-endonuclease breekt fosfodiester af.
DNA polymerase vult gat en ligase verbind.
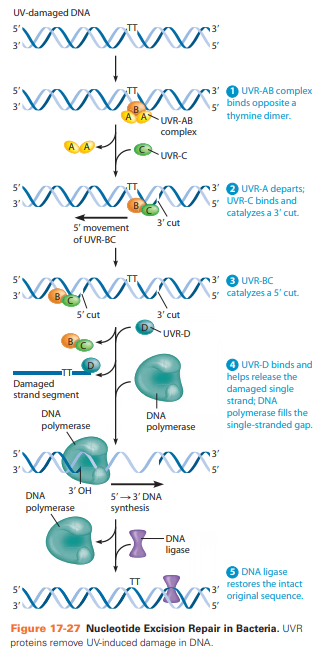
NER
Bij UV schade (hierdoor ontstaan dimeren tussen thymine)
UVR-AB complex bindt aan tegenovergestelde kant van thymine dimeer. UVR-A komt lost en UVR-C bindt → sneetje aan 3’.
UVR-BC gaat richting 5’ en sneidt aan 5’. UVR-D bindt en zorgt voor vrijkomen beschadigde DNA.
DNA polymerase en ligase
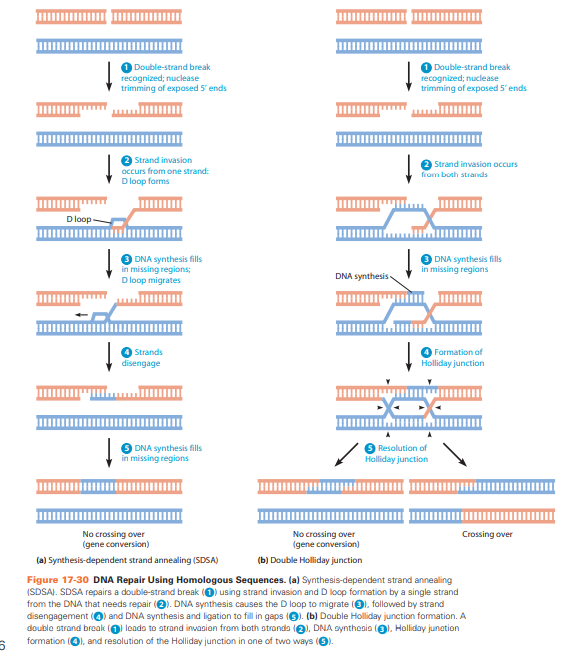
Double strand break repair
HR:
genetische informatie steekt over tussen DNA-moleculen die uitgebreide overeenkomsten vertonen. Alleen bij S- en G2- fase celcyclus.
Bij HR worden de ontbrekende stukken van de gebroken strengen nauwkeurig hersteld met behulp van de identieke zusterchromatide als sjabloon
NHEJ
breuk herkend door eiwitten Ku70 en Ku80.
Uiteindes afgesneden door nucleases
Dna ligase IV sluit de breuk weer af.
Heel fout gevoelig en alleen gedaan als er geen DNA is die het als voorbeeld kan nemen.
Heterogene ziekte
Iedere tumor en individu = uniek
Heterogeniteit
Verschillende combinaties tumor, subklonen, agressiviteit
Primair vs metasase
Invloed op behandeling
Hallmarks van metastasen
Eigenschappen/processen betrokken bij vorming en verspreiding van metastasen
Motiliteit en invasie:
motiliteit: kankercellen hebben verhoogde beweeglijkheid → loskomen van oorspronkelijke tumor
Invasie: kankercellen kunnen aangrenzend weefsel binnenkomenModulatie micro omgeving: micro-omgeving beïnvloeden door vrijgeven signaleringsmoleculen, groeifactoren en manipuleren immuunrespons
Plasticiteit: vermogen van kanker om fenotype te veranderen. Aanpassen aan omgeving, waardoor metastase in nieuwweefsel kan bevinden
kolonisatie: kankercellen vestigen en prolifereren in nieuwe locatie → vorming secundaire tumoren/metastasen
8 Stappen van metastase
Evolutie van tumorcel met de juiste invasieve kenmerken
Pre-metastase niche
lokale invasie
intravasatie
overleven in bloedbaan
extravasatie
Adapteren nieuwe omgeving
uitgroeien van nieuwe tumormassa
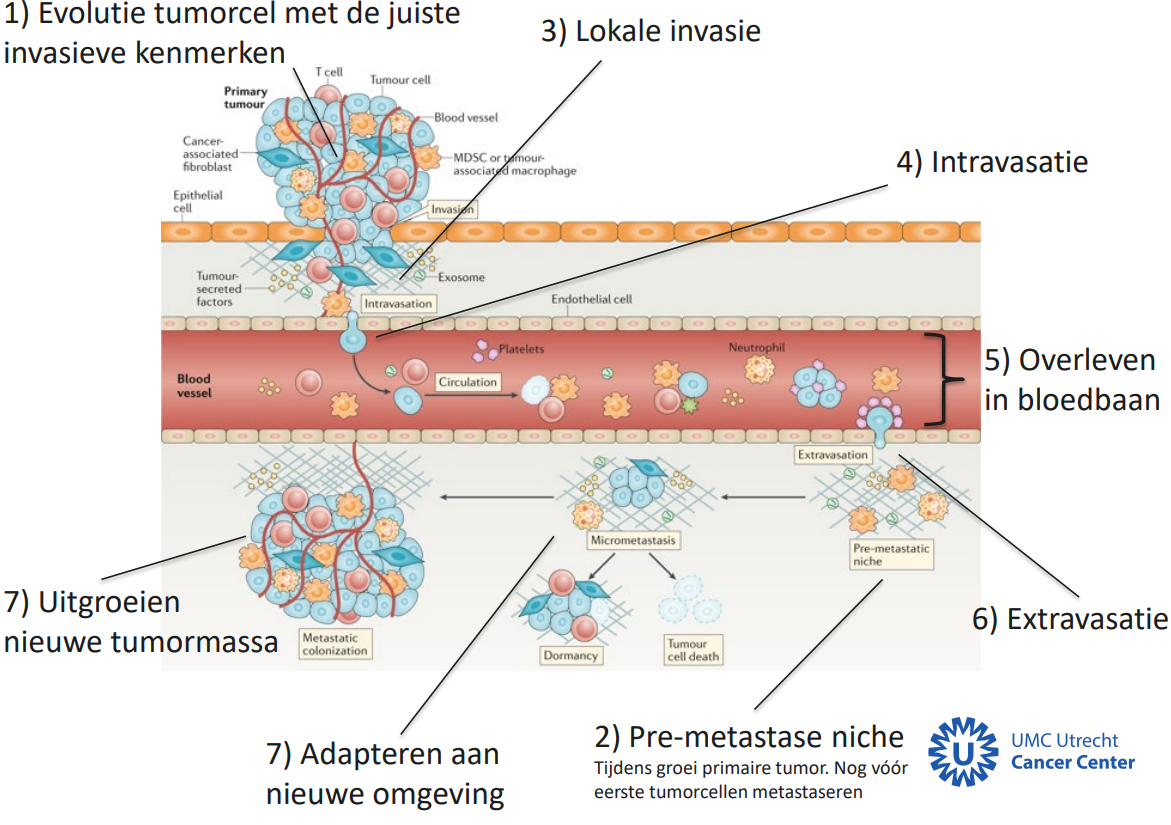
Pre-metastase niche (stap 2)
Tumor stuurt signaalstoffen en zorgt voor pro-tumor omgeving op afstand.
Hierdoor wordt afstand locatie meer verwelkomend. De pro-tumoromgeving heet pre-metastatic niche
In lymfesysteem:
remodellering van lymfevaten en klieren: tumoren veranderen functie en structuur vaten en klieren → groei van nieuwe vaten en wijzigen bestaande vaten en klieren → makkelijker doorgang en vestiging metastatische cellen
Meer immuuntolerante lymfeklieren: tumoren kunnen de omgeving beinvloeden → meer immuuntolerante toestand → immuunrespons gemanipuleerd/onderdrukt → tumorcellen minder vatbaar vernietiging → hogere overlevingsskans metastatische cellen
Lokale invasie (stap 3)
Tumor gaan naar bloedvaten
Breekt basaalmembraan af en breekt extra-cellulaire matrix af door middel van matrixmetalloproteases (MMP’s).
Intravasatie (stap 4)
tumorcellen in bloedbaan: circulerende tumorcellen (CTC)
overleven in bloedbaan (stap 5)
Tumorcellen moeten te zien om te overleven in bloedbaan tegen:
fysieke stress van bloedstroom zelf
vermijden van immuunsysteem
Betere overleving:
tumorcellen overleven beter als ze bewegen als clusters in plaats van individuele cellen (beschermt tegen fysieke stress en immuunreacties)
CTCs kunnen interactie aan met bloedplaatjes (tumor-bloedplaatje interactie), wat de overleving van CTC’s in bloedbaan kan bevorderen en helpen bij voorkomen vroegtijdige immuunresponsen
extravasatie (stap 6)
CTC’s gaan bloedbaan uit
Adapteren nieuwe omgeving (stap 7)
meeste metastasen overleven niet (<1% van CTC overleeft)
Pre-metastase niche helpt hierbij
Uitgroeien tot micrtometastase: als ze niet de juiste interacties hebben met omgeving → tumorceldood of dormancy (slaaptoesstand)
Dormancy: tumorcellen gaan in slaaptoestand → weinig tot geen groei → kunnen weer activeren en bijdragen bij recidieven.
Kunnen minder responsief zijn op medicatie
Uitgroeien tumormassa (stap 8)
Tumorcellen hebben juiste interactie met omgeving → kunnen uitgroeien.
Nogsteeds belangrijk om omgeving te manipuleren: angiogenese etc
Seed and soil theorie
Interactie tussen tumoren(seeds) en micro omgeving(soil) als essentieel voor metastase. Specifieke tumoren hebben voorkeur voor bepaalde organen of weefsels.
Factoren die bijdragen aan vookeur voor metastase:
micro omgeving: extracellulaire matrix, vasculaire netwerk, cellulaire componenten. Tumoren vestigen waar micro omgeving gunstig is voor overleving.
Chemische signalen en interacties: groeifactoren en cytokines spelen een rol bij aantrekken van tumorcellen naar specifieke locaties.
immunologische factoren: sommige organen minder actieve immuunrespons waardoor tumorcellen makkelijker overleven,
vasculaire kenmerken: vasculair netwerk van weefssel kan circulatie beinvloeden. Kunnen extravasatie en kolonisatie makkelijker maken.
Tumor micro-omgeving
Macrofagen: bijna in alle weefsels (in bloedbaan monocyten). Ze reageren op signalen in omgeving en passen hun gedrag daarop aan.
Macrofagen kunnen vormen van kanker helpen door stoffen uit te scheiden die tumor bevorderend zijn.
TAM (tumor associated macrophage), bepaalde macrofaag is lijkt bij kanker anders dan normaal. Macrofagen maken belangrijke groeifactor VEGFC.
Lymfevaten: snelweg immuunsysteem, route voor tumorverspreiding
Fibroblasten: cellen in bindweefsel, rol bij proiductie ECM
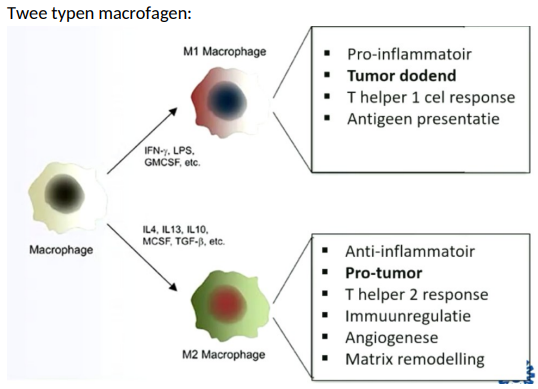
Typen macrofagen
Macrofagen kunne plasticiteit vertonen en wisselen tussen M1- en M2-fenotypen afhankelijk van de signalen in hun omgeving. Hierdoor heel adaptief en kunnen ze functies uitvoeren op basis van behoefte omgeving.
Type 1 (M1): Pro-inflammatior, tumor dodent, Th1 cel respons, antigen presentatie
Type 2 (M2): Anti-inflammatoir, pro-tumor, th2 repsons, immuunregulatie, angiogenese, matrix remodelling
M2 kunnen helpen bij tumormotiliteit door adherens junctions en tight junctions tussen cellen te knippen door MMP’s uitgescheden door M2.
MMP maakt bloedvatendotheel dus meer permeabel en tumorcellen volgen de macrofagen door endotheel heen.
Macrofagen bij behandeling
Oproep van monocyten verminderen
Activatie van TAM’s verminderen
TAMs herprogrammeren tot anti-tumormacrofagen (M1)
Richten op TAMs samen met standaard behandeling (chemo/radiotherapie)
Lymfevaten in tumor micro-omgeving
tissue fluid homeostasis: belangrijke rol bij handhaven weefselvloeistoffen, vangt overtollig vloeistof op, samen met opgeloste stoffen en macromoleculen in lymfevaten → omgeving stabieler
Snelweg immuunsysteem: in lymfeklieren kunnen immuuncellen inspecteren op pathogenen en abnormale cellen
Classificatie van tumoren: TNM
Route voor tumor verspreiding: tumoren kunnen verspreiden naar lymfeklieren en van daaruit naar andere delen in lichaam.
Complex interactie tumor en lymfendotheelcellen: Tumor hijacken lymfesysteem waardoor ze de omgeving beïnvloeden en mogelijk creëren voor metastasering
Veranderingen lymfesysteem onder invloed van tumor
Lymphangiogenese: tumoren stimuleren groei van nieuwe lymfevaten → tumoren kunnen deze vaten gebruiken als routes om te migreren naar lymfeklieren en verder in het lichaam.
Snellere flow: door tumor, toename in lymfestroom → snellere transport tumor in lymfesysteem → sneller toegang lymfeklieren en andere delen lichaam
Immuuntolerante omgeving: tumoren kunnen deze omgeving maken in de lymfevaten en -klieren, waardoor immuunsystem minder effectief is in detecteren en aanvallen tumorcellen die in lymfe getransporteerd zijn. Hierdoor kan tumor immuunrespons ontsnappen
CAF: Cancer-Associated Fibroblasts
Bevinden in tumoromgeving → ondergaan veranderingen in fenotype en functie als rractie om kankercellen en omringe tumoromgeving.
Sleuterl rol bij interatie tuseen tumor en omliggende stroma(ondersteunende weefsel van orgaan)
functies CAF in tumormicro-omgeving
restructurering van ECM rond tumor → omgeving bevorderlijk voor groei en verspreiding kanker
groei en overleving tumor: CAF scheiden groeifactoren en cytokines voor groei en overleving.
Angiogense: stimuleren angiogenese door vrijgeven factoren, waardoor tumor voorzien van voedingstoffen en zuurstof
immuunmodulatie: CAF onderdrukken soms immuuncellen en CAF creëren immuun oncologisch onderdrukkend eomgeving
FAP: Fibroblast Activation Protein
Geassocieerd met CAFs. Laag tot niet detecteerbaar in gezond weefsel, maar overmatig in tumoromgeving.
- FAP Targeting Radiotracers: moleculen ontworpen om specifiek te binden aan cellen die FAP-expressie hebben, onder andere CAFs.
-Kunnen worden gebruikt voor beeldvormingstechnieken als: PET en SPECT, om aanwezigheid en lokalisatie van FAP en daarmee CAFs te zien.