Klinsch Chemische Labordiagnostik
1/137
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
138 Terms
Ziel der Lehrveranstaltung Tag 1
Bestimmung der unbekannten Massenkonzentration zweier Kaliumpermanganat-Lösungen (KMnO4) mittels grafischer Kalibrierung und der Transmission als Messsignal
messen
vergleichen
Kalibrierung
Standard
Wellen-Teilchen-Dualismus
Licht kann sowohl als Welle als auch als Teilchen, Photonen, betrachtet werden
Bereich des sichtbaren Lichts
400 nm bis 800 nm
> 800 nm
Infrarot-Bereich
< 400 nm
UV-Bereich
verschiedenen Wechselwirkungen zwischen Licht und Materie
Absorption, Reflexion, Emission, Transmission und Brechung
Absorption
strahlt man Licht durch ein gefärbtes Medium, wird ein Teil des Lichtes von den Molekülen aufgenommen
Transmission
strahlt man Licht durch ein gefärbtes Medium, so wird ein Teil durchgelassen
polychromatisches Licht
“viel-farbig”, Licht aus einer Mischung unterschiedlicher Farben, spektralbreitbandig
monochromatisches Licht
“eine Farbe”, einfarbiges sichtbares Licht, elektromagnetische Strahlung einer genau definierten Frequenz
Transmission T
Quotient von ϕ1/ϕ0, Quotient von ausgestrahltes Licht/ eingestrahltes Licht, T% = ϕ1/ϕ0 × 100
Schematischer Aufbau eines Photometers
Lichtquelle → Linse(n) → Blende(n) → Filter - ϕ0 → Küvette - ϕ1 → Strahlungsdetektor → Anzeige
KMnO4
Kaliumpermanganat
KMnO4 Versuch
Mit einer KMnO4-Verdünnungsreihe werden unbekannte Konzentrationen der KMnO4-Lösungen bestimmbar, Messignale (T%) auf der y-Achse , auf der x-Achse bekannte Konzentrationen (mmol/L) eingetragen am Millimeterpapier
Extinktion
E = −logT = log 1/T = log ϕ0/ϕ1
Extinktion E
Extinktion bei einer bestimmten Wellenlänge ist der negative dekadische Logarithmus der Transmission T
Proportionalität
Transmission: exponentiell, indirekt proportional
Extinktion: direkt proportional
Pierre Bouguers
Schichten, gleicher Art und gleicher Dichte, bestimmten proportionalen Anteil des einfallendes Lichts absorbieren
Lambert Experiment
Strahlungsleistung oder Lichtstrom des austretenden Lichtes nimmt exponentiell ab bei linearer Zunahme der Schichten (Schichtdicke)
Lambert Experiment Strahlungsleistung
ϕ0 100% → -50% ϕ1= 0,5 → -50% ϕ2= 0,25 → -50% ϕ3=0,125
allgemein nach Lambert
ϕ= (1/x)d * ϕ0 → austretendes Licht
Beers Experiment
Beer ließ die Schichtdicke d konstant und veränderte die Konzentration c
allgemein nach Beer
ϕ= (1/y)c * ϕ0
Lambert und Beers allgemeine Formulierung
ϕ= (1/ x*y) c*d * ϕ0
Lambert-Beer’sche Gesetz
E= ϵ * c * d
Paracetamol
Para(acetylamino)phenol
spezifisch molare Extinktionskoeffizient ϵ
ϵ= E/c*d
spezifisch molare Extinktionskoeffizient ϵ Einheit
L/mol*cm
Stoffmenge n Formel
n=m/M
m= Masse
M=molare Masse
Proteine
biologische Makromoleküle, die aus Aminosäuren aufgebaut sind, befinden sich in alles Zellen
Aminosäuresequenz
Aminosäuresequenz eines Proteins → sein Aufbau ist in der DNA codiert
Hauptfunktionen der Proteine
Aufbau
Schutz
Transport
Signalfunktion
regulatorische Funktionen
Reservestoffe
Gesamtheit aller Proteine
Proteom
Aminosäuren
kleinste Proteinbausteine, organische Verbindung mit mind. einer Carboxygruppe (-COOH) und Aminogruppe (-NH2), 20 sind proteinogen, 8 AS sind essentiell
proteinogen
Protein bildend
chiral
alles AS sind chiral aufgebaut, ausgenommen Glycin
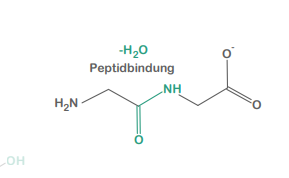
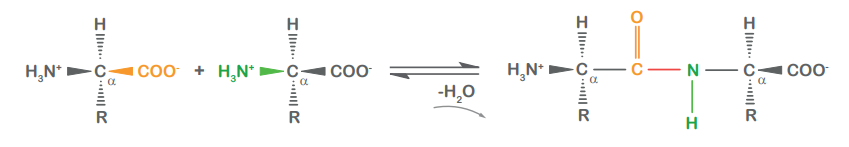
Peptid
miteinander verknüpfte Aminosäuren
Peptidbindungen
zwischen der Säuregruppe der einen und der Aminogruppe der anderen Aminosäure (jeweils am α-C-Atom)
räumlicher Aufbau
Primärstruktur - Aminosäuresequenz
Sekundärstruktur - Substrukturen
Teritärstruktur - 3d Strukturen
QuartärsturkturKomplex aus Proteinmolekülen
Totalprotein
TP, gesamte Eiweißgehalt der Blutflüssigkeit gemessen
Referenzbereich Biuret Methode
66 - 83 g/L
Dysproteinämie
Verschiebung des Eiweißgehalts
Hypoproteinämie
zu wenig Eiweiß, Mangel, < 66 g/L
Hyperproteinämie
zu viel Eiweiß, > 83 g/L
Indikation von Total Protein
Inflammation
Proteinurie
Ödeme
chronische Nierenerkrankung
chronische Lebererkrankung
maligner Tumor
Verbrennungen
Primärstandard
durch Einwaage einer definierten Menge in ein Lösungsmittel gewonnen, Substanzen höchster Reinheit, bei selbst hergestellten Standards auf Reinheit der Substanzen zu achten
Sekundärstandard
entspricht weitgehend der Matrix der Probe, enthält gleiche Komponenten wie Untersuchungsmaterial, Konzentrationsermittlung der Kalibratoren erfolgt durch chemische Analyse unter Bezugnahme auf primäre Standards mit Analysenmethoden bekannter Präzision
1-Punkt Kalibrierung
wird mit nur einem Kalibrator durchgeführt, wobei die Kalibriergerade durch den 0-Punkt, der durch den Reagenzienleerwert festgelegt wird, geht
β-D-Glucose
Bestimmung der unbekannten Glucosekonzentration einer Probe mittels der enzymatischen Endpunktmethode GOD-PAP über eine 2-Punkt Kalibrierung
Aufgabe von Kohlenhydraten
Energiespeicher
Brennstoff
ATP
Strukturelement in Zellwänden von Pflanzen und Bakterien
Schlüsselrolle in Zell-Zell—Erkennungsprozessen
Zellen sind auf Glucose zur Aufrechterhaltung ihrer Funktionen angewiesen: Muskelzellen, Nervensystemzellen, Erythrozyten
Referenzbereich GOD-PAP Methode
Erwachsene, nüchtern: 60 - 99 mg/dL
Hypoglykämie
zu wenig Glucose, < 60 mg/dL
Hyperglykämie
zu viel Glucose, > 99 mg/dL
gemessene Extinktion setzt sich zusammen aus
Egemessen = EProbe + EProbenleerwert + EReagenzienleerwert
Kalibrierfunktion
Die Kalibrierfunktion ist der funktionale Zusammenhang zwischen dem Erwartungswert eines Messsignals (z.B. Extinktion) und der Messgröße (z.B. Massenkonzentration)
Analysenfunktion
Wird die Kalibrierfunktion nach der gesuchten Konzentration umgestellt, nennt man das Ergebnis Analysenfunktion
2-Punkt Kalibrierung
wenn Merkmals- und Signalgröße voneinander linear abhängig sind, reichen 2 Punkte für gesamten Zusammenhang zu beschreiben. Kalibriergerade geht nicht zwingend durch den 0-Punkt. Steigung sit der Quotient aus den Differenzen der beiden Messignalen und Messgrößen der Datenpunkte gebildet
s-Grenzen
µ ± 1 σ → 68,27%
µ ± 2 σ → 95,45%
µ ± 3 σ → 99,73%
γ-GT
γ-Glutamyltransferase
Was sind Enzyme?
Katalysatoren biologischer Systeme, bestimmen Muster chemischer Umsetzungen bzw. auch Umwandlung von einer Energieform in die andere
Enzyme
beschleunigen Reaktionen um 108 bis 1020
gehen unverändert aus Reaktion hervor
Stoffklasse der Proteine
katalysieren alle Stoffwechselabläufe im Organismus
Substratspezifität
Fähigkeit eines Enzyms an bestimmte Substrate zu binden und nur spezifische Reaktionen zu katalysieren
Wirkungsspezifität
von den vielen möglichen Reaktionen, die ein Stoffwechselzwischenprodukt eingehen kann, wird nur eine einzige Reaktion katalysiert
Zellenzyme
zellgebundene Enzyme des Energiestoffwechsels, Enzyme mit spezialisierten Funktionen, Wirkungsort liegt innerhalb der Zelle → Zytoplasma, Mitochondrien, Zellkern, Membran; bei vielen Organkrankheiten ist der Enzymaustritt gesteigert
Sekretenzyme
in exokrinen Drüsen gebildet (Pankreas, Parotis, Prostata), gelangen durch Sekretion an Wirkungsort, Schädigung der Herkunftsorgane vermehrt im Blut, weitgehend organspezifisch
Plasmaspezifische Enzyme
entfalten Aktivität im Plasma, bei Krankheit ist eine erniedrigte Enzymaktivität im Blut, z.B. Cholinesterase und einige Gerinnungsfaktoren
1 Internationale Enzymeinheit
1 U, diejenige Enzymaktivität, die unter Standardbedingungen die Umsetzung von 1 µmol Substrat pro Minute katalysiert
Reaktionsbedingungen
Temperatur
pH-Wert
Konzentration und Art des Substrates
Konzentration und Art des Co-Substrates
Pufferkonzentration
Ionenstärke
Peptidase
katalysier den Transfer von Aminosäuren von einem Peptid zum anderen
Glycylglycin
Referenzbereich Szasz/Persijin standardisiert nach IFCC
Frauen < 40 U/L
Männer < 60 U/L
Differenzen zwischen Messpunkten
E1= E1 - E0
Massenkonzentration
U/L Probe = (U/L Kalibrierlösung / ØΔEKalibrierlösung ) * ØΔEProbe
LDH
Laktatdehydrogenase
Peptidbindung
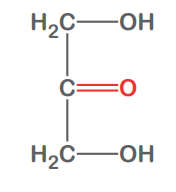
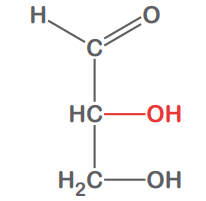
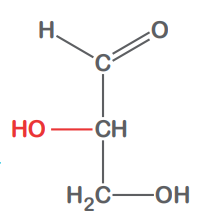
Glyceral
Glycerin
Glyceron
D-Glyceral
L-Glyceral
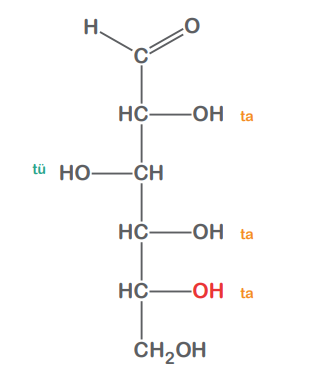
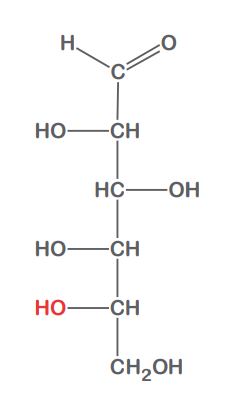
D-Glucose
L-Glucose
Oxidation
e- - Abgabe
H+-Abgabe
Reduktion
e- - Aufnahme
H+- Aufnahme
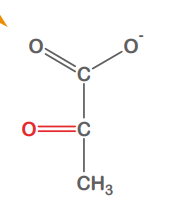
Lactat
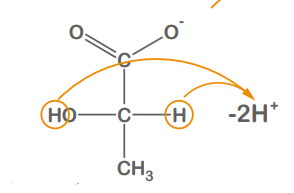
Pyruvat
NAD+
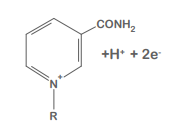
NADH
einfacher optischer Test nach Warburg mit Probenstart
Lactat oxidiert zu Pyruvat
NAD+ wird reduziert zu NADH
Bei welcher Wellenlänge wird bei LDH gemessen und warum?
bei 340 nm, weil dort der Extinktionsunterschied am größten ist
Enzymkinetik
beschreibt die Geschwindigkeit einer enzymatischen Reaktion und soll Auskunft darüber geben, wie effektiv das Enzym diese Reaktion katalysiert
Biuret-Methode
Zweiwertige Kupferionen reagieren im alkalischen Milieu mit je vier Peptidbindungen der Eiweiße zu einem charakteristischen violetten Biuretkomplex. Mittels Kaliumnatriumtartrat wird die Ausfällung von Kupferhydroxid und mit Kaliumjodid die Autoreduktion des Kupfers verhindert.
zwei Möglichkeiten Enzymaktivität nachzuweisen
durch Abnahme der Konzentration des Substrats, das mit Hilfe des Enzyms in ein Produkt umgewandelt wird
durch Zunahme der Konzentration des Produkts, das im Laufe der Enzymreaktion gebildet wird
steady state
Zustand bei dem Konzentration über einen bestimmten Zeitraum relativ konstant bleibt, weil die Rate der Zufuhr bzw. Bildung der Rate des Abbaus bzw. Ausscheidung entspricht.
Michaelis-Menten Gleichung
beschreibt Abhängigkeit der Umsatzgeschwindigkeit des Enzyms von der Substratkonzentration und kann Geschwindigkeit einer ablaufenden Reaktion vorhersagen
AL(A)T
Alanin-Aminotransferase
Indikation AL(A)T
Kenngröße einer Leberzellschädigung,
Erkennung von Leberschäden durch:
Alkohol
Arznei
Hepatotoxine
Überernährung
autoimmune Lebererkrankung
Verdacht auf hereditäre Stoffwechselstörung
IFCC Methode zur Bestimmung ALAT-Aktivität
Die Alanin-Aminotransferase katalysiert die Übertragung einer Aminogruppe von Alanin auf 2-Oxoglutarat unter der Bildung von Glutamat und Pyruvat