3.11 - ADDITIE AAN DE GEPOLARISEERDE π-BINDING: DE CARBONYLGROEP
1/59
Earn XP
Description and Tags
McMurry - hoofdstuk 19 (604 - 649)
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
60 Terms
naamgeving
zie deel 1 — IUPAC NAAMGEVING
carbonylgroep
aldehyden en ketonen
binding wordt ook wel een gepolariseerde π-binding genoemd
C heeft δ+ ; nucleofiele aanval mogelijk
O heeft δ- ; zwakke base (zuur-base)
bereiding aldehyden
oxidatie 1° alc
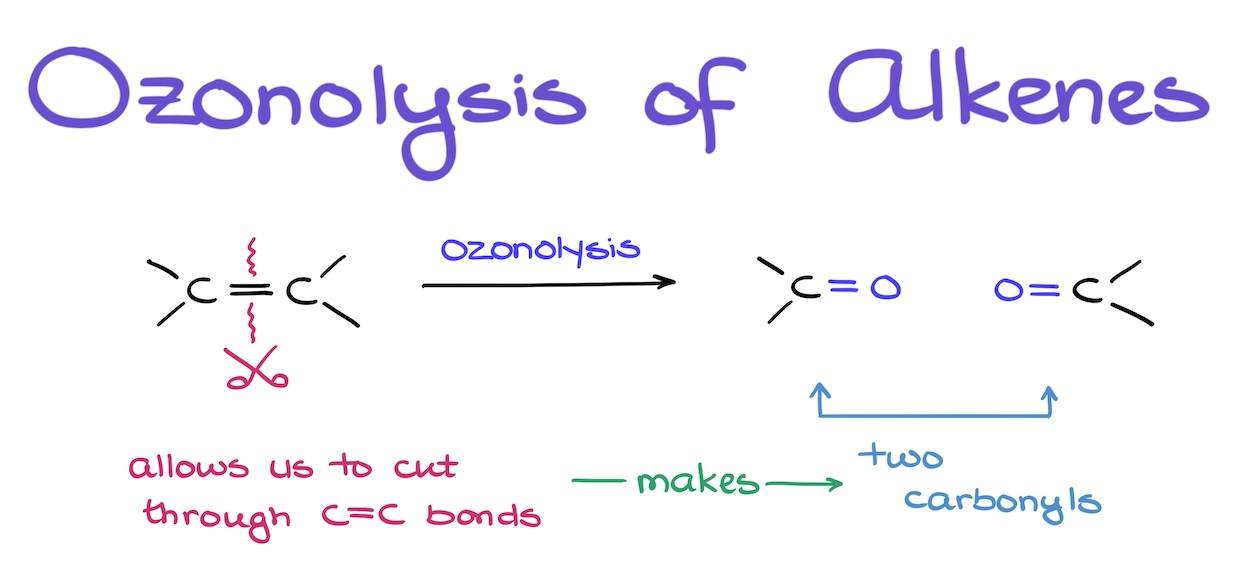
ozonisatie alkenen
partiële reductie carbonzuurderivaten
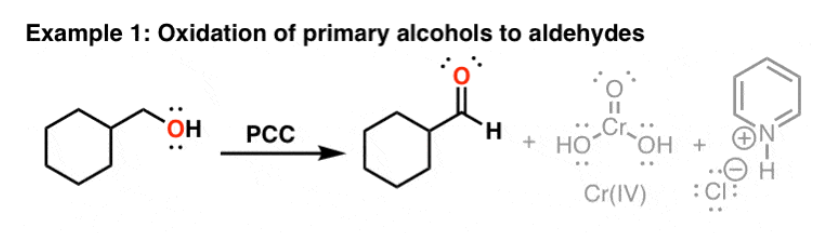
aldehyde — oxidatie 1° alc
Cr(VI) oxidatie
alc + CrO3 → chromaatester
chromaatester + PCC →
aldehyde
Cr(IV) → Cr(III)
aldehyde — ozonisatie alkenen
aldehyde — partiële reductie carbonzuurderivaten
partiële reductie;
DIBAH in tolueen
ester/zuurchloride → aldehyde
volledige reductie;
LiAlH4 in ether
ester/carbonzuur/zuurchloride → aldehyde → 1° alc
bereiding ketonen
oxidatie 2° alc
ozonisatie alkenen
hydratatie alkynen
reactie zuurchloride met diorganokoper reagens
keton — oxidatie 2° alc
Cr(VI) oxidatie
alc + CrO3 → chromaatester
chromaatester + PCC →
keton
Cr(IV) → Cr(III)
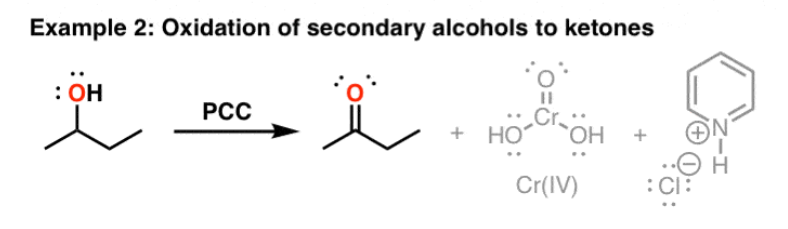
keton — ozonisatie alkenen
keton — hydratatie alkynen
zuurgekatalyseerde hydratatie
+ H2O
katalysatoren; HgSO4 en H2SO4
Markovnikov
opm; alkyn → enol → keton;
via keto-enol tautomerie
keton — reactie zuurchloride met diorganokoper reagens
= Gilman reagentia
(R)₂CuLi; lithium diorganokoperverbindingen
Cl wordt vervangen door R
carbonylgroep
aldehyden en ketonen
binding wordt ook wel een gepolariseerde π-binding genoemd
C heeft δ+ ; nucleofiele aanval mogelijk
O heeft δ- ; zwakke base (zuur-base)
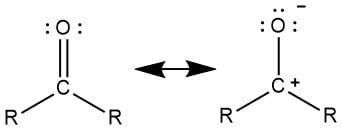
carbonylgroep — bindingen
C en O
SG = 3 → sp2
vlakke structuur
C = O
σ-binding = overlap tss 2 v/d 3 sp2-orbitalen
π-binding = (zijdelingse) overlap tss 2 overige p-orbitalen
homo- vs heterolytische splitsing
homolytisch
elke bindingselektron gaat naar één van de atomen → vorming van radicalen
heterolytisch
beide elektronen gaan naar één atoom → vorming van ionen
dubbele binding — eigenschappen
sterke binding
moeilijk homolytisch te splitsen
thermodynamisch aspect; dubbele binding bevat meer energie dan enkele
reactieve binding
vlot heterolytisch te splitsen
kinetisch aspect; π-elektronen zijn toegankelijk en reageren vlot
carbonylgroep — nucleofiele additie
nucleofiel valt aan op koolstof;
langs boven
langs onder
gevormde producten;
identiek
enantiomeren (één stereogeen centrum)
diastereomeren (meerdere stereogene centra)
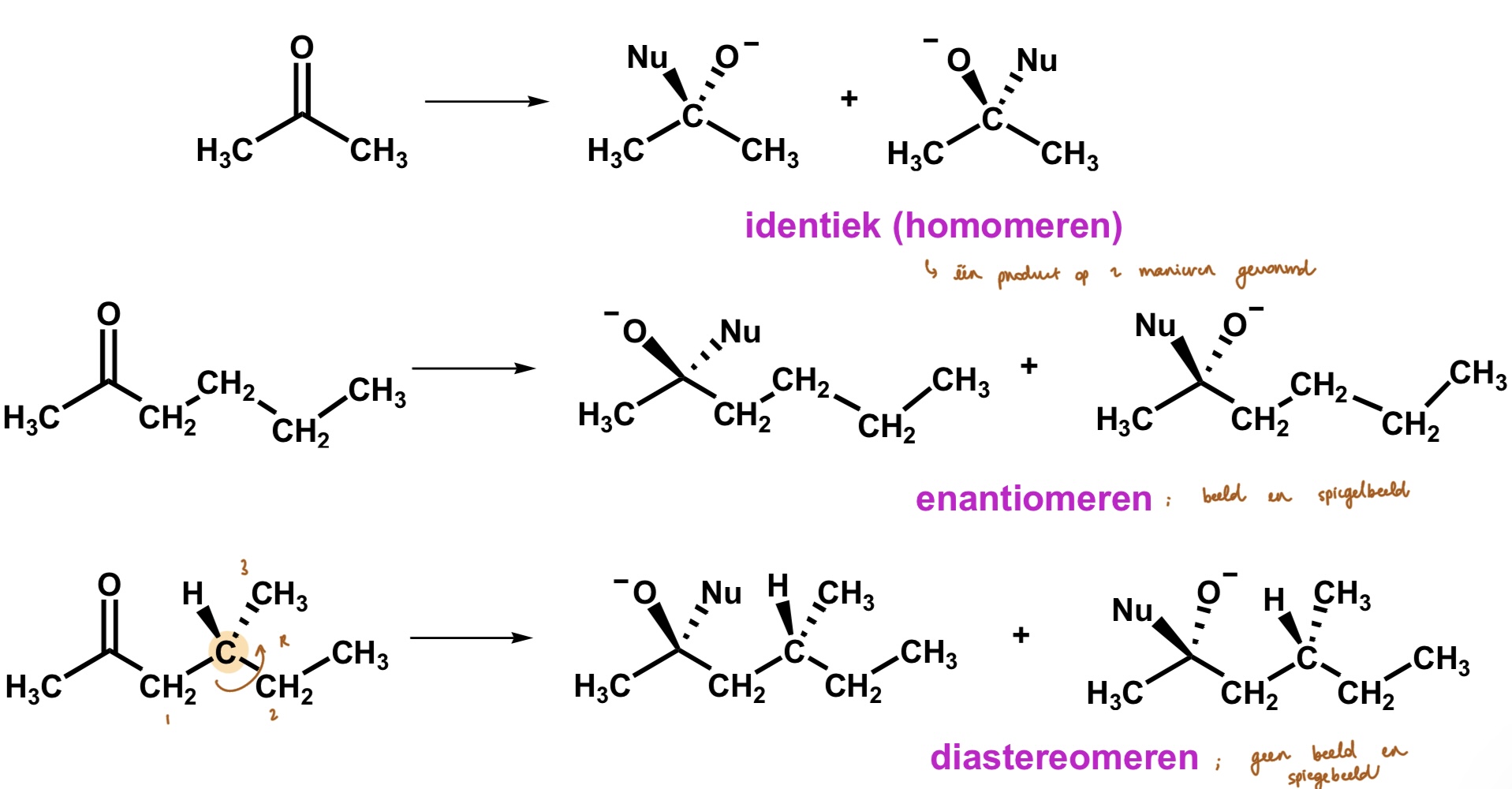
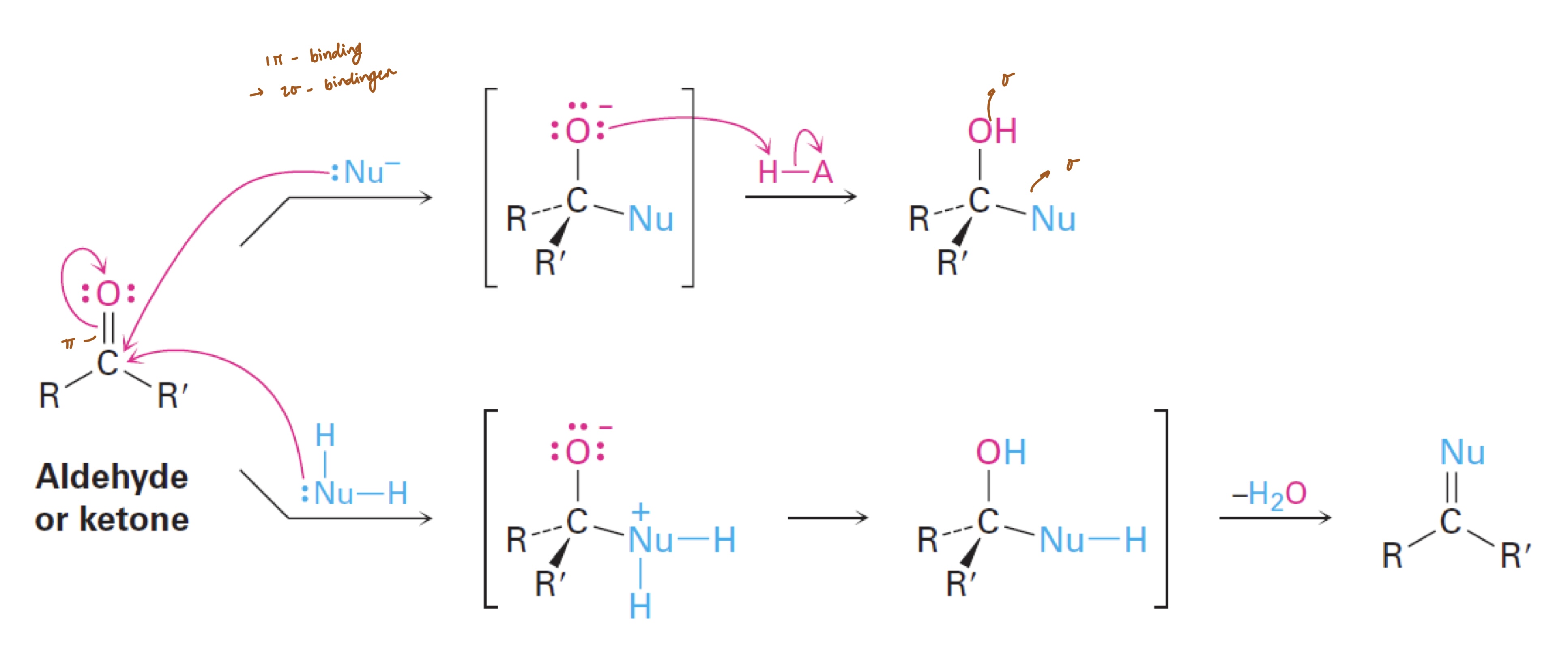
carbonylgroep — nucleofiele additie
nucleofiel valt aan op koolstof carbonylgroep;
sp2 → sp3
dubbele binding verdwijnt;
1 σ-binding + 1 π-binding → 2 σ-bindingen
vaak afwerking met zuur/H2O; leidt tot vorming alcohol
formaldehyde → 1° alc
aldehyde → 2° alc
keton → 3° alc
carbonylgroep — zuur-base
Brønstedzuur
H+ afgeven
Lewiszuur
e- opnemen
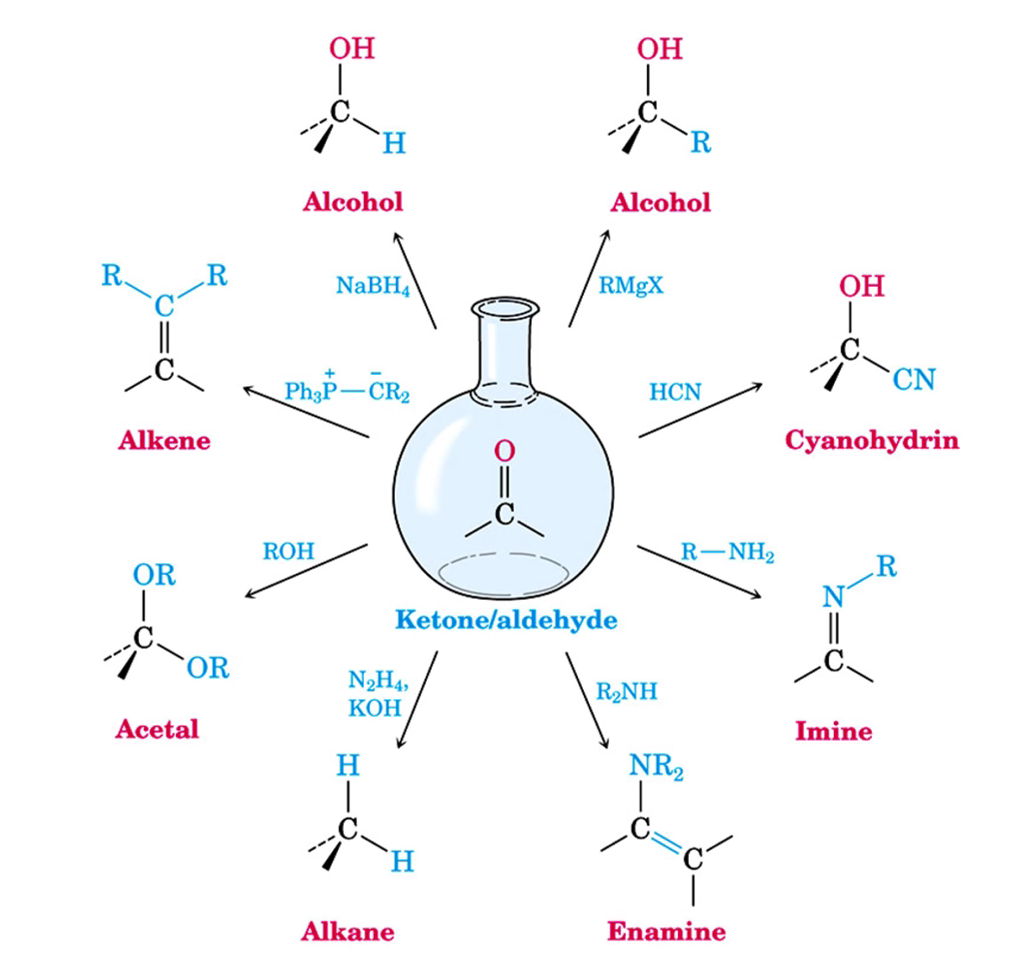
mogelijke reacties — samengevat
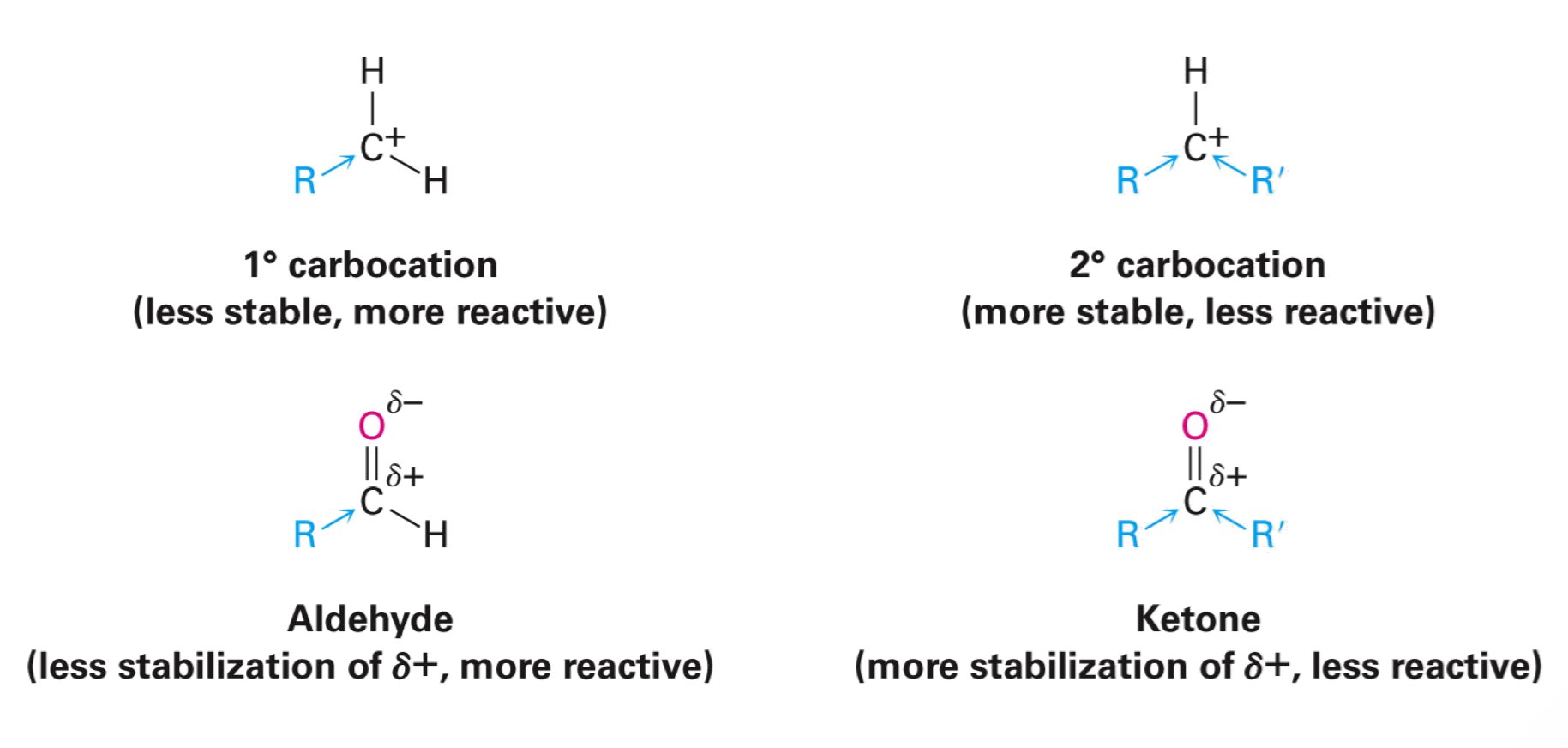
relatieve reactiviteit
aldehyden reactiever dan ketonen
(bij nucleofiele additie);
sterische redenen
elektronische redenen
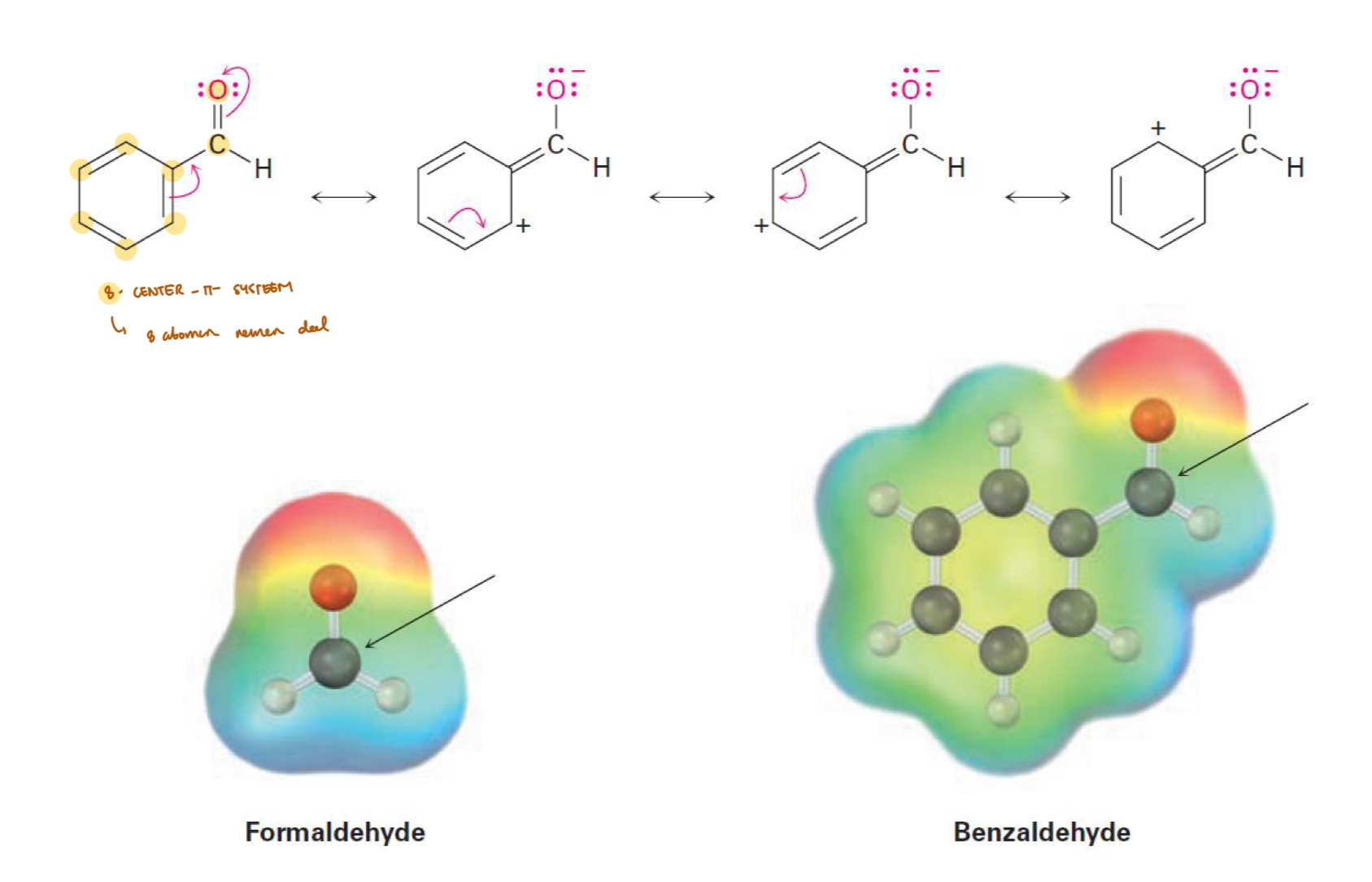
opm; niet-aromatische structuren minder reactief door resonantie
sterische redenen
aldehyde minder sterische hinder;
1 vs 2 substituenten
nucleofiel makkelijker naderen
TTS intermediair lager in E
elektronische redenen
aromatisch vs niet-aromatisch — resonantie
hoe meer resonantiestructuren, hoe stabieler, en dus ook hoe minder reactief
aromatische structuren hebben meer mogelijke resonantiestructuren
types nucleofielen (2)
geladen
neutraal
geladen nucleofiel — stabiliteit
lage pKz H-Nu → stabiel nucleofiel
endotherme reactie; irreversibel
zwakke σ-binding gevormd
gemiddelde pKz H-Nu
matig endo-/exotherme rectie; reversibel
hoge pKz H-Nu → onstabiel nucleofiel
exotherme reactie; irreversibel
sterke σ-binding gevormd
neutraal nucleofiel
HOH = water
→ hydraat = geminaal diol; HO-C-OH
ROH = alcohol
→ acetal; RO-C-OR
RNH2 = primair amine
→ imine; C=N-R
R2NH = secundair amine
→ enamine; C=C-NR₂
aanval geladen vs neutraal nucleofiel
geladen nucleofiel
afwerking adhv zuur → alc
neutraal nucleofiel
H (nucleofiel) verplaatst naar O-
-H2O
product; hydraat, acetal, imine of enamine
nucleofiele additie — koolstofnucleofielen
organometaalverbinding
fosforyliden
HCN-additie
organometaalverbinding — types
Grignardreagens;
R - Mg - X
Organozink;
R - Zn - X
Organolithium;
R - Li
Gilman reagens = organokoperreagens
R2CuLi
organometaalverbinding
bereiding organometaalreagens
Mg wordt toegevoegd om Grignard reagens te vormen (bij halogeen); maakt van carbonyl betere acceptor
nucleofiele additiereactie
protonatie
door H2O of zwak zuur
vorming alcohol
fosforyliden — Wittig reactie
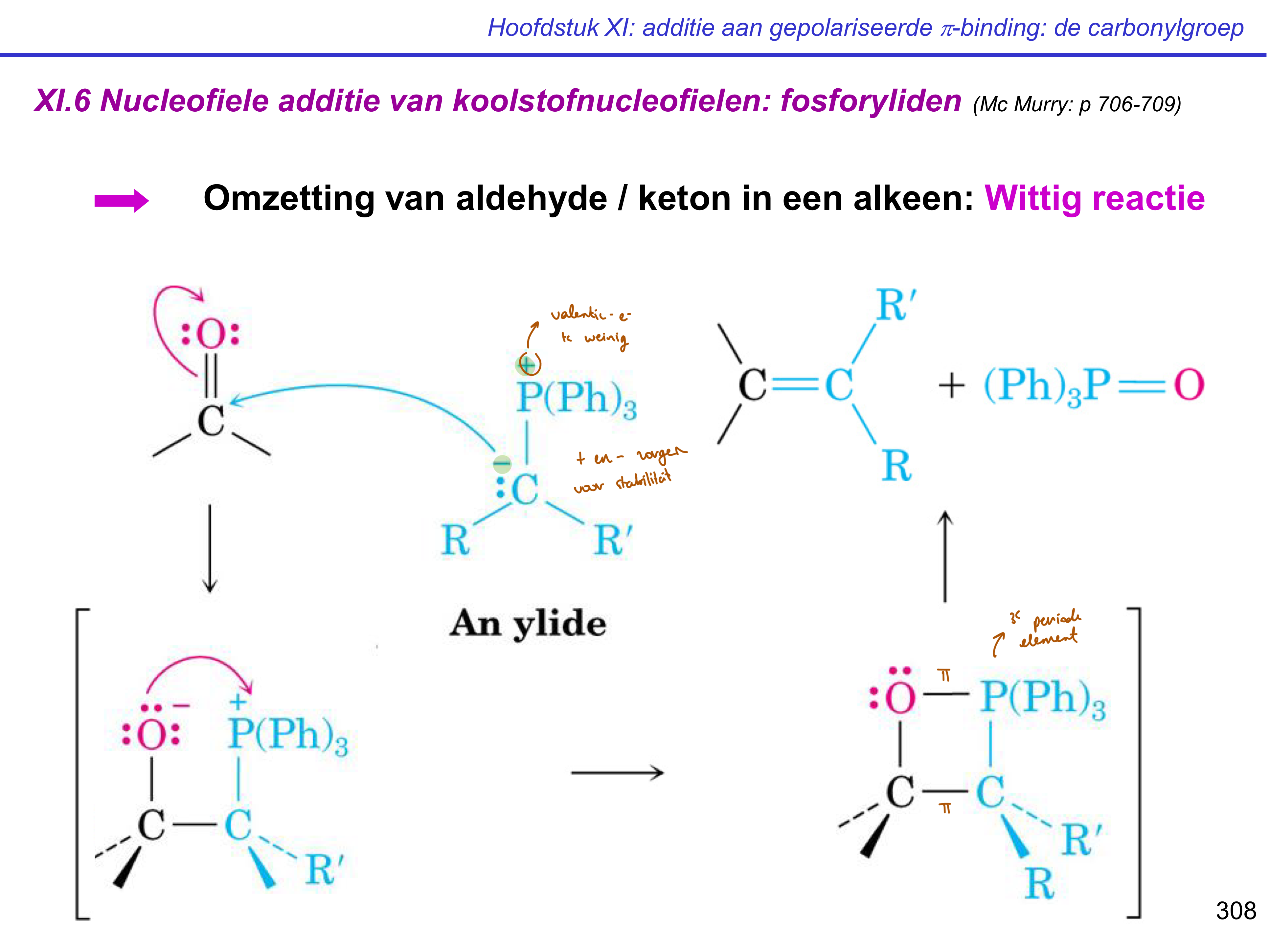
fosforyliden — Wittig reactie
aldehyde/keton + fosforylide → alkeen
C- v/d fosforylide valt C carbonyl aan
O- en P+ trekken elkaar aan → box
alkeen + P=O
ylide
bevat + en -lading naast elkaar;
zorgt voor stabiliteit
fosforylide
= ylide met fosfor
vb. P(Ph)3 = trifenylfosfine
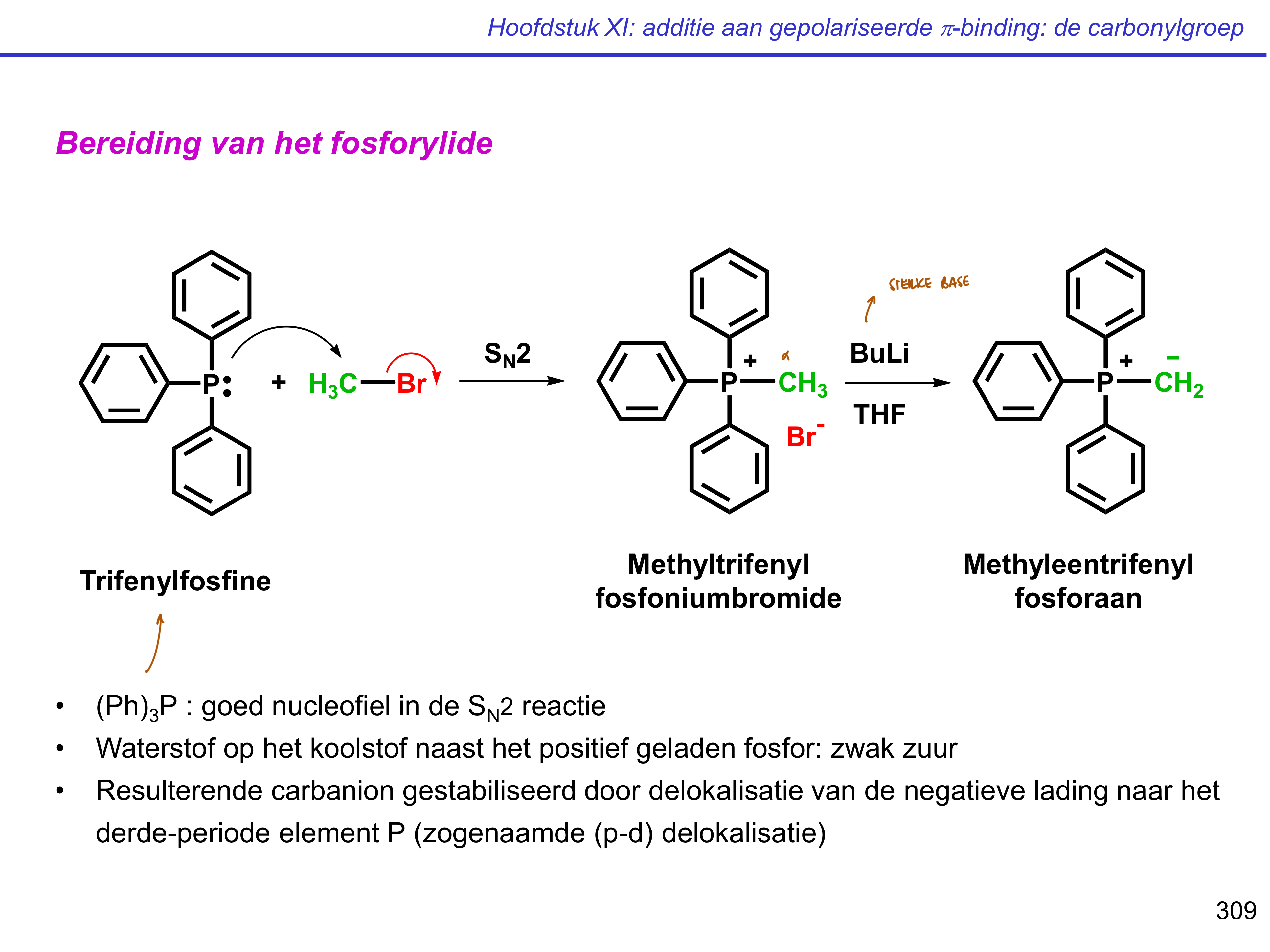
fosforylide — vorming
halogeenalkaan bevat;
willekeurig halogeen
aantal toe te voegen koolstoffen
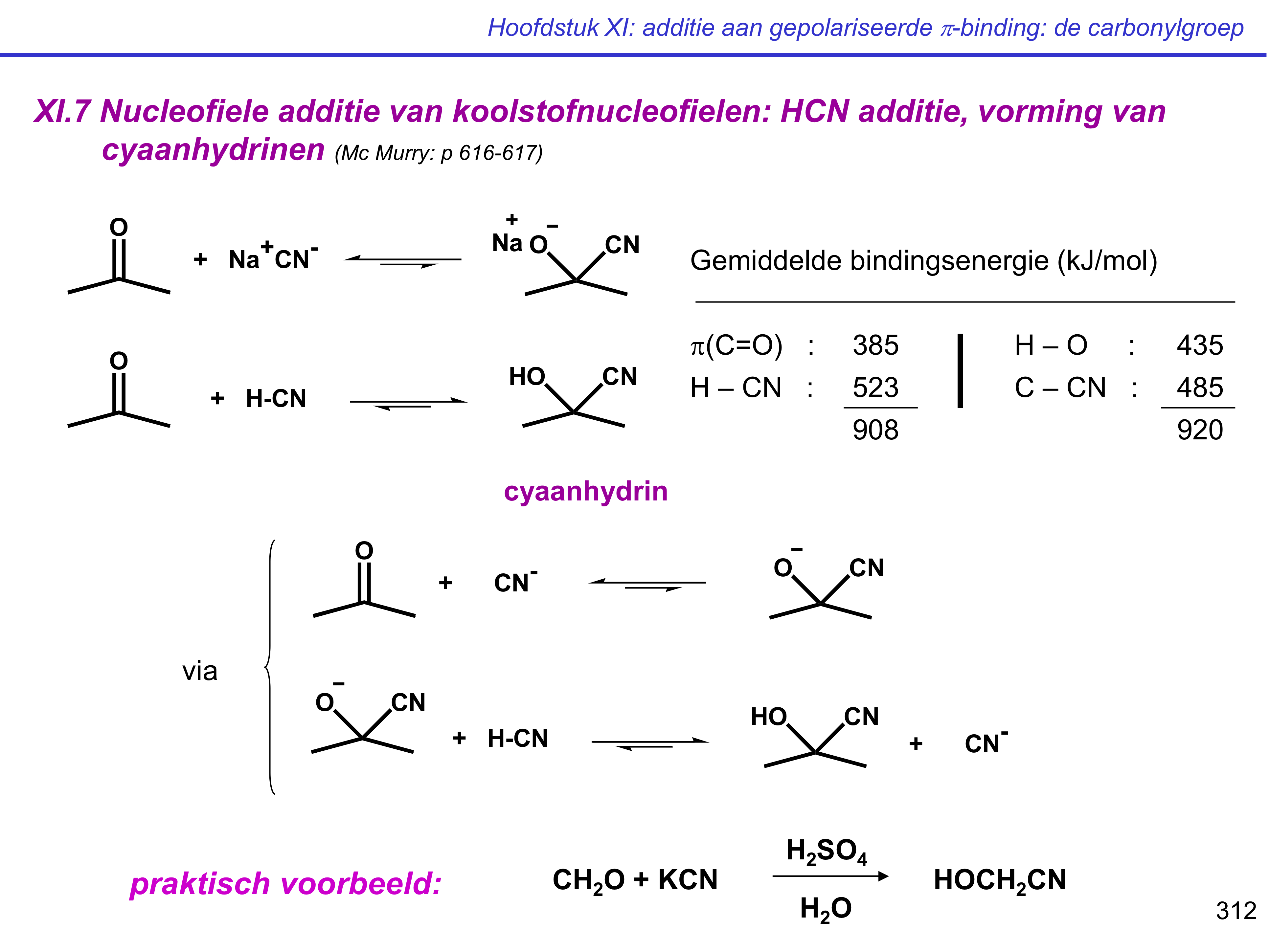
HCN-additie
vorming cyaanhydrinen
HO - C - CN
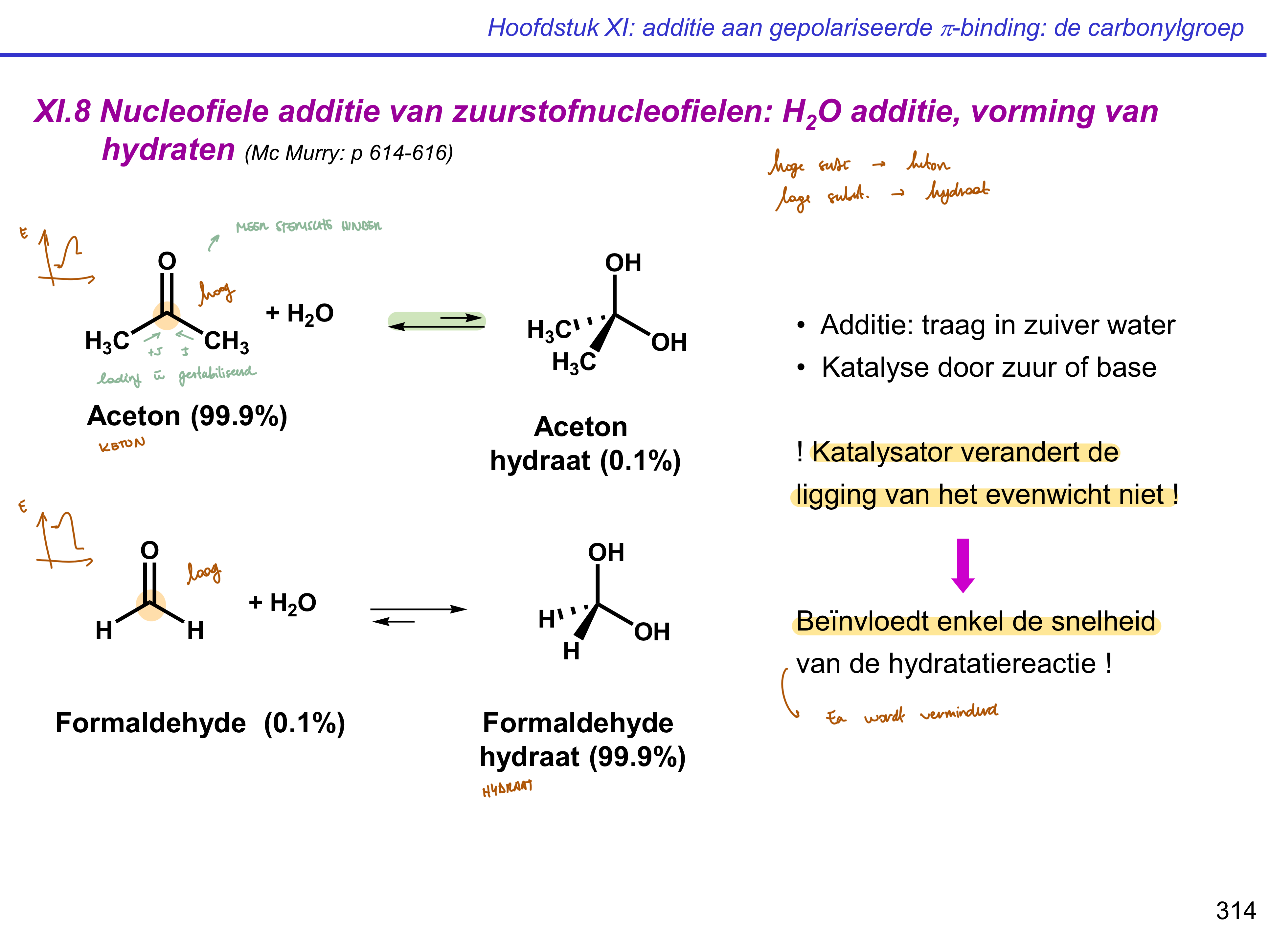
nucleofiele additie — zuurstofnucleofielen
additie H2O
additie alcoholen
additie H2O
vorming hydraten
HO - C - OH
traag in zuiver water,
katalyse door zuur/base
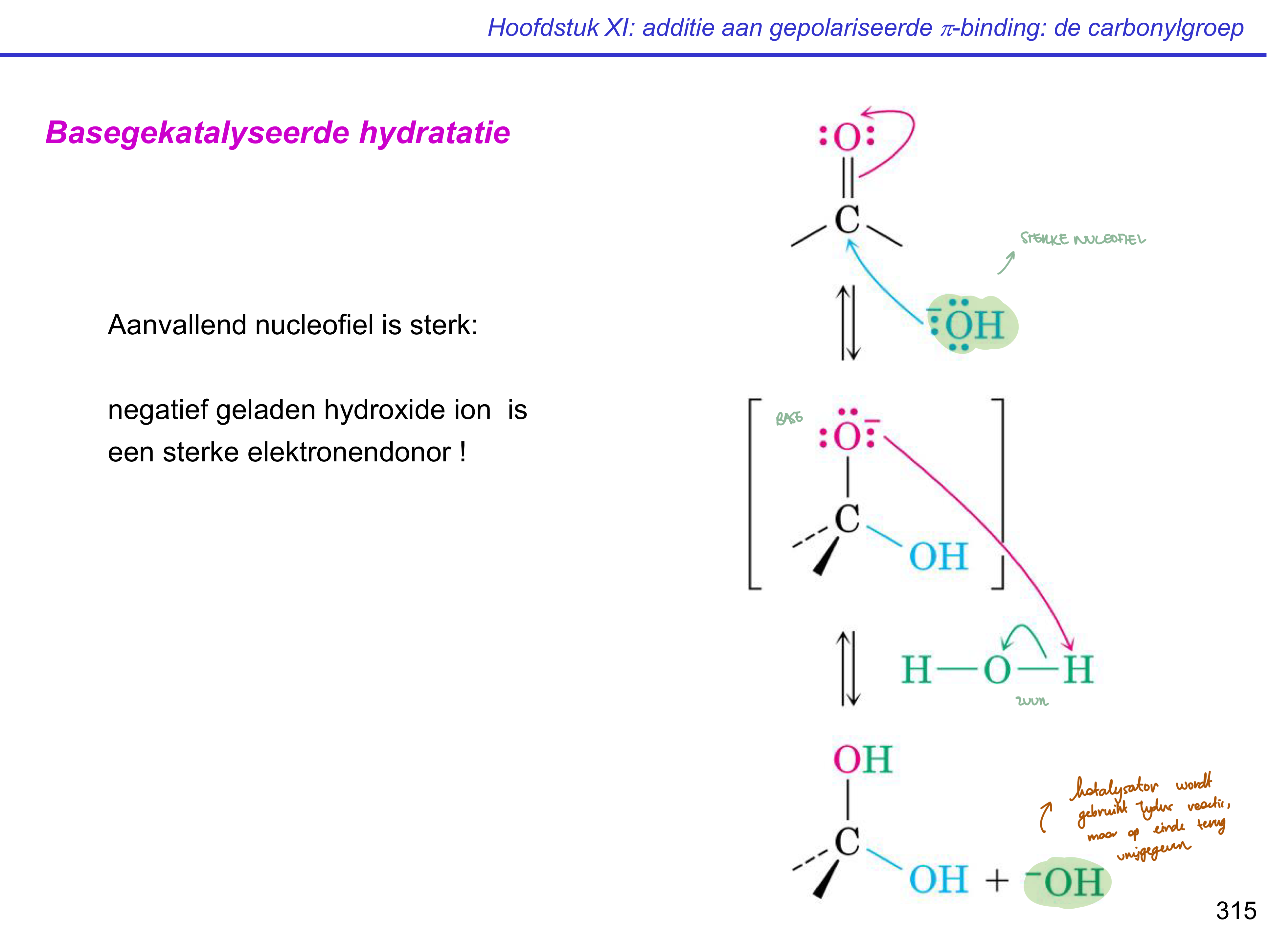
basegekatalyseerde hydratatie
nucleofiele additie
zuur-base
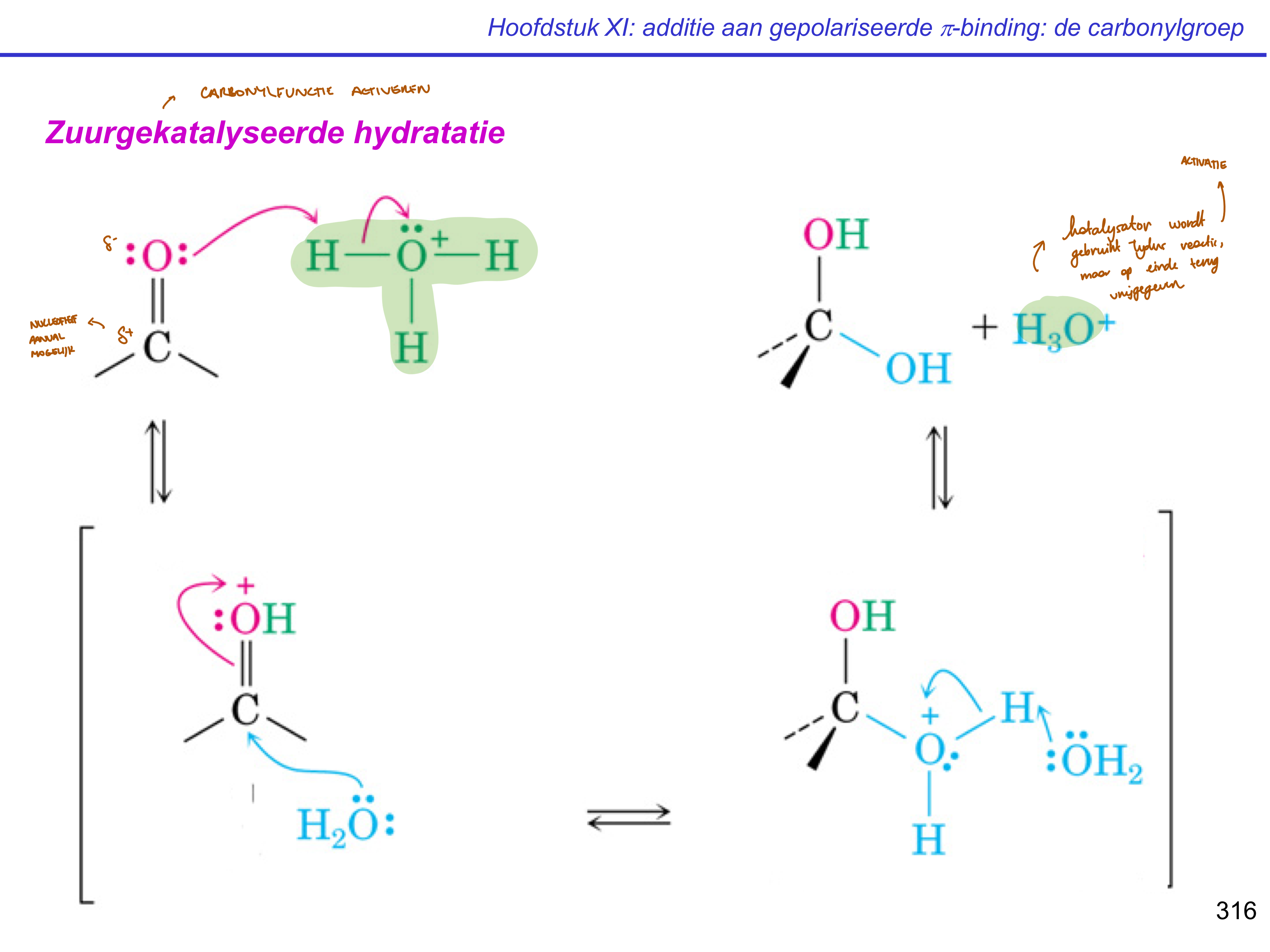
zuurgekatalyseerde hydratatie
protonatie
nucleofiele additie
deprotonatie
additie alcoholen
vorming acetalen
RO - C - OR
zie ook 4.1 - CARBO- OF KOOLHYDRATEN
keton/aldehyde + 2 R-OH → acetal + H2O
intermediar = hemi-acetal
omgekeerde reactie = hydrolyse
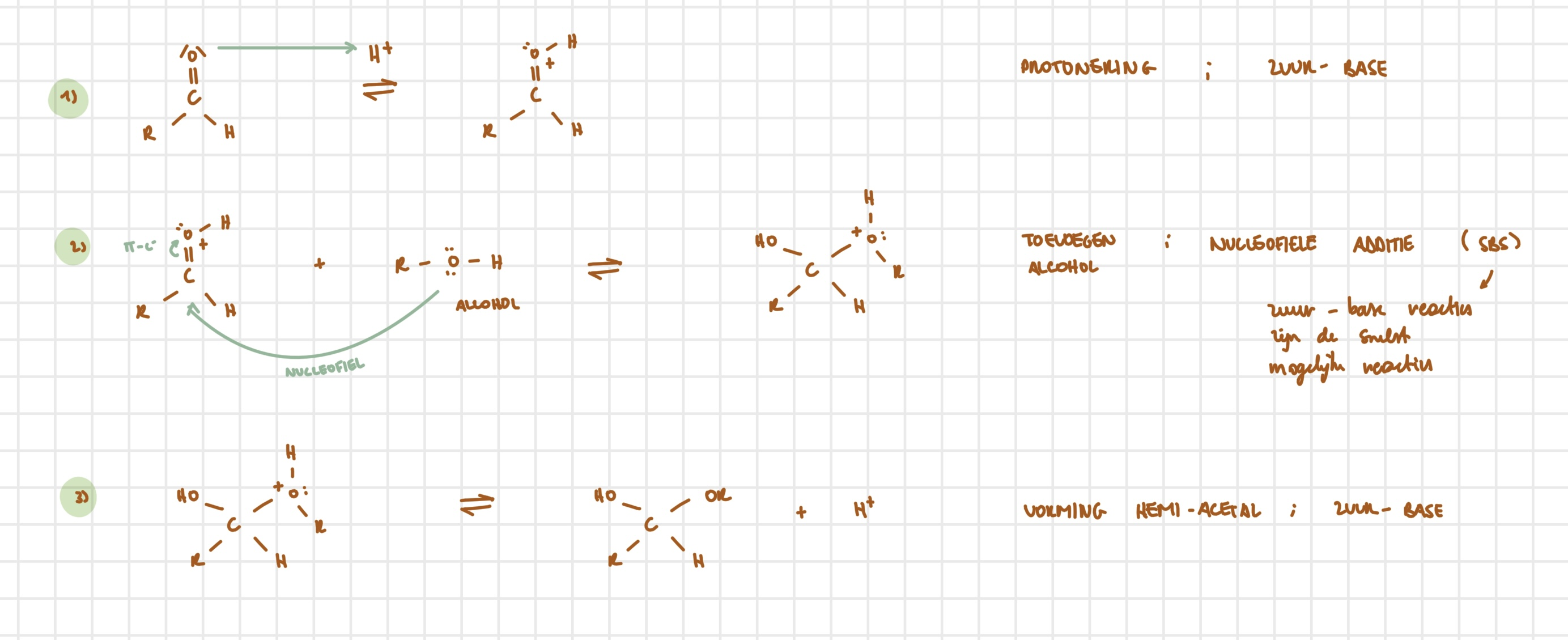
aldehyde → hemi-acetal — stappen
zuur-base; protonering carbonylgroep
nucleofiele additie; aanval alcohol (SBS)
zuur-base; vorming hemi-acetal
aldehyde → hemi-acetal — uitwerking
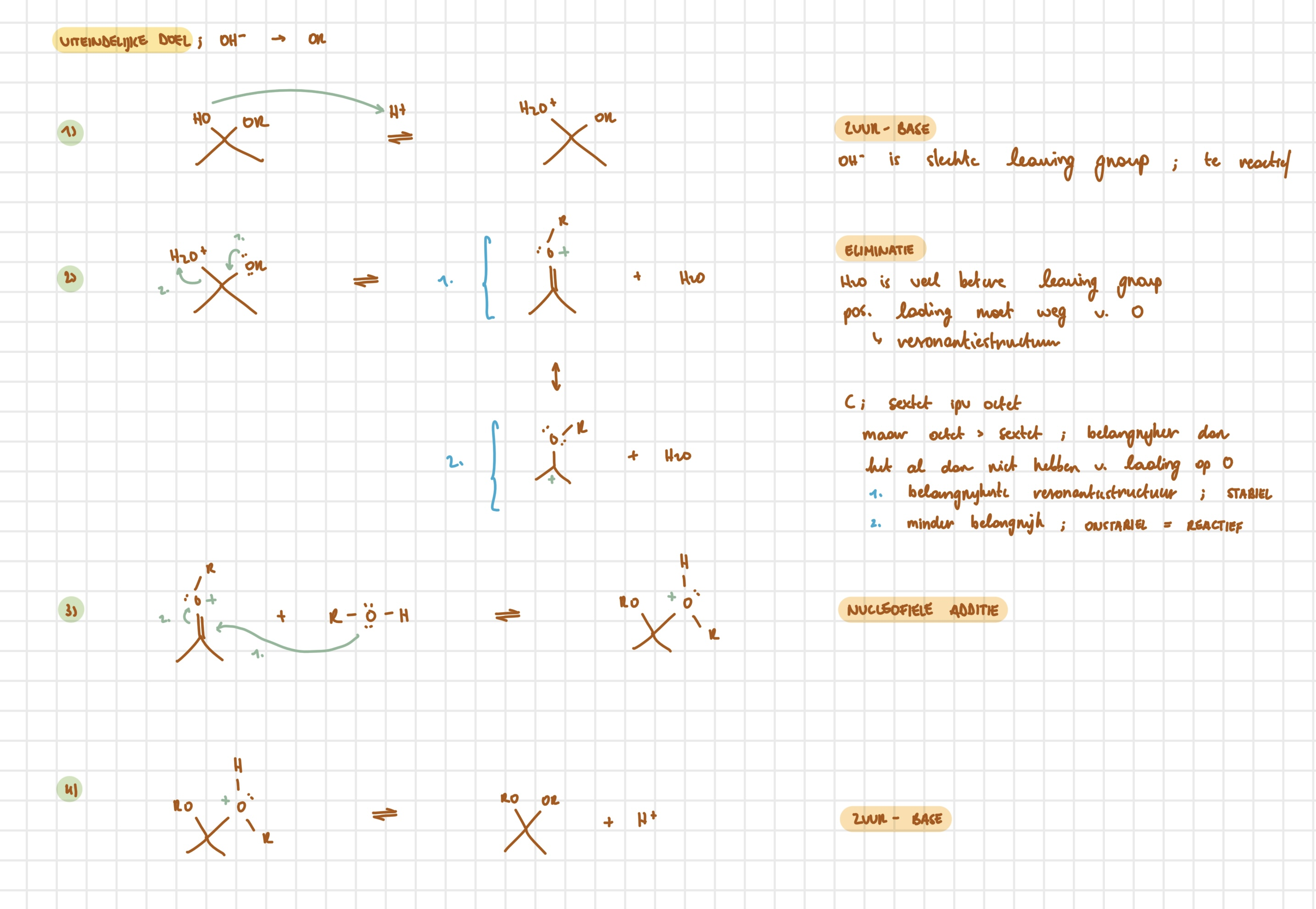
hemi-acetal → acetal — stappen
zuur-base; protonering hydroxylgroep
eliminatie; vorming oxonium-ion
nucleofiele additie; aanval alcohol
zuur-base; deprotonering
hemi-acetal → acetal — uitwerking
vorming acetal — beïnvloedende factoren
we kunnen evenwicht meer naar rechts verschuiven door;
[ROH] ↗ én/of [H2O] ↙
inspelen op entropiefactor; dalende entropie is ongunstig; 2 ⇄ 2 > 3 ⇄ 2
1× keton/aldehyde + 2× ROH → acetal
1× keton/aldehyde + 1× diol → afscherming
opm; reactie gebeurt onder zure katalyse; versnelt reactie, maar verplaatst evenwicht niet
hydrolyse acetal
acetal → hemi-acetal → keton/aldehyde
= PAD-PEAD omgekeerd
= PEAD - PED
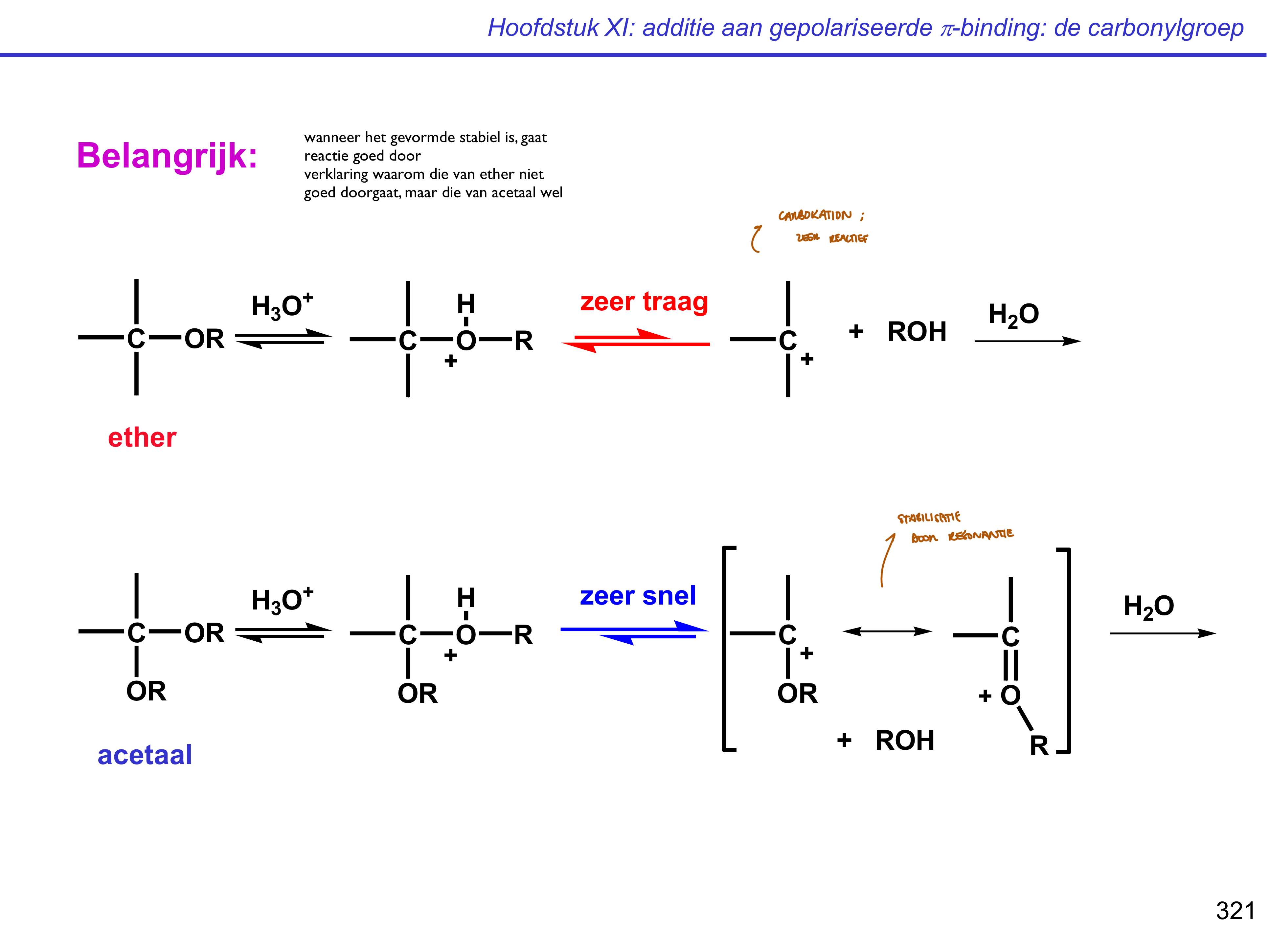
hydrolyse — ether vs acetal
let goed op, want beide lijken op elkaar
ether zal reactie niet of nauwelijks doorgaan
acetaal → hemi-acetal → keton/aldehyde
via omgekeerd PAD-PEAD
nucleofiele additie — stikstofnucleofielen
additie amines
additie amines
primair amine → imine
secundair amine → enamine
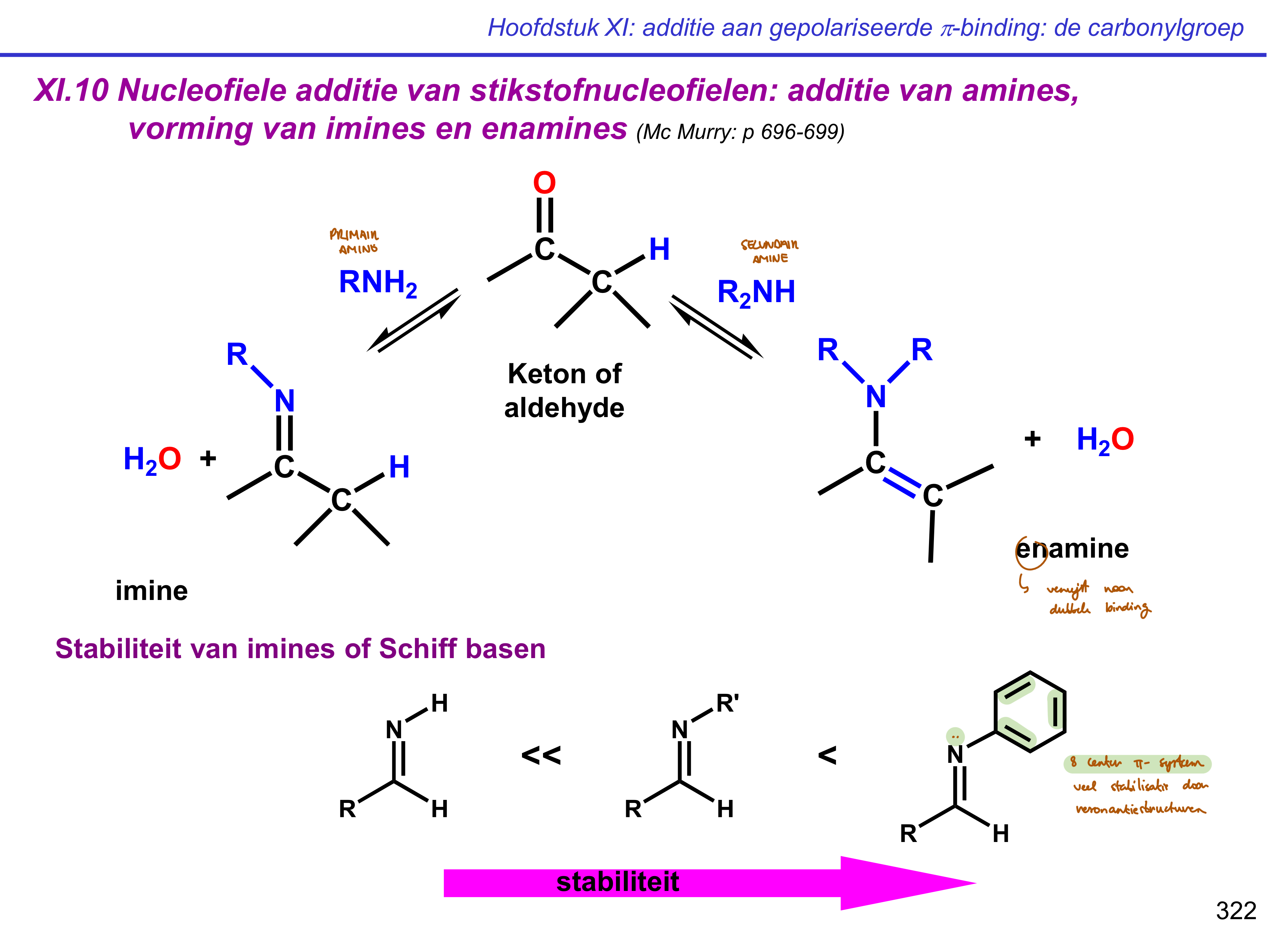
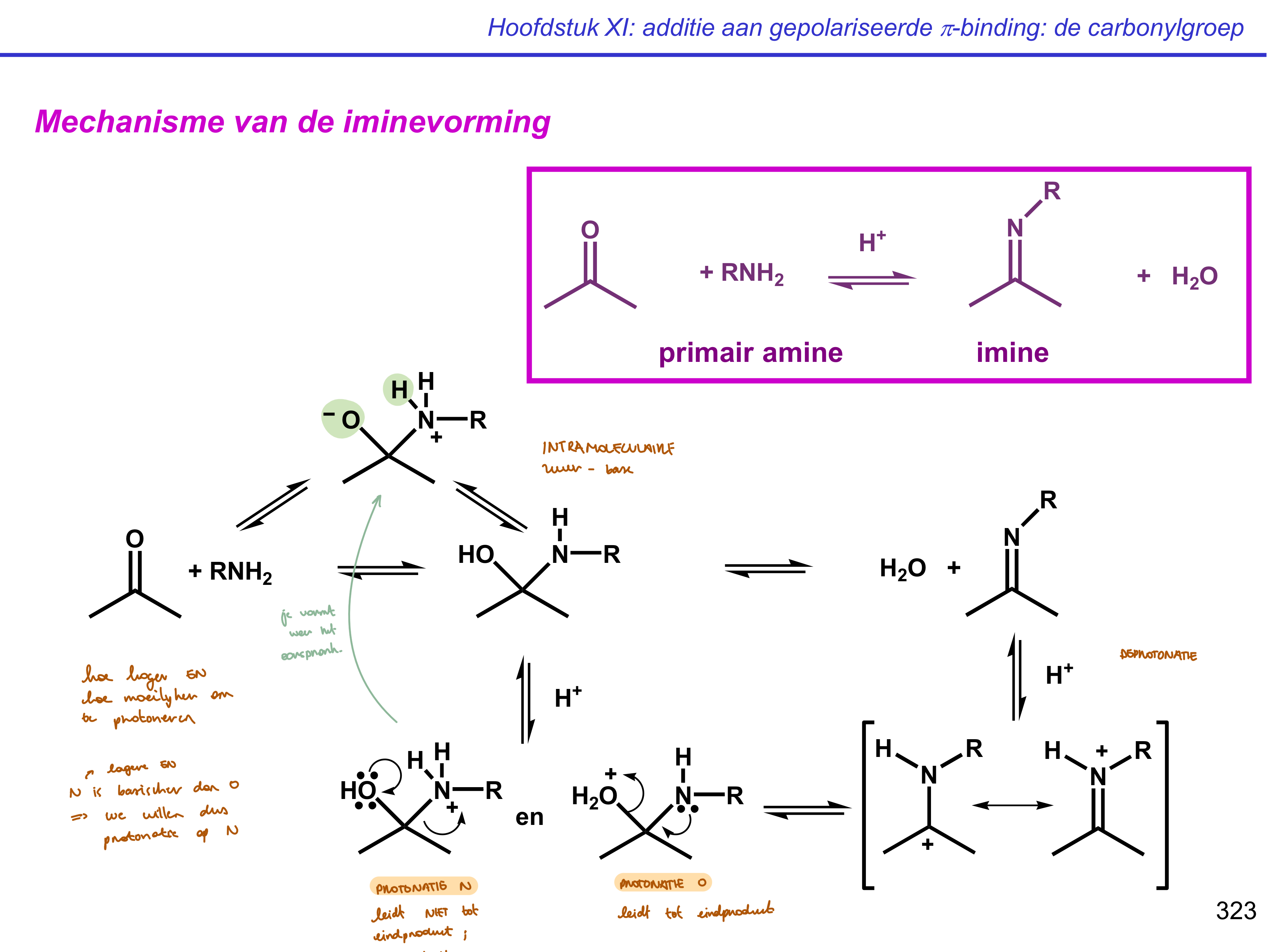
iminevorming
PAD - PED
op N of O
enkel O leidt tot eindproduct
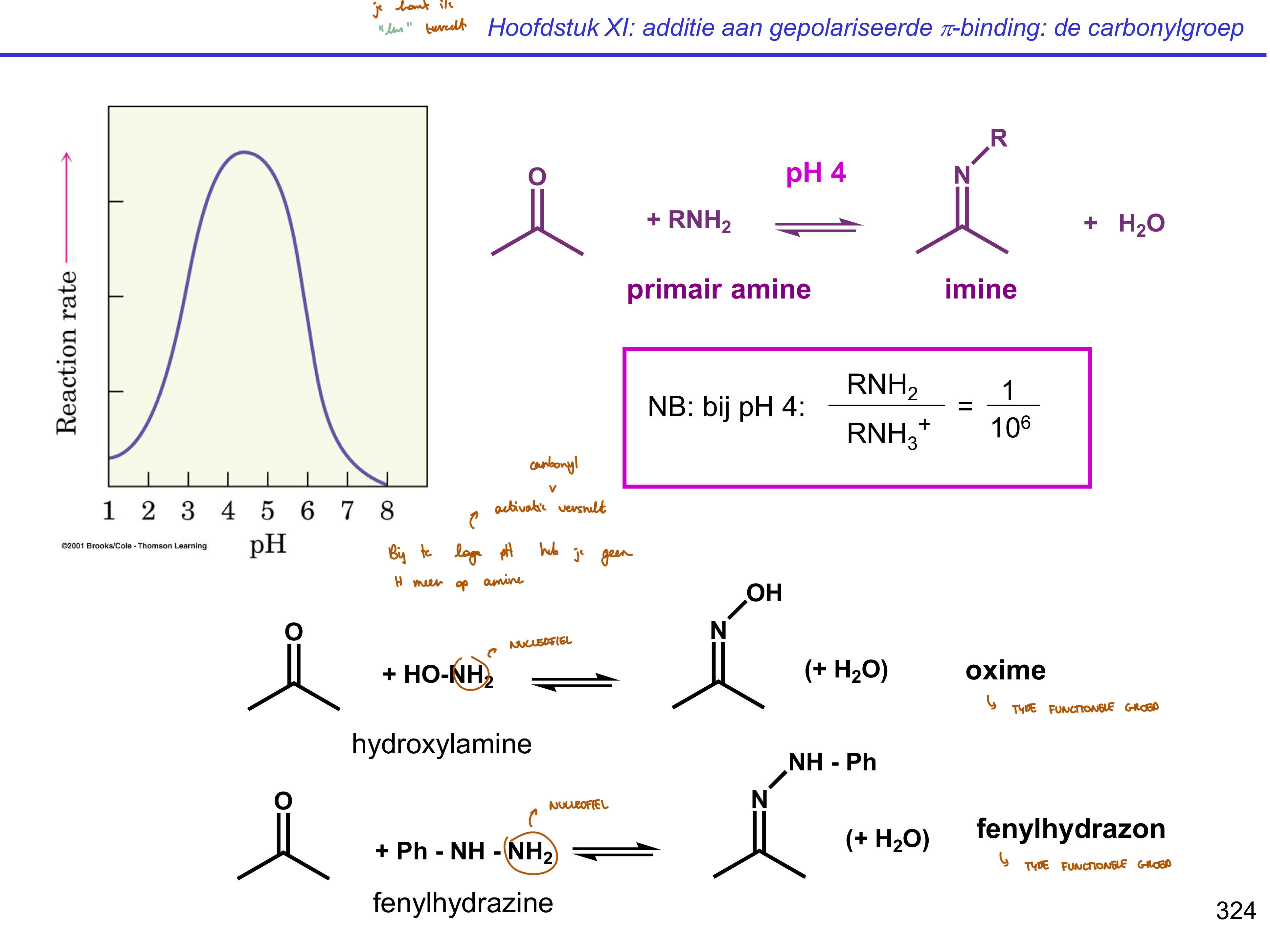
iminevorming — invloed pH
enaminevorming
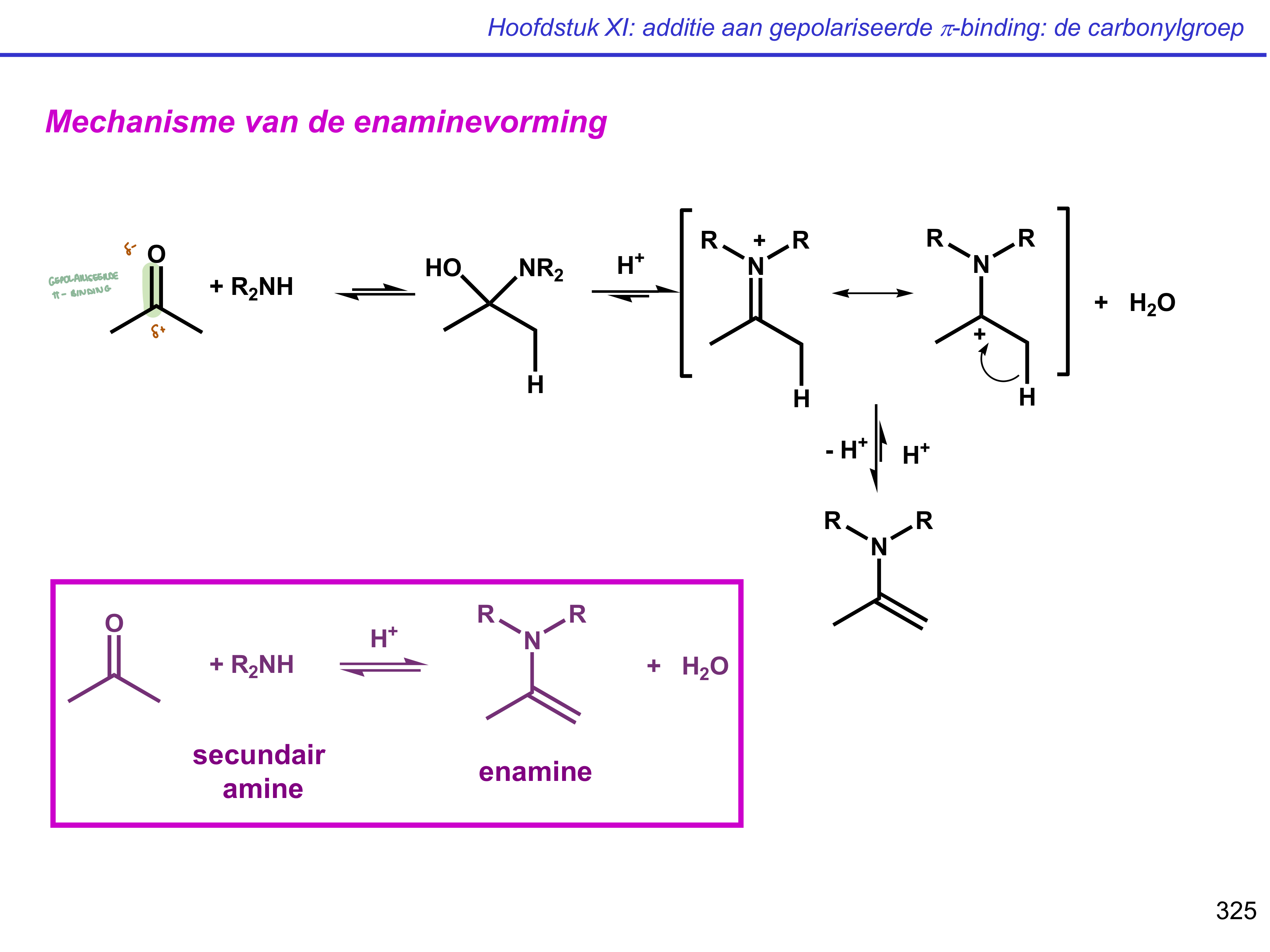
imine- vs enaminevorming — opm
verlopen grotendeels via zelfde mechanisme;
activatie carbonyl (door protonatie)
aanval amine
deprotonatie amine
protonatie OH tot H2O als LG
varschil in laatste stap;
1° amine; deprotonatie amine
2° amine; base neemt H van α-koolstof
geconjugeerde nucleofiele additie
α,β-onverzadigde aldehyden/ketonen
amines
alkylgroepen; organokoper reacties
α,β-onverzadigde aldehyden/ketonen — filmpje (7 min)
α,β-onverzadigde aldehyden/ketonen
nucleofiel kan op twee plaatsen aanvallen;
koolstof van carbonyl; δ+ door ΔEN
β-koolstof; +lading door resonantie
afhankelijk van nucleofiel waar aangevallen wordt;
sterk nucleofiel; directe aanval (carbonyl)
zwak nucleofiel; geconjugeerde aanval (β)
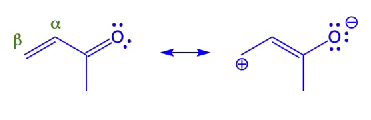
sterk vs zwak nucleofiel
sterk
Grignard (MgBr), organolithium, LiAlH4
zwak
alcohol, water, alkoxides, hydroxide, amines, thiolen, cyaniden, Gilman ((R2)CuLi)
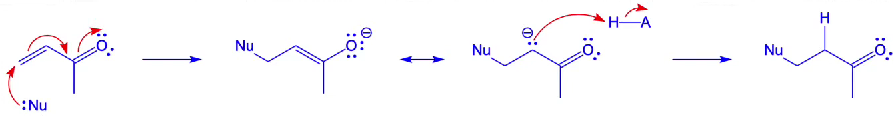
geconjugeerde aanval — voorbeeld
let op; protonatie
niet op zuurstof carbonyl
wel op α-koolstof
enantioselectieve additie
= additie waarbij één enantiomeer voorkeursmatig wordt gevormd ipv racemisch mengsel (50/50)
maakt gebruik van chirale katalysator;
"dwingt" de reactie in een bepaalde 3D-richting
oef — enkele opm
voor reacties bij carbonyl heb je nucleofiel nodig
alkyn + carbonyl → x
alkyn + base → nucleofiel + carbonyl → …
als protonatie carbonyl mogelijk is, voer je die eerst uit; op die manier kan nucleofiel nog beter aanvallen
H2O kan op zichzelf molecule verlaten als LG
(de)protonatie gebeurt altijd via zuur/base in opl
oef 5 WC3 — opm
keten verlengen kan op 2 manieren;
nucleofiele additie
nucleofiele substitutie
afhankelijk van waar O moet komen;
op 1e C gebruik je carbonyl + Grignard
(form)aldehyde / keton
je verkrijgt 1°, 2° of 3° alc
op 2e C gebruik je epoxide + nucleofiel