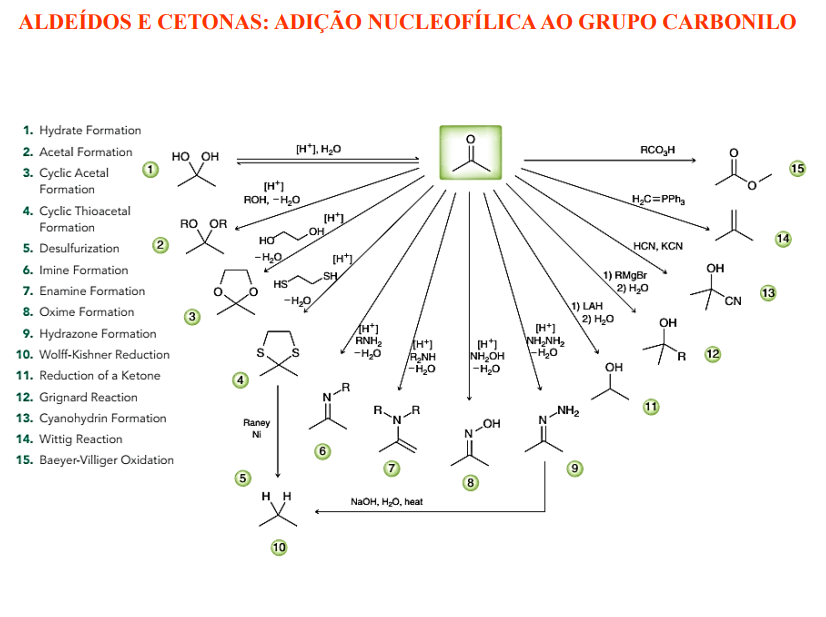
aldeídos e cetonas IV
1/27
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
28 Terms
hidrólise de acetais
a hidrolise de acetáis é efetuada em meio ácido
os acetais são estáveis em meio básico
mecanismo de hidrólise dos acetais (facilmente hidrolisados adicionando água com catálise ácida)
1) protonação do grupo carbonilo (para ficar + eletrofílico)
2) saída de grupo abandonante (molécula de álcool sai)
3) ataque nucleofílico da água
4) desprotonação da água
5) hemiacetal é protonado
6) saída de grupo abandonante (molécula de álcool sai)
7) desprotonação para dar origem a uma cetona

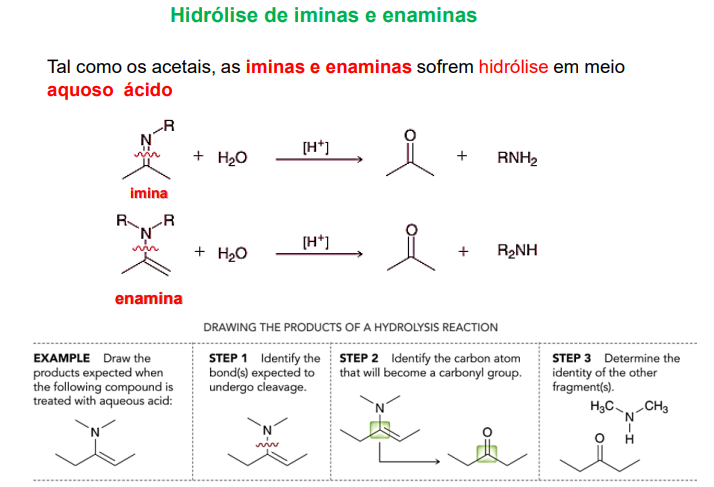
hidrólise de iminas e enaminas (em meio aquoso acídico)
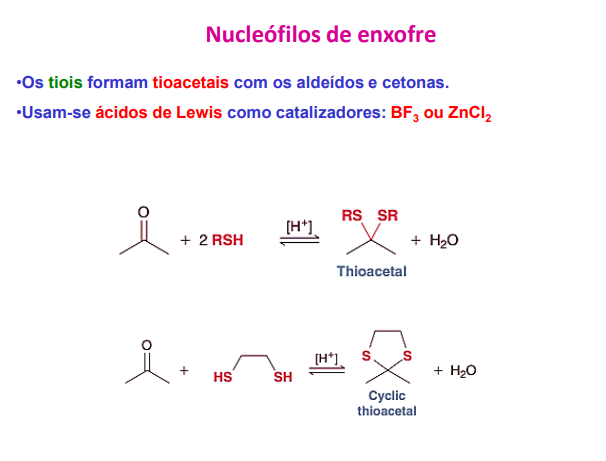
nucleófilos de enxofre
os tióis formam tioacetais com os aldeídos e cetonas
usam-se ácidos de lewis como catalisadores: BF3 ou ZNCl2
nucleófilos de enxofre
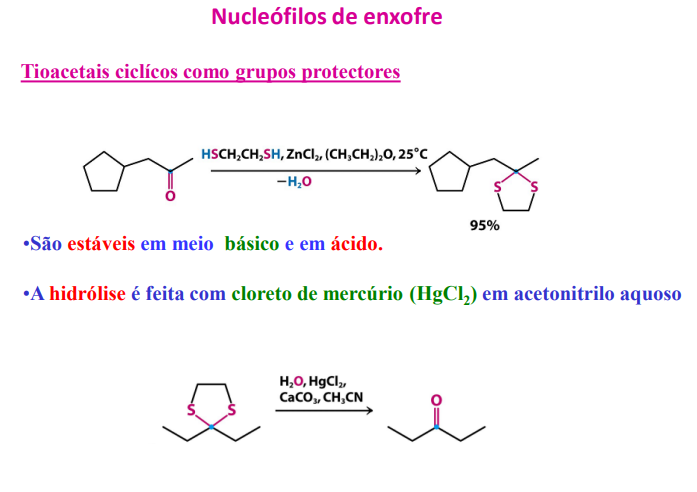
tioacetais cíclicos como grupos protetores
são estáveis em meio básico e em ácido
hidrólise é feita com cloreto de mercúrio
nucleófilos de enxofre
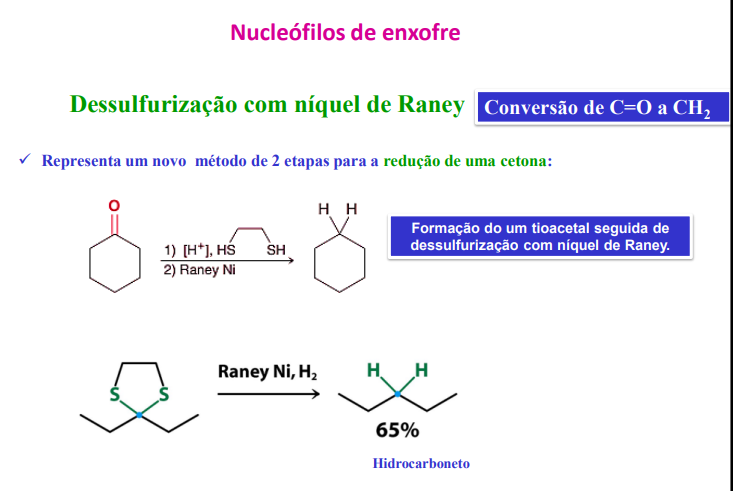
dessulfurização com níquel de raney (conversão de C=O a CH2)
novo método para a redução de uma cetona: fomração do tioacetal seguida de dessulfurização com níquel de raney
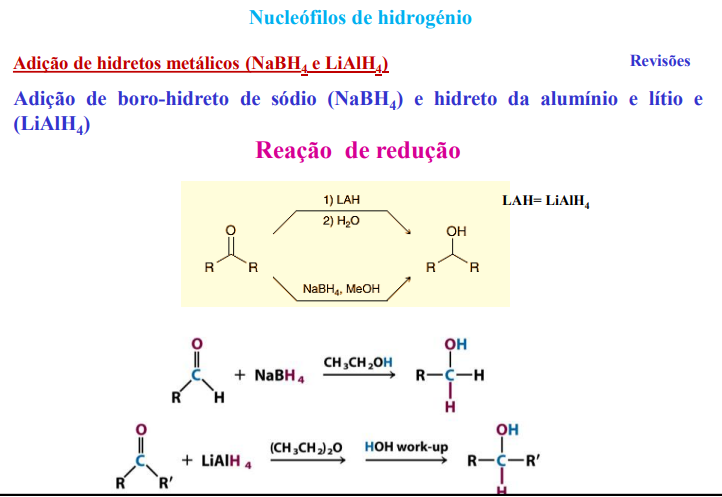
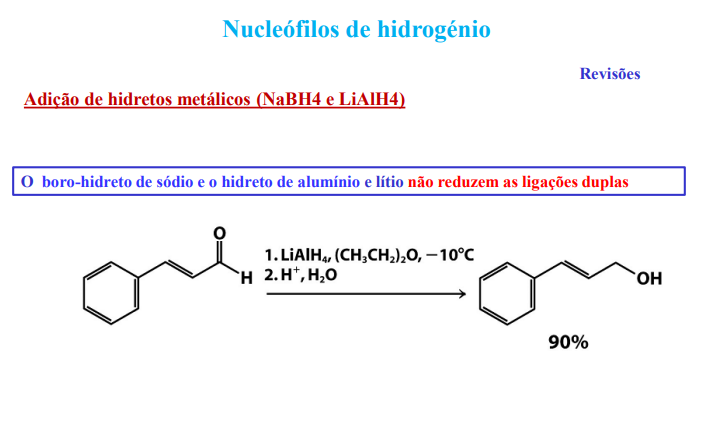
nucleófilos de hidrogénio: adição de hidretos metálicos (NaBH4 e LiAlH4)
dadores de hidreto (H-)

adição de hidretos metálicos (NaBH4 e LiAlH4)
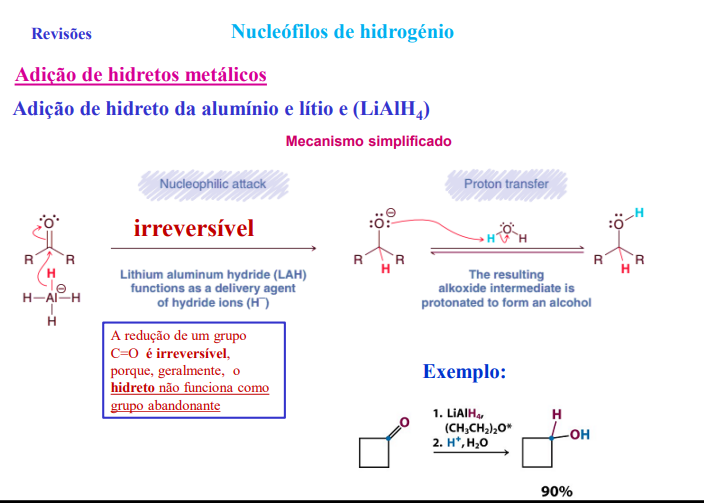
adição de hidretos metálicos (NaBH4 e LiAlH4)
mecanismo (irreversível):
1) ataque nucleofílico (a redução do C=O é irreversível, porque geralmente o hidreto não funciona como grupo abandonante)
2) protonação do ião alcóxido

adição de hidretos metálicos (NaBH4 e LiAlH4)
o boro-hidreto e o hidreto de alumínio e lítio não reduzem as ligações duplas
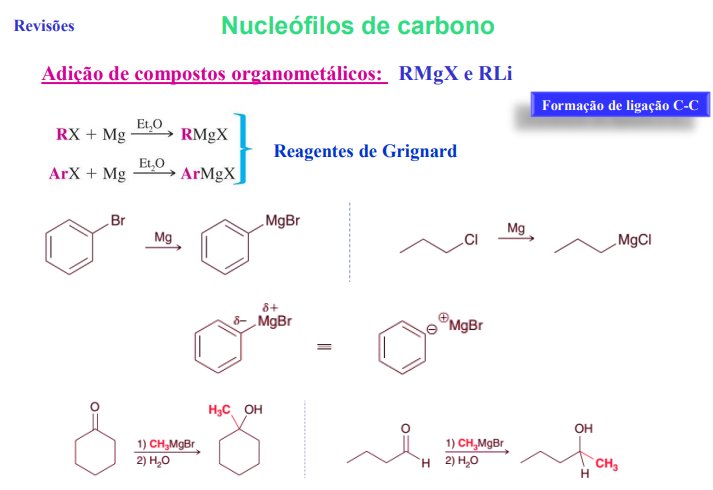
nucelófilos de carbono
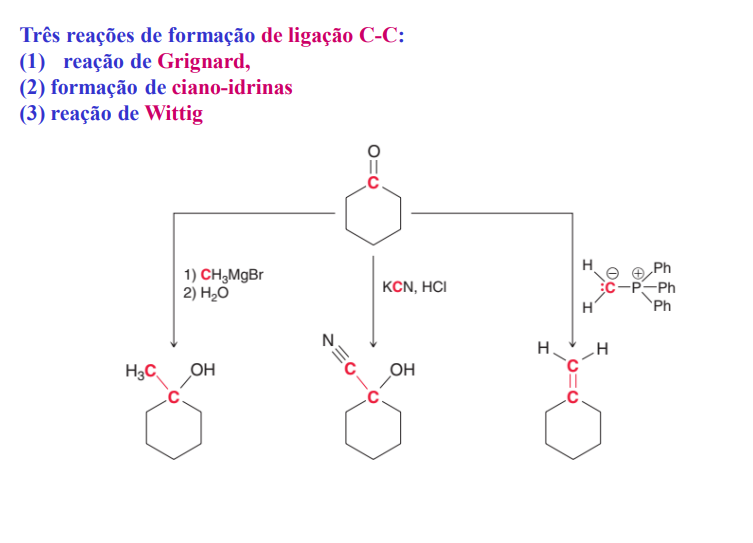
adição de compostos organometálicos: RMgX e RLi
formação de ligação C-C
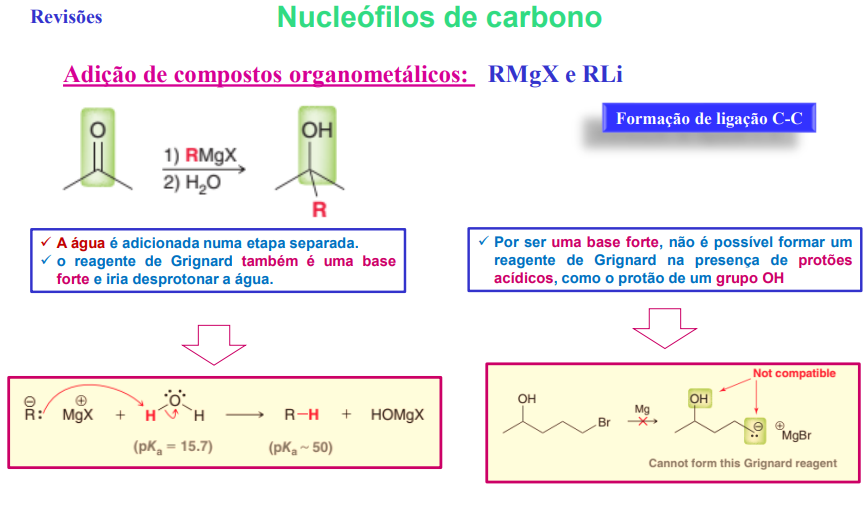
adição de compostos organometálicos: RMgX e RLi
a água é adicionada numa etapa separada
o reagente de grignard também é uma base forte e iria desprotonar a água
por ser uma base forte, não é possível formar um reagente de grignard na presença de protões acídicos como o protáo de um grupo OH
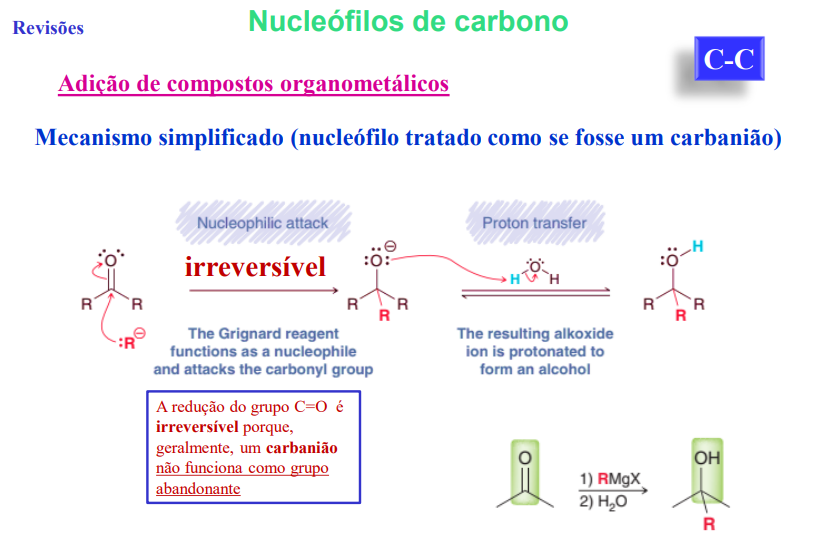
nulceófilos de carbono: adição de compostos organometálicos
mecanismo simplificado (nucleófilo tratado como se fosse um carbanião)
a redução do grupo C=O é irreversível porque, geralmente um carbanião não funciona como grupo abandonante
nucleófilos de carbono: adição de compostos organometálicos: RMgX e RLi e adição de hidretos metálicos (NaBH4 e LiAlH4)
são reações irreversíveis

nucelófilos de carbono: adição de cianeto de hidrogénio- formação de ciano-hidrinas
quando tratados com cianeto de hidrogénio (ácido cianídrico; HCN), os aldeídos e cetonas são conevrtidos em ciano-hidrinas
a formação de ciano-hidrinas requer a presença de CN- assim como HCN (condições moderadamente básicas)
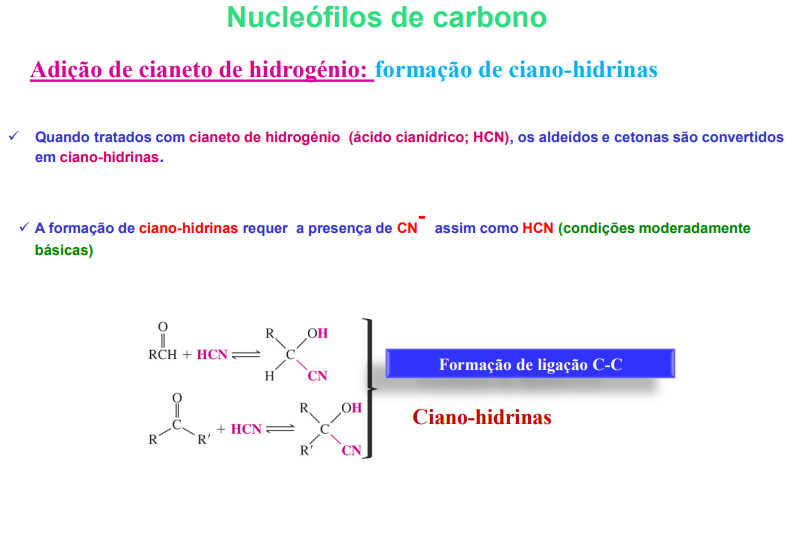
adição de cianeto de hidrogénio- formação de ciano-hidrinas
a reação ocorre + facilmente em condições levemente básicas
a reação é geralmente realizada numa mistura de HCN e iões cianeto (KCN)
o processo é reversível
mecanismo:
1) ataque nucleofílico: o ião cianido funciona como um nucleófilo
2) protonação gera uma cianohidrina
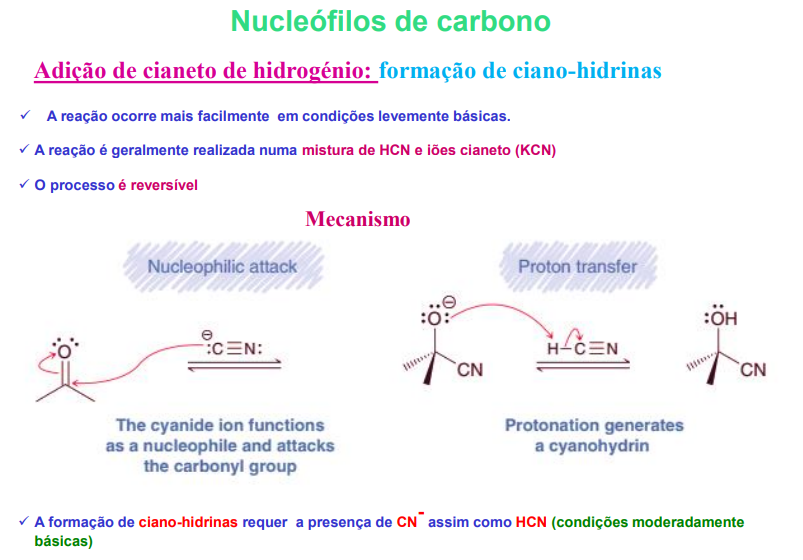
adição de cianeto de hidrogénio- formação de ciano-hidrinas
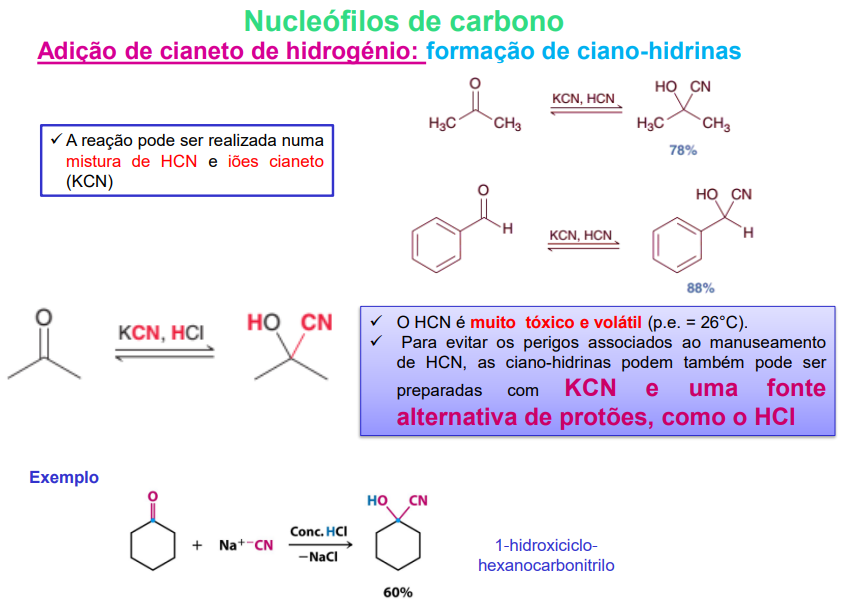
o HCN é muito tóxico e volátil
para evitar os perigos associados ao manuseamento de HCN, as ciano-hidrinas podem também ser preparadas com KCN e uma fonte alternativa de protões (HCl)
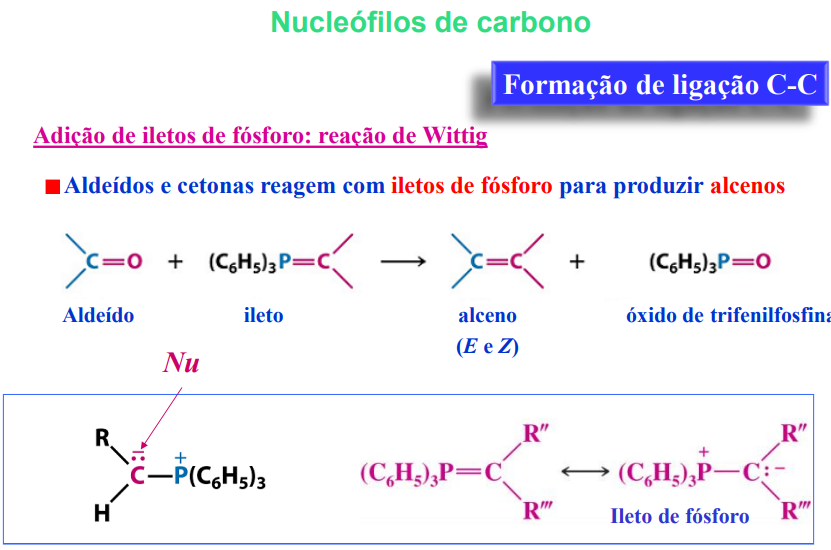
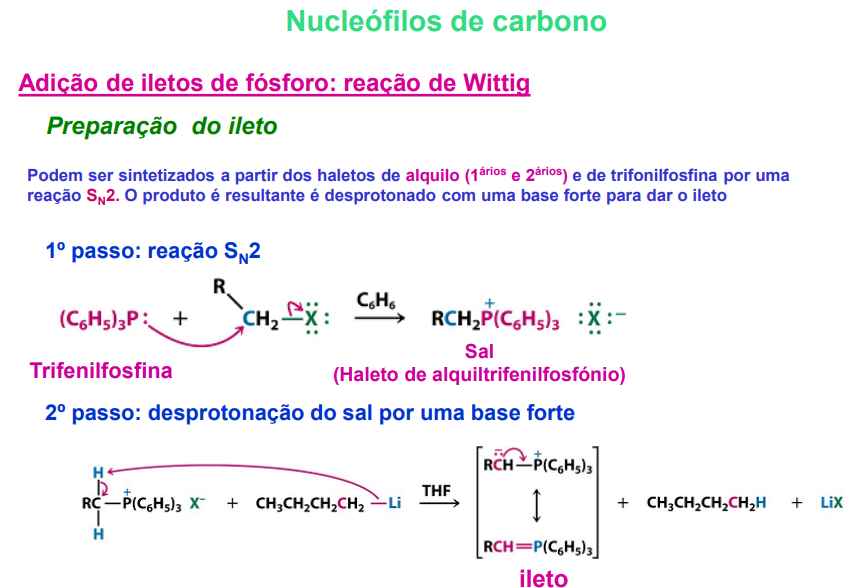
nucleófilos de carbono: adição de iletos de fósforo: reação de wittig
aldeídos e cetonas reagem com iletos de fósforo para produzir alcenos
formação de ligação C-C
adição de iletos de fósforo: reação de wittig
preparação do ileto:
podem ser sintetizados a partir de haletos de alquilo (primários e secundários) e de trifonilfosfina por uma reação SN2
o produto resultante é desprotonado com uma base forte apra dar ileto
adição de iletos de fósforo: reação de wittig
mecanismo:
1) [2+2] cicloadição (reação do reagente de wittig com o grupo carbonilo→ oxafosfetano)
2) fragmentação (produção de um alceno e de óxido de trifenilfosfina)
![<p>mecanismo:</p><p>1) [2+2] cicloadição (reação do reagente de wittig com o grupo carbonilo→ oxafosfetano)</p><p>2) fragmentação (produção de um <strong>alceno e de óxido de trifenilfosfina</strong>)</p>](https://knowt-user-attachments.s3.amazonaws.com/1466209a-9dae-4489-a18c-a0fc76ac09f4.png)

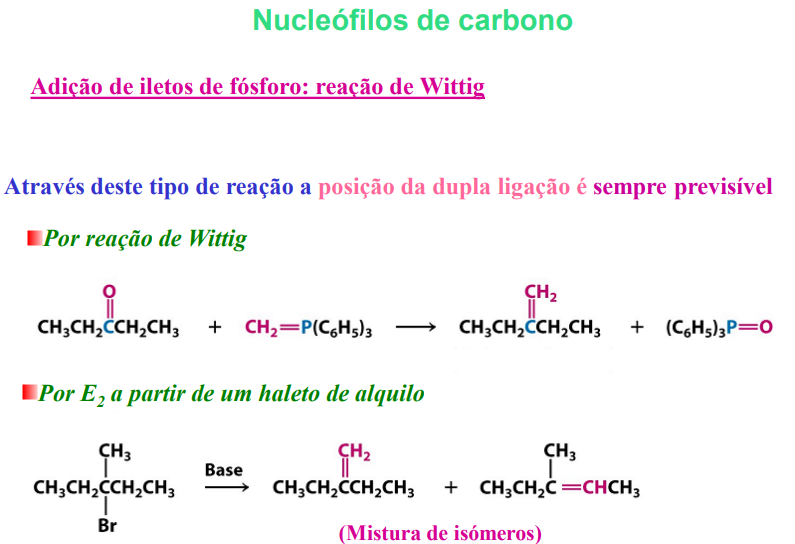
adição de iletos de fósforo: reação de wittig (pode ser estéreo-seletiva, por vezes formam-se misturas de isómeros cis-trans)
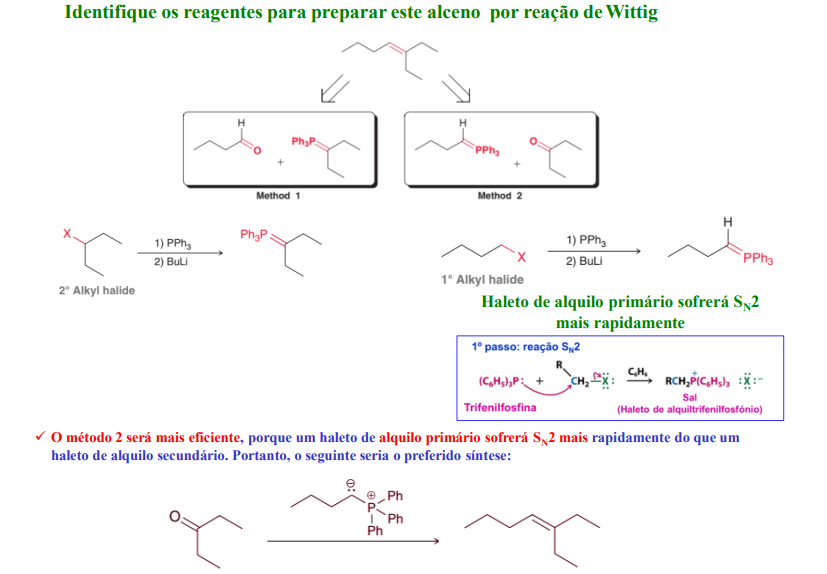
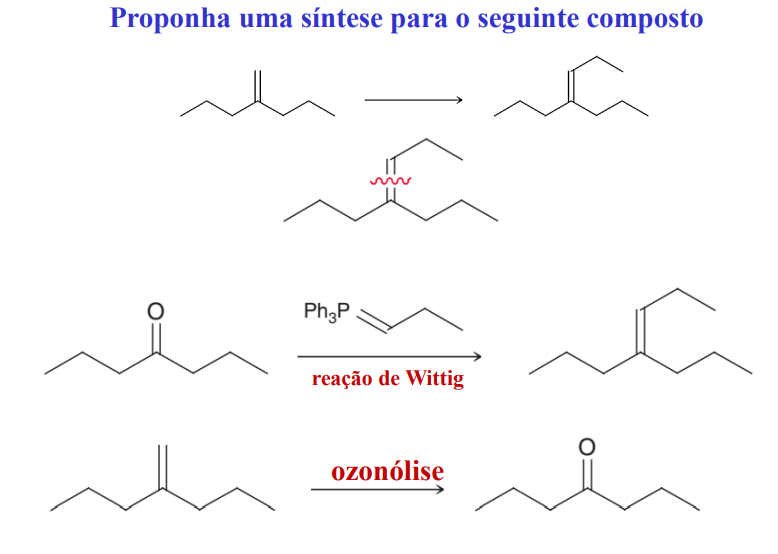
identifique os reagentes para preparar este alceno por reação de wittig
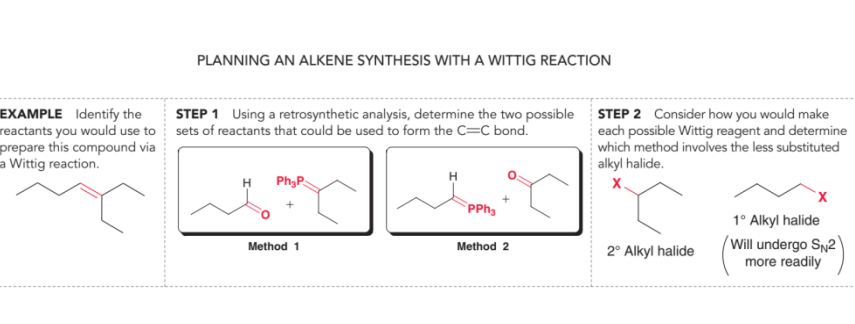
3 reações de formação de ligação C-C
oxidação de aldeídos e cetonas
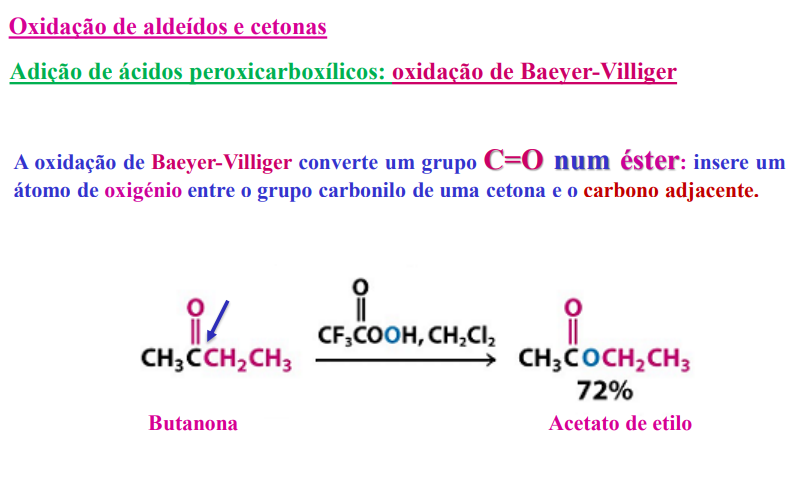
adição de ácidos peroxicarboxílicos: oxidação de baeyer- villiger:
a oxidação de baeyer- villiger converte um grupo C=O num éster: insere um átomo de oxigénio entre o grupo carbonilo de uma cetona e o carbono adjacente
adição de ácidos peroxicarboxílicos: oxidação de baeyer- villiger:
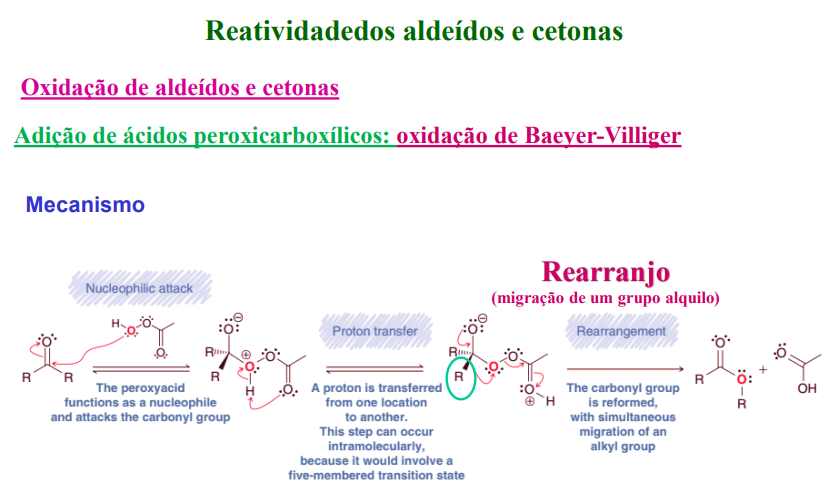
mecanismo:
1) ataque nucleofílico do peroxiácido
2) um protão é transferido de um sítio para outro
3) rearranjo (migração de um grupo alquilo e o grupo carbonilo volta a formar-se)
adição de ácidos peroxicarboxílicos: oxidação de baeyer- villiger:
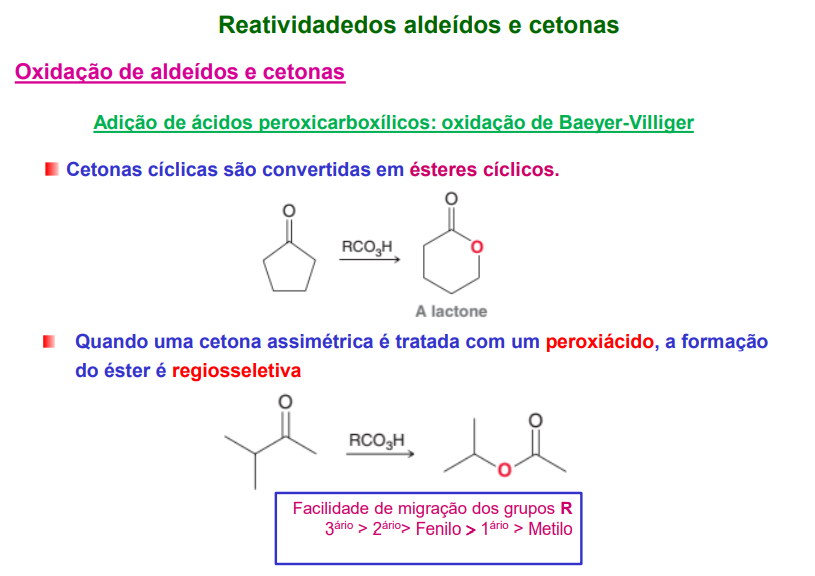
cetonas cíclicas são convertidas em ésteres cíclicos
quando uma cetona assimétrica é tratada com um peroxiácido, a formação do éster é regiosseletiva
proponha uma síntese para o seguinte composto