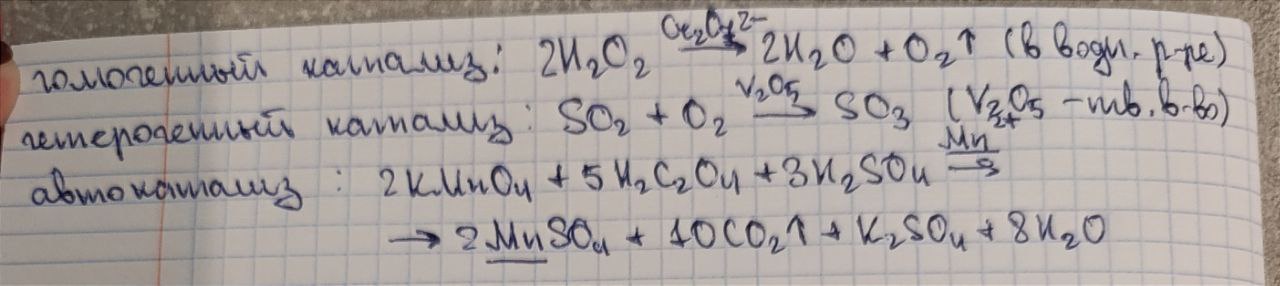Коллоквиум 2: Термодинамика и кинетика.
1/25
Earn XP
Description and Tags
Коллоквиумы 1 курс
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
26 Terms
Понятие термодинамической системы. Типы систем.
Совокупность тел, мысленно (или реально) обособленных от окружающей среды, способных обмениваться друг с другом энергией и в-вом и по-разному взаимодействующих с окружающей средой.
Типы систем: открытые (обмен и Е, и n), закрытые/замкнутые (обмен только Е), изолированные (обмен невозможен). Также тд-системы могут подразделять на гомо- и гетерогенные, равновесные и неравновесные, одно- и многокомпонентные, простые и сложные (по характеру производимой работы).
Внутренняя энергия. Интенсивные и экстенсивные параметры.
Внутренняя энергия определяется в основном кинетической энергией составляющих систему частиц (молекул, атомов, е, ядер и тд) и энергией их взаимодействия.
Интенсивные параметры не зависят от количества в-ва: T, p, c (мольная концентрация), вязкость и тд.
Экстенсивные параметры зависят от количества в-ва: V, m, U.
Термодинамические функции
Функции состояния: U, H, S, G, F. Их изменения зависят от конечного и начального состояния системы и не зависят от количества промежуточных стадий процесса.
Функции процесса: A, Q. Их величина зависит от количества промежуточных стадий, поскольку они являются формами энергии для обеспечения изменения состояния системы.
Термодинамический процесс. Типы процессов. Химический процесс.
Термодинамическим процессом называют такое изменение общего состояния системы, при котором полностью меняется хотя бы один из её основных параметров.
ХИМИЧЕСКИЕ ПРОЦЕССЫ -превращения одних веществ в другие вещества
ТИПЫ ПРОЦЕССОВ
- ИЗОТЕРМИЧЕСКИЕ (t=const)
- ИЗОБАРИЧЕСКИЕ (ИЗОБАРНЫЕ) (p=const)
- ИЗОХОРИЧЕСКИЕ (ИЗОХОРНЫЕ) (V=const)
- ИЗОБАРНО-ИЗОТЕРМИЧЕСКИЕ ((р, t=const)
- ИЗОХОРНО-ИЗОТЕРМИЧЕСКИЕ (V,t=const)
- АДИАБАТИЧЕСКИЕ – отсутствует теплообмен с внешней средой
1й закон термодинамики. Математическое выражение этого закона для разных процессов.
Количество теплоты, переданное системе, расходуется на увеличение её внутренней энергии и совершение этой системой работы.
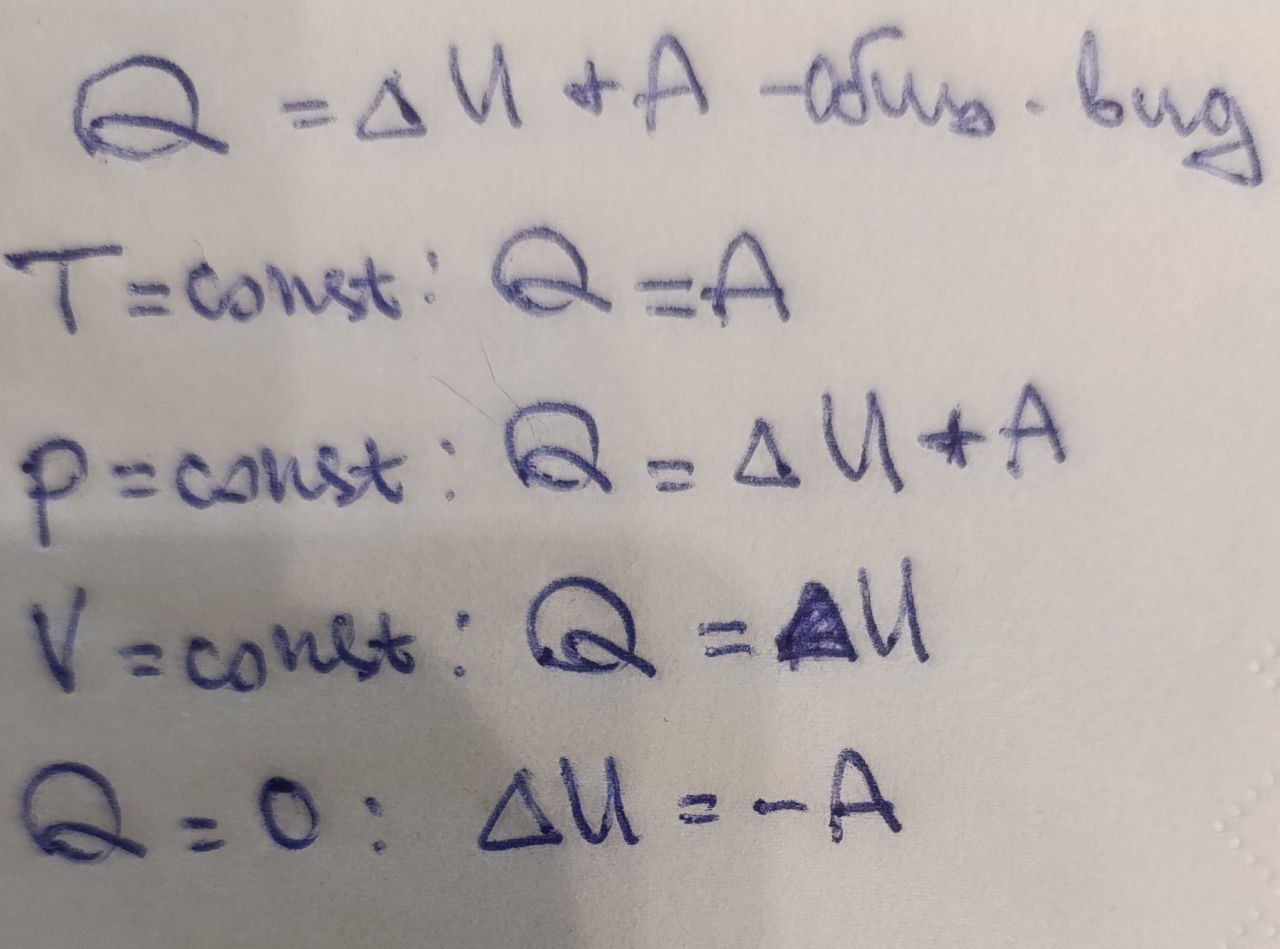
Энтальпия.
Энтальпию можно рассматривать как энергию расширенной системы: как и внутренняя энергия, она характеризует энергетическое состояние системы, но включает энергию, затрачиваемую на преодоление внешнего давления, то есть на работу расширения. Значит, энтальпия характеризует и внутреннюю энергию системы, и её способность к выполнению работы.
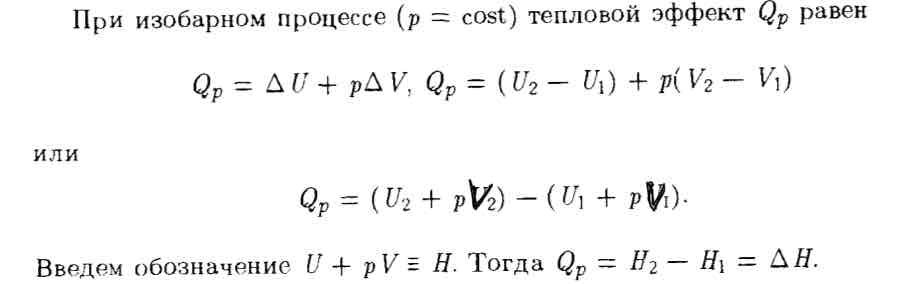
Стандартная энтальпия образования простых и сложных веществ. Правило знаков.
Стандартной энтальпией образования химического соединения называют тепловой эффект реакции образования 1 моля этого вещества из простых веществ, взятых в том агрегатном состоянии, в котором они находятся при стандартных условиях.
Стандартные энтальпии образования простых веществ (рассматриваются аллотропные формы, устойчивые при стандартных условиях) принимаются равными нулю.

Закон Гесса. Следствия из закона Гесса. Энтальпийная диаграмма.
Закон Гесса - Тепловой эффект химических реакций, протекающих при р,Т=const или V,T=const, зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Закон Гесса - следствие 1-го закона термодинамики
Следствия из закона Гесса: 1.Энтальпия реакции не зависит от числа промежуточных стадий,
2. Энтальпия прямой реакции равна энтальпии обратной реакции, взятой с противоположным знаком
3. Тепловой эффект реакции равен разности между суммой теплот образования всех продуктов реакции и суммой теплот образования всех реагентов, взятых с соответствующими стехиометрическими коэффициентами

Энтропия.
Энтропия пропорциональна логарифму термодинамической вероятности состояния системы W (числу микросостояний, осуществляющих данное макросостояние): S = klnW. Словесная формулировка уравнения Больцмана: все самопроизвольно протекающие процессы в замкнутой системе, приближающие её к состоянию равновесия и сопровождающиеся ростом энтропии, направлены в сторону увеличения вероятности состояния.
Также энтропию можно назвать мерой беспорядка или разупорядоченности системы.

2й закон термодинамики. Самопроизвольный процесс. Стандартная энтропия в-ва и реакции.
Второй закон определяет направление самопроизвольного протекания процессов, в том числе и химических реакций. Формулировка: невозможна передача тепла от менее нагретого тела более нагретому.
Самопроизвольным называется процесс, который протекает самостоятельно без воздействия внешних факторов.
Изменение энтропии в обратимом процессе равно отношению теплоты процесса к абсолютной температуре (по шкале Кельвина).
В термодинамически необратимом процессе изменение энтропии всегда больше отношения теплоты процесса к абсолютной температуре.
Стандартная энтропия вещества – абсолютное значение энтропии вещества при стандартных условиях в любом данном агрегатном состоянии.
Энтропия-функция состояния, поэтому Энтропия реакции, проведенной в стандартных условиях, называется стандартной энтропией реакции.

Качественная оценка изменения энтропии процесса.

3 закон термодинамики.
Постулат Планка («Третий закон термодинамики») Энтропия идеального кристалла чистого вещества при абсолютном нуле равна нулю.
В идеальном кристалле при абсолютном нуле атомы должны находиться в единственном самом низком энергетическом состоянии, вероятность которого равна единице, а энтропия соответственно нулю (S = klnW; W = 1 → lnW = 0 → S = 0).

Энергия Гиббса. Стандартная энергия Гиббса образования в-в. Энергия Гельмгольца.
Функция состояния, связывающая энтальпию и энтропию – энергия Гиббса (G). Она отражает баланс между энтальпийным и энтропийным факторами процесса. Поскольку движущей силой химической реакции считается максимальная работа, которую можно совершить за счёт этой реакции, f энергия Гиббса характеризует ту часть изменения внутренней энергии, которая может быть превращена в полезную работу, энергию Гиббса также называют изобарно-изотермическим потенциалом системы.
При условии постоянства объема и температуры пользуются термодинамической функцией состояния энергией Гельмгольца, её физический смысл аналогичен энергии Гиббса.

Энтальпийный и энтропийный факторы процессов.
При самопроизвольном протекании химического, изобарно-изотермического процесса одновременно влияют два фактора:
1. Энтальпийный фактор (∆Н) — стремление частиц системы к образованию прочных связей, сопровождающееся понижением энергии системы.
2. Энтропийный фактор (T·∆S) — стремление частиц к увеличению беспорядка, разъединению, к увеличению энтропии.
Суммарный эффект двух движущих сил при стандартных условиях отражает энергия Гиббса.

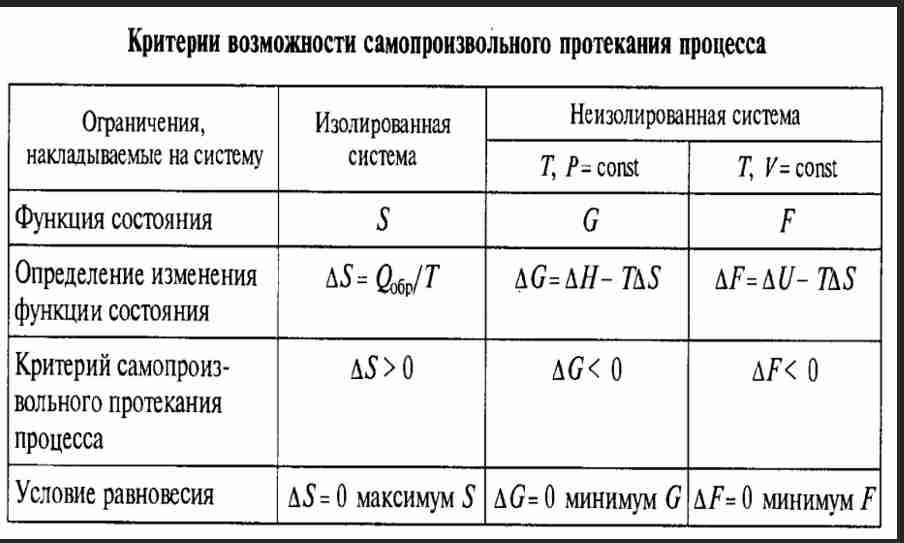
Критерии самопроизвольно протекающих процессов.
Единицы измерения термодинамических величин
А, Q - Дж S, cₙ - Дж/(моль*К)
∆H, ∆G, ∆F - кДж/моль
Скорость химической реакции. Средняя и истинная скорости.
Скорость химической реакции - количество в-ва, вступающего в р-ю или образующегося в результате р-и за единицу времени в единице объёма системы (гомогенная реакция) или в единице площади системы (гетерогенная реакция).
Средняя скорость х.р. - конечное изменение концентрации в-ва или его количества в единице объёма системы или в единице площади системы за определённый промежуток времени.
Истинная скорость х.р.в момент времени т - первая производная от концентрации (гомогенная реакция) или первая производная от количества в-ва (гетерогенная реакция) по времени. Иначе говоря, это мгновенная скорость реакции.

Влияние концентрации и давления в-в на скорость химической реакции. Закон действующих масс.
Закон действующих масс: скорость элементарной реакции при постоянной температуре пропорциональна произведению мольной концентрации в степенях, равных их стехиометрическим коэффициентам. Отсюда вытекает, что изменение концентрации влияет на скорость гомогенной реакции. Изменение давления влияет на скорость гомогенных реакций в газовой фазе.

Константа скорости химической реакции. Её физический смысл. Факторы, влияющие на константу скорости.
Константа скорости химической реакции численно равна скорости реакции при концентрациях в-в, равных 1 моль/л. В этом случае константа скорости реакции равна скорости этой реакции.
Константа скорости зависит от природы реагирующих в-в, температуры и наличия катализатора, но не зависит от концентраций реагирующих в-в.
Порядок реакции. Закон действующих масс и кинетическое уравнение реакции. Молекулярность реакции.
Порядок реакции по какому-либо из реагентов - экспериментально определяемый показатель степени, в которую нужно возвести концентрацию этого реагента в кинетическом уравнении. Общий (суммарный) порядок реакции - сумма показателей степеней в данном кинетическом уравнении.
Кинетическое уравнение - форма записи закона действующих масс для сложной реакции, в которой порядки не равны стехиометрическим коэффициентам.
Молекулярность х.р. - минимальное число молекул, участвующее в элементарной химической реакции. По молекулярности реакции делятся на моно-, би- и тримолекулярные.
Важные замечания (n = порядок, m = молекулярность):
N не равно m для многостадийных (сложных) реакций
Существуют реакции с нулевым и дробным n
Не существуют реакции с нулевой или дробной m
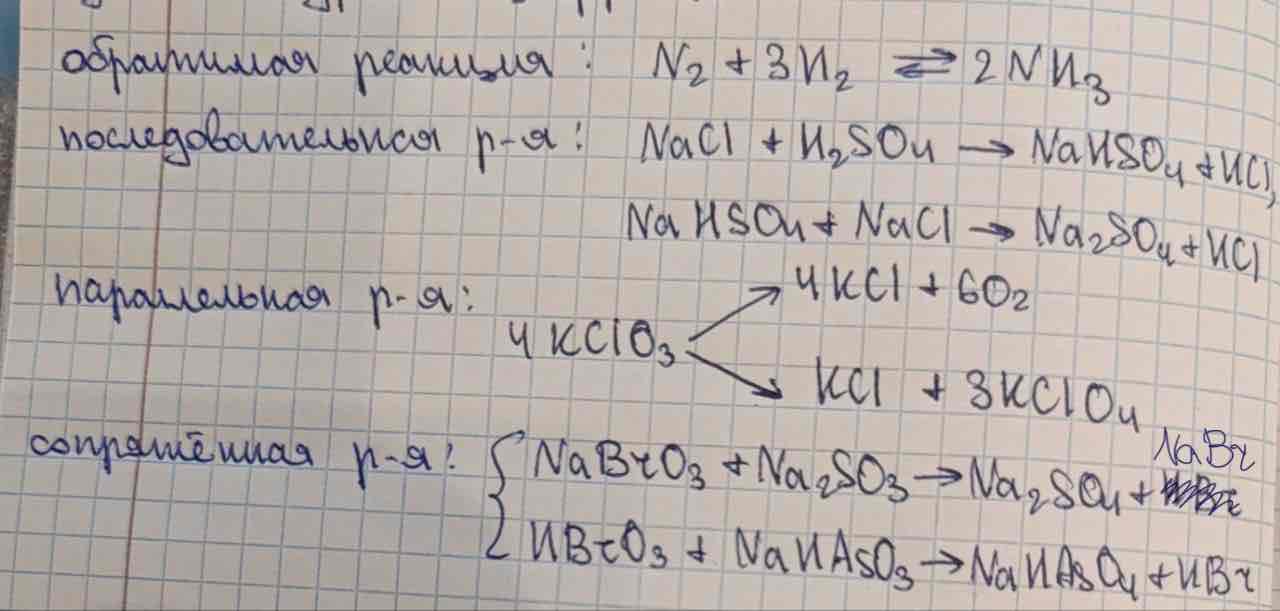
Простые и сложные реакции. Типы сложных реакций. Лимитирующая стадия реакции.
Простая реакция - реакция, протекающая в 1 стадию. Сложная реакция - многостадийная реакция.
Типы сложных реакций представлены на картинке.
Лимитирующая стадия х.р. - самая медленная стадия реакции. Скорость всей реакции определяется скоростью лимитирующей стадией данной реакции.

Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса.
При увеличении температуры увеличивается кинетическая молекул, следовательно, увеличивается скорость их движения и повышается вероятность их столкновения. Таким образом увеличивается скорость химической реакции.
Правило Вант-Гоффа: при увеличении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза.
Уравнение Аренниуса см.на картинке.

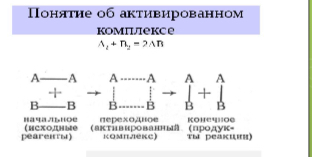
Энергия активации и активированный комплекс.
Энергия активации - минимальное количество энергии, необходимое для протекания реакции.
Активированный комплекс - промежуточное неустойчивое состояние вещества, характеризующееся большим запасом энергии.
Обратимые и необратимые реакции. Принцип Ле Шателье и его применение.
Необратимые химические реакции - реакции, протекающие только в 1 направлении.
Обратимые химические реакции - реакции, протекающие при одних и тех же условиях одновременно в двух противоположных направлениях.
Принцип Ле Шателье: при внешнем воздействии на систему, находящуюся в равновесии, равновесие сместится в сторону той реакции, которая компенсирует это воздействие.
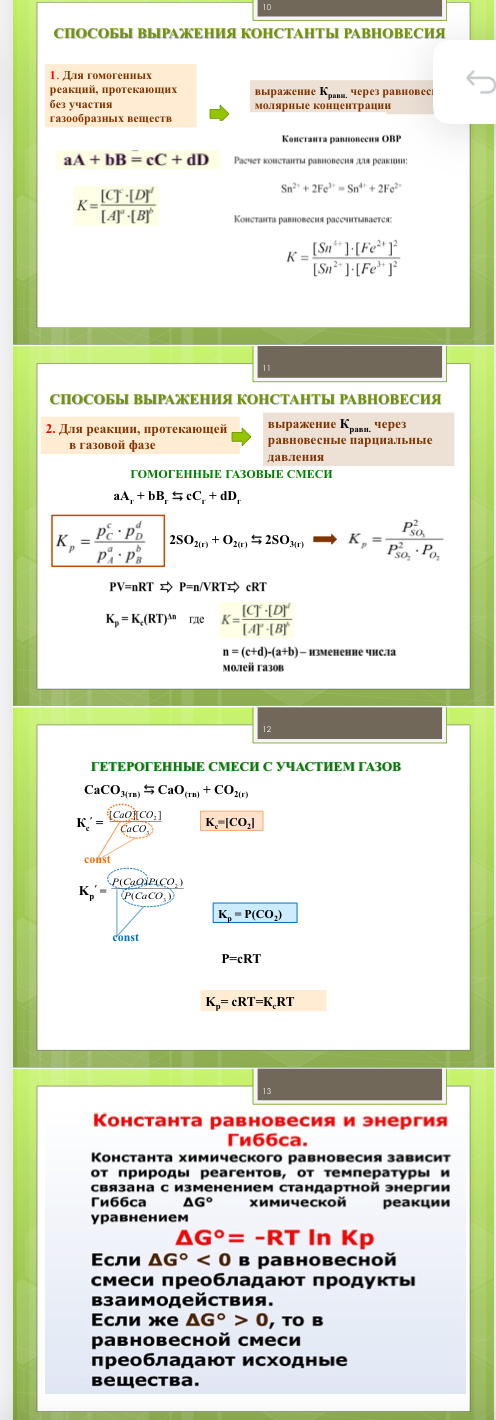
Константа равновесия. Способы её выражения для разных реакций. Связь константы равновесия и энергии Гиббса.
Константа равновесия показывает, во сколько раз прямая реакция протекает быстрее обратной при стандартных условиях. Это мера глубины протекания реакции: чем больше значение К, тем больше концентрации продуктов реакции, тем с большей полнотой проходит прямая реакция.
Катализ. Гомогенный и гетерогенный катализ, примеры. Автокатализ, примеры.
В случае гомогенного катализа катализатор и реагирующие в-ва образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазы.
Автокатализ - катализ химической реакции одним из её продуктов или исходных веществ.
Примеры на картинке.