Química bloque 2 Soluciones
1/22
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
23 Terms
Soluciones
Mezcla homogénea de dos o más sustancias que interactúan íntimamente a nivel de los átomos, moléculas o iones para formar un todo con sus características propias.
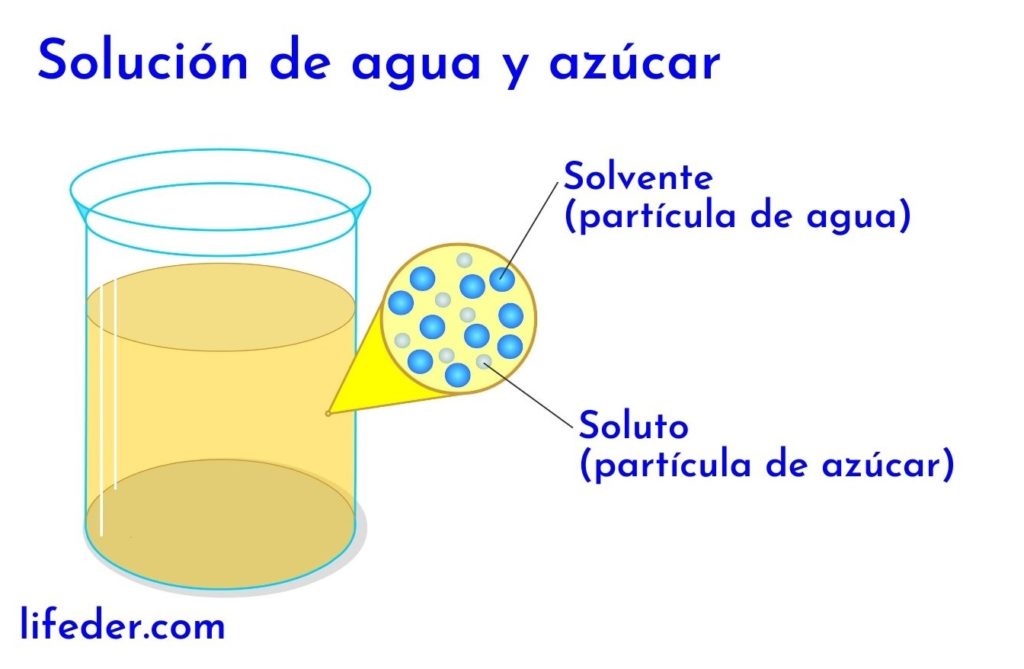
Concentración de una solución
Relación cuantitativa entre los componentes de una solución

CLASIFICACIÓN DE LAS SOLUCIONES CUALITATIVAS
Diluídas, Concentradas, Saturadas y Sobresaturadas
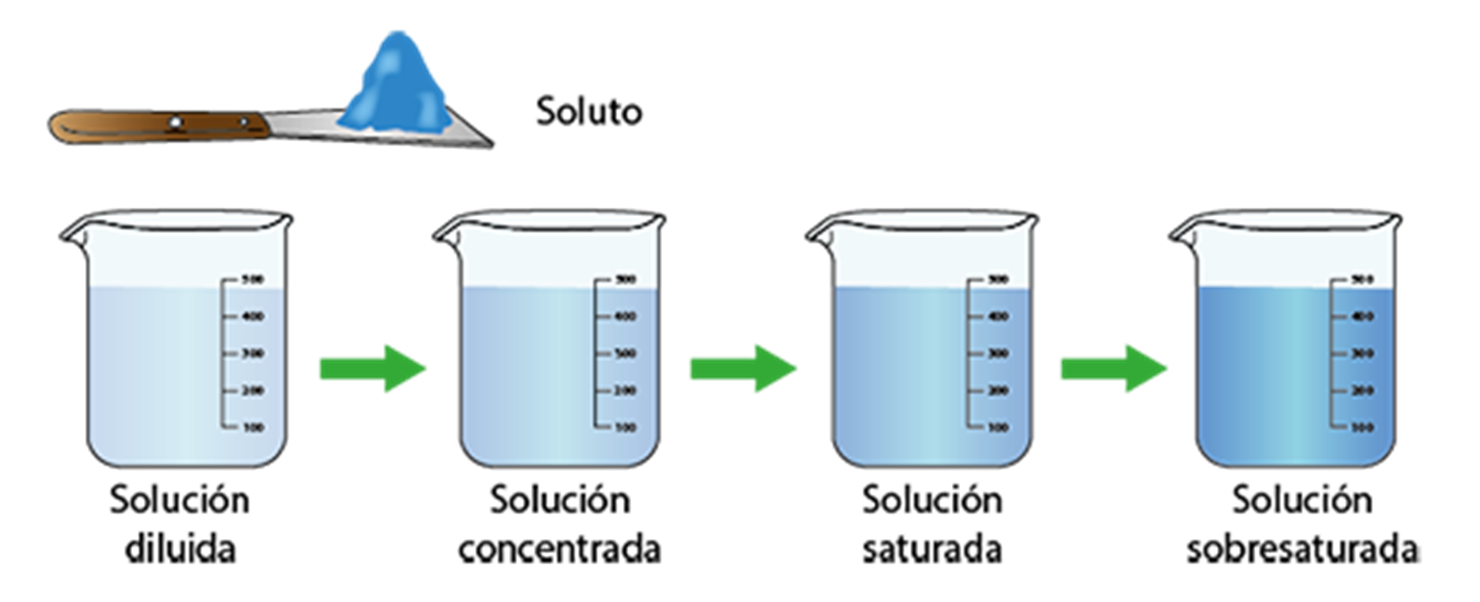
Solución diluída
Es la solución donde el soluto se encuentra en pequeña proporción
Solución concentrada
El soluto se disuelve en cantidades relativamente grandes con respecto al solvente
Solución saturada
El soluto se encuentra en la máxima cantidad que el solvente puede disolver a una temperatura y presión dadas
Solución sobresaturada
El soluto se encuentra en una cantidad mayor que el solvente puede disolver a una temperatura y presión específicas
¿Qué son las soluciones cuantitativas?
Son aquellas soluciones en las que se debe tener una cantidad exacta del soluto y del solvente en su preparación.
Clasificación de las soluciones cuantitativas
Porcentuales, Partes por millón Y Molaridad
Solución porcentuales en masa
El soluto se encuentra en estado sólido en la solución, Indica la masa de soluto presente por cada 100 unidades de masa de solución.
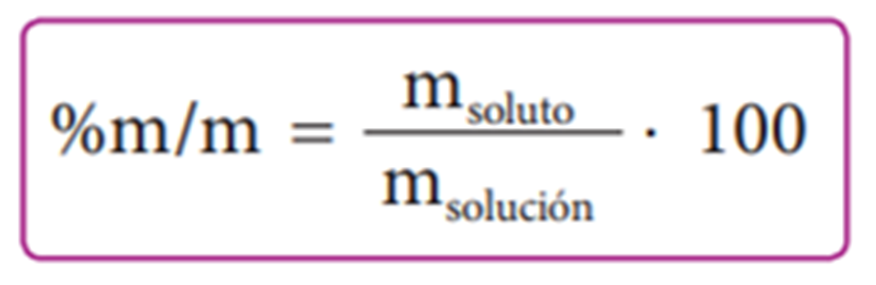
Expresión para porcentaje en masa
Para calcular el porcentaje en masa de una solución, la masa de soluto y la masa de solución deben expresarse en la misma unidad. Es frecuente expresar la masa en gramos. La concentración de la solución expresada de esta manera se designa como % m/m, resultando la siguiente expresión:
Solución porcentuales en volumen
El soluto y el solvente se encuentran en estado líquido en la solución
Expresión para porcentaje en volumen
Al determinar el porcentaje en volumen de una solución, el volumen de soluto y el volumen de solución deben expresarse en la misma unidad, por ejemplo en mililitros.
La concentración de la solución expresada de esta manera se designa
como % V/V, resultando la siguiente expresión:

Solución Partes por millón
El soluto se presenta en cantidades de la milésima parte de un gramo con respecto al solvente, pero también existen otras soluciones donde el soluto se presenta en cantidades de la milésima parte de un gramo con respecto al solvente y al calcular la concentración, ya sea en porcentaje en masa o volumen, los resultados son diminutos
Expresión para partes por millon

Molaridad
La concentración molar, también llamada molaridad, expresa la cantidad química de soluto por litro de solución.
Expresión para molaridad
es necesario dividir la cantidad de soluto presente en una muestra de solución entre el volumen de esta, expresada en litros. La concentración de la solución expresada de esta manera se designa con la letra M. Resulta así la siguiente expresión:
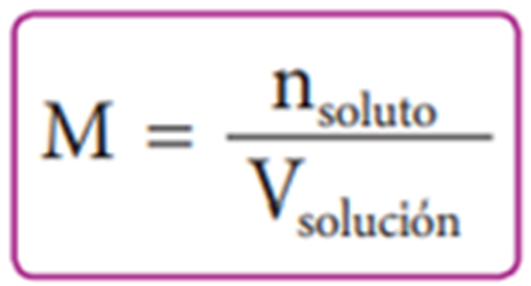
NOM-052-SEMARNAT-2005
“Sustancias químicas que han perdido, carecen o presentan variación en las
características necesarias para ser utilizados, transformados o comercializados
respecto a los estándares de diseño o producto originales”.
Características
químicas de
peligrosidad
Clasificación
corrosivo
Reactivo
Explosivo
Tóxico
Inflamable
Características
biológicas de
peligrosidad
Clasificación:
Punzocortante
Sangre
Patológicos
No anatómicos
Características
radiactivas de
peligrosidad
Material con
radiaciones
arriba del
límites
saludables o
que afectan al
medio ambiente
Normalidad
Molalidad
medida de la concentración de un soluto en una solución y se utiliza cuando se requiere tener un control de la temperatura. Mol entre kg