Structure et fonction des proteines
1/76
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
77 Terms
En fonction de la taille des chaines, quels sont les noms des differents polymeres d’acides amines ?
n = 1 → acide amine
n = 2-30 → oligopeptide
n > 30 → polypeptide
Qu’est ce qu un acide amine essentiel et lesquels le sont ?
Un acide amine qui ne peut pas etre bien synthetise par l’organisme et doit etre apporte par l’alimentation.
On retrouve les 9 suivants :
Phe
Val
Trp
Thr
Ile
Met
His
Leu
Lys
Ou retrouve t on generalement les acides amines hydrophiles et hydrophobes dans la proteine ?
hydrophiles retrouves a l exterieur de la proteine
hydrophobe a l’interieur de la proteine
Quels sont les acides amines polaires/hyrdophile ?
Asp
Glu
His
Lys
Arg
Ser
Thr
Asn
Gln
Tyr
Que peut on dire des acides amines avec une chaine laterale comprenant un groupe OH ? (hydroxyle)
Sont importants pour la phosphorylation
Le codon start code pour quel acide amine ?
La methionine
Que peut on dire sur l’absorbance de la lumiere de certains aa ?
Les aa avec chaines laterales aromatiques (Trp, Tyr et Phe) absorbent la lumiere a 280 nm. Cela permet de quantifier la concentration de chacun dans un echantillon, sachant que l’absorption est la plus forte pour Trp et la plus faible pour Phe
Que peut faire la cysteine avec son S ?
Elle peut s oxyder pour former un pont disulfuer avec un autre cysteine du meme ou d’un autre polypeptide
Qu’est ce qu une proteine ?
Assemblage de un ou plusieurs polypeptides avec une structure 3D bien definie. Elle peut contenir des composants non polypeptidiques
Quelle est la MM moyenne d’un aa ?
113 Da
Qu’est ce que le proteome et qu’en est il de celui de l’homme ?
Ensemble de toutes les proteines exprimees dans un organisme et celui de l’homme se compose de 30’000 proteines
A quoi servent les enzymes ?
Proteines qui catalysent les reactions chimiques dans la cellule
A quoi servent les proteines de structure ?
Fournissent une solidite structurelle aux cellules (cytosquelette) et tissus
A quoi servent les proteines motrices ?
Proteines connectees au cytosquelette qui permettent le mouvement des cellules
A quoi servent les proteines de transport ?
Servent au transfert de molecules a travers les membranes cellulaires
A quoi servent les proteines de signalisation ?
A reguler toutes les activites intra et extra cellulaires
Que definit la fonction d’une proteine ?
Sa structure 3D
Qu’est ce que la structure primaire d’une proteine ?
La sequence d’acides amines du debut a la fin de la molecule
Est ce qu’on definit un sens a une proteine ?
Oui, directionnalite partant du N-terminal au C-terminal
Que retrouvons nous dans le squelette de la proteine ?
NH — CαH — C=O — NH …
Comment s’appelle la liaison en acides amines et ou se trouve elle ?
Liaison peptidique. Resulte d’une deshydratation. liaison entre C=O et NH
Qu’est ce qui est caracteristique de la liaison peptidique ?
Structure de resonnance (On a donc les atomes autour tous dans le meme plan)
Qu’est ce que la structure secondaire et quelles sont les differentes existentes ? (noms)
Structure 3D localement adoptee par certains segments d’un polypeptide.
helice α
feuillet beta
coude
boucle
Quelle proportion de la proteine adopte une structure secondaire ?
60%
Quelles sont les differentes liaisons non-covalentes intervenant dans la proteine ? Lesquels stabilisent quoi ?
liaisons ioniques
liaisons H → stabilisent la structure secondaire
interaction Van der Walls, surtout dipole induit - dipole induit entre chaines hydrophobes
Quelle est la structure de l’helice α ? (liaison H, rotation complete, pas, position chaine laterale R, sens de tour, N et C terminus)
Liaison H se fait entre le O du C=O et le H du N--H des acides amines n et n+4. OH appartient a l aa plus haut dans l’helice.
3.6 aa par tour complet
0.54 nm de pas
chaine lateral R pointe a l’exterieur
peut etre left handed (tourne anti-horaire) ou right-handed (horaire) → right handed majoritaire
N terminus en haut, C terminus en bas
Decris la structure du feuillet beta (chaines laterales, liaisons, R)
normalement 4-5 brins regroupes lateralement
structure stabilisee par liaisons CO et NH du squelette du brin voisin
angles fixes qui donnent une geometrie ondulee du feuillet
les R sortent alternativement du plan (en haut, en bas, en haut, …) → permet d’avoir une face hydrophile et une hydrophobe → amphipatique
les brins n’appartiennent pas forcement au meme polypeptide
Quelle est l’orientation relative entre les brins beta ?
parallele (N→C meme orientation
anti-paralleles (N→C opposes)
Dans quelles structures secondaires peut on trouver la proline ?
Pas dans les helices α ni dans le feuillet beta a cause de l’angle fixe de la proline qui perturberait ces deux configurations.
On retrouve notamment la proline dans les coudes
Dans quelle structure secondaire peut on retrouver la glycine ?
Dans les coudes car c’est petit et peu aller un peu partout
C’est quoi les coudes ?
Virages composes de 3-4 acides amines qui reorientent la chaine peptidique.
Comment un coude est stable ?
Grace a la liaison H entre le CO du aa1 du coude et NH du aa4 du coude
C’est quoi une boucle ?
Reorientation mais plus longue avec des formes plus variees et moins bien definies
Ou retrouvons nous les coudes et les boucles dans les proteines ?
A leur surface car elles participent souvent aux interactions avec d’autre proteines et molecules
Qu’est ce que la structure tertiaire d’une proteine ?
Arrangement 3D du polypeptide complet
De quels sous ensemble est constitue la structure tertiaire d’une proteine ?
Constitue de domaines, a condition que la structure tertiaire soit au moins de 15 000 Da
Comment est stabilisee la structure tertiaire de la proteine et quelle partie des aa stabilisent ?
Grace aux interactions entre les chaines laterales des acides amines :
interactions hydrophobes
ioniques
liaisons H
Qu’est ce qu’un domaine ? Comment sont ils stabilises ?
Structure super-secondaire, un niveau d’organisation entre structure secondaire et tertiaire.
Ce sont des regions polypeptidiques d’une proteine, auto-stabilisee, qui forme une structure 3D et qui peut se replier independamment du reste. Les domaines d’une proteine peuvent avoir des fonctions differentes.
Les domaines peuvent contenir plusieurs motifs.
Qu’est ce qu’un motif structurel et quelle information nous donne t elle ?
Une petite structure 3D, situee entre la structure secondaire et tertiaire, mais plus petite qu’un domaine. Compose de seulement quelques elements de la structure secondaire.
Elle peut egalement nous donner des informations sur la fonction de la proteine
Qu’est ce que helice-boucle-helice ?
Un motif compose de trois elements de structure secondaire : 2 helices et une boucle.
Quelle est la fonction principale du Helice-boucle-helice ?
Permet de se lier au calcium. Creer le EF hand motif dans ce cas.
Comment se lient le motif helice-boucle-helice au calcium ?
Grace a la presence d’acides amines hydrophiles dans la boucle : Asn, 2 Asp, Thr et Glu
Les atomes d’O dans les acides amines hydrophiles, ainsi qu’une molecule H2O, se lient au calcium
Dans combien de proteines retrouve on le EF hand motif et quelle est la fonction de ces proteines ?
Dans plus de 100 proteines qui ont pour fonction de se lier au calcium
Dans quelle proteine retrouve on le motif EF hand ?
Dans la calmodunine, qui en a 4 et qui lui permettent d’induire une liaison avec sa proteine cible
Chez quelle autre type de proteine retrouve t on ce motif et quel est son nom specifique ?
On le retrouve dans les facteurs de transcription chez les eucrayotes, sous le nom de Basic Helix Loop Helix
Que regule le facteur de transcription bHLH chez les animaux ?
regulateurs du developpement embryonnaire dans la :
neurogenese
myogenese
developpement cardiaque
hematopoiese
D’ou vient le terme basique de bHLH ?
Du fait que les facteurs de transcription contiennent des acides amines basiques, afin de faciliter l’ancrage sur l’ADN grace aux phosphates -
Qu’est ce que coiled coil et on le retrouve ou ?
Un motif structurelle dans des proteines fibreuses.
De quoi est constitue coiled coil ?
De plusieurs helices alpha torsadees ensemble. On peut retrouver 2-7 helices alpha torsadees dans un coiled coil
Que peuvent faire les proteines qui ont le motif coiled coil ?
Les proteines peuvent s’auto-associer en oligomeres
Comment sont stabilises les helices alpha dans le motif coiled coil ?
Grace a des interactions hydrophobes entre les acides amines hydrophobes des 2 helices. Imaginons la chaine alpha constituee de aa : a, b, c, d, e, f, g, a, b, c … → les acides amines a et d seraient hydrophobes. Cela forme des helices amphiphathiques.
Il y a egalement des acides amines charges en positions e et g, de charges opposees, pour stabiliser d’avantage
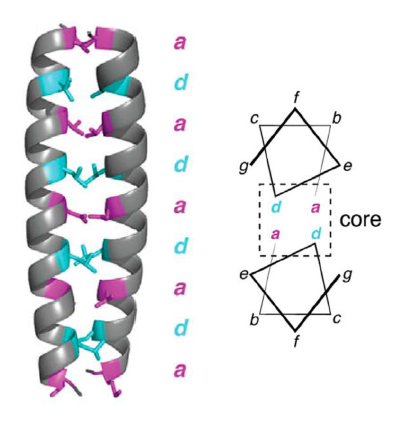

Qu’est ce que bZIP ?
Basic leucine zipper, un sous-type du motif coiled-coil qui se trouve dans de nombreuses proteines eucaryotes, comme des facteurs de transcription. Elle contient en plus une partie basique qui permet la dimerisation pour pouvoir se lier a l’ADN.
On retrouve les helices appelees c-Jun, c-Fos
Qu’est ce que le doigt de zinc ?
C’est un motif, qui lient l’ADN ou l’ARN
Quelle est la structure du doigt de zinc et sa fonction ?
Motif de 25 aa, avec une helice alpha et deux brins qui forment un feuillet beta. Les deux cysteines dans le feuillet beta et les deux Histines dans l helice alpha peuvent maintenir un ion de Zinc
Qu’est ce que la structure quaternaire ?
Association de plusieurs polypeptides grace a des liaisons non covalentes.
Est ce que y a que des liaisons non covalentes dans les structures quaternaires ?
Non, dans certains cas on retrouve des liaisons covalentes comme des ponts disulfures.
Quelle est la structure d’un anticorps ?
Forme a partir de deux chaines lourdes identiques et deux chaines legeres, reliees par des liaisons disulfides
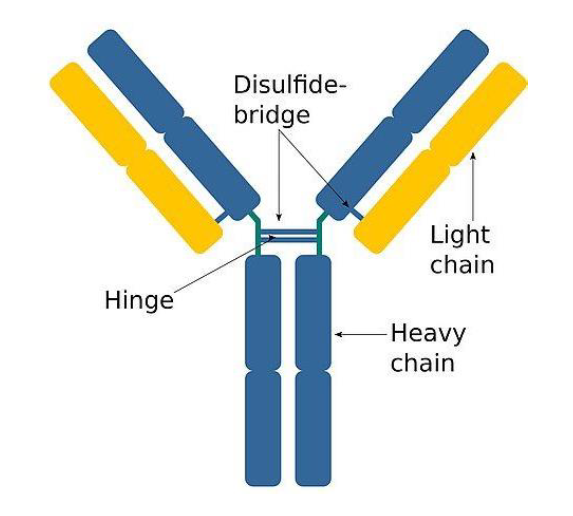

Comment se fixe un anticorps sur l’antigene ? Nom du site de liaison ?
Chaque bras d’un anticorps possede un site de liaison a l’antigene, CDR, qui est specifique d’un endroit de l’antigene, l’epitope.
De quoi est composee la region determinant la complementarite (CDR) ?
Composee de 6 boucles avec une sequence d’aa tres variable. Cette sequence est specifique de la surface d’un epitope
Comment se fixe l’anticorps a l’epitope ?
Grace a des interactions non covalentes entre les deux surfaces, comme liaisons H, hydrophobe, ionique
Que sont les globines et qu’elle est son orginine ?
Grande famille de proteines qui sont impliquees dans la liaison ou transport d’O2. Elle provient d’une proteine ancestrale qui pouvait se lier a l’oxygene.
Quels sont les differentes classes de proteines dans la famille de globines et leur characteristique ?
Hemoglobine → dans globules rouges et fixe O2 pour aller vers tissus
Myoglobine → fixe O2 dans tissus musculaires pour le stocker et l utiliser pendant la contraction musculaire
Leghemoglobine → dans les racines des legumineuses et fixe O2
Que peut on dire sur la structure des globines ?
Leghemoglobine et myoglobine ont une structure tertiaire alors que hemoglobine composee de 4 polypeptides donc structure quaternaire.
Les polypeptides de ces 3 globines sont tres semblables car il ya bcp d’aa semblables → structure tertiaire similaire
De quoi est compose la myoglobine ? (structures secondaires presentes et groupes non polypeptidiques)
70% helices alpha, avec un groupe heme
Quelle est la structure de l’hemolglobine ?
2 sous unites alpha
2 sous unites beta
un groupe heme par sous-unite
Les sous unites sont surtout composes d helices alpha
Qu’est ce qui est relie au Fe dans une hemoglobine ?
le groupe heme
l’histidine de la chaine polypeptidique, grace aux groupe aromatique de l’histidine
un O2 dans le cas oxygene
Quelle est la difference entre l’hemoglobine oxygenee est non oxygenee ?
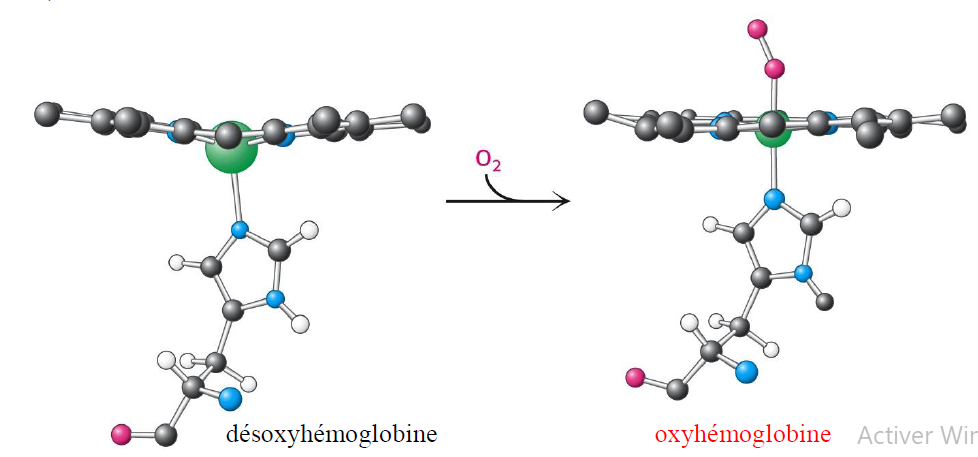
Desoxygene, le fer est un peu hors du plan de l’heme. Quand l’oxygene s’attache, il tire le fer vers le haut et ca tire l’histidine qui change la structure tertiaire et quaternaire de l’hemoglobine. Une rotation de 15° entre dimere alpha1beta1 et alpha2beta2

Dans quel ‘state’ sans oxygene et avec ?
tense sans et relax avec
Que peut on dire de l’affinite qu’a la myoglobine et l’hemoglobine pour l’oxygene ?
myoglobine : affinite constante
hemoglobine : affinite augmente par O2 ajoute. La constante de liaison K4 est 20x K1, qui K1 est difficile a lier.
Compare le fait que y a ait cet fixation cooperative avec un cas ou elle n’existerait pas. Decris le graphe de la saturation des hemoglobines en fonction de la pression partielle, avec l’oxygenation et relachement des O2.
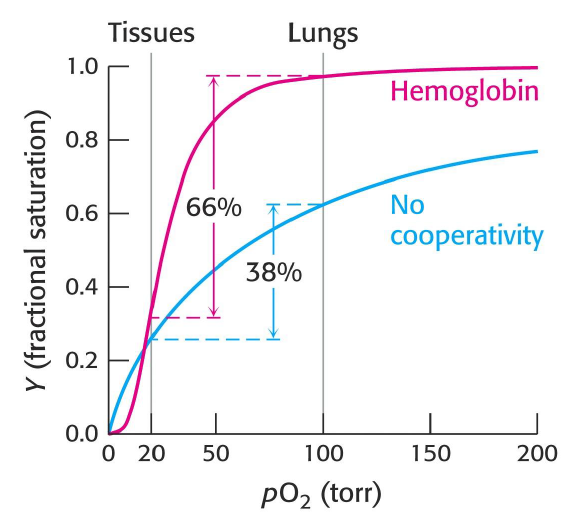

Pourquoi on n’utilise pas la myoglobine pour transporter l’O2 ? Decris son graphe.
La saturation se fait a pression tellement faible que la liberation d’O2 est tres basse. C’est pour cela que l’on l’utilise pour le stockage.
C’est quoi des machines moleculaires ? (taille et poids)
grand assemblage de proteines et autres elements
plus de 1MDa
30-300 nm (on voit au microscope)
Quelles sont les differentes manieres de determiner la structure des proteines ?
cristallographie a rayons X
resonance magnetique nucleaire
cyromicroscopie electronique
Alphafold (IA)
Quelle est l’etape cle de la cristallographie a rayons X ?
Modification des conditions afin d’obtenir des grands monocristaux
Quels sont les etapes de la cryomicroscopie electronique ?
Echantillon plonge dans cryogene pour congeler l’echantillon, vitrifiant l’eau pour eviter de former des cristaux de glace qui pourraient endommager la structure
Qu est ce qui est complique pour la cryoscopie electronique ?
dizaines de milliers de particules pour bonne qualite