chemie
1/67
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
68 Terms
Wat betekent polariteit in de scheikunde?
Een ongelijke verdeling van elektronen in een binding of molecuul, waardoor ladingsverschillen ontstaan. (een positieve en een negatieve kant).
Dit komt door elektronegativiteit = de kracht waarmee een atoom elektronen naar zich toetrekt.
Apolair (Elektronen zijn gelijk verdeeld) and polair (1 is sterker)
Wat is een edelgasconfiguratie in verkorte notatie?
je schrijft de elektronenconfiguratie met het voorgaande edelgas tussen blokhaken, bv. [Ne]3s²3p⁵.
Waaruit bestaat de kern van een atoom?
Uit nucleonen: protonen (p⁺, positief geladen) en neutronen (n⁰, ongeladen).
Wat is het atoomnummer (Z)?
Het aantal protonen; bepaalt het element en in een neutraal atoom ook het aantal elektronen.
Wat is het massagetal (A)?
Het totaal van protonen en neutronen: A = Z + N.
Wat zijn isotopen?
Atomen van hetzelfde element (zelfde Z) met een verschillend aantal neutronen (verschillend A).
Wat is de relatieve atoommassa (Ar)?
Het gewogen gemiddelde van de massa’s van alle natuurlijk voorkomende isotopen, uitgedrukt in u.
Wat is ionisatie-energie?
De benodigde energie om een elektron uit een atoom te verwijderen (vorming van een kation).
Wat is elektronenaffiniteit?
De energieverandering wanneer een atoom een elektron opneemt (vorming van een anion).
Wat zijn valentie-elektronen?
Elektronen in de buitenste schil; ze bepalen de chemische reactiviteit.
Hoe stelde Dalton het atoom voor?
Als ondeelbare, massieve bollen.
Wat was het model van Thomson?
Het krentenbol- of puddingmodel: positief geladen bol met negatieve elektronen erin “geplakt”.
Wat ontdekte Rutherford met het goudfolie-experiment?
Dat atomen een kleine, positief geladen kern hebben en grotendeels uit lege ruimte bestaan.
Wat stelde Bohr voor?
Elektronen bewegen in vaste, discrete schillen; overgang tussen schillen gaat gepaard met opname of emissie van energie (fotonen).
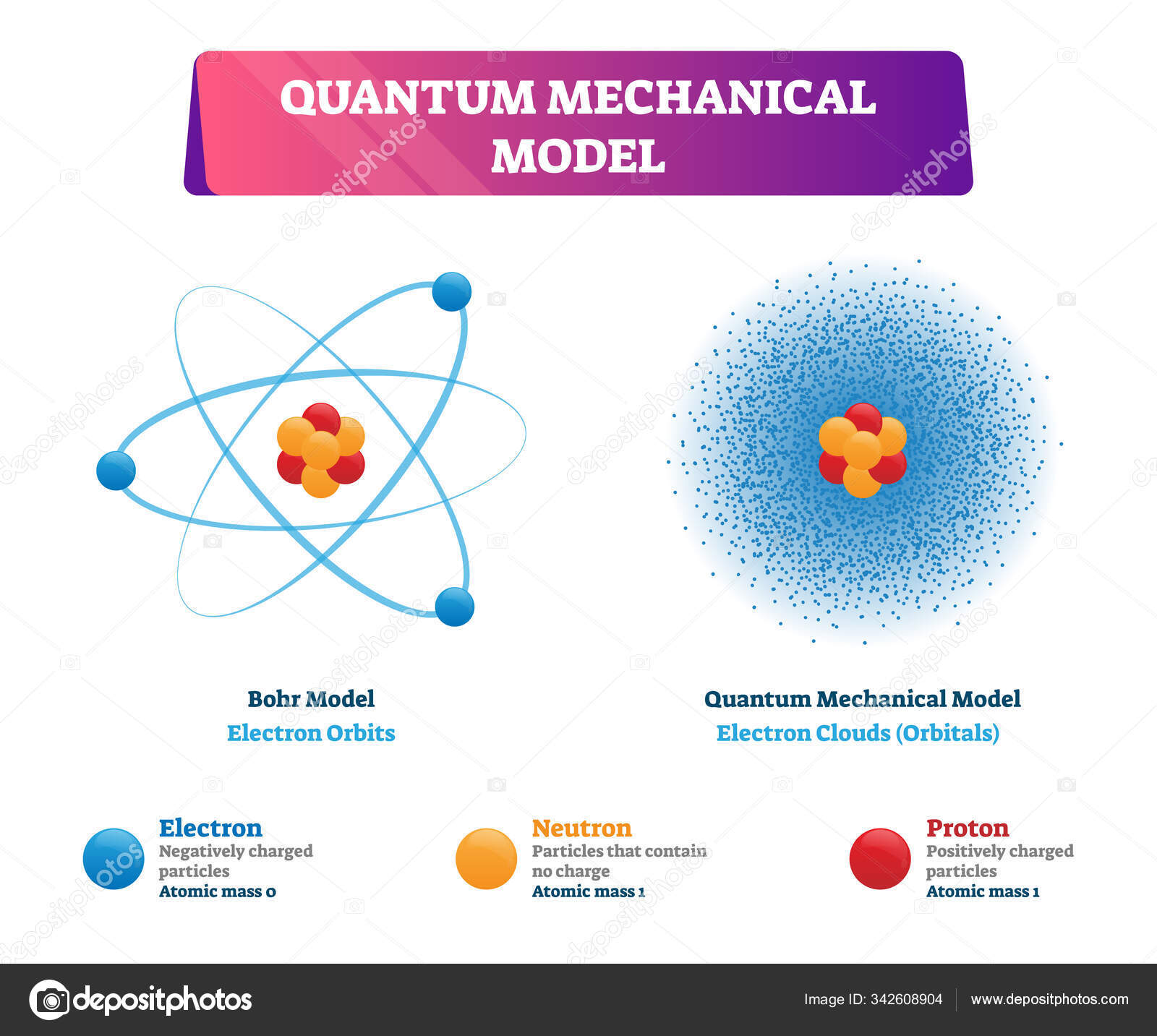
Wat zegt het moderne kwantummechanische model?
Elektronen bevinden zich in orbitalen: ruimten met de grootste waarschijnlijkheid, gebaseerd op golf-deeltje dualiteit.
Wat geeft het hoofdkwantumgetal (n) aan?
Het hoofdschilnummer/energieniveau (n=1,2,3,… of K,L,M,…).
Wat bepaalt het magnetisch kwantumgetal (ml)?
De oriëntatie van de orbitaal in de ruimte (−l tot +l).
Wat geeft het nevenkwantumgetal (l) aan?
De vorm van de orbitaal (s,p,d,f).
Wat beschrijft het spinkwantumgetal (ms)?
De spin van het elektron (±½).
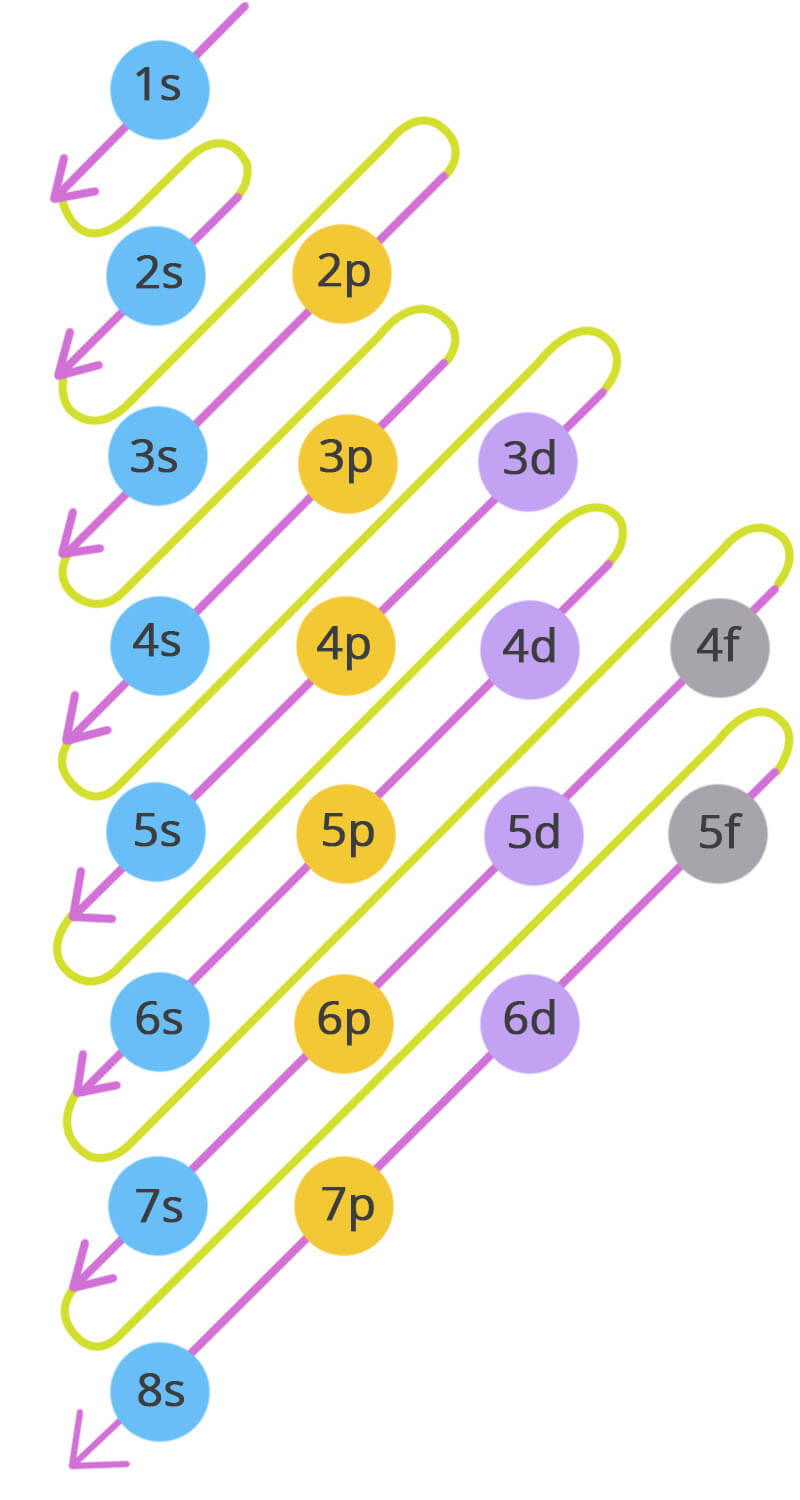
Wat is het Aufbau-principe?
Orbitalen worden gevuld in volgorde van stijgende energie (diagonalenregel).
Wat is de regel van Hund?
Elektronen bezetten eerst elk een aparte orbitaal in een subschil (met parallelle spin) voordat ze paren vormen.
Wat zegt het Pauli-verbodsprincipe?
Geen twee elektronen in een atoom mogen dezelfde vier kwantumgetallen hebben; per orbitaal maximaal 2 elektronen met tegengestelde spin.
Hoe is het atoommodel geëvolueerd?
Van Dalton’s bollen → Thomson’s puddingmodel → Rutherford’s kernmodel → Bohr’s schillenmodel → modern kwantummechanisch model.
Hoe worden elektronen beschreven in het moderne model?
Met vier kwantumgetallen (n, l, ml, ms).
Wat bepaalt de elektronenconfiguratie?
De regels van Aufbau, Hund en Pauli.
Waar hangt de chemische reactiviteit vooral van af?
Van de valentie-elektronen.
Wat zijn isotopen?
Atomen met hetzelfde aantal protonen (Z) maar een verschillend aantal neutronen (N).
Hoe ontstaan ionen?
Door het opnemen of afstaan van elektronen; afhankelijk van ionisatie-energie en elektronenaffiniteit.
Aufbau-principe (“opbouwprincipe”)
Betekent letterlijk opbouwen.
Elektronen vullen de orbitalen in volgorde van laagste naar hoogste energie.
Volgorde kun je onthouden met de diagonalenregel:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s …
Regel van Hund
Binnen een subschil (zoals 2p, die 3 orbitalen heeft) worden de elektronen zo veel mogelijk apart verdeeld voordat ze paren.
Dit minimaliseert afstoting tussen elektronen (want ze zijn negatief en stoten elkaar af).
Voorbeeld:
In een 2p-orbitaal kan je hebben:
Elektron 1: n=2, l=1, ml=0, ms=+½
Elektron 2: n=2, l=1, ml=0, ms=−½
Je ziet: alles gelijk behalve de spin.
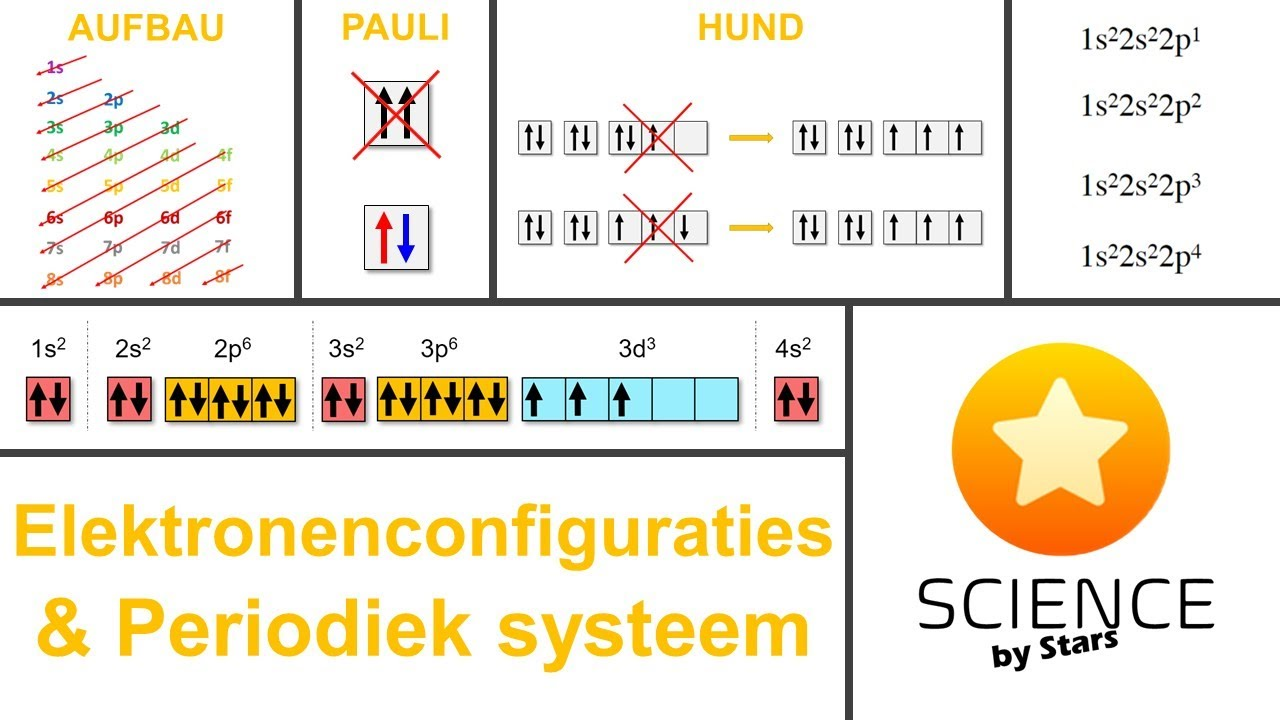
In 2p⁴ (zoals bij zuurstof): regel van hund
Eerst: ↑ ↑ ↑ (3 elektronen in 3 orbitalen, allemaal dezelfde spin).
Daarna: ↑↓ ↑ ↑ (het 4e elektron moet paren).
Pauli-verbodsprincipe
In één orbitaal kunnen maximaal 2 elektronen zitten.
Deze moeten altijd een tegengestelde spin hebben (↑↓).
Geen twee elektronen in een atoom kunnen precies dezelfde vier kwantumgetallen hebben (n, l, ml, ms).
korte samenvatting van Aufbau, Hund, Pauli
Aufbau → op volgorde van energie vullen.
Hund → eerst verdelen over lege orbitalen, dan pas paren.
Pauli → maximaal 2 elektronen per orbitaal, met tegengestelde spin.
relative lading van proton
+1
relatieve lading van neutron
0 (neutraal)
relatieve lading van elektron
-1
plaats van proton
kern
plaats van neutron
kern
plaats van elektron
mantel
aantal proton vinden
Z
aantal vinden Elektron
Z
aantal vinden Neutron
A - Z
massa bepaalt door
neutron en Proton
nuclide?
een specifieke kernsoort (vastgelegd door Z en N).

Isotopen
verschillende nucliden van hetzelfde element (zelfde Z, ander N).
koolstof-12, koolstof-13 en koolstof-14 zijn verschillende
koolstof-12, koolstof-13 en koolstof-14 zijn verschillende nucliden, maar ook isotopen van koolstof.
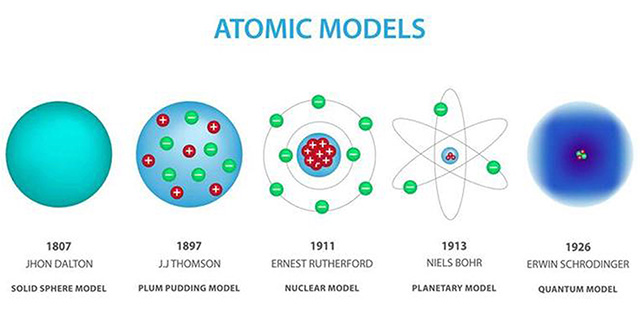
volgens Dalton (begin 19e eeuw)
Atomen = massieve, ondeelbare bollen.
Atomen van hetzelfde element zijn identiek in massa en eigenschappen.
Verschillen in massa en volume verklaren de verschillen tussen elementen.
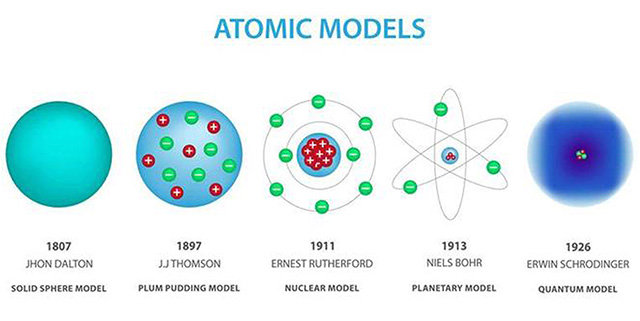
Thomson (ca. 1900, “krentenbolmodel”)
Atomen = bol van positieve lading (“grondmaterie”).
Daarin zitten negatieve elektronen “ingebed” (zoals rozijnen in een pudding).
Hij dacht dat de elektronen vooral aan de buitenkant zaten.
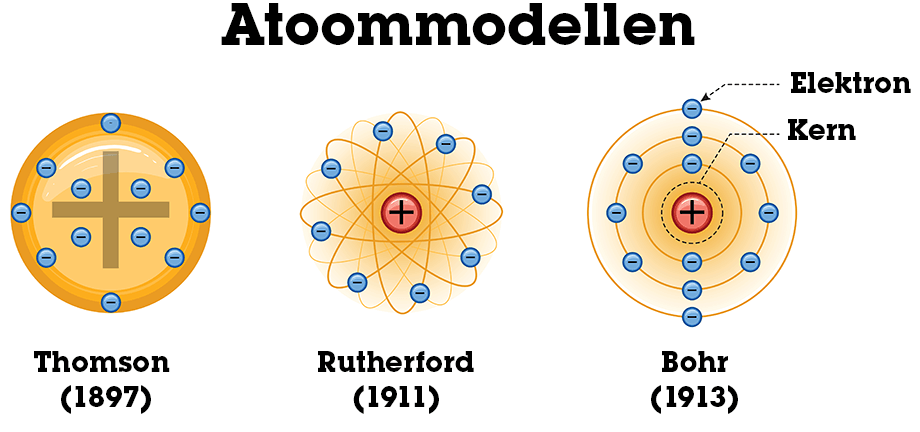
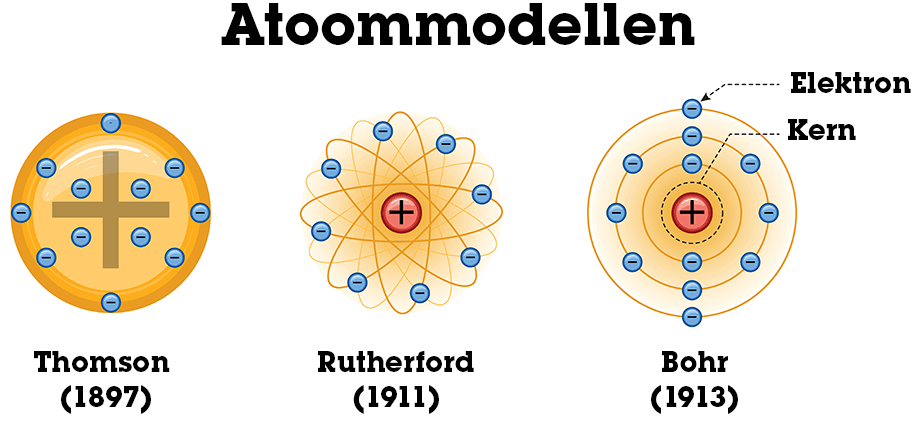
Rutherford (1911, goudfolie-experiment)
Ontdekte de atoomkern.
Atoom bestaat grotendeels uit lege ruimte.
In de kern: bijna alle massa en positieve lading.
Elektronen bewegen rond de kern, zoals planeten rond de zon → daarom ook wel “planetenmodel”.
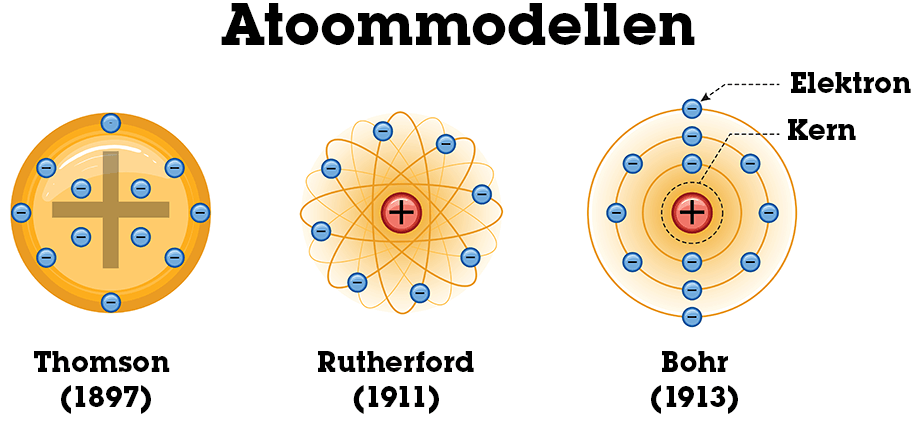
bohr
Bohr (1913)
Elektronen bewegen in vaste banen/energieniveaus rond de kern (K, L, M,…).
Ze kunnen alleen van baan veranderen door energie op te nemen of uit te zenden (als fotonen).
👉 “elektronenwolk”, maar dat hoort eigenlijk bij het moderne kwantummechanische model.
Modern kwantummechanisch model
Elektronen zitten niet meer in vaste banen, maar in orbitalen → ruimten waar je de grootste kans hebt om een elektron te vinden.
Dit noemen we de elektronenwolk.
(Kwantummechanisch) - Modern model (kwantummechanisch/golfmechanisch): Elektron bevindt zich in een orbitaal (ruimte met grootste waarschijnlijkheid). Gebaseerd op de dualiteit golf-deeltje.
Hoofdkwantumgetal (n)
- Hoofdkwantumgetal (n): Geeft de hoofdschil en het energieniveau aan (n=1,2,3,… of K,L,M,…).
Nevenkwantumgetal (l)
- Nevenkwantumgetal (l): Beschrijft de subschil of vorm van de orbitaal (l=0,1,2,3 → s,p,d,f).
Magnetisch kwantumgetal
(ml)
- Magnetisch kwantumgetal (ml): Bepaalt de oriëntatie van de orbitaal in de ruimte (van −l tot +l).
Spinkwantumgetal (ms)
- Spinkwantumgetal (ms): Beschrijft de spin van het elektron (±2/1).
Aufbau-principe
- Aufbau-principe: Orbitalen worden gevuld in volgorde van stijgende energie (gebruik de diagonalenregel).
Regel van Hund
- Regel van Hund: Elektronen vullen eerst elk een aparte orbitaal binnen dezelfde subschil met parallelle spin voordat ze paren vormen.
Pauli-verbodsprincipe
- Pauli-verbodsprincipe: Geen twee elektronen in een atoom mogen dezelfde vier kwantumgetallen hebben. In één orbitaal → maximaal 2 elektronen met tegengestelde spin.
Edelgasconfiguratie
- Verkorte notatie: Gebruik de edelgasconfiguratie van het voorgaande edelgas om de kernschillen te vervangen, bv. [Ne]3s23p5.
Nucleonen
- De kern bestaat uit nucleonen: protonen (p+, positief geladen) en neutronen (n0, ongeladen).
Atoomnummer (Z)
- Atoomnummer (Z): Aantal protonen (bepaalt het element). In een neutraal atoom ook gelijk aan het aantal elektronen.
- Massagetal
- Massagetal (A): Som van het aantal protonen en neutronen (A=Z+N).
Isotopen
- Isotopen: Atomen van hetzelfde element (zelfde Z) maar met een verschillend aantal neutronen (verschillend A).
Relatieve atoommassa
- Relatieve atoommassa (Ar): Gewogen gemiddelde van de massa's van alle natuurlijk voorkomende isotopen (uitgedrukt in u).
Ionisatie-energie
- Ionisatie-energie: De benodigde energie om een elektron uit een atoom te verwijderen (vorming van een kation).
Elektronenaffiniteit
- Elektronenaffiniteit: De energieverandering wanneer een atoom een elektron opneemt (vorming van een anion).
Valentie-elektronen
- Valentie-elektronen: Elektronen in de buitenste schil, bepalen chemische reactiviteit.