Chapitre 1 : Le rôle du glucose et de la glutamine dans la progression cancéreuse
1/185
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
186 Terms
Le métabolisme de la glutamine
Sur quels deux piliers repose la croissance tumorale ?
→ L’activation de signaux mitogéniques et l’approvisionnement en briques moléculaires.
Quels récepteurs transmettent les signaux des facteurs de croissance ?
→ Les récepteurs à activité tyrosine kinase (RTK).
Quelles voies de signalisation sont activées par les RTK ?
→ ERK : Ras→Raf→MAP kinase (ERK)
→ PI3K (phosphatidylinositol 3-kinase)
Vers quel régulateur central convergent ERK et PI3K ?
→ mTOR.
Quel est le rôle principal de mTOR dans les cellules cancéreuses ?
→ Contrôler un programme métabolique pro-anabolique.
Que retrouve-t-on dans la plupart des cancers ?
La plupart des cancers présentent des mutations activatrices des régulateurs principaux (K-Ras, H-Ras, N-Ras, B-Raf, la sous-unité p110α de PI3K et les RTK) ou de leurs effecteurs en aval (tels que les kinases Akt et PDK1), ou des mutations inactivatrices des régulateurs négatifs de ces protéines.
Pourquoi les cellules tumorales ont-elles besoin d’un flux continu de nutriments ?
→ Pour soutenir une prolifération rapide.
Quels sont les principaux substrats métaboliques requis par les cellules tumorales ?
→ Le glucose, la glutamine et les lipides.
Quel est le rôle principal de ces nutriments dans la cellule tumorale ?
→ Fournir des précurseurs biosynthétiques plutôt que de l’ATP.
Pourquoi le glucose est-il central dans le métabolisme tumoral ?
→ Il alimente de nombreuses voies biosynthétiques.
Quelle enzyme convertit le glucose en glucose-6-phosphate ?
→ L’hexokinase.
Dans quelle voie le G6P peut-il entrer pour produire du NADPH ?
→ La voie des pentoses phosphates.
À quoi sert le NADPH dans la cellule tumorale ?
→ Au contrôle du stress oxydatif et à la synthèse lipidique.
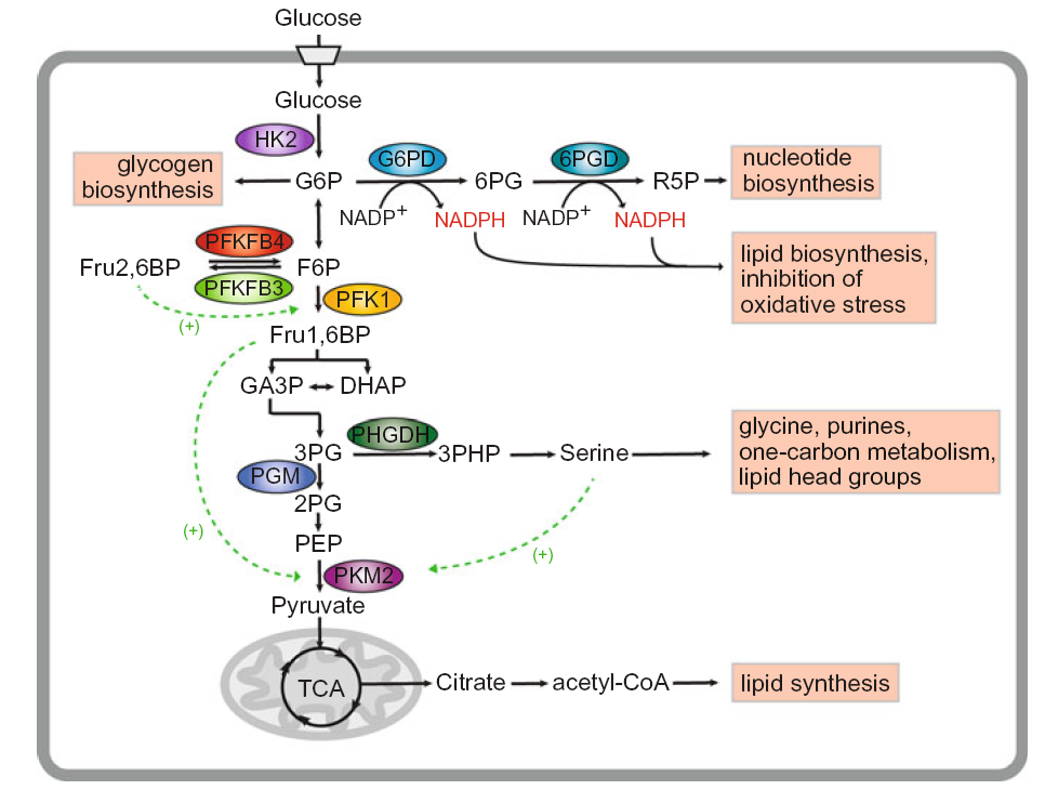
Quel métabolite de la PPP est nécessaire à la synthèse des nucléotides ?
→ Le ribose-5-phosphate.
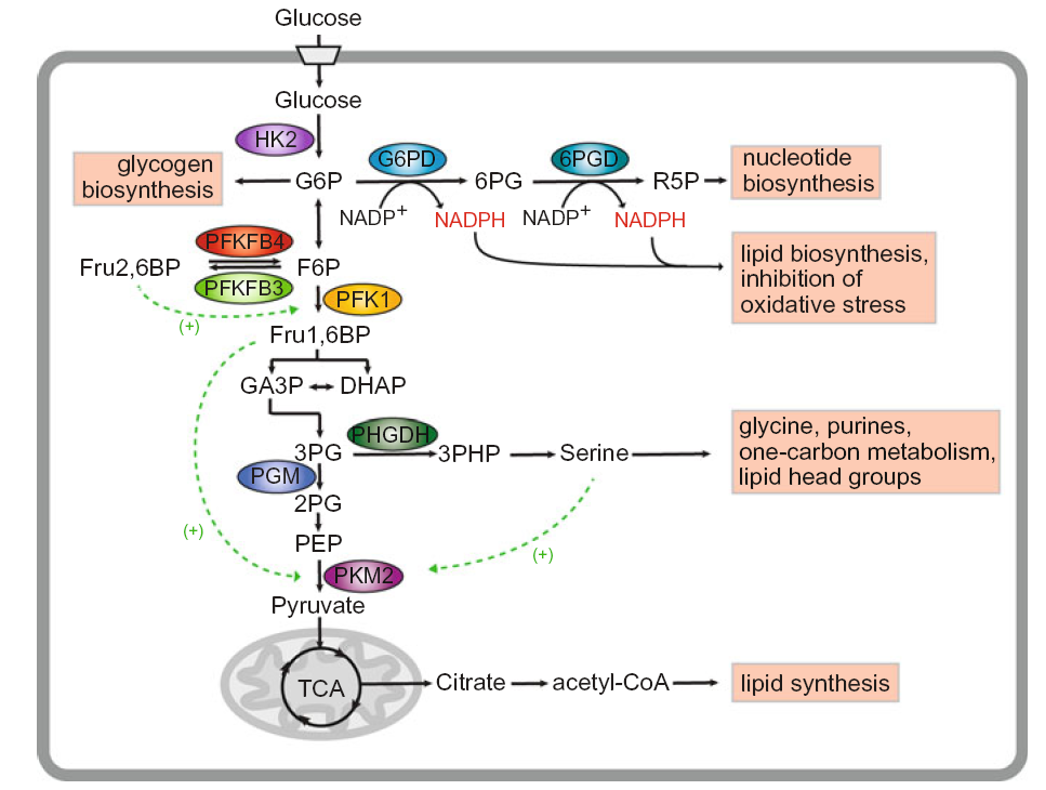
Comment le glucose contribue-t-il à la synthèse des acides aminés non essentiels ?
→ Via la branche sérine dépendante de PHGDH à partir du 3-phosphoglycérate.
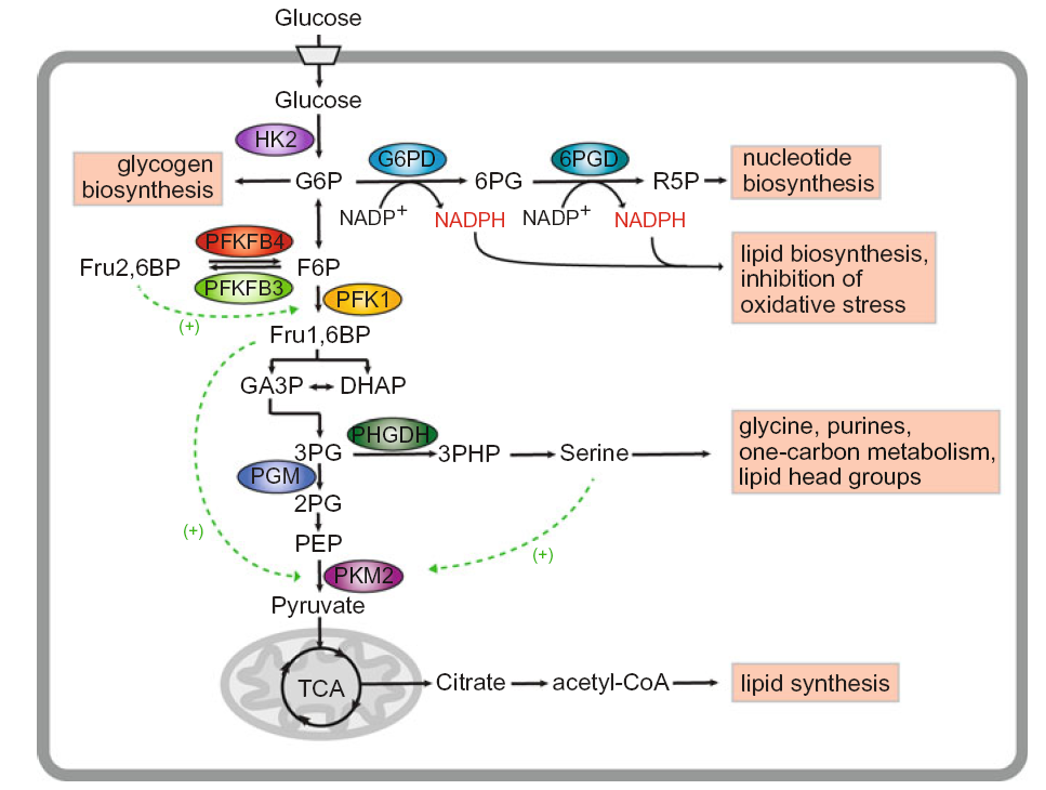
Quels métabolites sont produits à partir de la sérine ?
Glycines, purines et le métabolisme “one-carbon” (cycle folate-méthionine), etc.
À quoi servent les unités carbone issues du cycle folate-méthionine ?
→ À la méthylation et à la synthèse nucléotidique.
Quelles enzymes glycolytiques sont surexprimées dans les cellules cancéreuses ?
→ PFKFB3/4 et PKM2.
Quel est l’effet de PKM2 sur le devenir du pyruvate ?
→ Elle limite son entrée dans la mitochondrie.
Pourquoi les cellules cancéreuses maintiennent-elles un flux glycolytique élevé ?
→ Pour favoriser l’anabolisme.
Pourquoi les cellules tumorales privilégient-elles la glycolyse ?
→ Pour produire des briques biosynthétiques plutôt que de l’ATP.
Comment appelle-t-on cette préférence métabolique ?
→ L’effet Warburg.
Comment la voie PI3K/AKT influence-t-elle la glycolyse ?
→ Elle augmente la disponibilité du glucose via les transporteurs GLUT.
→ Elle augmente l’expression de l’hexokinase et PFK1
Quel est le rôle normal de la voie LKB1–AMPK ?
→ Répondre au stress énergétique et freiner l’anabolisme.
Que se passe-t-il avec LKB1–AMPK dans de nombreux cancers ?
→ Elle est inactivée.
Quelle conséquence métabolique entraîne l’inactivation d’AMPK ?
→ La levée d’un frein métabolique majeur.
→ Normalement, elle inhibe PFK1
Quel est le rôle de p53 sur le métabolisme lorsqu’il est fonctionnel ?
→ Il exerce une action anti-glycolytique.
Comment p53 agit-il sur les transporteurs GLUT ?
→ Il en diminue l’expression.
→ Il diminue aussi l’expression de l’hexokinase
Quelle protéine métabolique est activée par p53 pour réduire la glycolyse ?
→ TIGAR.
Comment TIGAR réduit-il la glycolyse ?
→ En diminuant le fructose-2,6-bisphosphate qui diminue l’activité de PFK1
Quel métabolisme p53 favorise-t-il à l’inverse de la glycolyse ?
→ La phosphorylation oxydative.
Quel rôle p53 joue-t-il dans l’anaplorèse ?
→ Il la favorise via la malate déshydrogénase.
L’anaplorèse désigne l’ensemble des réactions métaboliques qui reconstituent les intermédiaires du cycle de Krebs.
Quelle est la conséquence métabolique majeure de la perte de p53 ?
→ La bascule vers une glycolyse de type Warburg.
Quel oncogène est un régulateur majeur du métabolisme tumoral ?
→ MYC.
Comment MYC agit-il sur le métabolisme cellulaire ?
→ Il réoriente massivement la cellule vers l’anabolisme.
Quels processus sont stimulés par MYC ?
→ La transcription, la biogenèse mitochondriale et la synthèse protéique, la glycolyse, l’anaplorèse et la glutaminolyse.
Pourquoi MYC est-il qualifié de “chef d’orchestre” métabolique ?
→ Il coordonne l’ensemble des flux nécessaires à la croissance tumorale.
Quel est le rôle central de MYC dans la régulation métabolique tumorale ?
Coupler le métabolisme du glucose à celui de la glutamine.
Quels transporteurs sont induits par MYC pour augmenter l’entrée des nutriments ?
→ GLUT1 pour le glucose et SLC1A5 pour la glutamine.
Vers quelle voie est majoritairement dirigé le glucose sous contrôle de MYC ?
→ La glycolyse.
Pourquoi le pyruvate entre-t-il peu dans la mitochondrie dans les cellules MYC-dépendantes ?
→ MYC induit PDK1 qui inhibe la pyruvate déshydrogénase impliquée dans la décarboxylisation oxydative
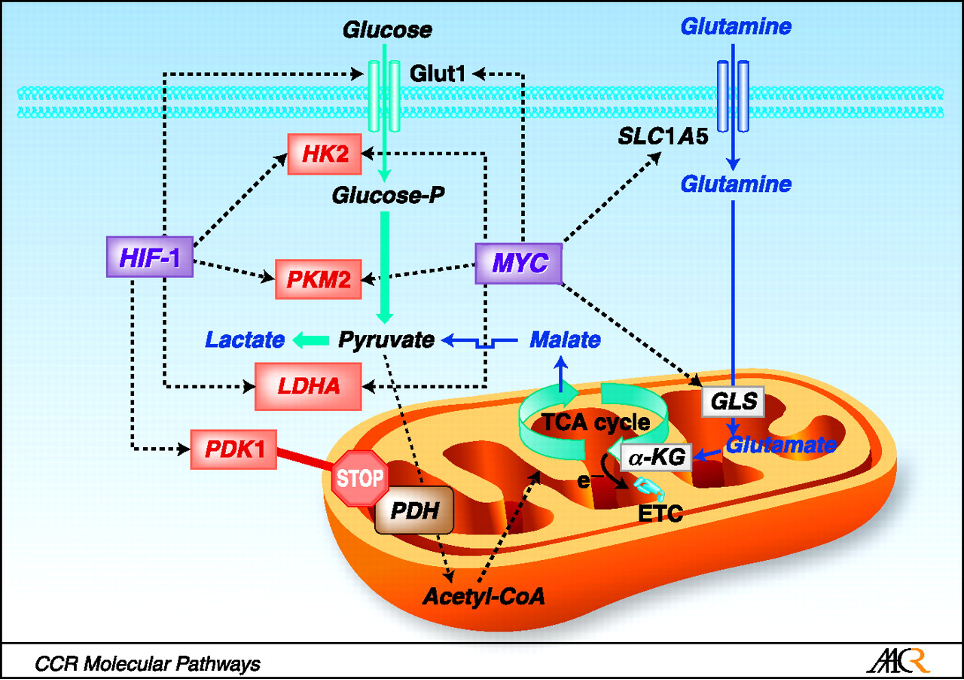
Quelle est la conséquence de l’inhibition de la PDH ?
→ Une production accrue de lactate.
Quelle enzyme initie la glutaminolyse ?
→ La glutaminase (GLS).
Quel métabolite est produit à partir de la glutamine par GLS ?
Glutamate
En quel métabolite clé du cycle de Krebs le glutamate est-il converti ?
→ L’α-cétoglutarate.
Quel est le rôle principal de l’α-cétoglutarate dans la cellule tumorale ?
→ Il permet de réalimenter le cycle de Krebs lorsque l’entrée du pyruvate est limitée.
Pourquoi parle-t-on d’anaplorèse glutamine-dépendante ?
→ Parce que la glutamine devient la principale source de carbone pour maintenir le cycle TCA fonctionnel.
Pourquoi cette anaplorèse est-elle essentielle à la prolifération ?
→ Elle soutient la synthèse lipidique, nécessaire à la formation de nouvelles membranes cellulaires et donc la prolifération quand l’activité mitochondriale est altérée.
Qu’explique la notion de “glutamine addiction” ?
→ Les cellules cancéreuses deviennent dépendantes de la glutaminolyse pour survivre et proliférer.
Quelle est la différence fonctionnelle majeure entre PKM1 et PKM2 ?
→ PKM1 est l’isoforme constitutivement active, favorisant une glycolyse complète et une entrée efficace de pyruvate dans la mitochondrie pour la production d’ATP.
→ PKM2 est une isoforme à activité plus faible, modulable, et beaucoup mieux adapté aux besoins biosynthétiques de la cellule proliférative.
Dans quels types de cellules PKM1 est-elle principalement exprimée ?
→ Dans les tissus différenciés à forte demande énergétique.
Pourquoi PKM2 est-elle privilégiée dans les cellules prolifératives ?
→ Son activité réduite permet l’accumulation d’intermédiaires glycolytiques utilisables pour la biosynthèse.
Quel est le rôle de MYC dans le contrôle du splicing de PKM ?
→ MYC active des facteurs de splicing qui favorisent l’expression de PKM2.
Quels facteurs de splicing sont impliqués dans ce basculement ?
→ hnRNPA1, hnRNPA2 et PTB/hnRNPI.
→ Ils se fixent sur les éléments régulateurs de PMK
Quel exon est inclus pour produire PKM2 et pourquoi est-ce important ?
→ L’exon 10, car il confère à l’enzyme une activité adaptée aux besoins anaboliques.
→ L’exon 9 est lié à PMK1.
Vers quelles voies sont redirigés les intermédiaires glycolytiques accumulés ?
→ La synthèse des nucléotides, des acides aminés et des lipides.
Quel rôle joue l’hypoxie dans la régulation de PKM2 ?
→ HIF-1α stabilise et renforce l’expression de PKM2.
Comment la voie PI3K/AKT/mTOR contribue-t-elle à ce remodelage ?
→ Elle augmente l’expression de facteurs de splicing favorables à PKM2.
Quelle est la conséquence globale de ces voies convergentes ?
→ L’imposition d’un programme métabolique pro-prolifératif commun.
Quel changement métabolique caractérise le passage d’une cellule quiescente à une cellule proliférative ?
→ Le passage d’une phosphorylation oxydative efficace à une glycolyse élevée couplée à la glutaminolyse.
Quel est le devenir principal du glucose dans les cellules cancéreuses ?
→ Il est majoritairement converti en lactate malgré la présence d’oxygène.
(Effet Warburg).
Quel est le rôle fondamental de la glutamine dans ce contexte ?
→ Maintenir la biosynthèse et le fonctionnement du cycle de Krebs.
Pourquoi le métabolisme est-il considéré comme un programme actif dans le cancer ?
→ Parce qu’il est directement contrôlé par les oncogènes et indispensable à la prolifération.
Glutamate et métabolisme des acides aminés
Pourquoi le métabolisme des acides aminés est-il essentiel pour la cellule ?
→ Les acides aminés servent à la synthèse protéique mais aussi comme sources de carbone et d’azote pour de nombreuses voies métaboliques.
→ Ils peuvent produire aussi des corps cétoniques, du glucose ou des carbohydrates.
De quoi sont composés les acides aminés ?
D’un groupe amine, un groupe acide et un radical.
Quelle est la première étape majeure du catabolisme des acides aminés ?
→ La déamination, qui correspond au retrait du groupe amine.
Qu’est-ce que la déamination oxydative ?
→ Une réaction qui enlève le groupe amine tout en oxydant l’acide aminé.
Quelle enzyme catalyse principalement la déamination oxydative dans la mitochondrie ?
La glutamate déshydrogénase dans la mitochondrie.
Dans quel autre compartiment cellulaire peut avoir lieu la déamination oxydative ?
→ Dans les peroxysomes via des amino-acid oxydases.
Quelles autres formes de déamination existent en dehors de l’oxydation ?
→ Les déaminations directes non oxydatives comme la déshydratation ou la désulfhydration.
Quels sont les deux produits principaux de la déamination d’un acide aminé ?
→ De l’ammoniaque (NH₃) et un acide α-cétonique.
Qu’est-ce que la transamination ?
→ Le transfert du groupe amine d’un acide aminé vers un acide cétonique (a-cétoglutarate).
Quelles enzymes catalysent les réactions de transamination ?
→ Les aminotransférases comme AST (GOT) et ALT (GPT) présentes dans le cytoplasme ou dans les mitochondries.
GOT : glutamate oxoglutarate transaminase
GPT : glutamate pyruvate transaminase
ASP : Aspartate aminotransférase
ALT : Alanine aminotransférase
Quel cofacteur est indispensable aux aminotransférases ?
→ Le pyridoxal phosphate (PLP), dérivé de la vitamine B6, groupe prosthétique.
Quel est le principe général du mécanisme de transamination ?
→ Le groupe amine est temporairement porté par le PLP avant d’être transféré à un accepteur.
Quelle forme intermédiaire est générée lorsque le PLP accepte un groupe amine ?
→ Le pyridoxamine-phosphate.
Quel est l’accepteur du groupe amine le plus fréquent dans les transaminations ?
→ L’α-cétoglutarate.
Quel acide aminé est formé lorsque l’α-cétoglutarate capte un groupe amine ?
→ Le glutamate.
Que devient l’acide aminé donneur après la transamination ?
→ Il est converti en son acide α-cétonique correspondant.
Pourquoi le glutamate est-il central dans le métabolisme des acides aminés ?
→ Il centralise l’azote provenant de la majorité des acides aminés.
Comment le glutamate libère-t-il l’azote accumulé ?
→ Elle relie la transamination à la libération d’ammoniaque.
Comment appelle-t-on le couplage transamination–déamination ?
→ La transdésamination.
Que deviennent les squelettes carbonés après déamination ?
→ Ils rejoignent les grandes voies métaboliques centrales.
Quels acides aminés ont une dégradation simple vers le cycle de Krebs ?
→ L’alanine, le glutamate et l’aspartate.
À quels intermédiaires métaboliques ces acides aminés sont-ils convertis ?
→ Le pyruvate, l’α-cétoglutarate ou l’oxaloacétate.
Pourquoi certains acides aminés ont-ils une dégradation plus complexe ?
→ Ils nécessitent plusieurs étapes avant d’atteindre des intermédiaires centraux.
Quels acides aminés suivent des voies de dégradation complexes ?
→ La tyrosine, la lysine ou le tryptophane.
Que se passe-t-il pour la phénylalanine ?
La phénylalanine est transformé en tyrosine avant sa dégradation.
Qu’est-ce qu’un acide aminé glucogénique ?
→ Un acide aminé dont le catabolisme permet la production de glucose.
Qu’est-ce qu’un acide aminé cétogénique ?
→ Un acide aminé produisant de l’acétyl-CoA ou des corps cétoniques.
→ Les cétones sont des petits lipides produits à partir d’acétyl-Coa. Les longs lipides peuvent être produits à partir de citrate.
Que sont les acides aminés mixtes ?
→ Des acides aminés pouvant être à la fois glucogéniques et cétogéniques.
Quels sont les grands devenirs des squelettes carbonés ?
→ Production d’énergie (oxydation), synthèse lipidique ou néoglucogenèse.
Dans quelle situation la néoglucogenèse à partir des acides aminés est-elle particulièrement importante ?
→ En situation de jeûne.
Quels cofacteurs sont requis pour l’activité de la glutamate déshydrogénase ?
→ NAD⁺ ou NADP⁺.
Pourquoi la glutamate déshydrogénase est-elle un point de régulation redox ?
→ Son activité dépend de l’état oxydoréducteur de la cellule.
Quel lien existe entre métabolisme azoté et métabolisme énergétique ?
→ Ils sont connectés via le glutamate et le cycle de Krebs.
Pourquoi le glutamate est-il qualifié de carrefour métabolique ?
→ Il relie le métabolisme des acides aminés, l’azote, le TCA et le redox cellulaire.
Métabolisme de la glutamine