Hemoglobin
1/25
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
26 Terms
Vai trò hemoglobin
Vận chuyển O2 từ phổi đến mô(chính)
Vận chuyển CO2 từ mô đến phổi(phụ có thể có các quá trình khác hỗ trợ)
Nồng độ Hemoglobin và lượng oxy vận chuyển
Nồng độ Hemoglobin 15g/dL,mỗi gam hemoglobin vận chuyển max 1,34ml O2→100ml máu vận chuyển tối đa 20ml O2
chromprotein(protein có màu)
Protein tạp có nhóm ngoại là chất màu gồm 2 loại:
porphyrinoprotein:có nhóm ngoại porphyrin
CHromoprotein nhóm ngoại ko porphyrin
porphin
Gồm 4 vòng pyrol nối với nhau bằng 4 cầu nối methenyl(-CH=)

porphyrin
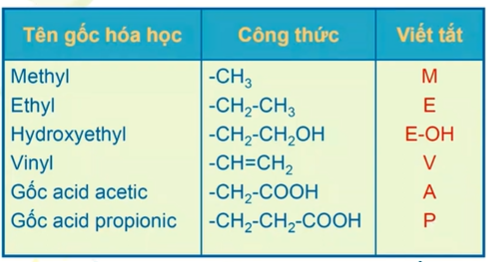
Porphin gắn với các nhóm thế(gốc hóa học)
Cấu tạo hem của hemoglobin
Hem gồm:
Fe
protoporphyrin IX :porphin+nhóm thế MVMVMPPM
→Cấu trúc Hem chia làm 2 bên:methyl và vinyl kị nước mạnh→tạo lk bền vững; acid propionic ưa nước→giúp Hb tan tiếp xúc O2 trong nước
Teichman test
khi máu ra môi trg→Fe2+ trong heme bị oxh thành Fe3+(hematin)→Pháp y cho tác dụng nhiệt độ và acid acetic →Nếu máu người sẽ tạo tinh thể tím(hemin)
→rất nhạy chỉ cần 0.001ml máu hay 0.1mg Hb
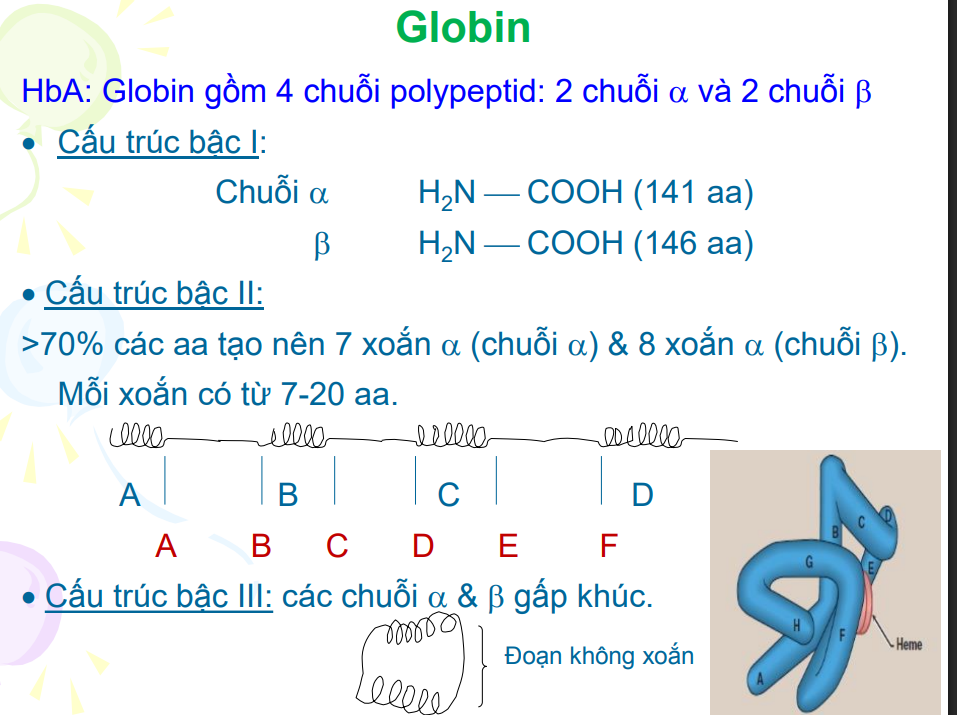
Globin của HbA
Có 2 chuỗi alpha 2 chuỗi beta
Chuỗi alpha→7 xoắn alpha
Chuỗi beta→8 xoắn alpha
Các bệnh đột biến điểm globin
Hồng cầu hình liềm(HbS) biến đổi chuỗi beta globin Glu(6)→Valine
Bệnh hemoglobin C(HbC) biến đổi chuỗi beta globin Glu(6)→lysine
Sự kết hợp heme và globin
Heme sẽ nối với 1 chuỗi globin bằng liên kết phối trí của Fe2+ với N của histidine E7,F8→1 bán đvị Hb
Tổng Fe có 6lk:4 phối trị, 2 CHT
Khi Oxy gắn vào heme thì Fe vẫn hoá trị 2 do nó gắn chứ ko oxh

Thành phần hemoglobin người lớn
HbA(95-97%):2 chuỗi alpha và 2 chuỗi beta
HbA2(2-3,5%):2 alpha và 2 delta
HbF(Fetal thai nhi)(1-2%):2 alpha và 2 gamma
sự gắn O2
1.Cấu hình T(tense)→deoxyHb có ái lực thấp với O2
2.Cấu hình R(relaxed)→oxyHb có ái lực cao với O2
→càng gắn nhiều O2 ái lực càng cao
2,3DGP kiểm soát sự gắn O2 do nó giữ Hb ở cấu hình T
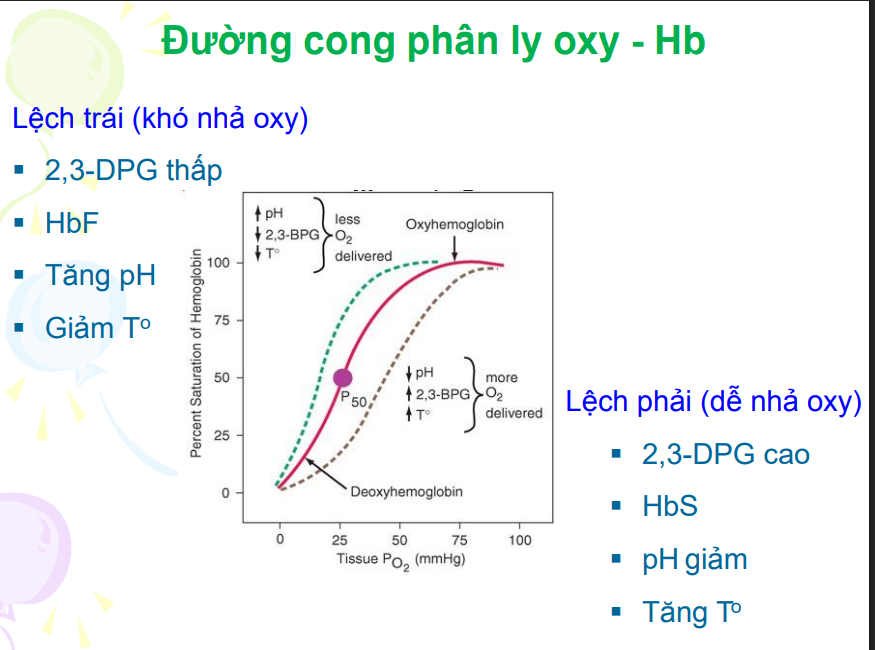
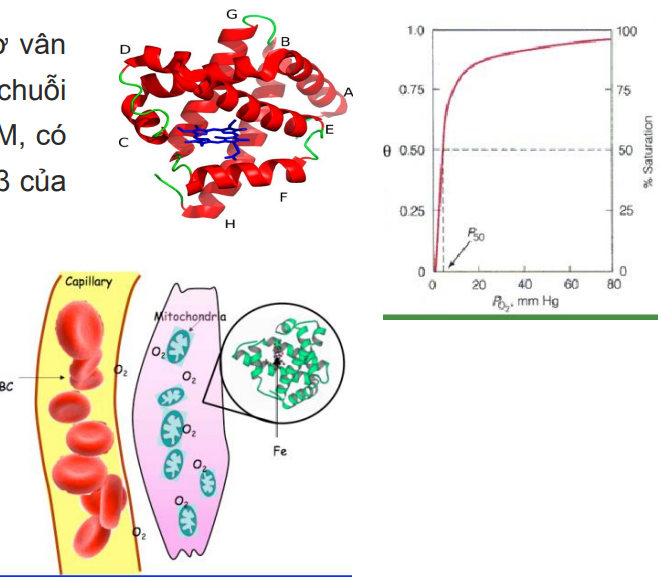
Đường cong phân ly Hb-O2
Tên khác là barcroff
Biểu thị tỉ lệ giữa phân áp O2 và SpO2(%oxy bão hòa)
P50
Phân ấp O2 mà tại đó spO2 là 50%
Khi P50 lệch phải →ái lực Hb-O2 giảm
Khi P50 lệch trái→ái lực Hb-O2 tăng
Nhận xét vùng PO2 cao trong đường cong phân ly Hb-O2
Đường cong tà→sự thay đổi PO2 không dẫn đến sự thay đổi đáng kể spO2
→Giúp con người thích nghi với các môi trường có PO2 khác nhau→Duy trì lượng O2 giao cho mô
Nhận xét vùng PO2 thấp trong đường cong phân ly Hb-O2
Đường cong dốc→sự giảm nhỏ về PO2 dẫn đến giảm mạnh spO2→Ở mô có pO2 thấp→Lượng O2 thải cho mô nhiều
Ở trạng thái nghỉ ngơi
Lượng O2 tiêu thụ chỉ khoảng 25%
Cách tính ta lấy tỉ lệ lượng O2 đã mất/lg O2 ban đầu(ml O2/100ml máu)
Còn tính lg thì ta đo pO2 sau đó suy ra spO2, ta biết 100ml máu chứa 15g Hb và 1gHb vận chuyển tối đa 1,34ml O2.
ml O2=15.1,34.spO2
Hiệu ứng bohr
Ái lực O2 tỉ lệ nghịch nồng độ H+(tỉ lệ thuận PH)
Mô CO2 tăng→H+ tăng→Ph giảm→giảm ái lực HbO2
Phổi CO2 giảm→H+giảm→Ph tăng→tăng ái lực HbO2
Các yếu tố tác động đường cong phân ly HbO2
Làm lệch phải(giảm ái lực):
2,3DPG
PH giảm
HbS
Tăng to
Myoglobin
Sắc tố hô hấp của cơ gồm 1 chuỗi polypeptide và nhân hem,chuỗi pp cấu trúc tương tự beta globin(8 xoắn alpha)
Ái lực Mb cao hơn Hb nhiều→giành O2 của Hb dự trữ cho cơ
Vận chuyển CO2 thải ra từ mô
CO2 hòa tan(7%)
CO2 vận chuyển trực tiếp bằng gắn thẳng Hb(23%)
Vận chuyển gián tiếp qua Hb(70%)
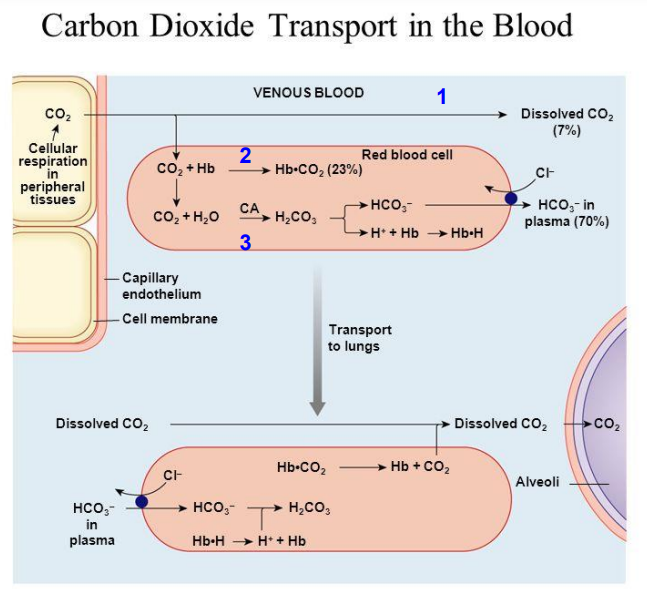
Vận chuyển trực tiếp CO2
CO2 gắn vào NH2 tự do của globin trong Hb
R-NH2+CO2<->RNH2.CO2
Vận chuyển gián tiếp CO2
Dựa trên pư H2O+CO2<->H2CO3<->H++HCO3- enzyme CA(carbonic anhydrase) xúc tác
Ở mô CO2→H++Hb→Hb.2H, H+ gắn vào histidine(146) tận cùng của beta globin, đồng thời giải phóng O2
Ở phổi ngược lại và CO2 thải ra qua phế nang
Ngộ độc CO
Do đốt cháy ko hoàn toàn
CO có ái lực với Hb gấp 210 lần O2→đẩy O2 ra khỏi Hb→ chỉ 0,1% CO cũng nguy hiểm
Methemoglobin(MetHb)
Hb có heme chứa Fe3+ do Fe2+ bị oxy hóa
Trong cơ thể luôn có 1 số chất oxh heme nhưng cơ thể có enzyme hồi phục Fe2+
Trong cơ thể MetHb<1% bth, còn MetHb>1,5%→ko

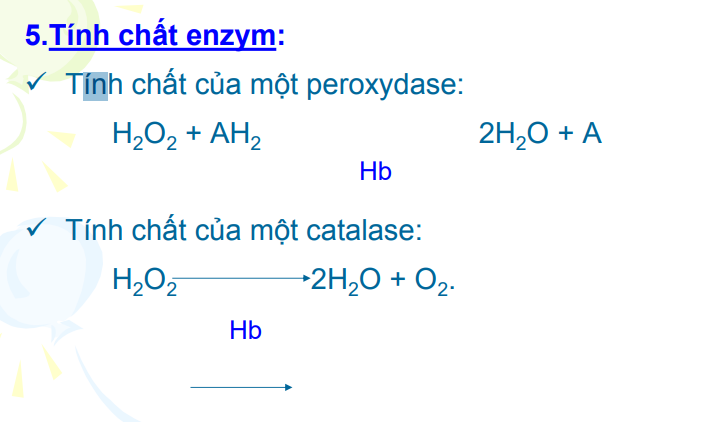
Hemoglobin còn có xúc tác enzyme
Có thể xúc tác như catalase hay peroxydase
→Xử lý H2O2