Chemie Teorie
1/28
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
29 Terms
Verduidelik, ten opsigte van elektrostatiese kragte tussen protone en elektrone, en ten opsigte van energie-oorwegings, waarom:
o Twee H-atome 'n H2-molekuul vorm
o He nie He vorm nie
Beskryf die reëls vir bindingvorming
Verskillende atome, elk met 'n ongepaarde valenselektron, kan hierdie elektrone deel om 'n chemiese binding te vorm, bv. twee H-atome vorm 'n H2 -molekuul deur die deling van 'n elektronpaar.
Verskillende atome met gepaarde valenselektrone, wat alleenpare genoem word, kan nie hierdie vier elektrone deel nie en kan nie 'n chemiese binding vorm nie, bv. geen binding vorm tussen twee He-atome nie.
Verskillende atome, met ongepaarde valenselektrone, kan hierdie elektrone deel en 'n chemiese binding vorm vir elke elektronpaar wat gedeel word. Die twee atome kan meervoudige bindings tussen hulle vorm. Indien twee elektronpare gedeel word, vorm 'n dubbelbinding, bv. tussen twee O-atome om O2 te vorm.
Atome met 'n leë valensskil kan 'n alleenpaar elektrone van 'n ander atoom deel om 'n koördinaat- of datief-kovalente binding te vorm, bv. in NH+4 word die alleenpaar van stikstof gedeel met H+ en in H3O+ word die alleenpaar van suurstof gedeel met H+.
Beskryf die vorming van die datief-kovalente (of koördinaat-kovalente) binding deur middel van elektrondiagramme deur NH+4 en H3O+ as voorbeelde te gebruik.
Noem die vernaamste beginsels wat in die VSEPA gebruik word:
o Molekulêre vorm word bepaal deur die afstotings tussen elektronpare teenwoordig in die valensskil van die sentrale atoom.
o Die getal elektronpare rondom die sentrale atoom kan bepaal word deur die Lewis-struktuur vir die molekuul te skryf.
o Die vorm van die molekuul is afhanklik van die getal bindingselektrongroepe (of atome gebind aan die sentrale atoom) en die getal alleenpare op die sentrale atoom.
o A word gebruik om die sentrale atoom voor te stel en X word gebruik om die terminale atome voor te stel.
o Daar is vyf ideale vorms wat voorkom wanneer daar GEEN alleenpare op die sentrale atoom is nie, maar SLEGS bindingspare.
Verduidelik hoe die verskil in elektronegatiwiteit (∆EN) tussen twee atome die aard van die binding wat tussen hulle gevorm word, beïnvloed.
Die karakter van ’n binding wissel van suiwer kovalent (wanneer ∆EN = 0) tot feitlik suiwer ionies (wanneer ∆EN > 3). Die verskille in elektronegatiwiteit is slegs ’n riglyn, en baie bindings het beide ioniese en kovalente karakter.
Verduidelik die verwantskap tussen bindingsenergie en bindingslengte
Bindings met 'n korter bindingslengte benodig meer energie om te breek as bindings met 'n langer
bindingslengte.
Verduidelik die verwantskap tussen die sterkte van 'n chemiese binding tussen twee atome en die Lengte van die binding tussen hulle.
Indien die aantrekkingskrag tussen twee atome sterk is, kom die kerne baie naby aan mekaar wat 'n korter bindingslengte tot gevolg het.
Verduidelik die verwantskap tussen die sterkte van 'n chemiese binding tussen twee atome en die Grootte van die gebonde atome.
Die bindingslengte tussen groter atome is langer as die bindingslengte tussen kleiner atome.
Verduidelik die verwantskap tussen die sterkte van 'n chemiese binding tussen twee atome en die Getal bindings (enkel, dubbel, tripel) tussen die atome.
Sterkte van bindings neem toe indien die getal bindings tussen atome toeneem, d.i.
tripelbindings is sterker as dubbelbindings wat sterker is as enkelbindings.
Noem en verduidelik die verskillende intermolekulêre kragte (Van der Waals-kragte):
Wedersyds geïnduseerde dipoolkragte/ Londonkragte: Kragte tussen nie-polêre molekule
Dipool-dipool-kragte: Kragte tussen twee polêre molekule
Dipool-geïnduseerde dipoolkragte: Kragte tussen polêre en nie-polêre molekule
Waterstofbindings: Kragte tussen molekule waarin waterstof kovalent gebind is aan stikstof, suurstof of fluoor – 'n spesiale geval van dipool-dipool-kragte
Ioon-dipoolkragte: Kragte tussen ione en polêre molekule
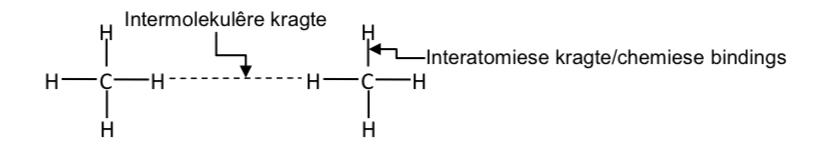
Beskryf die verskil tussen intermolekulêre kragte en interatomiese kragte (intramolekulêre kragte), deur 'n diagram van 'n groep klein molekule te gebruik, en in woorde.
Intramolekulêr (interatomies): sterk C–H kovalente bindings hou atome in een molekule bymekaar.
Intermolekulêr: swak London-dispersiekragte hou verskillende CH₄-molekules.
Noem die verwantskap tussen intermolekulêre kragte en molekulêre massa.
Vir nie-polêre molekule neem die sterkte van geïnduseerde dipoolkragte toe met molekulêre massa.
In nie-polêre molekules is die enigste intermolekulêre kragte London-dispersiekragte (geïnduseerde dipoolkragte).
Die sterkte van hierdie kragte neem toe soos die molekulêre massa (en dus die aantal elektrone) toeneem.
Groter molekulêre massa → meer elektrone → makliker polariseerbaar → sterker geïnduseerde dipole.
Gevolg: kook- en smeltpunte van nie-polêre molekules styg met toename in molekulêre massa.
Verduidelik die invloed van intermolekulêre kragte op kookpunt.
Kookpunt: Die temperatuur waarby die dampdruk van 'n stof gelyk is aan atmosferiese druk. Hoe sterker die intermolekulêre kragte, hoe hoër die kookpunt.
Verduidelik die invloed van intermolekulêre kragte op smeltpunt.
Smeltpunt: Die temperatuur waarby die vaste- en vloeistoffases van 'n stof in ewewig is. Hoe sterker die intermolekulêre kragte, hoe hoër die smeltpunt.
Verduidelik die invloed van intermolekulêre kragte op dampdruk.
Dampdruk: Die druk uitgeoefen deur 'n damp in ewewig met sy vloeistof in 'n geslote sisteem. Hoe sterker die intermolekulêre kragte, hoe laer die dampdruk.
Verduidelik die invloed van intermolekulêre kragte op oplosbaarheid.
Oplosbaarheid: Die eienskap van 'n chemiese stof in die vaste fase, vloeistoffase of gasfase (opgeloste stof) om in 'n oplosmiddel in die vaste fase, vloeistoffase of gasfase op te los om 'n homogene oplossing te vorm.
Wat is ‘n protolitiese reaksie
’n Protolitiese reaksie is ’n reaksie waarin ’n proton (H⁺) van ’n suur na ’n basis oorgedra word.
Monoprotiese Suur
‘n Suur skenk slegs een proton aan die reaksie
Diprotiese Suur
’n suur wat twee H⁺-ione per molekule kan afstaan tydens ’n protolitiese reaksie
Noem die verskillende inikators en hul eienskappe (kleu van suur/basis, kleur van ekwivalensie punte en pH reeks).
Doel van ‘n Indikator
’n Indikator is ’n stof wat deur ’n kleurverandering die eindpunt van ’n suur-basis reaksie aandui sodat neutralisasie kan plaasvind.
Verduidelik wat die pH-skaal is.
'n Skaal met nommers van 0 tot 14 wat gebruik word om die waterstofioon-konsentrasie uit te druk.
Beskryf die beweging van individuele gasmolekule
o Molekule is in konstante beweging en bots met mekaar en teen die kante van die houer.
o Daar is aantrekkingskragte tussen molekule.
o Molekule in 'n gas beweeg teen verskillende spoed.
Beskryf 'n ideale gas as 'n gas:
o Met identiese deeltjies van zero volume,
o Met geen aantrekkingskragte tussen deeltjies nie,
o Waarin alle botsings van molekule met hulself of met die kante van die houer volkome elasties is.
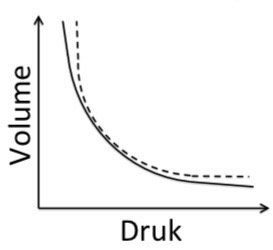
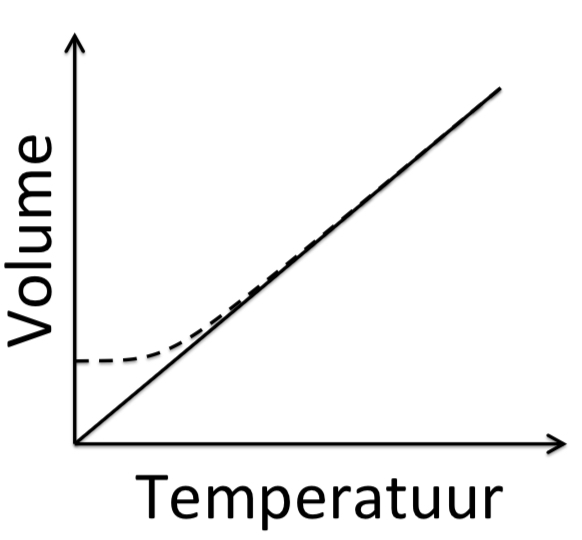
Verduidelik waarom werklike gasse afwyk van ideale gasgedrag by hoë drukke en lae temperature
Hoë druk: Volume van gasdeeltjies kan nie verwaarloos word nie → afwyking van ideale gas.
Lae temperatuur: Intermolekulêre kragte word belangrik → druk is laer as voorspel.
Noem die toestande waaronder werklike gasse ideale gasgedrag nader.
By lae druk: Deeltjies is ver van mekaar → volume van deeltjies word verwaarloosbaar.
By hoë temperatuur: Deeltjies beweeg vinnig → intermolekulêre kragte is onbeduided.
Teen LAE temperature (Afwyking vanaf Ideale Gasse)
Gas deeltjies beweeg stadiger, die aantal botsings verminder. Druk van die gas is laer as verwag.
Teen hoë druk (Afwyking vanaf Ideale Gasse)
Die volume van die gas partikels word onweglaatbaar in verhouding met die houer.
Toename in die intermolekulêre kragte tussen die deeltjies as gevolg van hul nabyheid, gas sal vervloei en die volume sal groter wees as wat verwag word.