ANALITIČKA KEMIJA 2
1/278
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
279 Terms
Jesu li u heterogenoj ravnotezi sve vrste u istoj fazi
nisu u istoj fazi

Kod heterogenih ravnoteza aktiviteti cistih tvari u cvrstom, tekucem stanju i aktiviteti otapala iznose..
Iznose 1 i ne ulaze u izraz za konstantu ravnoteze

Kod heterogenih ravnoteza sto moze nastati
kemijske i fizicke promjene ili samo promjene faza

Koje heterogene ravnoteze imamo

Ravnoteza izmedu cvrste slabotopljive tvari i njezinih iona
Otapanje, talozenje
Ravnoteza analita izmedu otapala koja se ne mijesaju te izmedu cvrste i tekuce faze
Ekstrakcija
Ravnoteza analita izmedu pokretne i nepokretne faze
Kromatografija
Ravnoteza analita izmedu crvate i tekuce faze
Ionska izmjena
Aktiviteti
kolika je tocna koncentracija, efektivna koncentracija
Racunanje koeficijenta aktiviteta puta ravnotezba koncentracija
Ovisan o ionskoj jakosti
Manji sto je veca koncentracija i naboji cestica - privlacne sile su jace Coulombova sila
Coulombova sila
Dielektricnost
Sposobnost otapala da razdijeli
Veca, aktivitet veci
Elektroliti
Tvari koje u vodi disocirajz na ione i provode elektricnu struju
Velike koncentracije provodnist manja nego sto bi ocekivali - aktivitet
Ionski parovi
Ioni koji se medusobno privlace elektrostatskim privlacenjem u otopinama
Ne mogu sudjelovati u provodenju el struje
Uveden pojam aktiviteta
Otapanje i talozenje - kakva otopina mora biti
mora biti zasicena otopina koja je u ravnotezi s talogom (heterogena ravnoteza)
Otopljena cvrsta tvar u ravnotezi s ionima
vodene otopine ako nije drukcije navedeno
Otapanje i talozenje - sto ako otopina nije zasicena
Ako otopina nije zasicena cijela cvrsta tvar se otopila i nema heterogene ravnoteze
Ravnoteze izmedu cvrste slabo topljive tvari i njezinih iona - sto otopina sadrzava
+konstanta produkta topljivosti

Ravnoteza izmedu cvrste, slabo topljive tvari i njezinih iona - sto vrijedi za aktivitet i sto se dobije od njega
razlikuje se od koncentracijske konstante produkta topljivostu - ukljucuje koeficijente aktiviteta

Ravnoteze izmedu crvste, slabo topljive tvari i njezinih iona - Kada samo vrijedi termodinamicka konstanta produkta topljivosti

Ravnoteze izmedu cvrste, slabo topljive tvari i njenih iona - kako se dobije i cemu je jednaka koncentracijska konstanta produkta topljivosti

Ravnoteze izmedu cvrste, slabo topljive tvari i njenih iona - kakva je ionska jakost kod male topljivosti cvrste faze u vodi
ravnoteza jako pomaknuta ulijevo, malo iona, koncentraciju tih iona zanemarujemo u kontekstu ionske jakosti, ta mala koncentracija iona koja nastaje disocijacijom ne pridonosi znacajno ionskoj jakosti otopine, zanemarujemo

Ravnoteze izmedu cvrste, slabo topljive tvari i njenih iona - sto trebamo uzeti u obzir kod povecane ionske jakosti
ne mozemo zanemariti ionsku jakost iona
Neutralni elektrolit - sadrzi ione koji ne sudjeluju u ravnotezi koja se uspostavila u otopini, samo povecavaju ionsku jakost otopine

Ravnoteze izmedu cvrste, slabo topljive tvari i njenih iona - sto jos utjece na topljivost i prema kojem principu
reakcija se pomice ulijevo, zajednicki ion - jedan od iona koji sudjeluju u ravnotezi, povecanje koncentracije, sustav tezi ponovnoj uspostavi ravnoteze, smanjenje topljivosti soli

Razlika ravnoteze izmedu cvrste, slabo topljive tvari i njenih iona u odnosu na stehiometrijske odnose

Ravnoteze izmedu cvrste, slabo topljive tvari i njenih iona - kakva mora biti otopina

Ravnoteze izmedu cvrste, slabo topljive tvari i njenih iona - primjer zadatka

Ravnoteze izmedu cvrste, slabo topljive tvari i njenih iona - kako se racuna topljivost

Ravnoteze izmedu cvrste, slabo topljive tvari i njenih iona - kako se moze iskazati Ksp
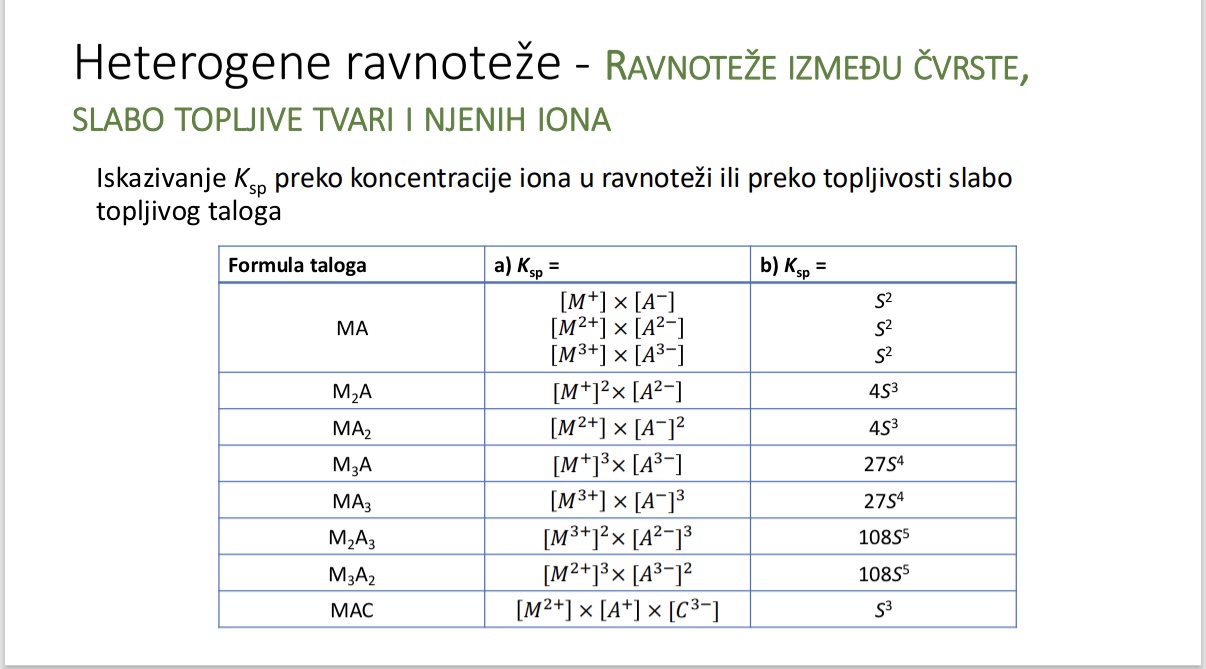
Ravnoteze izmedu cvrste, slabo topljive tvari i njenih iona - ovisnost topljivosti slabo topljive tvari o stehiometrijskom koeficijentu

Usporedba topljivosti PbSO4 i PbI2

Sto se postavlja za talozenje slabo topljive tvari
hoce li u nekoj otopini doci do talozenja - prvi izracunati Q
Reakcijski kvocijent
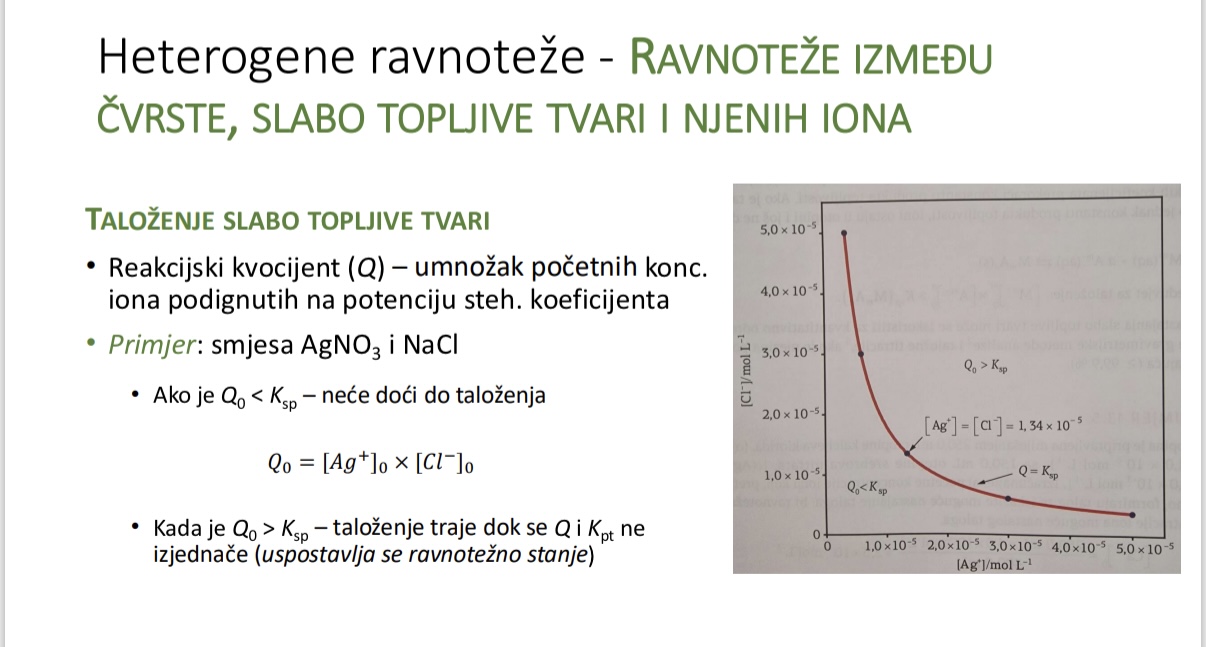
Kako se racuna reakcijski kvocijent Q - primjer smjesa AgNO3 i NaCl
AgNO3 topljiv i disocira, NaCl otapa se u vodi
Pocetne koncentracije tvari koje ulaze u ravnotezu Ag+ i Cl-, gtalog AgCl, umnozak prelazi Kpt dolazi do talozenja
Konc iona - talozenje Kpt - nema - aditivnost V
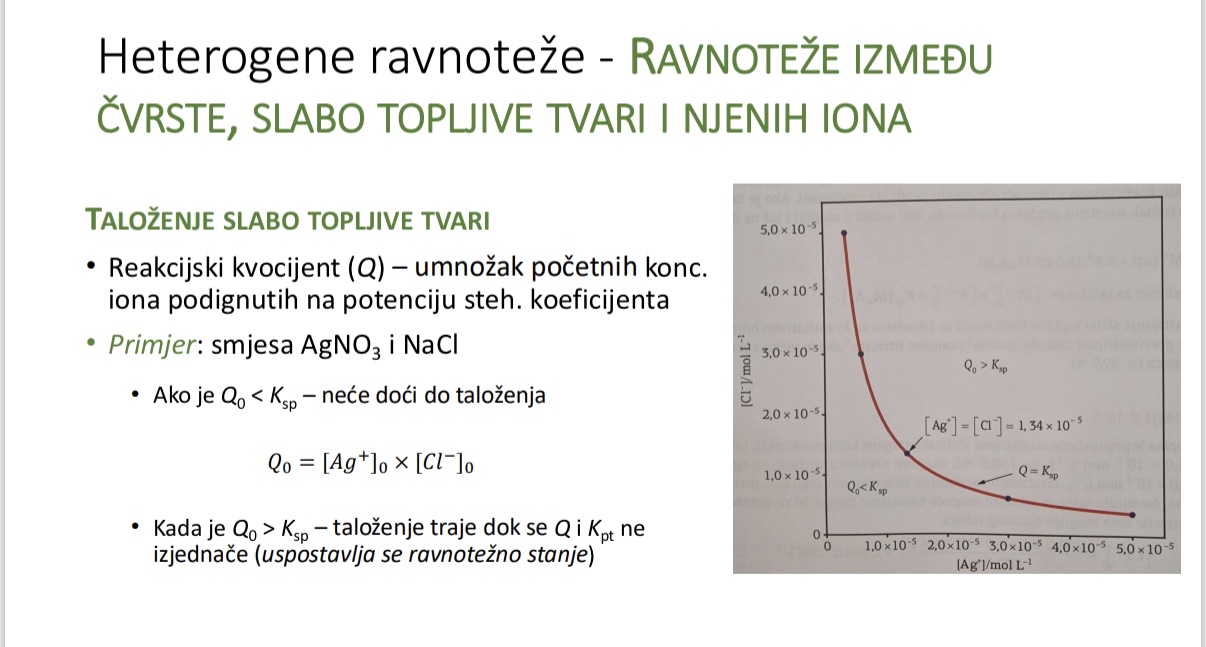
Kada dolazi do talozenja - ovisno o reakcijskom kvocijentu
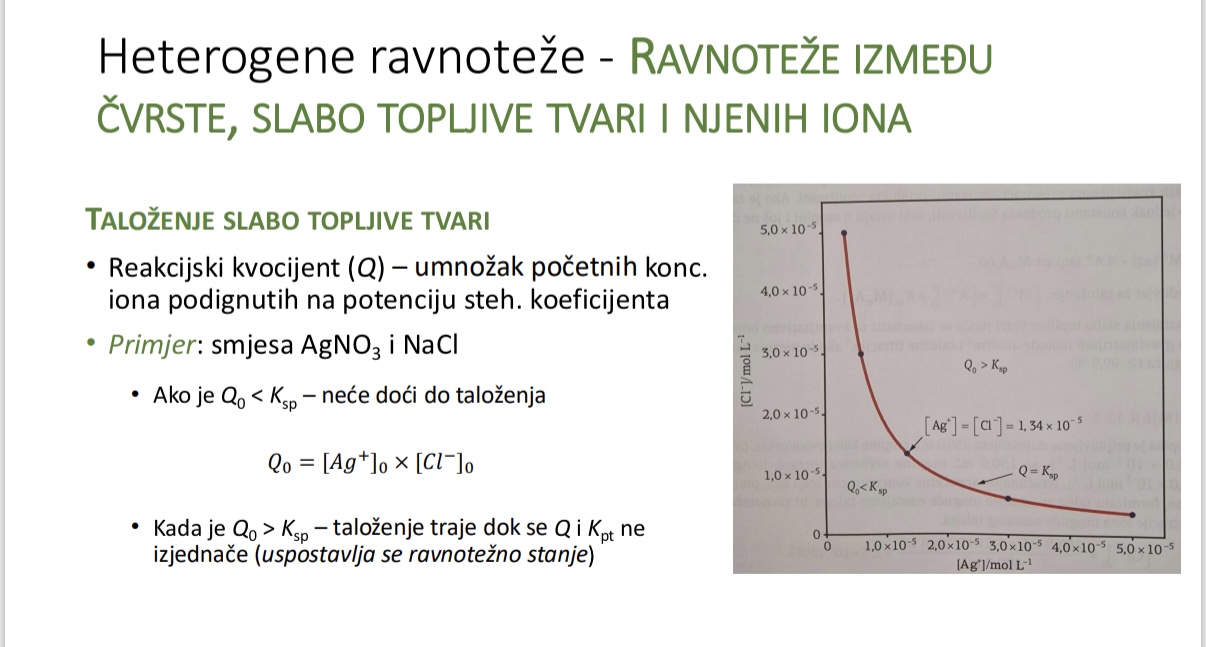
Sto mora biti prekoraceno kako bi doslo do talozenja

Sto se uzima u obzir kod otapanja
u obzir i heterogena i homogena ravnoteza, nije kod svih soli, ne mozemo zanemariti udio otopljene ali ne disocirane soli u otopini
Sto je heterogena ravnoteza

Sto je homogena ravnoteza

Ukupna reakcija otapanja=

Kakva je topljivost CuSO4 ukoliko je u smjesi prisutan i dio nedisociranih otopljenih tvari

Na koje sve nacine se moze opisati proces otapanja slabo topjive tvari

Utjecaj ionske jakosti otopine na topljivost taloga

Dodatkom neutralnog elektrolita u zasicenu otopinu slabo topljivog taloga sto je potrebno promijeniti u proracunu

Primjer utjecaja ionske jakosti na topljivost slabo topljive cvrste tvari

Kako se racuna ionska jakost

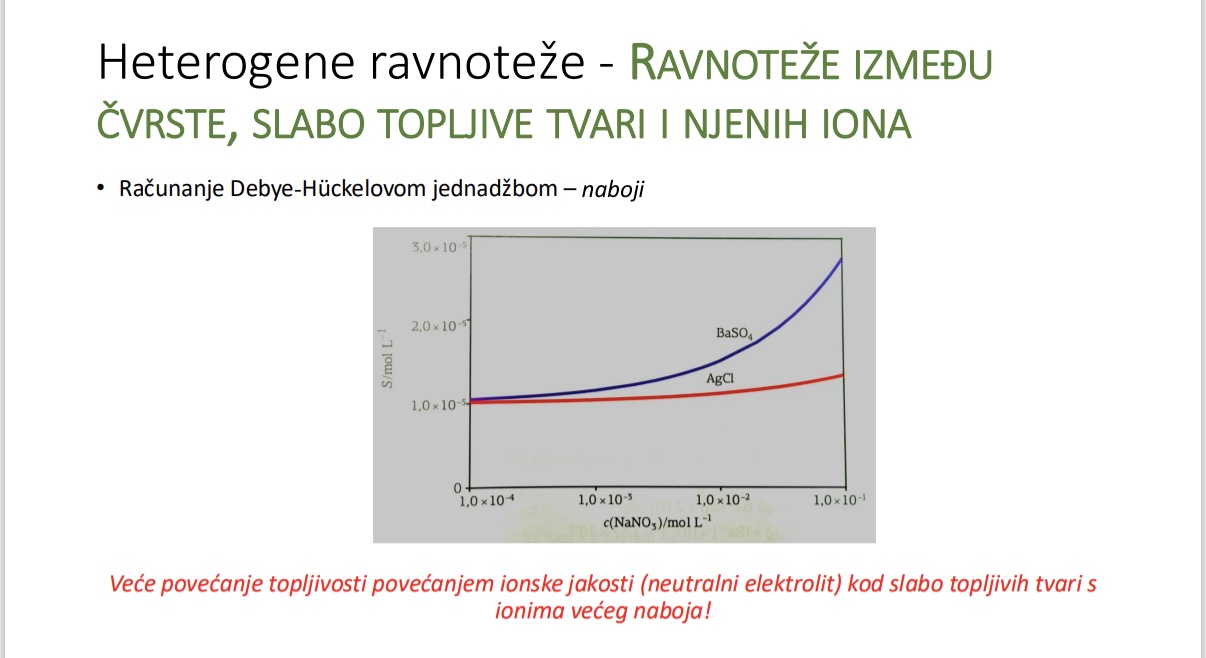
Sto se odvija s topljivosti povecanjem ionske jakosti na primjeru

Objasni zasto je veca topljivost povecanjem ionske jakosti

Ionski oblaci
Usporedba utjecaja ionske jakosti na topljivost BaSO4 i AgCl

Debye-Huckelova jednadzba
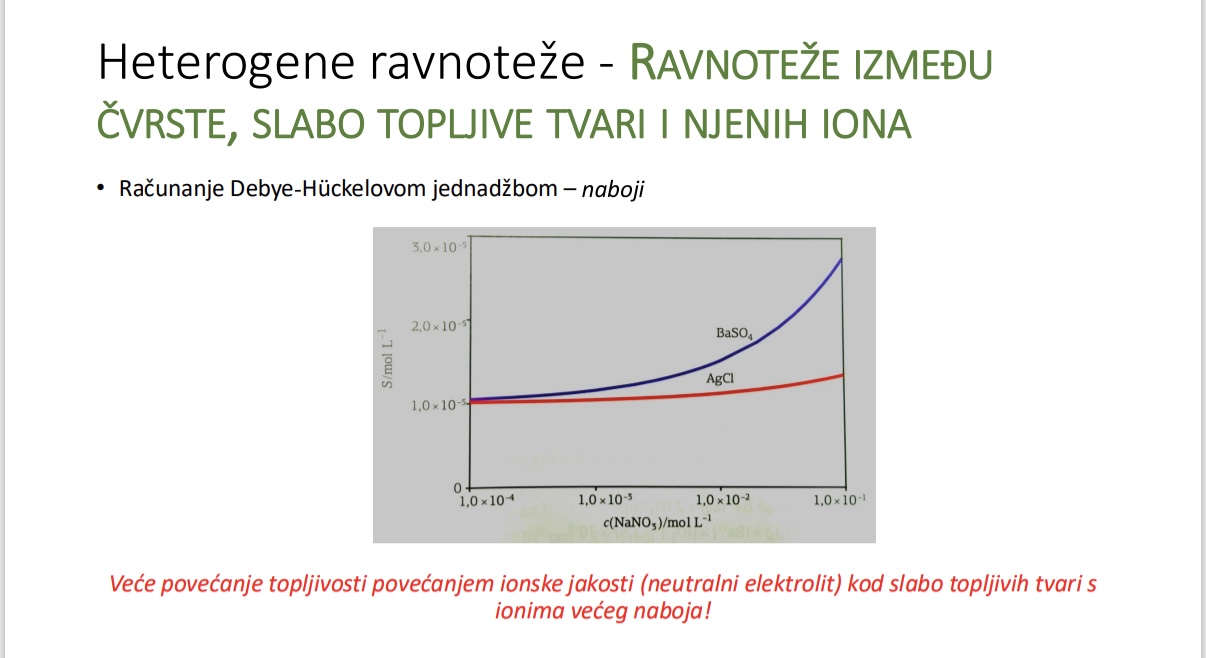
Ukoliko koristimo ione veceg naboja dodatkom neutralnog elektrolita kako to utjece na topljivost
Utjecaj dodatka zajednickog iona na ravnotezu cvrste slabo topljive tvari i njenih iona

Smanjuje li se uvijek topljivost slabo topljivog taloga odatkom velikog suviska zajednickog iona?

Sto je stvarno stanje u reakciji

Ovisnost topljivosti slabo topljivog AgCl o koncentraciji dodanog Cl-
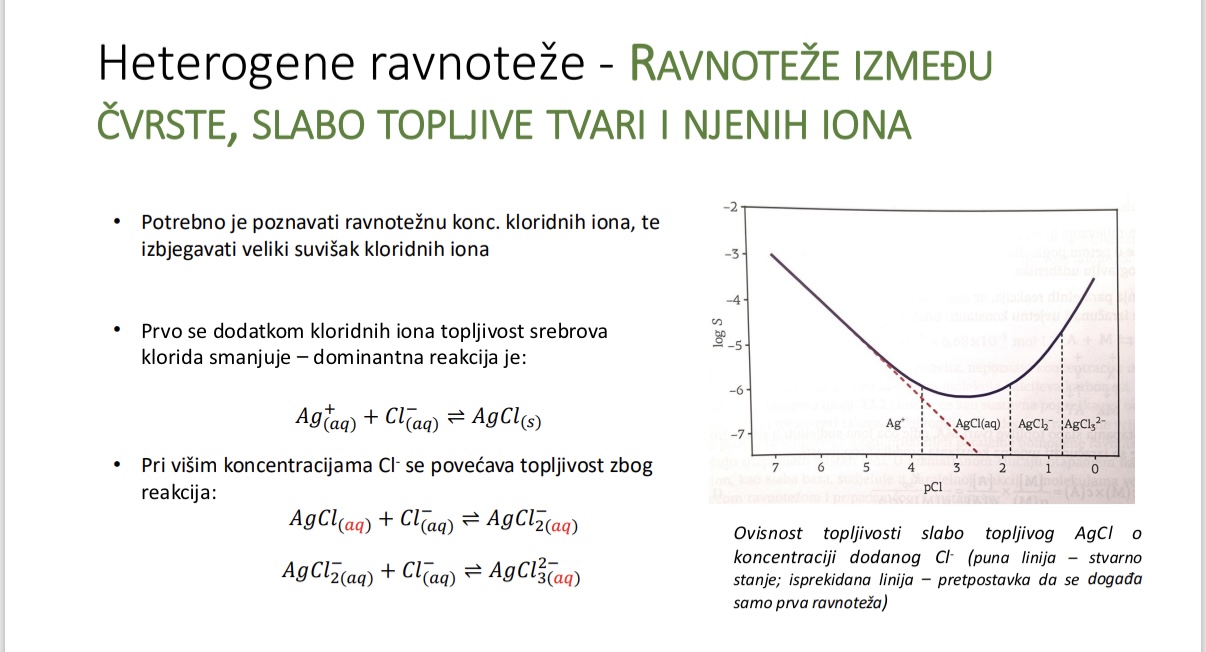
Utjecaj paralelnih reakcija na topljivost

Sto se dogada kada oba iona sudjeluju u paralelnim reakcijama

Utjecaj skrivene paralelne reakcije na topljivost taloga

Kakva je topljivost kada se u obzir uzme paralelna homogena reakcija

Utjecaj pH na topljivost taloga

Primjer topljivost kalcijevog oksalata u prisutnosti jake kiseline

Primjer - topljivost kalcijevog oksalata u prisutnosti jake kiseline - koje se sve ravnoteze postavljaju u sustavu

______________ vrijedi samo za odredenu pH vrijednost

Primjer- topljivost kalcijevog oksalata u pristunosti jake kiseline

Sto je ligand
Utjecaj liganda na topljivost

Primjer- utjecaja liganda na topljivost - topljivost AgCl u prisutnosti liganda amonijaka

U slucaju liganda uvjetna konstanta produkta topljivosti vrijedi samo…

Sto je titracija
Sto je talozni reagens
Odjeljivanje iona kontroliranjem koncentracije taloznog reagensa - koji je nuzan uvjet

Odjeljivanje iona kontroliranjem koncentracije taloznog reagensa - kako se postize tocna kontrola koncentracije taloznog reagensa

Odjeljivanje iona kontroliranjem koncentracije taloznog reagensa - sto je pozeljno za talozenje

Odjeljivanje iona kontroliranjem koncentracije taloznog reagensa - primjer Ag+ i Tl+ talozenje s Cl-

Sto oznacava kvantitativnost
Odjeljivanje iona kontroliranjem koncentracije taloznog reagensa - primjer s AgCl - zasto nije moguca 99,9% tna kvantitativnost

Primjer odjeljivanje Pb+ i Hg22+ talozenjem s I-

Odjeljivanje iona kontroliranjem koncentracije taloznog reagensa - primjer - koji je zahtjev potrebno zadovoljiti

Primjer- kada zavrsava talozenje Hg22+

Odjeljivanje iona kontroliranjem koncentracije i pH vrijednosti reakcijske otopine - primjer

Odjeljivanje iona kontroliranjem koncentracije taloznog reagensa - koje su koncentracije taloznog reagensa (pH) potrebnog za pocetak talozenja pojedinoga iona?

Je li moguce kvantitativno uklanjanje Fe3+ iona?

Sto je selektivnost
Odjeljivanje iona talozenjem u obliku sulfida - Kakva je selektivnost S2- ovisno o pH

Odjeljivanje iona talozenjem u obliku sulfida - Sto tvore sulfidi

Odjeljivanje iona talozenjem u obliku sulfida - kakav je H2S

Odjeljivanje iona talozenjem u obliku sulfida - sto se koristi umjesto H2S

Odjeljivanje iona talozenjem u obliku sulfida - primjer

Odjeljivanje iona talozenjem u obliku sulfida - primjer

Odjeljivanje iona talozenjem u obliku sulfida - primjer

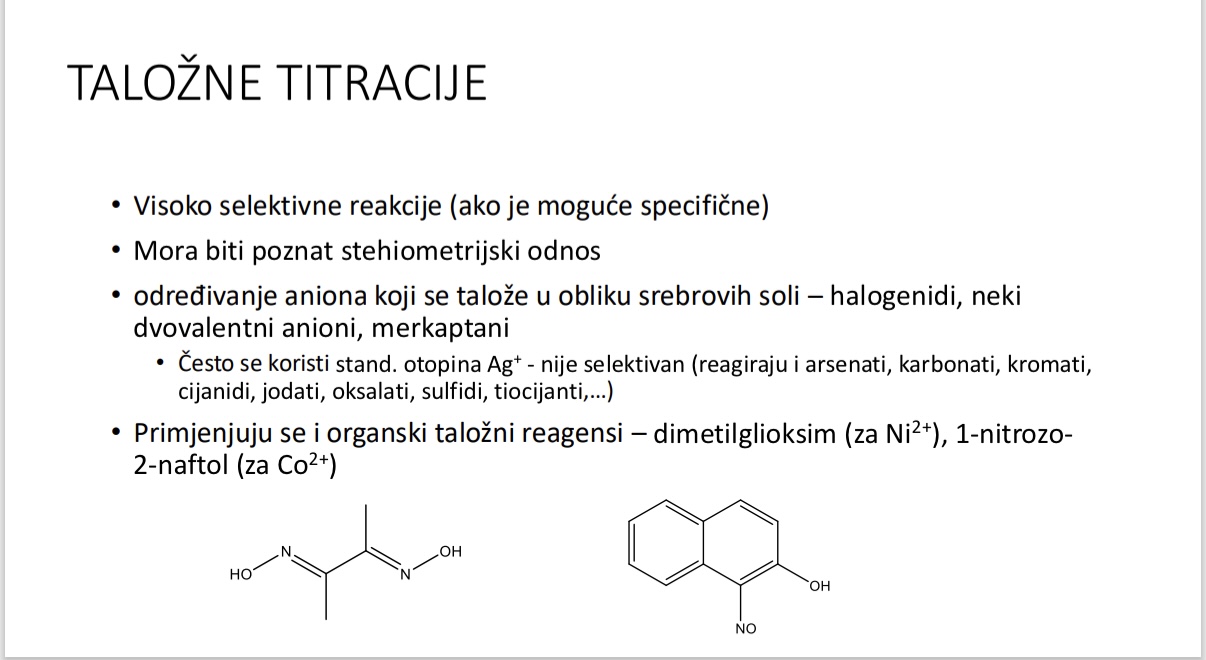
Talozne titracije - kakve su po selektivnosti i stehiometrijskim odnosima
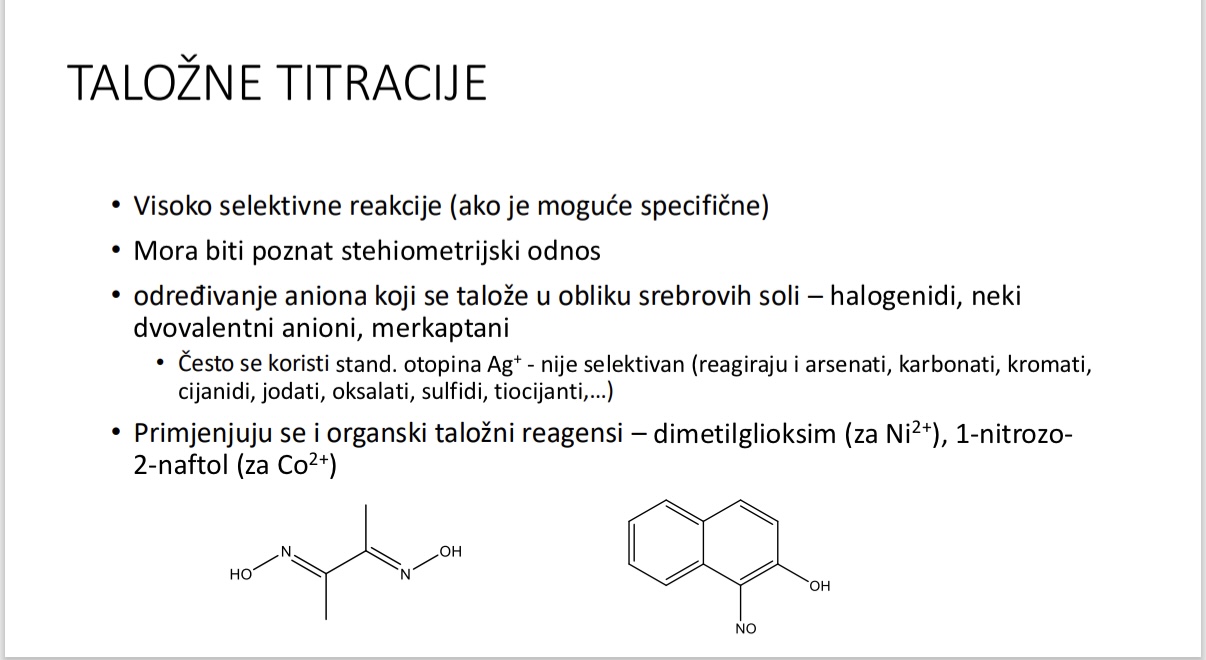
Za sto sluze talozne titracije
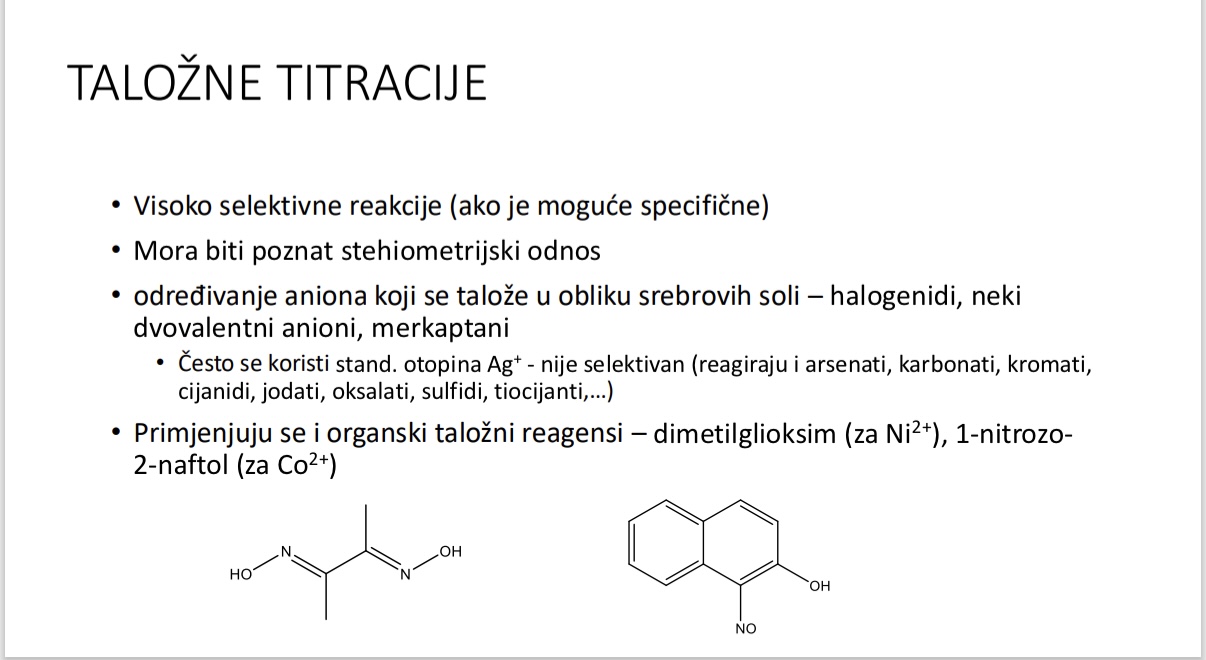
Koji talozni reagensi se primjenjuju u taloznim titracijama
Sto su argentometrijske metode
Talozne titracije sa srebrovim nitratom

Argentometrijske metode - koja su tri nacina racunanja

Argentometrijske metode - primjer
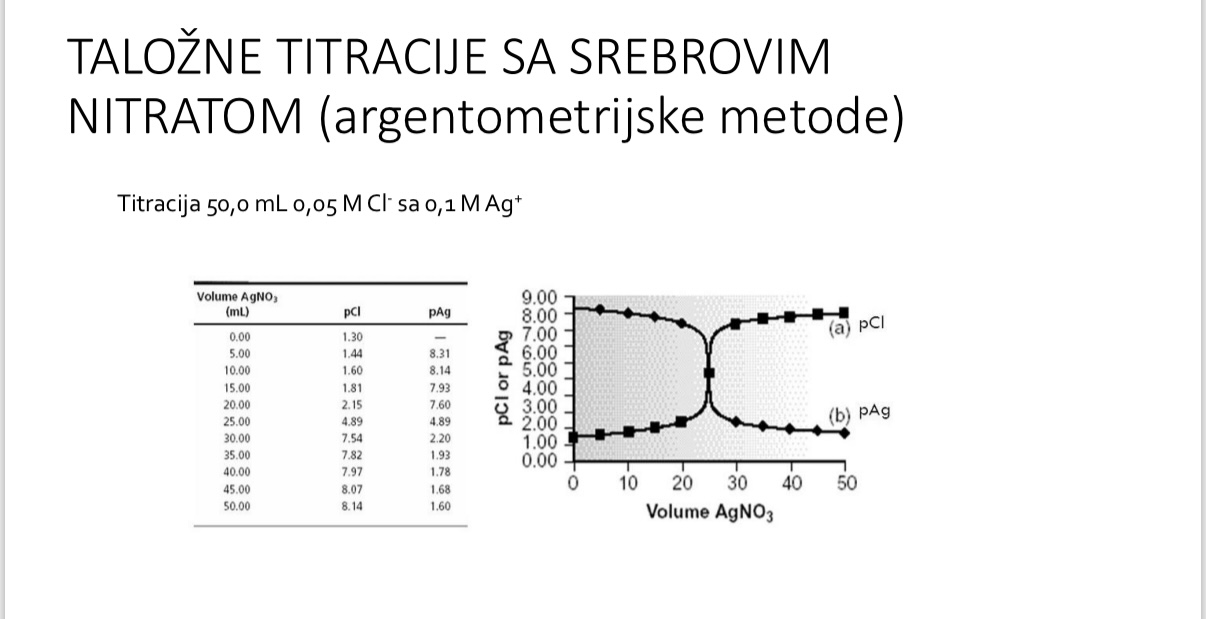
Primjer - argentometrijske

Primjer - argentometrijske

Primjer - argentometrijske - sto je tocka ekvivalencije

Primjer - argentometrijske

Argentometrijske - ostra zavrsna tocka

Argentometrijske - utjecaj koncentracije
