REACTIEMECHANISMEN
1/96
Earn XP
Description and Tags
oorspronkelijk van; https://knowt.com/flashcards/b72e52b9-5670-40cf-b245-85f2c5fc27f9
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
97 Terms
(HALOGEEN)ALKANEN
alkanen
weinig reactief, zeer stabiel op zichzelf
enige mogelijke reactie;
radicalaire halogenering
alkaan → halogeenalkaan
radicalaire halogenering
Cl2 of Br2
hν
Hammond postulaat — bij vorming C° geldt;
Cl2 exotherm (lage Ea)
reactiever, minder selectief → mengsel
Br2 endotherm (hoge Ea)
trager, selectiever → meest gesubstitueerde
alkeen → halogeenalkaan
elektrofiele additie
hydrohalogenering
+ HX
Markovnikov
halogeenalkaan → alkeen
dehydrohalogenatie
H onttrokken van β-koolstof
Zaitsev; meest gesubstitueerde alkeen gevormd
= H wordt onttrokken waar minste H’s zijn
dubbele binding gevormd
E2; 1° / 2° hak + SB
E1; 3° hak + ZB
halogeenalkaan → organometaal
2 mogelijkheden;
+ 2× Li → organolithium
+ Mg → Grignard
organonatrium bereiding (zie verder);
eindstandig alkyn + NaNH2
reactiviteit (ΔEN)
C-Na > C-Li > C-Mg
ALKENEN
alkenen
allylische bromering
ozonisatie
epoxidatie
elektrofiele additie — let op mogelijke shift!!
katalytische hydrogenering
halogenering (in H2O)
hydrohalogenering
hydroboratie
hydratatie
alkeen → Br op alkeen
allylische/benzyllische bromering
+ NBS in CCl4
hν
opm; let steeds op resonantiestructuren
opm; waarom allylische positie?
allylische radicalen gestabiliseerd door resonantie
C–H heeft lagere bindingsdissociatie energie
alkeen → (form)aldehyde/keton
ozonisatie
+ O3
+ Zn in CH3COOH/H2O
opm; wordt vaak gevolgd door oxidatie en daarom ook wel oxidatieve splitsing genoemd
(form)aldehyde → carbonzuur
alkeen → epoxide
epoxidatie
e- -rijk; + R-CO-O-OH in CH2Cl2
e- -arm; + -OH / H2O2 in CH3OH
opm; zure hydrolyse epoxide
+ H3O+ → vicinaal diol
anti-additie
alkeen → alkaan
katalytische hydrogenering
+ H2
katalysator; PtO2 of Pd/C
syn-additie, vanwege katalysator
alkeen → vicinaal dihalogeenalkaan
halogenering
+ X2
anti-additie, vanwege grote halogenen
alkeen → halohydrine
halogenering in water
+ X2
bromonium-ion + H2O
anti-additie, vanwege grote halogenen
competitie tussen H2O en X
halogeen komt op plaats waar H
zou komen volgens Markovnikov
alkeen → hydroboraan → alcohol
hydroboratie + oxidatie
+BH3 / THF
+OH- / H2O2
syn-additie
anti-Markovnikov!!!
alkeen → alcohol
kwik/zuurgekatalyseerde hydratatie
+ H2O
katalysator; Hg(OAc)2 of H3O+
mechanisme kwikgekatalyseerd;
dubbele binding valt aan op Hg → -OAc = LG
aanval H2O op mercuronium ion + deprotonatie
laatste stap niet volledig gekend
+ NaBH4 → alc + Hg
ALCOHOLEN
alcohol → alkeen
dehydratatie
vaak eerst protonering OH → H2O = LG
vaak ook verhoogde temperatuur (Δ)
E2; 1° / 2° alc + SB
E1; 3° alc + ZB
alcohol → alkoxide
zuur/base reactie
alcohol → halogeenalkaan
substitutie
+ HCl / HBr / HI
1° → SN2
2° → SN2 / SN1
3° → SN1
1° alcohol → aldehyde
oxidatie
2° alcohol → keton
oxidatie
ALKYNEN
alkyn
deprotonering eindstandige alkynen
elektrofiele additie
katalytische hydrogenering
+2X2, +2HX …
hydroboratie
kwik/zuurgekatalyseerde hydratatie
eindstandig alkyn → nucleofiel
alkyn kan niet reageren tenzij het omgezet wordt in een nucleofiel, hiervoor is sterke base nodig;
+ NaNH2
+ nBuLi
+ LDA
alkyn → alkeen → alkaan
katalytische hydrogenering
+ H2
syn-additie
volledige reductie; alkyn → alkaan
katalysator; PtO2 of Pd/C
partiële reductie; alkyn → alkeen
katalysator; Lindlar
intern/eindstandig alkyn → enol → aldehyde/keton
hydroboratie + oxidatie
+BH3 / THF
+OH- / H2O2
sterische hinder; BH3 niet 3× reageren
anti-Markovnikov én syn-additie!!!
eindstandig → aldehyde
intern → keton
intern/eindstandig alkyn → enol → keton
kwik/zuurgekatalyseerde hydratatie
+ H2O
katalysatoren; HgSO4 en H2SO4
Markovnikov
eindstandig → één product
intern én C’en gelijk gesubstitueerd → mengsel
NITRIL
bereiding nitril
SN2
RX + NaCN → RCN + NaX
bij reacties met nitril;
nucleofiele aanval op C (δ+)
e- verspringen naar N (δ-)
nitril → amide → carbonzuur
zure hydrolyse
+ SZ
+ H2O
nitril → amine
reductie
nitril → aldehyde
reductie
nitril → imine anion → keton
nucleofiele additie
+ R-Mg-X
zure hydrolyse
+ SZ
+ H2O
ALDEHYDES
KETONEN
aldehyde/keton → alcohol
via Grignardreagens
via reductie
aldehyde/keton → alcohol — Grignardreagens
nucleofiele additie
+ R-Mg-X
formaldehyde → 1° alc
aldehyde → 2° alc
keton → 3° alc
aldehyde/keton → alcohol — reductie
reductie
+ LiAlH4 of NaBH4
aldehyde → 1° alc
keton → 2° alc
aldehyde/keton → cyanohydrine
nucleofiele additie
+ HCN
aldehyde/keton → imine/enamine
nucleofiele additie + dehydratatie
+ R - NH2 = 1° amine → imine
+ R2 - NH = 2° amine → enamine
PAD - PED mechanisme
protonatie, additie, deprotonatie
protonatie, eliminatie, deprotonatie
aldehyde/keton → (hemi-)acetal
nucleofiele additie + nucleofiele substitutie
+ R-OH
PAD - PEAD mechanisme
protonatie, additie, deprotonatie
protonatie, eliminatie, additie, deprotonatie
aldehyde/keton → alkaan
Wolff-Kishner reductie
+ N2H4
+ KOH
opm; vgm niet te kennen
aldehyde/keton → alkeen
Wittig reactie
+ (Ph)3P+ - -CR2 = fosforylide
bereiding fosforylide
SN2; trifenylfosfine ((Ph)3P:) + H3C-X
P+
deprotonatie met BuLi (butyllithium)
C-
aldehyde/keton → hydraat
nucleofiele additie
+ H2O
kan zowel zuur als base gekatalyseerd;
zuur; PAD
base; AP
hydraat kunnen we oxideren tot carbonzuur
met Jones reagens; CrO₃ in H₂SO₄
aldehyde/keton → aldol = β-hydroxy aldehyde/keton
aldolcondensatie
OH- neemt H van α-koolstof
elektronen vallen aan op carbonyl andere = nieuwe C-C binding gevormd
protonatie tot OH
aldolcondensatie — opmerkingen
dehydratatie aldol → enal/enon = α,β-onverzadigd aldehyde/keton
in praktijk steeds base gekatalyseerd
OH- neemt H van α-koolstof
e- verspringen, -OH als LG
intramoleculaire aldolreactie
2 carbonylgroepen op één molecule
steeds meest stabiele ring gevormd
enol → keton
keto-enol tautomerie
base gekatalyseerd
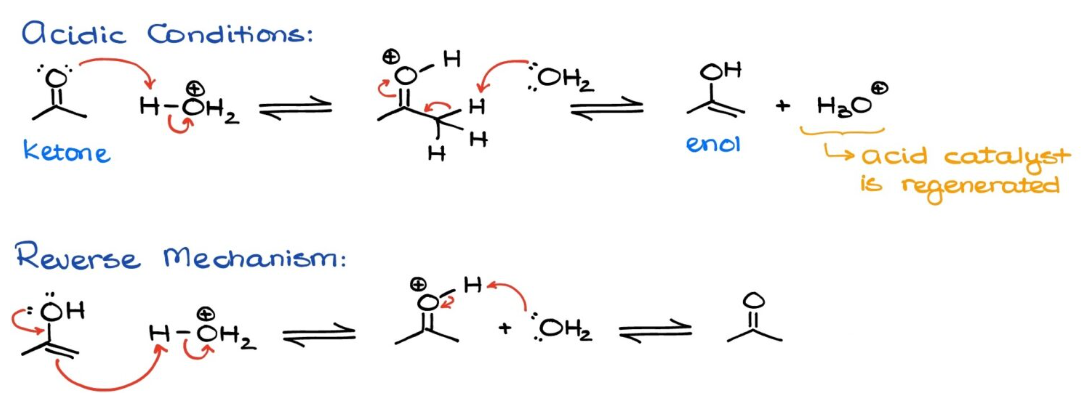
zuur gekatalyseerd
base gekatalyseerd
keton → enol
enol → keton
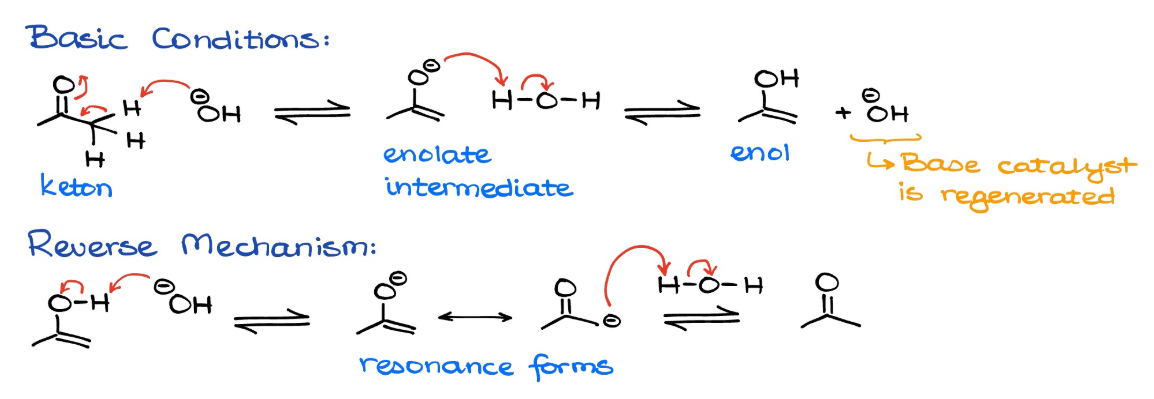
zuur gekatalyseerd
keton → enol
enol → keton
CARBONZUUR & DERIVATEN
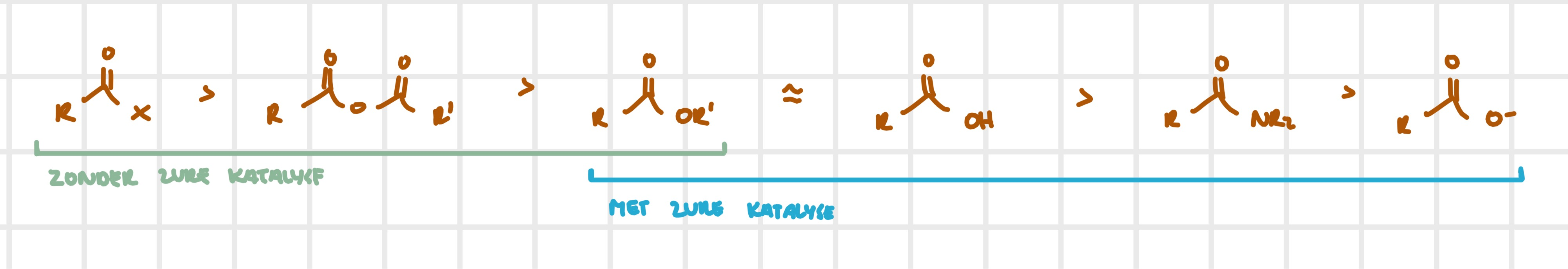
reactiviteit — zie ook 3.12
halogeenalkaan → carbonzuur
2 mogelijkheden;
vorming Grignard + CO2
vorming nitril → amide → carbonzuur
alkylbenzeen → carbonzuur
oxidatie
vb. KMnO4
alkeen → carbonzuur
oxidatieve splitsing
+ KMnO4 en +H3O+
+ O3 en +H2O2
opm; enkel voor alkenen met min. 1× vinyllisch H
indien niet kan je alleen ketonen vekrijgen
enkel aldehydes kunnen omgezet worden in carbonzuur
1° alcohol → aldehyde → carbonzuur
oxidatie
carbonzuur → zuurchloride
+ SOCl2
je verkrijgt op einde;
zuurchloride + SO2 + Cl-
2× carbonzuur → zuuranhydride
dehydratatie
carbonzuur → ester
2 mogelijkheden;
Fischer-esterificatie; + R-OH
SN2; vorming carboxylaat + 1° halogeenalkaan
carbonzuur → amide
eerst omzetting naar zuurchloride!!
aminolyse
+ NH3
zuurchloride → carbonzuur
hydrolyse
+ H2O
zuurchloride → ester
alcoholyse
+ R-OH
zuurchloride → amide
aminolyse
+ NH3
zuurchloride → aldehyde → 1° alcohol
partiële reductie; zuurchloride → aldehyde
reductor; DIBAH
volledige reductie; zuurchloride → 1° alc
reductor; LiAlH4
zuurchloride → keton → 3° alcohol
partiële omzetting tot keton
+ R2CuLi
RX + 2× Li → RLi + XLi
2× RLi + CuI → R2CuLi + LiI
volledige omzetting tot alc
+ 2× Grignardreagens
RX + Mg → RMgX
zuurchloride → zuuranhydride
+ carboxylaat
zuuranhydride → 2× carbonzuur
hydrolyse
+ H2O
zuuranhydride → ester
alcoholyse
+ R-OH
zuuranhydride → amide
aminolyse
+ NH3
ester → ester
omestering
+ R-OH
ester → carbonzuur
zure hydrolyse — volledig reversibel
+ SZ
+ H2O
opm; dit is omgekeerd van Fischer
je verkrijgt dus carbonzuur + alc
HOR (alc) = LG
ester → carboxylaat
basische hydrolyse = verzeping — irreversibel
+ SB
+ H2O
je verkrijg een carbonzuur, maar -OR = LG
valt niet aan als nucleofiel, want te zwak
neemt H op v/d OH-groep v/h carbonzuur
uiteindelijk verkrijg je dus carboxylaat!!
ester → amide
aminolyse
+ NH3
ester → aldehyde → 1° alcohol
partiële reductie; ester → aldehyde
reductor; DIBAH
volledige reductie; ester → 1° alc
reductor; LiAlH4
ester → keton → 3° alcohol
+ 2× Grignardreagens
amide → amide met N-
zuur/base reactie
+ SB
amide → amine
reductie
+ LiAlH4
amide → carbonzuur → carboxylaat
uitzonderlijke reactie, want;
carbonzuur minder stabiel dan amide
maar uiteindelijke product, nl. carboxylaat
is nog stabieler dan amide
dus reactie gaat door
zure hydrolyse
+ SZ
+ H2O
SPECIALE MECHANISMEN
malonester + halogeenalkaan → carbonzuur
Malonester synthese
-OEt valt aan op zure H’s op α-positie
aanval vrij ep op halogeenalkaan
zure hydrolyse ester; OEt → OH
decarboxylatie; Δ
keto-enol tautomerie
acetylazijnester + halogeenalkaan → methylketon
acetylazijnester synthese
-OEt valt aan op zure H’s op α-positie
aanval vrij ep op halogeenalkaan
zure hydrolyse ester; OEt → OH
decarboxylering; Δ
keto-enol tautomerie
aldehyde/keton → aldol
aldolcondensatie
2× aldehyde/keton → β-hydroxy aldehyde/keton = aldol
mechanisme;
OH neemt H op van α-koolstof
vrij ep valt aan op koolstof carbonyl v/e andere molecule
O- neemt H op van H2O
aldol → enon
volgt onmiddellijk na aldolreactie, want -OH neemt uit zichzelf meest zure H (v/d α-positie) op
vrij ep verspringt → dubbele binding
OH wordt uitgestoten als LG (basisch milieu)
opm;
aldol = β-hydroxy aldehyde/keton
enon = α,β-onverzadigd aldehyde/keton
ester + ester → β-ketoester
ester + keton → β-diketon
Claisen condensatie
(1,05 eq) -OEt neemt H van α-koolstof
elektronen vallen aan op carbonyl ester
OEt verlaat molecule als LG
reactie gaat verder!!
EtO- neemt zure H v/d α-positie tss carbonylgroepen → EtOH + enolaatanion
zure opwerking enolaatanion
intramoleculaire Claisen condensatie = Dieckmann cyclisatie
enolaat + α,β-onerzadigd carbonyl → 1,5-dicarbonyl
Michael additie
donor = enolaat
acceptor = α,β-onerzadigd carbonyl
donor is best zwakke base, want
aanval op β-positie
niet direct op carbonyl
enolaat + α,β-onerzadigd carbonyl → 1,5-dicarbonyl → ring
Robinsonannelatie
Michael additie + intramoleculaire aldolcondensatie
REDUCTIE
OXIDATIE
reductie & oxidatie
reductie
= stijging e- densiteit
minder C-O, meer C-H
oxidatie
= daling e- densiteit
minder C-H, meer C-O
reductie
alkenen, alkynen
katalytische hydrogenering
aldehyde, ketonen
NaBH4
ester, carbonzuur, zuurchloride
LiAlH4 of DIBAH
katalytische hydrogenering — alkenen, alkynen
+ H2
syn-additie
volledige reductie
katalysator; PtO2 of Pd/C
alkeen → alkaan
alkyn → alkeen → alkaan
partiële reductie
katalysator; Lindlar
alkyn → alkeen
NaBH4 / ether — aldehyden, ketonen
aldehyde → 1° alc
keton → 2° alc
LiAlH4 / ether — ester, carbonzuur, zuurchloride
ester/carbonzuur/zuurchloride/zuuranhydride → aldehyde → 1° alc
1e stap = reductie
2e stap = zure opwerking
DIBAH / tolueen — ester, zuurchloride
partiële reductie
ester, zuurchloride → aldehyde
reductie & oxidatie — samengevat
1° alc ⇄ aldehyde ⇄ carbonzuur(derivaten)
2° alc ⇄ keton
CARBOHYDRATEN
monosacharide (hemiacetaal) → glycoside (acetaal)
glycosidevorming
PEAD mechanisme
protonatie, eliminatie, additie, deprotonatie
monosaccharide → alditol
reductie
aldose → aldonzuur/aldarzuur
oxidatie