Thẻ ghi nhớ: CHƯƠNG 2: NHÓM IA: CÁC KIM LOẠI KIỀM | Quizlet
1/90
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
91 Terms
tên nhóm được đặt do ?
- Bản chất kiềm (base ) của các oxid của chúng và do dd base mà các nguyên tố đó tạo thành khi tan trong nước.
( khi phản ứng với nước, chúng tạo ra dung dịch bazơ mạnh, hay còn gọi là dung dịch kiềm.)
Nhóm IA cho ta các vd điển hình về ?
Nhóm IA cho ta các vd điển hình về sự biến thiên ?? của các tính chất mà có/không có ngoại lệ nào đáng kể.
Tất cả các nguyên tố trong nhóm đều là các kl hoạt động mạnh/rất mạnh/yếu.
Tất cả các nguyên tố trong nhóm đều là các kl hoạt động rất mạnh.
kl kiềm không tồn tại ở trạng thái ? mà chỉ có ở dạng hợp chất của M+ do ???
Do hoạt động hoá học mạnh, trong thiên nhiên, kl kiềm không tồn tại ở trạng thái tự do mà chỉ có ở dạng hợp chất M+
Hợp chất quan trọng của Na? có trong đâu?
NaCl, có trong nước biển, mỏ muối, hồ nước mặn.
Các khoáng chất quan trọng của K là?
KCl.NaCl ( xinvinit); KCl.MgCl2.6H20 ( cacnalit)
KCl.NaCl
xinvinit

KCl.MgCl2.6H20
cacnalit

Khoáng chất của Li là ? rất ntn?
Khoáng chất của Li là Alumo silicat , rất PHÂN TÁN.
Khoáng của Rb, Cs rất ntn ?
Khoáng của Rb, Cs rất hiếm, thường lẫn trong các khoáng của các kim loại kiềm khác với lượng rất nhỏ.
Cấu hình e ngoài cùng của nhóm??
ns1
tất cả đều có oxy hoá +1 và tạo ion M+
trong chu kỳ, các ntố IA có kích thước? và năng lượng ion hoá, độ âm điện?
trong chu kỳ, các ntố IA có kích thước lớn nhất và năng lượng ion hoá, độ âm điện thấp nhất.
Đi từ trên xuống, kích thước nguyên tử và kích thước ion ? nên điều gì giảm?
Đi từ trên xuống, kích thước nguyên tử và kích thước ion tăng dần nên năng lượng ion hoá, độ âm điện giảm. ( dễ bứt e).
Các kim loại kiềm có màu trắng gì?, có vẻ sáng kim loại, dẫn ? tốt, nhẹ .
Các kim loại kiềm có màu trắng bạc có vẻ sáng kim loại, dẫn điện tốt, nhẹ .
Liên kết kl tương đối ?? ở trong mạng tinh thể
Liên kết kl tương đối YẾU ở trong mạng tinh thể
Liên kết kl tương đối yếu ở trong đâu?
Liên kết kl tương đối YẾU ở trong MẠNG TINH THỂ.
* Lí do: vì chỉ có 1 e hoá trị
--> vì vậy, các kim loại này MỀM, có nhiệt độ nóng chảy. và nhiệt độ sôi tương đôi thấp.
Các kl này? có nhiệt độ nc và nhiệt độ sôi cao/thấp?
* Lí do: vì chỉ có 1 e hoá trị
--> vì vậy, các kim loại này MỀM, có nhiệt độ nóng chảy. và nhiệt độ sôi tương đôi thấp.
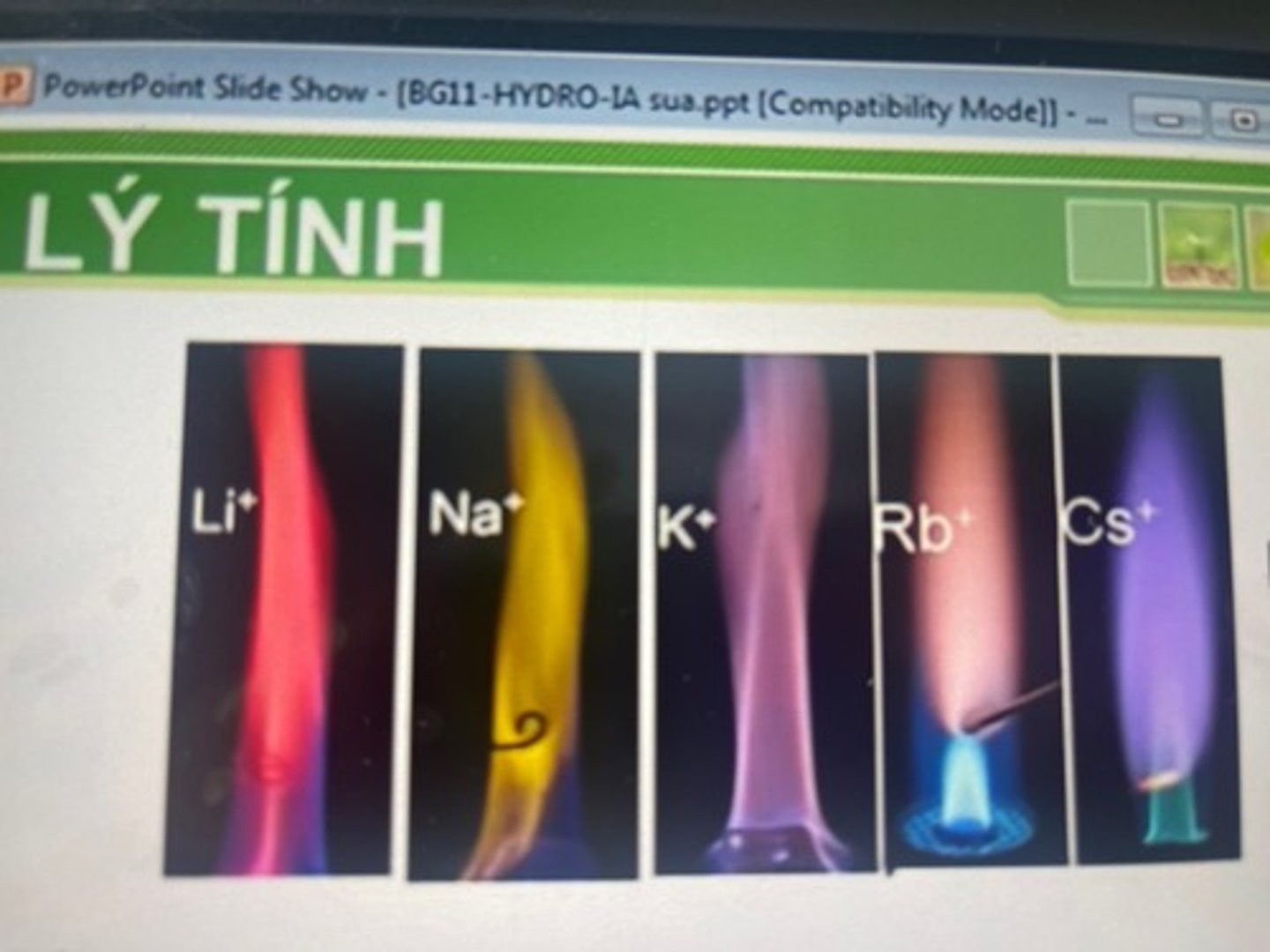
khi đốt các kl kiềm hay hc dễ bay hơi của chúng trên ngọn lửa ? thì ngọn lửa nhuốm màu đặc trưng.
khi đốt các kl kiềm hay hc dễ bay hơi của chúng trên ngọn lửa KHÔNG MÀU thì ngọn lửa nhuốm màu đặc trưng.
--> dùng để làm pháo hoa và dùng trong phân tích để nhận biết kim loại kiềm.
Li
đỏ tía
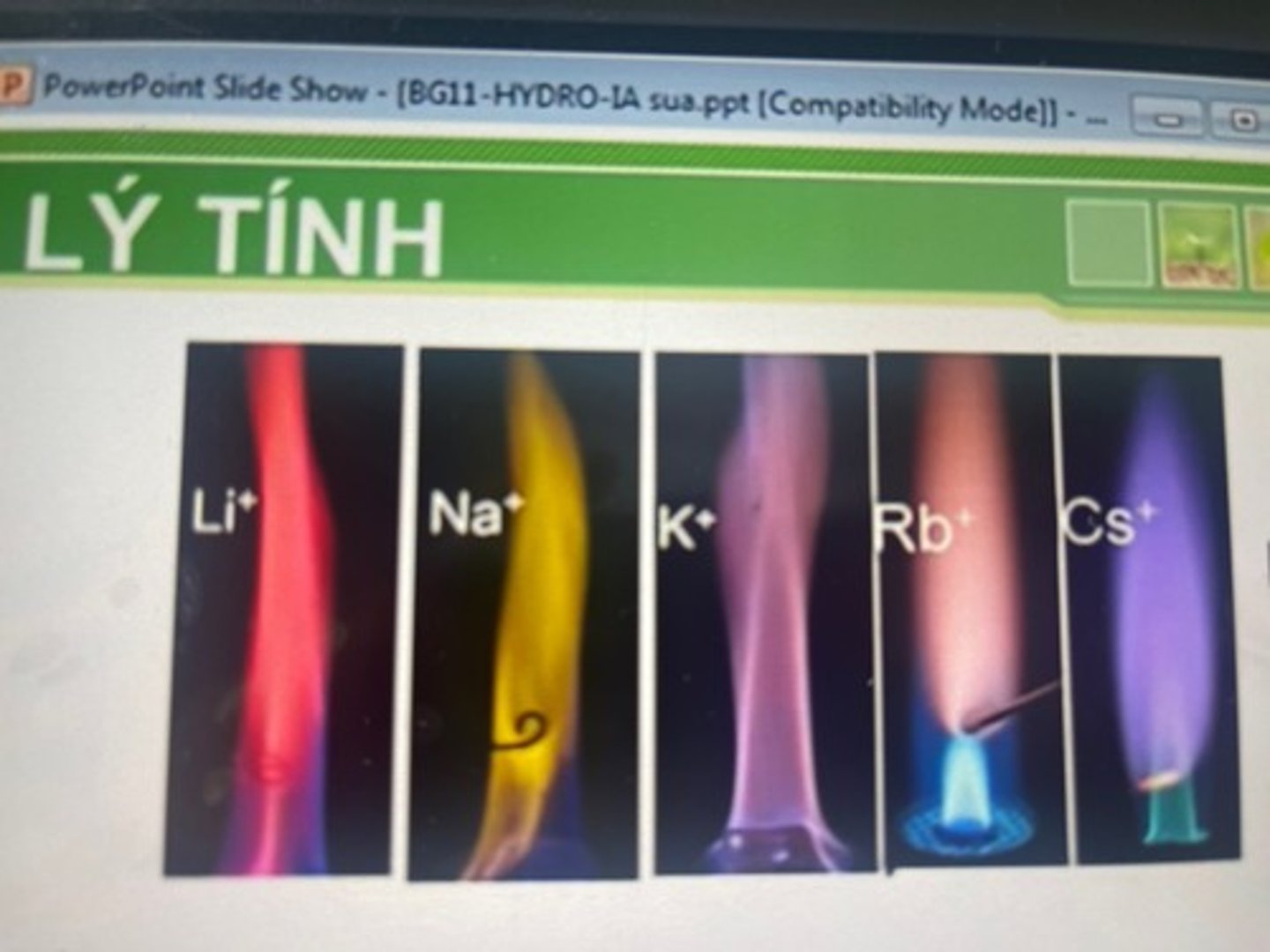
Na
vàng
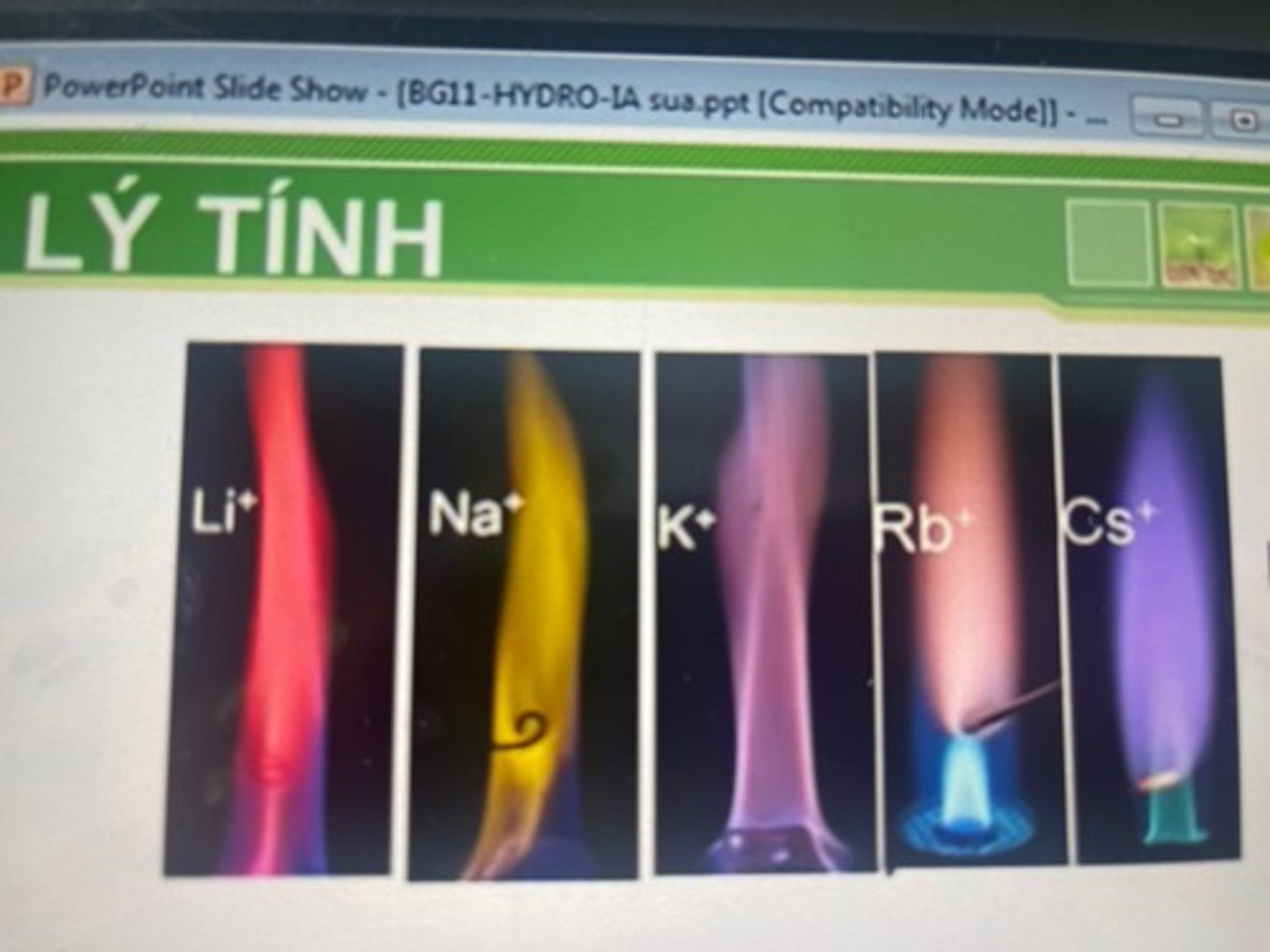
K
tím
Rb
tím hồng
Cs
xanh da trời
kiểu mạng tinh thể của kim loại kiềm?
Các kim loại kiềm đều có
kiểu mạng tinh thể lập phương tâm khối
Các tính chất này
BIẾN ĐỔI TUẦN HOÀN
theo chiều tăng của ? trong nhóm
(ngoại trừ ?)
Các tính chất này
BIẾN ĐỔI TUẦN HOÀN
theo chiều tăng của số hiệu nguyên tử trong nhóm
(ngoại trừ nhiệt độ sôi)
Là các kim loại hoạt động nhất, thể hiện tính? mạnh, Tính? tăng/ giảm dần từ Li đến Cs
Là các kim loại hoạt động nhất, thể hiện tính KHỬ mạnh, Tính KHỬ tăng dần từ Li đến Cs.
Tác dụng với nước : Các kl kiềm khử H+ TRONG NƯỚC thành H^0
2M + 2H2O -> 2M^+ + 2OH^- + H2 + Q( nhiệt )
(CK) (COXH)
- Phản ứng trở nên mãnh liệt khi đi từ dưới lên/ từ trên xuống trong nhóm IA.
- Do phản ứng toả nhiều/ ít nhiệt, cái j? thoát ra có thể bốc cháy trong kk (với K), hoặc nổ( với Rb, Cs).
- Khi pưng với H20, Chất j? không cho ngọn lửa, Na nóng chảy thành hạt ? chạy trên mặt nước ( do ?), hạt lớn có thể bị bốc cháy.
- Phản ứng trở nên mãnh liệt khi đi từ dưới lên/ từ trên xuống trong nhóm IA.
- Phản ứng trở nên mãnh liệt khi đi từ trên xuống trong nhóm IA.
- Do phản ứng toả nhiều/ ít nhiệt, cái j? thoát ra có thể bốc cháy trong kk (với K), hoặc nổ( với Rb, Cs).
- Do phản ứng toả nhiều nhiệt, hydro thoát ra có thể bốc cháy trong kk (với K), hoặc nổ( với Rb, Cs).
- Khi pưng với H20, Chất j? không cho ngọn lửa, Na nóng chảy thành hạt ? chạy trên mặt nước ( do ?), hạt lớn có thể bị bốc cháy.
- Khi pưng với H20, Li không cho ngọn lửa, Na nóng chảy thành hạt tròn chạy trên mặt nước ( do BỊ KHÍ HYDRO ĐẨY ), hạt lớn có thể bị bốc cháy.
Khử oxy nhưng sản phẩm phụ thuộc ?
Khử oxy nhưng sản phẩm phụ thuộc kim loại.
+ Li tạo ? 4Li(r)+O2(k) → 2Li2O(r)
+ Na tạo ? 2Na(r)+O2(k) → Na2O2(r)
+ K, Rb, Cs tạo ? K(r)+O2(k)→ KO2(r)
+ Li tạo ?
4Li(r)+O2(k) → 2Li2O(r)
+ Li tạo oxid Li2O.
Na tạo ?
2Na(r)+O2(k) → Na2O2(r)
Na tạo Peroxide Na2O2.
+ K, Rb, Cs tạo ?
K(r)+O2(k)→ KO2(r)
+ K, Rb, Cs tạo superoxid MO2.
Trong không khí KHÔ ở điều kiện thường
+ Li: phủ 1 lớp màu xám ?
+ Na: bị oxy hóa thành ?.
+ K: phủ 1 lớp ?
+ Rb và Cs: tự ? tạo thành RbO2 và CsO2.
Li: phủ 1 lớp màu ? Li2O, Li3N
Li: phủ 1 lớp màu xám Li2O, Li3N.
Na: bị ? thành Na2O2 và một ít Na2O.
Na: bị oxy hóa thành Na2O2 và một ít Na2O.
K: phủ 1 lớp ?
K: phủ 1 lớp KO2
Rb và Cs: tự bốc cháy tạo thành ? và ?
Rb và Cs: tự bốc cháy tạo thành RbO2 và CsO2.
Trong không khí ẩm
Các oxid kim loại kiềm tạo thành sẽ kết hợp với hơi nước tạo ? rồi ? kết hợp với CO2 tạo thành muối ?
Các kim loại Na, K, Rb, Cs không/ có phản ứng với nitơ?
Các kim loại Na (nhỏ này bị kì ???), K, Rb, Cs không phản ứng với nitơ.
Tác dụng với các phi kim
- Với Halogen: Các kl kiềm khử Halogen để tạo các ?
- Với Nito: Chỉ có ? phản ứng cho M3N2.
- Với cacbon và silic: chỉ có ? tác dụng trực tiếp khi ?
Với Halogen: Các kl kiềm khử Halogen để tạo các ?
Với Halogen: Các kl kiềm khử Halogen để tạo các HALOGENUA ION:
2M + X2--> 2MX
( iod chỉ phản ứng khi đun nóng )
Với Nito: Chỉ có ? phản ứng cho M3N2.
Chỉ có Li và Na phản ứng cho M3N2.
Với cacbon và silic: chỉ có ? tác dụng trực tiếp khi ?
Với cacbon và silic: chỉ có Li tác dụng trực tiếp khi ĐUN NÓNG cho Li2C2 và Li4Si.
Các oxid kim loại kiềm tạo thành sẽ kết hợp với ? tạo hydroxid rồi hydroxid kết hợp với ? tạo thành muối cacbonat.
Các oxid kim loại kiềm tạo thành sẽ kết hợp với hơi nước tạo hydroxid rồi hydroxid kết hợp với CO2 tạo thành muối cacbonat.
Bảo quản
- Dầu hoả KHAN ( Li, Na, K)
- Trong bình chân không ( Rb, Cs)
Trong công nghiệp, NaH là một ? công nghiệp và là chất khử được dùng để ? các chất khử khác.
Trong công nghiệp, NaH là một base công nghiệp và là chất khử được dùng để điều chế các chất khử khác.
- Khử hydro để tạo hydrua ion (hydrua muối).
2M(r)+H2(k) → 2MH(r)
- Phản ứng mãnh liệt với ACID.
- Khi cho kim loại vào các dung dịch acid, kim loại sẽ phản ứng với ? trước, nếu ? hết sẽ phản ứng với ?.
Khi cho kim loại vào các dung dịch acid, kim loại sẽ phản ứng với acid trước, nếu acid hết sẽ phản ứng với H2O.
TÁC DỤNG VỚI NH3
+ Khi đun nóng kim loại kiềm trong khí NH3
dễ tạo ?
2Na + 2NH3 → 2NaNH2+H2
+ Trong công nghiệp, NaNH2 là hợp chất được dùng nhiều để tổng hợp ? và điều chế ?
+ Khi đun nóng kim loại kiềm trong khí NH3
dễ tạo ?
Khi đun nóng kim loại kiềm trong khí NH3
dễ tạo amidua
2Na + 2NH3 → 2NaNH2+H2
+ Trong công nghiệp, NaNH2 là hợp chất được dùng nhiều để tổng hợp ? và điều chế ?
Trong công nghiệp, NaNH2 là hợp chất được dùng nhiều để tổng hợp thuốc nhuộm và điều chế NaCN.
Các oxid của kim loại kiềm là các chất ?, là oxid ?, là các hợp chất ion, rất bền/ không bền? với nhiệt, nóng chảy ở nhiệt độ thấp/ cao?
Các oxid của kim loại kiềm là các chất rắn là oxid base, là các hợp chất ion, rất bền với nhiệt, nóng chảy ở nhiệt độ cao.
VD: Na2O
các peroxid
R-O-O-R
- Na2O2 + 2H2O -> 2NaOH + H2O2 (tẩy rửa, oxy già)
sau đó : H2O2 -> H2O + 1/2 O2
Nên peroxid là chất ?, nhưng nếu gặp chất ? mạnh hơn, nó thể hiện tính?
--> Nên peroxid là chất OXH MẠNH, nhưng nếu gặp chất OXH mạnh hơn, nó thể hiện tính KHỬ.
Na2O2, K2O2 tác dụng với khí CO2 và CO : có tác dụng để???
+) 2Na2O2(r) + 2CO2(k) → 2Na2CO3(r) + O2(k)
--> Ứng dụng?
+) Na2O2(r) + CO2(k) → Na2CO3(r)
--> Ứng dụng?
+) 2Na2O2(r) + 2CO2(k) → 2Na2CO3(r) + O2(k)
--> Ứng dụng: Dùng trong bình lặn, tàu ngằm, phi thuyền.
+) Na2O2(r) + CO(k) → Na2CO3(r)
--> Ứng dụng: Dùng trong mặt nạn phòng độc.
+) Na2O2 còn có trong bột giặc ?
+) Na2O2 còn có trong bột giặc ?
+) Na2O2 dùng để tẩy trắng vải sợi do PHÓNG THÍCH H202 khi tan trong nước.
Na2O2 + 2H2O -> 2NaOH + H2O2
CÁC SUPEROXID.
( là oxid có chứa ion O2- trong mạng lưới tinh thể).
KO2, RbO2
superoxide khi tác dụng nước: cho cái j ???
---> là chất j mà mạnh???
superoxide khi tác dụng nước: cho cái j ???
---> là chất j mà mạnh???
superoxide khi tác dụng nước: cho base, H2O2, và O2
4KO2 + 6H2O -> 4KOH + 4H2O2 + O2
---> là chất oxy hoá mạnh.
Ứng dung: nhìn mà k biết?
OZONIT
( là oxicd có chứa ion O3- trong mạng lưới tinh thể.)
KO3,RbO3
khi tác dụng với nước chúng giải phóng o2 với lượng nhiều hơn.
CÁC HYDROXID MOH
- hydroxid kim loại kiềm là các chất rắn có màu gì ?, dễ/không dễ tan trong nước ( trừ nhỏ nào), và là chất gì ( đụng vô là giật) nên là---> những base ? ( Tốp mấy) trong tất cả các base.
- hydroxide Kim loại kiềm là các chất rắn có màu trắng, dễ tan trong nước ( trừ LiOH) và là chất ĐIỆN LY MẠNH nên là ---> những base mạnh 1 trong tất cả các base.
Kiềm ăn da:
Xút ăn da: NaOH
phá huỷ giấy, vải, da
Các MOH dễ tan trong H20 và ?. Hút ẩm yếu/ mạnh? --> ????? trong không khí.
Các MOH dễ tan trong H20 và rượu. Hút ẩm mạnh
--> chảy rửa trong không khí.
Ở Trạng thái ? các MOH ?? thuỷ tinh, sứ, và nếu có ?? thì phá huỷ cả Pt, nên ---> để nấu chảy chúng thì phải dùng chén ?,? hoặc ?
Ở Trạng thái NÓNG CHẢY các MOH ĂN MÒN thuỷ tinh, sứ, và nếu có KHÔNG KHÍ thì phá huỷ cả Pt, nên ---> để nấu chảy chúng thì phải dùng chén Fe, Ni hoặc Ag.
*Lí do: Các kim loại như sắt (Fe), niken (Ni) hoặc bạc (Ag) có độ bền cao trong môi trường nhiệt độ cao và không bị ăn mòn hoặc oxi hóa dễ dàng bởi các hợp chất kiềm.
Trong các hydroxid chất nào quan trọng NHẤT, được dùng để sản xuất chất tẩy rửa, xà phòng, giấy, tơ nhân tạo.
NaOH
2NaOH + Cl2 → NaClO + NaCl + H2O : nước javel
Tác dụng độc hại của các chất kiềm: các chất kiềm mạnh NaOH, KOH tan/ không tan trong nước, có tính đốt cháy da và niêm mạc do ??? và có thể làm thủng ống?
Các chất kiềm mạnh NaOH, KOH tan nhiều trong nước, có tính đốt cháy da và niêm mạc do LÀM TAN ANBUMIN và có thể làm thủng ống tiêu hoá.
---> Tính ăn mòn cực cao.
---> Mức độ phụ thuộc vào nồng độ chất kiềm và VỊ TRÍ TIẾP XÚC.
Muối của các kim loại kiềm:
Phần lớn là các hợp chất ?, ở dạng? và có/không màu. Có nhiệt độ nóng chảy ? và ? khi nóng chảy.
Muối của các kim loại kiềm:
- Phần lớn là các hợp chất ion, ở dạng tinh thể và không màu. Có nhiệt độ nóng chảy cao và DẪN ĐIỆN khi nóng chảy.
Muối của các kim loại kiềm:
- Đa số dễ tan trong nước trừ các muối của ?. Vì sao.
LiCl và LiBr
do Li+ có kích thước ? nên có ? với nước và lại có Delta H hoà tan >0 .
---> nên được làm ?
LiCl và LiBr
do Li+ có kích thước ? nên có ? với nước và lại có Delta H hoà tan >0 .
---> nên được làm ?
LiCl và LiBr
do Li+ có kích thước NHỎ nên có ÁI LỰC MẠNH với nước và lại có Delta H hoà tan >0 .
---> nên được làm CHẤT CHỐNG ẨM VÀ CHẤT LÀM MÁT KHÔNG KHÍ
( CÓ trong máy hút ẩm, máy lạnh.)
Muối qtrong NHẤT của kl kiềm?
NaCl
trong CN nó được dùng hằng triệu tấn/ năm để sx Na, NaOH, Cl2, H2, NA2CO3, Na2SO4, hay điều chế muối ăn tinh khiết.
NaCl ---dpnc→ 2Na + Cl2 bay hơi
2NaCl + 2H2O (DPDDCMN) → NaOH(X) + Cl2↑ (anot) + H2↑ (catot)
Na2SO4 rất quan trọng trong công nghiệp ?; Hcl cần thiết trong sản xuất thép, nhựa, sợi và thực phẩm.
Na2SO4 rất quan trọng trong công nghiệp giấy; Hcl cần thiết trong sản xuất thép, nhựa, sợi và thực phẩm.
2nacl +h2so4 -> na2so4 + 2hcl
Nacl
- Dùng làm thuốc cung cấp ?
Nacl
- Dùng làm thuốc cung cấp CHẤT ĐIỆN GIẢI.
Dung dịch NaCl 9% đẳng trương dùng để?
- dùng để tiêm truyền tĩnh mạch
- cung cấp bổ sung nước và các chất điện giải trong các TH tiêu chảy, sốt cao, sau phẫu thuật, mất máu và các TH mất nước khác.
- Dùng để tưới, rửa các mô bị tổn thương.
Na + là cation dùng để ?? tác dụng dược học của các thuốc hữu cơ như ?
Na + là cation dùng để tối ưu hoá tác dụng dược học của các thuốc hữu cơ như Na- phenolbarbital ( thuốc gây ngủ, giãn cơ), Na sulfamit ( thuốc kháng khuẩn).
Na+ có khuynh hướng ? trong mô gây phù, nên các muối Na+ cần được use thận trọng trong điều trị các bệnh?
Na+ có khuynh hướng giữ nước trong mô gây phù, nên các muối Na+ cần được use thận trọng trong điều trị các bệnh TIM MẠCH VÀ THẬN.
Na- phenolbarbital
huốc gây ngủ, giãn cơ
thuốc kháng khuẩn
Na sulfamit
Li2co3 dùng để điều trị và phòng ngừa các rối loạn cảm xúc ?, Khi điều trị phải kiểm soát ? nồng độ Li+ trong máu vì ?
Li2co3 dùng để điều trị và phòng ngừa các rối loạn cảm xúc LƯỠNG CỰC, Khi điều trị phải kiểm soát CHẶT CHẼ nồng độ Li+ trong máu vì ?
Vì cation Li+ ở nồng độ CAO có ĐỘC TÍNH.
Kcl dùng làm
phân đạm
Kno3
dùng làm thuốc nổ, pháo hoa, phân đạm.
na2co3 (natri cacbonat)
dùng như một base công nghiệp, làm giấy, xà phòng, thuỷ tinh.
nahco3 ( natri hydrocacbonat)
tách Co2 ở nhiệt độ tháo (50-100 độ C) được dùng làm bột nở bánh mì và trong bình chữa cháy.
Na+ chiếm khoảng? trọng lượng cơ thể.
Na+ chiếm khoảng 0,26% trọng lượng cơ thể.
Na+ là nguyên tố ? dịch ngoại bào, cùng với. ? duy trì áp suất thẩm thấu cho dịch ngoại bào, giúp điều hoà cân bằng ? của cơ thể.
Na+ là nguyên tố QUAN TRỌNG NHẤT CỦA dịch ngoại bào, cùng với CL-, HCO3- duy trì áp suất thẩm thấu cho dịch ngoại bào, giúp điều hoà cân bằng ACID- BASE MỘT SỐ DỊCH VỊ của cơ thể.
Natri được đào thải CHỦ YẾU QUA
ĐƯỜNG BÀI TIẾT của cơ thể.
Na có trong?
xương, cơ, trong tb và máu.
Nguồn cung cấp chính natri cho cơ thể là
nacl trong gia vị nấu ăn.
kali chiểm khoảng? trọng lượng cơ thể.
0,7% là ion của tổ chức.
kali cùng với một số ion khác của NỘI BÀO tạo ? cho dịch nội bào.
kali cùng với một số ion khác của NỘI BÀO tạo ÁP SUẤT THẨM THẤU cho dịch nội bào.
kali tham gia dẫn truyền xung động thần kình, điều hoà sự co bóp của ?.
kali còn tham gia vào ? của hồng cầu, hoạt hoá nhiều?, giúp cho việc giữ nước của cơ thể.
- kali tham gia dẫn truyền xung động thần kình, điều hoà sự co bóp của cơ tim và cơ xương.
- kali còn tham gia vào HỆ THỐNG ĐỆM của hồng cầu, hoạt hoá nhiều ENZIME giúp cho việc giữ nước của cơ thể.
kali có trong máu, cơ và ?. HẠ kali máu gây mỏi?
kali có trong máu, cơ và MÔ THẦN KINH. HẠ kali máu gây mỏi CƠ VÀ TIM ĐẬP NHANH...
Đang học (90)
Bạn đã bắt đầu học những thuật ngữ này. Tiếp tục phát huy nhé!