Oxygen transport
1/28
Earn XP
Description and Tags
Schaad
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
29 Terms
Hémoglobine
Vertébrés
Protéine tétramérique avec groupement hème (Fe²⁺).
Transport réversible de max 4O₂ (sélectif = not CO₂ etc)
45 % du volume cytoplasmique des globules rouges (++ soluble)
Myoglobine
Protéine monomérique dans les muscles (Fe²⁺)
Stockage temporaire d’O₂ dans muscles (++ affinité)
Lab mice can survive without
Hémocyanine
Mollusques et antropodes (Cu²⁺)
Hémérythrine
invertébrés marins (Fe)
érythrocytes
Globules rouges
détection fixation hémoglobines
Fixation ligand sur Fe affecte états électroniques → change absorption de la lumière.
Forme sans oxygène ~ pourpre
Forme avec oxygène ~ rouge
Heme structure
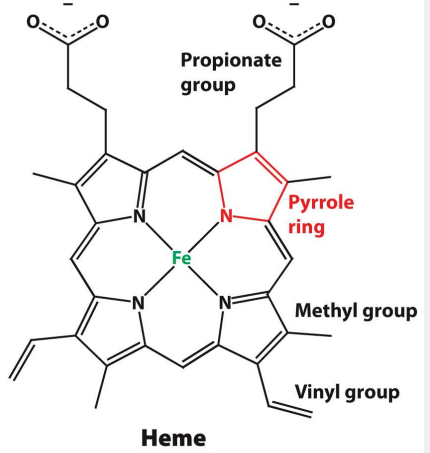
His E7 (distale)
Histidine dans cavité de l’hème, proche site de liaison de l’oxygène
Stabilise l’O₂ lié au Fe²⁺ par liaison hydrogène
Fixation CO moins stable
mutation His E7 → Gly
Glycine = apolaire = pas liaison H avec O₂
Perte de stabilisation de l’O₂ → l’affinité de la myoglobine pour O₂ diminue
Fixation de CO plus stable → l’affinité relative CO augmente → la myoglobine devient ++ sensible au CO.
Hb met
oxidée (Fe 3+) → no O2 transport
état stable proche de R
Hémoglobine structure
structure globine (intéraction αβ-αβ)
assemblage stable 4 myoglobines (monomérique)
dimère de dimères (αβ)2 (tétramérique)
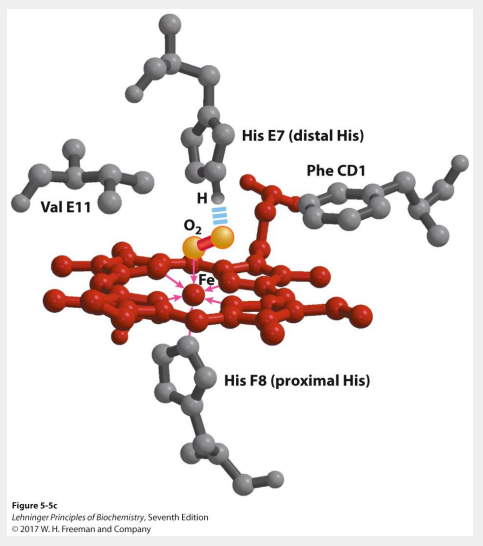
Efficacité transport O2 hémoglobine
Kd élevé quand pO2 faible
Kd faible quand pO2 élevé
Kd ↓ quand pO2 ↑
Coopérativité n
récepteur multi ligand
intéractions entre sites fixation
<1 : affinité ↓ ligands fixés ↑
>1 : affinité ↑ fixés ↑
Relation de Hill
θ = Ln/ (Kd+Ln) = Ln/ (L50%n+Ln)
Coopérativité Hb/Mb
0.66 / 0.11
Source coopérativité Hb
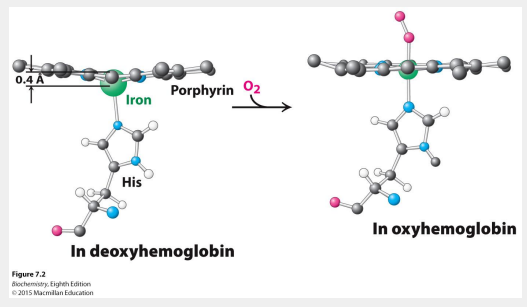
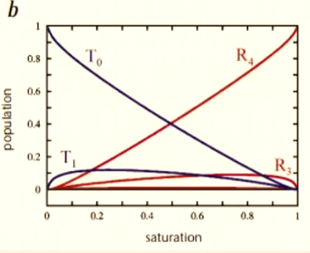
Fixation de ligand sur hémoglobine → déplacement du Fe(II) → changements de conformations (relaxed R to tense T)
Distance sites fixation Hb
Deoxy-Hb Intra dimer : 25 Å / Inter dimer : 34 – 39 Å
Oxy-Hb Intra dimer : 25 Å / Inter dimer : 34 – 35 Å
Tense state
> d’interactions entre dimères
> stable
< affinité pour O2
Relaxed state
< interactions
> flexible
grande affinité pour O2
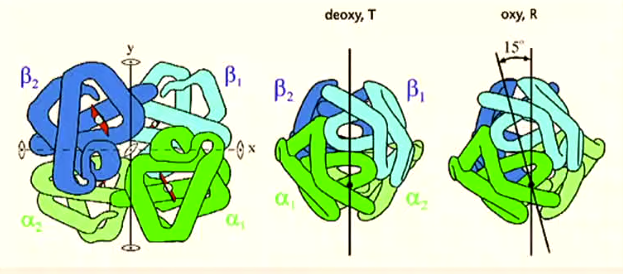
T → R
rupture ponts salins dans région interface α1 − β2
Rotation des dimères αβ liés symétriquement de ~ 15 ° l'un par rapport à l'autre et une translation de ~ 0,1 nm le long de l'axe de rotation.
mécanisme MWC
Équilibre R/T
Hors poumons : ↑CO2 ↓pH
H+ se lient à Hb et stabilisent l’état T
Protonation His 146 → formation d’un pont salin avec l’Asp94
↓ pH → déplace équilibre R-T vers T → ↑ O2 libérés au voisinage des tissus actifs → effet Bohr
Allostérie
Modification de la réactivité d’une molécule par substrat via site non actif de la protéine
2,3 DPG
Régulateur ↓ hémoglobine affinité pour l’oxygène
Quantités mM dans globules rouges
Produit lors de la glycolyse
Petite molécule chargée −
Lié dans cavité centrale de Hb dans état T
Favorise état T
HbF
↑ affinité oxygène
quatre sous-unités protéiques: 2 sous-unités α et 2sous-unités γ
même structure
anémie falciforme
Mutation Glu6 → Val dans chaîne 𝛽 de l’hémoglobine
Glu6 permet la liaison avec autre molécule Hb
Polymérisation → forme fibres déformant les globules rouges
Homozygotes : non viable
Hétérozygotes : ↑ résistance paludisme mais attaques catastrophiques imprévisibles possibles