organische Chemie
1/14
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
15 Terms
teilweise Verbrennung von Alkoholen
Ein Prozess, bei dem Alkohole in Gegenwart von Sauerstoff, indem man ein glühendes Kupferblech in Alkohol abschreckt.
Primärer Alkohol → Aldehyde → Carbonsäure → X
Sekundärer Alkohol → Keton → X
Tertiärer Alkohol → X
Redoxreaktionen
Chemische Reaktionen, bei denen es zu einer Übertragung von Elektronen zwischen Reaktionspartnern kommt, die eine Oxidation und eine Reduktion einschließen
Oxidation = -e
Reducktion = +e
Bei Molekülen werden Oxidationszahlen verwendet
Radikale Substitution
Startreaktion: Br-Br -Licht-> Br + Br
Kettenfortführungsreaktion (startet mit Radikal(en) bildet Radikal(e): CH4 + Br —> CH3 + H-Br
CH3 + Br-Br —> H3C-Br + Br
H3C-Br + Br —> H2C-Br + H-Br
CH3 + CH4 —> CH4 + CH3
Br-Br + Br —> Br + Br-Br
Kettenabruchreaktion (beginnt mit Radikalen es entstehen Moleküle): CH3 + CH3 —> C2H6
CH3 + Br —> H3C-Br
Br + Br —> Br-Br
=> Man kann nicht kontrollieren was entsteht
Addition
Typisch für ungesättigte Verbindungen bei denen Atome an Molekül mit mindestens einer Doppelbindung angelagert werden
Elektrophile Addition
Durch Angriff eines elektrophilen Teilchens z.b. Br-Br
Halogenmolekül in Wechselwirkung mit Doppelbindung des Alkens → Halogen polarisiert und Elektronenbindung heterolytisch gespalten (pi-Komplex). Es entsteht ein kurzlebiges ringförmiges Kation (Sigma-komplex)
Halogenid-Ion greift von der Rückseite das positivierte C-Atom an
gesättigtes Produkt entsteht
Nucleophile Substitution
Nukleophile: negativ geladene Ionen oder polare sowie leicht polarisierte Teilchen mit ihrem negativen Pol. Sie greifen den Reaktionspartner in Bereichen niedriger Elektronendichte an. (OH-, Br-) häufig Halogenalkane
die C-Cl Bindung wird heterolylisch gespalten
H3C-CH3-CH3-C-Cl —> H3C-C-CH3-CH3(+) + Cl-
Dabei entstehen ein Carbenion-Ion als Zwischenstufe und ein Chlor-Ion
Im zweiten Schritt greift das OH-Ion an
H3C-C-CH3-CH3(+) -OH —> H3C-CH3-CH3-C-O-H
Es bildet sich eine neue Bindung aus
C(S+)-O-H + Nu(+) —> C(S+)-Nu(S-) + OH-
Info: Veresterung ist auch eine Nukleophile Substitution, bei der aber kein Kation entsteht
Halogenalkan → Alkohol oder andersrum
Carbonsäure
Carboxygruppe (C Doppelbindung zu o und einfachbindung zu OH)
Eigenschaften: Siedetemp höher als Alk da Wasserstoffbrückenbindung und Dipol-Dipol
Acidität: protolysiert in in Wasser zu Carboxylat-Ion(mesomeriestabilisiert, da Elektronen delokalisiert sind)und Oxonium-Ion
Alken
Doppelbindung zwischen C Molekülen
Alkan
Ein Kohlenwasserstoff mit nur Einfachbindungen zwischen den Kohlenstoffatomen.
Alkanol
Ein Alkohol, der eine Hydroxylgruppe (–OH) enthält, die an ein Alkan gebunden ist.
Bildung:
alkoholische Gärung
Nucleophile Substitution von halogenalkanen
intramolekular: Wasserstoffbrückenbindung → viskosität, Löslichkeit, siedetemp
Mehrwertige Alkohole haben mehr OH Gruppen
Alkanal
Ein Aldehyd, der durch eine Carbonylgruppe (C=O) am Ende der Kohlenstoffkette charakterisiert ist.
Nachweis durch Oxidation in Tollens-Reagenz und Benedict-Reagenz
Intramolekular: Dipol-Dipol
Siedetemp: Alkane<Aldehyd<Alkohol
Keton
Ein Molekül, das eine Carbonylgruppe (C=O) enthält, die zwischen zwei Kohlenstoffatome gebunden ist.
Ester
Eine Verbindung, die aus der Reaktion eines Alkohols mit einer Carbonsäure gebildet wird
Carbonsäure + Alkohol -Kondensation→ Ester (Estergruppe: Doppelbindung von c und o und einfachbindung von c zu o mit Rest) + H2O
H2O + Ester -Hydrolyse→ Carbonsäure + Alkohol
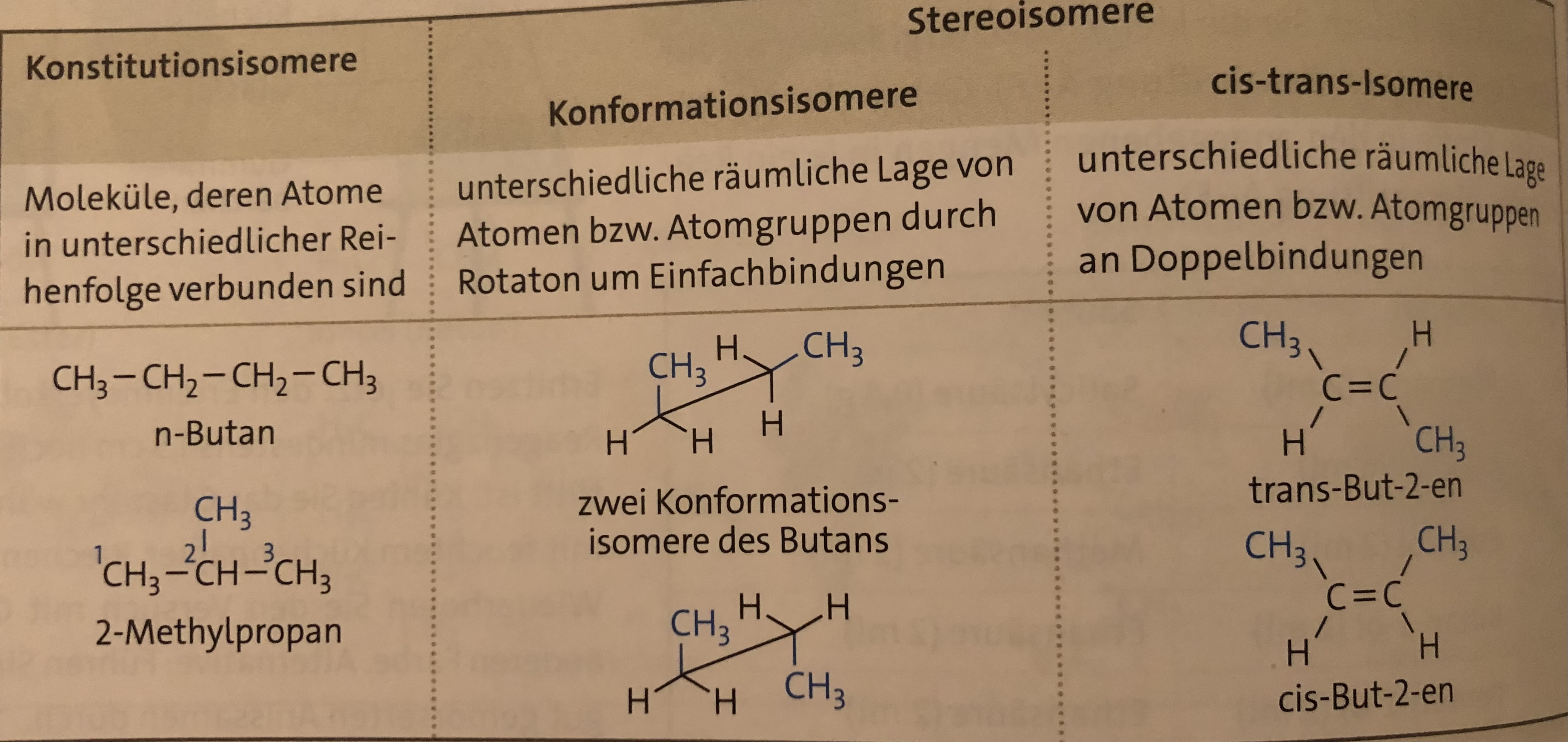
Isomere
Induktiver Effekt
Elektronischer Effekt der durch EN auf die Elektronenverteilung im Molekül ausübt
+i-Effekt = erhöht Elektronendichte an benachbarten Atome
-i-Effekt = verringern Elektronendichte an benachbarten Atomen