areny - teorie + reakce (copy)
1/12
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
13 Terms
pravidla aromaticity
cyklické sloučeniny, které jsou vždy planární (placaté)
vodík v hybridizaci sp2 (dvojná vazba)
konjugovaný systém dvojných vazeb
myšlenkovým posunem pí elektronů po cyklu musí být možno odvodit alespoň 2 resonanční struktury
Hückleovo pravidlo - počet delokalizovaných pí elektronů v kruhu je vždy roven hodnotě 4n+2
n kladné celé číslo
např. u benzenu 4n+2 = 6 => n=1
typické reakce
elektrofilní aromatické substituce (EAS)
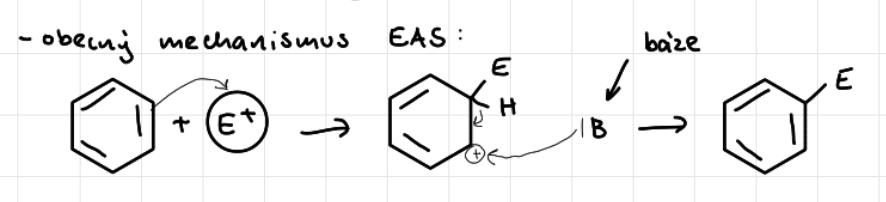
obecný mechanismus EAS
halogenace
reakce s chlorem nebo bromem
katalýza Lewisovými kyselinami (např. AlCl3 a FeCl3)
produktem halogenderivát
nitrace
navazuje se skupina -NO2
reakce s nitrační směsí (HNO3 + H2SO4)
sulfonace
reakce se směsí HS2O4, SO2 a SO3
vznikají sulfonové kyseliny (na benzenové jádro navázaná -HSO4 skupina)
Friedel-Craftsova alkylace
navazování uhlovodíků
použití halogenalkanů
katalyzátor AlCl3 nebo FeCl3
Friedel-Craftsova acylace
použití acylhalogenidu
katalýza AlCl3 nebo FeCl3
výjimkou je vznik aldehydu
substituenty první třídy
halogeny, alkoholy, cokoliv navázané jednoduchou vazbou přes kyslík (-O-R), alkyly (zbytky)
diriguje do poloh ortho a para
substituenty druhé třídy
nitro skupina (-NO2), sulfonové kyseliny (-SO3H), aldehydy, ketony, nitrily
diriguje do polohy meta
adice - hydrogenace
při mírnějších podmínkách katalýza iridiem a rhodiem
při drsnějších podmínkách (teplota, tlak) katalýza niklem
redukce až na alkan
oxidace
katalýza CO2
navazuje se -COOH skupina
chlorace
katalýza chlorem, iniciace UV zářením
chlor se navazuje na všechny uhlíky