Bioquimica I - Marks - Cap 4 - Agua, acidos, bases y amortiguadores
1/26
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
27 Terms
Agua
Molécula dipolar con una distribución desigual de electrones entre los átomos de H y O
Forma puentes de hidrógeno con otras moléculas polares
Solvente universal
Reacciones metabolicas se dan en solcuones acuosas
60% del peso corporal: ¾ LIC y 1/3 LEC
Puentes de hidrógeno en el agua
La naturaleza dipolar (carga parcial negativa en el O y carga parcial positiva en el H) de las moléculas de agua permite formar puentes de hidrógeno, una propiedad que posibilita la función del agua como solvente.
*Un puente de hidrógeno es una interacción debil no covalente entre el hidrogeno de una molecula y el atomo mas electronegativo de una molecula receptora (Oxigeno)
pH
El agua se disocia en cierta medida para formar iones hidrógeno e hidroxilo.
Agua como solvente
Moleculas organicas polares y sales inorgales se disuelven con rapidez por los puentes de hidrogeno e interacciones electrostaicas con esas moleculas
Moleculas organicas contienen una elevada proporcion de atomos electronegativos se disuelven por los puentes de hidrogeno con el agua
Los aniones (Cl- y HCO3-) son atraidos y rodeados por hidrogeno del agua
Los cationes (Na+ y K+) son atraidos y rodeados por oxigeno del agua
Agua y regulacion termica
Las estructura del agua permite resistir el cambio de temperatura
Punto de fusion es alto: es necesaria una reduccion de la temperatura para convertir el agua liquida al estado solido
Conductividad termica alta: fascilita la disipación del calor
Punto de ebullición alto: es necesaria alta energia para evaporarse
Responde al calor reduciendola amplitud de los puentes de hidrogenos
Electrolitos principales en el LEC (plasma y liquido intersticial)
Electrolitos principales en el LIC
Electrolitos principales en el LEC (plasma y liquido intersticial): Na+ y Cl+
Electrolitos principales en el LIC: K+ y HCO3-
Osmolalidad y movimiento del agua
Osmolalidad = concentracion de todas las moleculas disuelta
Agua se mueve de un comportamiento con baja concentracion de solutos (baja osmolalidad) a uno con alta concentración para alcanzar una osmolalidad igual en ambos lado
Constante de disociación para el agua kd
Expresa la relacion entre [H], [OH] y [H2O] en equilibrio
Los acidos organicos son acidos debiles que se disocian solo a un grado limitado en agua. En general, un acido debil (AD) conocido como acido conjugado, se disocia en
Un ion hidrogeno y un componente anionico (A-), llamado base conjugada
Presion osmotica
La fuerza que se necesita para mantener la misma cantidad de agua en ambos lados de la membrana.
pH
Logaritmo negativo de la concentración de iones de hidrógeno
Acido
Sustancia que puede liberar iones hidrógeno (protones)
*Un acido fuerte: Casi todas las moléculas de un ácido fuerte se disocian y liberan sus iones de hidrógeno
*Un acido debil: Solo un pequeño porcentaje del total de las moléculas se disocia
Base
Sustancia que puede aceptar ione de hidrógeno
Constnte de disociación Ka
a. Cuantifica el grado de disociación de un ácido débil: tendencia de un acido para disociarse y donar un ion hidrogeno a la dolucion
b. Cuanto mayor es el valor de Ka más fuerte es el ácido y viceversa, porque mayor es su tendencia a disociarse.
Amortiguadores
Mezcla de un acido no disociado y su base conjugada (la forma del acido qu eha perdido su protón), dando una solución que resiste el cambio de pH cuando se agregan H u OH
Un amortiguador tiene mayor capacidad de amortiguar cuando
a. Los limites de pH son cercanos a su pKa
b. Su concentración es alta: contienen un numero total mayor de moleculas de amortiguador por unidad de volumen que se pueden disociar o recombinar con los iones hidrogeno
El pKa
es una medida numérica de la acidez de un compuesto, específicamente el logaritmo negativo de la constante de disociación ácida (Ka).
Indica la tendencia de una molécula a donar o retener un protón (H+), y un valor de pKa más bajo significa un ácido más fuerte, es decir, que se disocia más fácilmente y con mayor facilidad.
Acidos y bases metabolicos
El metabolismo normal genera CO2 (reacciona con H2O parar formar acido carbonico), acidos metabolicos (acido lactico y cuerpos cetonicos) y acidos inorganicos.
Para mantener un pH normal, el cuerpo tiene amortiguadores: bicarbonato, fosfato y hemoglobina,
Procesos de respiración: remueven H2CO2 a traves de exhalacion CO2
Riñones excretan el acido como ion amonio NH4 y otros iones
Sistema amortiguador de bicarbonato
Acidosis respiratoria
Compensacion renal: El CO2 se combina con agua, y junto a la anhidrasa carbónica da resultado a H2CO3, que es un acido debil que disocia de manera parcial el H+ y el anion bicarbonato (HCO3).
Factores del equlibrio acido base, relacion entre pH, HCO2 y pCO2
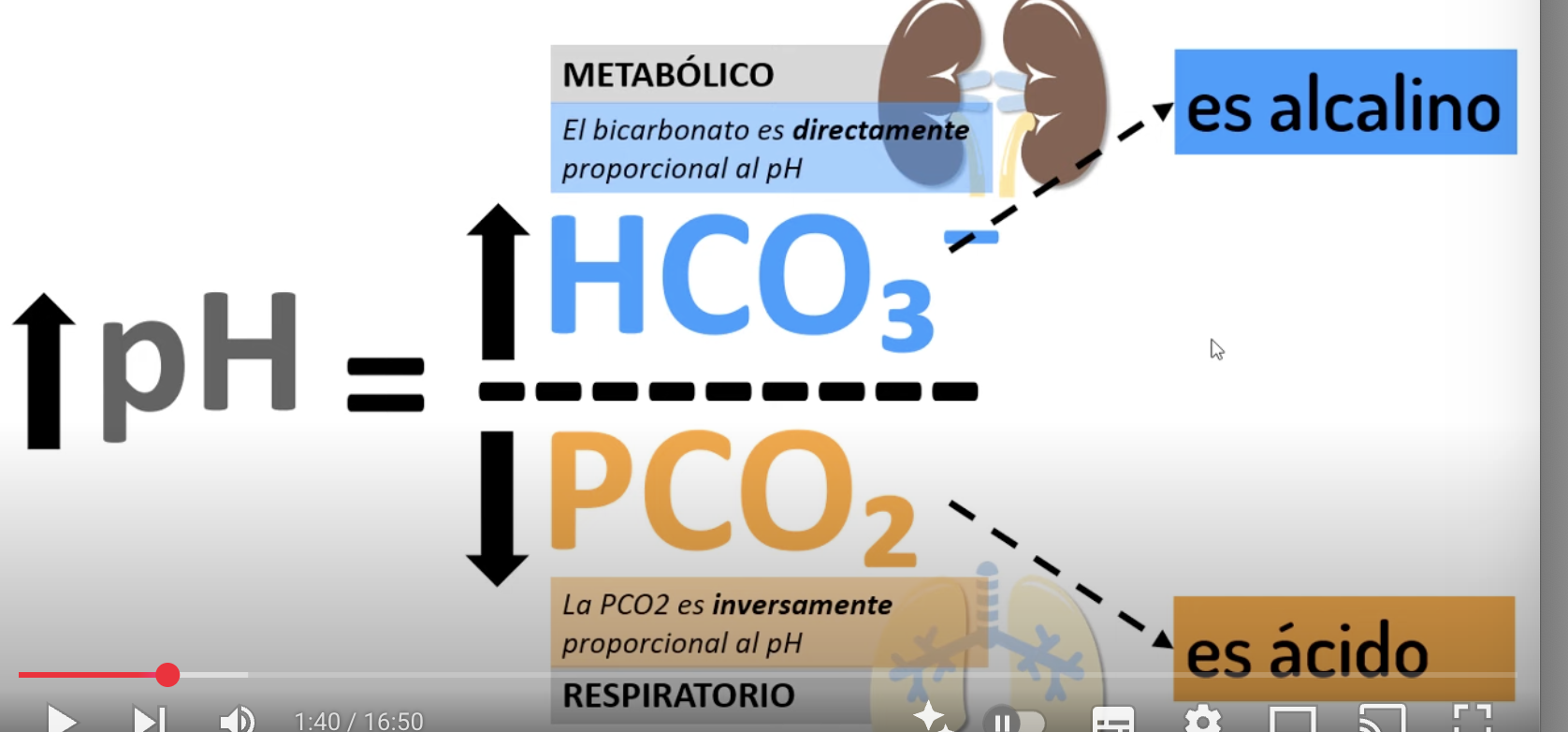
El pH está por debajo y la pCO2 es mayor que el rango normal, se trata de:
Acidosis respiratoria
Causa: hipoventilación
Compensación renal (retiene HCO3 y excreta H+ por la orina)
El pH está por debajo y la HCO2 es menor que el rango normal, se trata de:
Acidosis metabolica
Causa: Diarreas, diabetes, vomitos
Compensación respiratoria: pulmones empiezan a hiperventilar
El pH está por encima y la HCO2 es mayor que el rango normal, se trata de:
Alcalosis metabolica
Causa: dureticos, vomitos, etc
Compensacion respiratoria: Hipoventilacion para retener CO2
El pH está por encima y la pCO2 es menor que el rango normal, se trata de:
Alcalsosis respiratoria
Causa: Hiperventilacón
Compensación renal: Riñones eliminación de HCO3- por orina
Alteraciones metabolicas vs alteraciones respiratorias
Metabolicas: HCO3 se ve afectado
Respiratorias: CO2 se ve afectado