UNIDAD 4 - Termodinámica
5.0(1)Studied by 3 people
Card Sorting
1/45
Earn XP
Description and Tags
Last updated 8:04 PM on 2/3/23
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
46 Terms
1
New cards
==**CERO ABSOLUTO**==
Temperatura en la cual la Ec de las moléculas es 0.
2
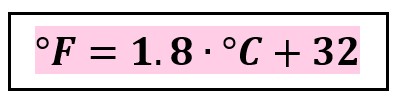
New cards
**°C a °F**
\
3
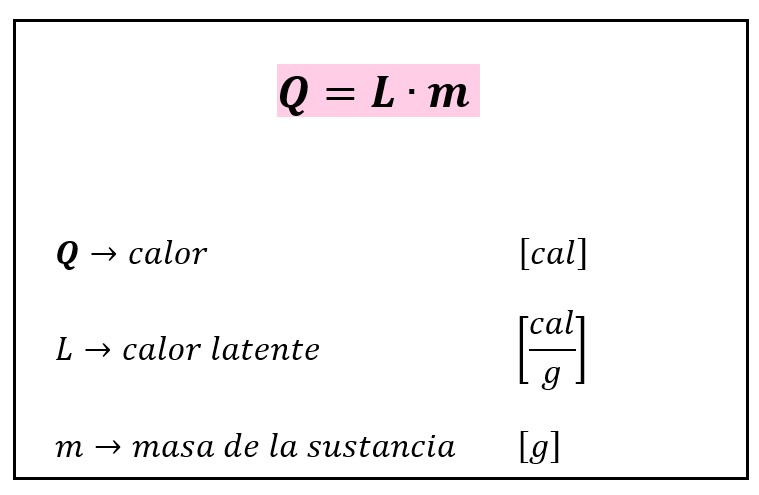
New cards
**°F a °C**
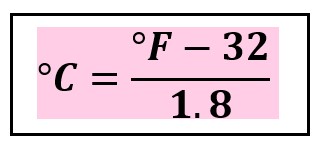
4
New cards
**°C a K**
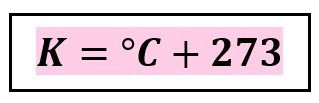
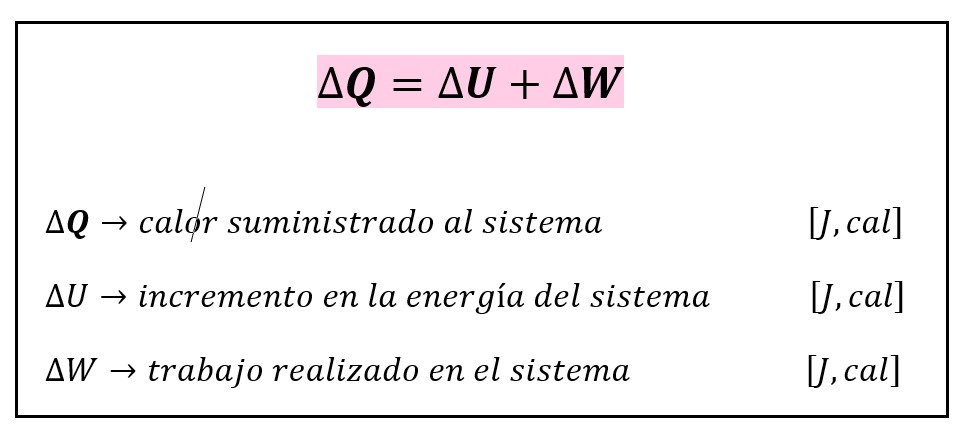
5
New cards
**K a °C**
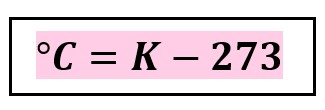
6
New cards
==**TEMPERATURA**==
Medida de la energía molecular de un cuerpo.
7
New cards
==**CALOR**==
Energía en tránsito.
8
New cards
%%FORMAS DE TRANSFERIR CALOR%%
* conducción
* convección
* radiación
* convección
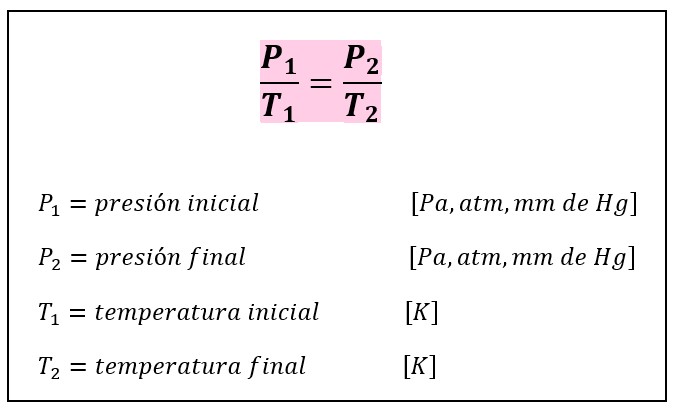
* radiación
9
New cards
==**CONDUCCIÓN**==
Se da en sólidos, debido al choque de las moléculas del cuerpo con el otro en que está en contacto.
10
New cards
==**CONVECCIÓN**==
Se da entre fluidos.
11
New cards
==**RADIACIÓN**==
Se da a través de ondas electromagnéticas.
12
New cards
==**CALORÍA**==
Cantidad de calor necesaria para elevar 1°C la temperatura de 1 g de agua.
13
New cards
**1 caloría**
4\.2 Joules
14
New cards
==**CAPACIDAD CALORÍFICA**==
Razón que existe entre la cantidad de calor que recibe un cuerpo y su incremento de temperatura.
15
New cards
FÓRMULA DE LA CAPACIDAD CALORÍFICA

16
New cards
==**CALOR ESPECÍFICO**==
Razón que existe entre la capacidad calorífica de una sustancia y su masa.
17
New cards
FÓRMULA DEL CALOR ESPECÍFICO

18
New cards
==**CALOR LATENTE**==
Energía necesaria para cambiar de estado de agregación.
19
New cards
* %%CALOR LATENTE DE FUSIÓN%%
Sólido a liquido.
20
New cards
* %%CALOR LATENTE DE VAPORIZACIÓN%%
Líquido a gas.
21
New cards
FÓRMULA DE CALOR LATENTE
22
New cards
==**EQUILIBRIO TÉRMICO**==
Es el intercambio neto de energía calorífica entre dos cuerpos.
23
New cards
FORLUMA DE EQUILIBRIO TÉRMICO

24
New cards
==**TERMIDINÁMICA**==
Estudia la transformación del calor en trabajo y viceversa.
25
New cards
%%1° LEY DE TERMODINÁMICA%%
“La materia no se crea ni se destruye, solo se transforma”.
26
New cards
FÓRMULA DE LA 1° LEY DE TERMODINÁMICA
27
New cards
%%2° LEY DE TERMODINÁMICA%%
Es imposible construir una máquina térmica que transforme todo el calor en trabajo.
28
New cards
FÓRMULA DE LA 2° LEY DE TERMODINÁMICA

29
New cards
==**MATERIA**==
Está formada por protones (+), electrones (-) y neutrones, partículas que forman átomos.
30
New cards
* %%PROPIEDADES GENERALES DE LA MATERIA%%
Depende de la cantidad de materia.
* peso
* volumen
* porosidad
* peso
* volumen
* porosidad
31
New cards
* %%PROPIEDADES ESPECIFÍFICAS DE LA MATERIA%%
No dependen de la cantidad de materia.
* punto de fusión
* punto de ebullición
* densidad
* punto de fusión
* punto de ebullición
* densidad
32
New cards
==**DENSIDAD**==
Es la masa por unidad de tiempo de un cuerpo.
33
New cards
FÓRMULA DE LA DENSIDAD

34
New cards
==**TEORÍA CINÉTICA DE LOS GASES**==
* las moléculas de un gas se mueven en línea recta y al zar.
* el movimiento se modifica si las moléculas chocan entre sí o con las paredes del recipiente.
* la energía cinética de las moléculas es proporcional a la temperatura absoluta del gas.
* el movimiento se modifica si las moléculas chocan entre sí o con las paredes del recipiente.
* la energía cinética de las moléculas es proporcional a la temperatura absoluta del gas.
35
New cards
==**PRESIÓN**==
Fuerza aplicada entre el área aplicada.
36
New cards
FÓRMULA DE LA PRESIÓN

37
New cards
==**LEY GENERAL DEL ESTADO GASEOSO**==
Establece la constante relación entre presión, volumen y temperatura.
38
New cards
FÓRMULA DE LA LEY GENERAL DEL ESTADO GASEOSO

39
New cards
==**LEY DE BOYLE**==
A __temperatura constante__, el volumen de una masa dada de un gas ideal es inversamente proporcional a la presión a que se encuentra sometido, en consecuencia, el producto de la presión por su volumen es constante.
40
New cards
FÓRMULA DE LA LEY DE BOYLE

41
New cards
==**LEY DE CHARLES**==
A __presión constante__, el volumen de una masa dada de un gas ideal, varia directamente proporcional a su temperatura.
42
New cards
FÓRMULA DE LA LEY DE CHARLES

43
New cards
==**LEY DE GAY - LUSSAC**==
A __volumen constante__, la presión del gas, varia directamente proporcional a su temperatura.
44
New cards
FÓRMULA DE LA LEY DE GAY - LUSSAC
45
New cards
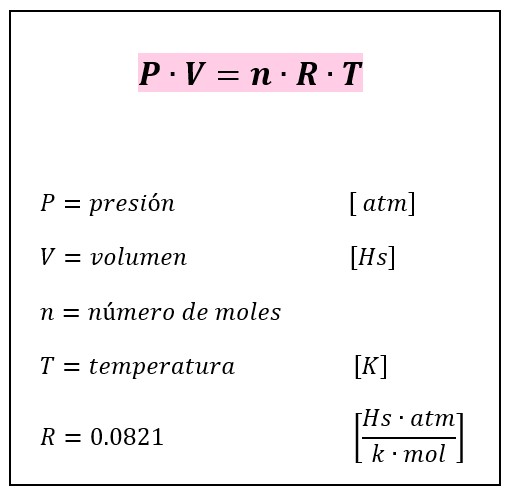
==**LEY DE LOS GASES IDEALES**==
Expresa la relación entre el volumen, la temperatura, la presión y el número de moles de una masa gaseosa.
46
New cards
FÓRMULA DE LA LEY DE LOS GASES IDEALES