Bioquimica I - Enzimas
1/87
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
88 Terms
V o F: Una enzima no puede alterar el equilibrio de una reacción, solo puede acelerar la velocidad de reacción hacia el equilibrio disminuyendo la energía de activación de la reacción. V
V
Factores que afectan a las reacciones enzimáticas
Temperatura
pH
Varios solutos, incluidos sustratos, productos, iones metálicos y moléculas reguladoras, afectan también a la velocidad de las reacciones enzimáticas.
Efecto de temperatura en reacciones enzimáticas
Las enzimas funcionan normalmente como catalizadores a una temperatura constante (ambiente o corporal).
En análisis de laboratorio, la actividad enzimática aumenta hasta una temperatura límite, porque después de ahi experimentan desnaturalización térmica.
Enzimas vs Catalizadores inorgánicos.
Los catalizadores inorgánicos aumenta su la velocidad de reacción al aumentar la temperatura del sistema.
Las enzimas aumentan su actividad cuando aumenta la temperatura, pero hasta un límite porque fuera de sus rangos óptimos, estas se desnaturalizan.
Efecto del pH en las reacciones enzimáticas
Cada enzima tiene un pH óptimo porque los aminoácidos ionizables (histidina, glutamato y la cisteína), participan en las reacciones catalíticas.
Enzimas citosólicas: pH optimo 7-8
Pepsinas (celulas gastricas y jugo gastrico): pH optimo 1,5-2.0
Tripsina y quimotripsina; Jugo pancreativo: pH optimo alcalino
Enzimas lisosómicas: pH optimo acido
La sensibilidad de las enzimas al pH es el resultado del efecto del pH sobre la carga iónica de las cadenas laterales de los aminoácidos de las enzimas.
Unidad de enzima
Es una medida de la cantidad de enzima
El katal
Es una unidad internacional de la cantidad de enzima que cataliza la conversión de 1 mol de sustrato en 1 mol de producto por segundo
1 kat = 1 mol/s
Unidad internacional (UI)
Es la cantidad de enzima que cataliza la conversión de 1 µmol de sustrato en producto por minuto.
(1 UI = 1 µmol/min).
¿Qué es la actividad enzimática?
Es la capacidad de una enzima para catalizar la conversión de un sustrato en producto por unidad de tiempo, bajo condiciones definidas (pH, temperatura, concentración de sustrato y coenzima).
¿Qué es la actividad específica de una enzima?
Es una medida de la actividad por cantidad de proteína, se expresa en µmol/min/mg de proteína o UI/mg de proteína
¿Por qué varía la actividad específica entre tejidos?
Porque refleja la función metabólica del tejido; por ejemplo, enzimas de síntesis de colesterol tienen mayor actividad específica en el hígado que en el músculo.
La actividad específica es útil para estimar la pureza:
Cuanto mayor es la actividad específica de una enzima, mayor es su pureza u homogeneidad.
La reacción que cataliza una enzima está determinada por
Los aminoácidos del centro catalítico de la enzima.
¿Qué determina la especificidad de una enzima hacia su sustrato?
La especificidad está determinada por los aminoácidos del sitio activo, incluyendo el sitio de unión al sustrato y el sitio catalítico, y depende del tamaño, estructura, carga, polaridad e hidrofobicidad del sitio de unión.
¿Qué diferencia hay entre enzimas muy específicas y enzimas con especificidad más amplia?
Las enzimas muy específicas, como la catalasa y la ureasa, catalizan solo una reacción química; otras enzimas, como las serina proteasas (quimotripsina, tripsina, elastasa), tienen especificidad por una serie limitada de sustratos.
¿Qué son las isoenzimas?
Son enzimas que catalizan la misma reacción, pero difieren en su estructura primaria y/o en la composición de sus subunidades. Pueden tener distintas propiedades físicas o electroquímicas.
¿Cómo se utilizan las isoenzimas en diagnóstico clínico?
Se miden las actividades de isoenzimas específicas en suero para detectar lesiones tisulares; por ejemplo, las isoenzimas aniónicas de LDH aumentan en infarto de miocardio y las catiónicas en hepatitis aguda.
Número de clasificación enzimática
Primer digito: Indica a cuál clase principal pertenece
Dos dígitos siguientes; Subclases y subsubclases de los sustratos
Cuarto digito: Número de serie de la enzima específica
Las deshidrogenasas y peroxidasas, oxigenasas y reductasas pertencen a la clase:
a. Oxidorreductasas
b. Transferasas
c. Hidrolasas
d. Liasas
Oxidorreductasas:
De óxido reducción (transferencia de e-)
La Hexocinasa y transaminasas, kinasas y transaminasas pertenecen a
a. Oxidorreductasas
b. Transferasas
c. Hidrolasas
d. Liasas
b. Transferasas
Transferencia de grupos
La Fosfatasa alcalina y Tripsina; Piofosfatasa, Tripsina y Aldolasa pertenecen
a. Oxidorreductasas
b. Transferasas
c. Hidrolasas
d. Liasas
c. Hidrolasas
Hidrólisis, con transferencia de grupos funcionales del agua
La fumarasa y deshidratasas; sintasas y descarboxilasa pertencen a:
a. Oxidorreductasas
b. Transferasas
c. Hidrolasas
d. Liasas
Liasas (sintasas)
Lisis de un substrato, generando un doble enlace, o
Adición de un substrato a un doble enlace de un 2o. substrato
(Sintasa)
Triosa fosfato isomerasa y fosfoglucomutasa; mutasas, epimerasas y racemasas pertencen:
a. Isomerasas
b. Transferasas
c. Hidrolasas
d. Liasas
a. Isomerasas
Transferencia de grupos en el interior de las moléculas para dar formas isómeras
La Piruvato carboxilasa y ADN ligasas pertenecen a las
a. Isomerasas
b. Ligasas
c. Hidrolasas
d. Liasas
b. Ligasas
La ATP sintasa mitocondrial y Na + /K + -ATPasa pertencen a
a. Isomerasas
b. Ligasas
c. Translocasas
d. Liasas
c. Translocasas
Da ejemplos de enzimas utilizadas para diagnóstico clínico y su fuente tisular.
ALT: hígado, para hepatitis
AST: corazón, músculo, hígado, cerebro, para enfermedad hepática
Amilasa: páncreas y glándula salival, para pancreatitis aguda
CPK: músculo, corazón, encéfalo, para infarto de miocardio
GGT: hígado, para hepatitis y cirrosis
LDH: corazón, hígado, eritrocitos, para linfoma y hepatitis
Lipasa: páncreas, pancreatitis aguda
Fosfatasa alcalina: osteoblastos, enfermedad ósea
Fosfatasa ácida (PSA): próstata, cáncer de próstata
Las enzimas con coenzimas unidas de forma covalente o no covalente se denominan
Holoenzimas
Una holoenzima sin coenzima se denomina
Apoenzima
*Es la parte proteica de la enzima.
¿Cómo se clasifican las coenzimas?
Se dividen en coenzimas solubles, que se unen de forma reversible a la enzima y suelen reciclarse después de la reacción, y grupos prostéticos, que están fuertemente unidos (a menudo covalentemente) y permanecen asociados durante todo el ciclo catalítico.
¿Cuál es la función principal de las coenzimas solubles?
Participan en la catálisis ayudando en la transferencia de grupos o electrones y pueden ser recicladas por otras enzimas; por ejemplo, las oxidorreductasas usan coenzimas que se oxidan y luego se reducen en otra reacción.
¿Qué son los grupos prostéticos?
Son coenzimas o moléculas no proteicas fuertemente unidas a la enzima, a menudo de manera covalente, y permanecen asociadas durante todo el ciclo catalítico.
¿Qué son los cofactores enzimáticos?
Son iones inorgánicos (generalmente metálicos) necesarios para la actividad de ciertas enzimas, como el Ca²⁺ en las enzimas de coagulación sanguínea.
¿Cuál es la relación entre vitaminas y coenzimas?
Muchas coenzimas son derivados vitamínicos, especialmente de vitaminas del grupo B, como la niacina y la riboflavina, que actúan como coenzimas en reacciones de oxidorreductasas.
¿Qué modelo describe la cinética de reacciones catalizadas por enzimas de manera sencilla?
El modelo de Michaelis-Menten, que supone que el sustrato (S) se une a la enzima (E) formando un complejo enzima-sustrato (ES), que luego se convierte en producto (P) y libera la enzima.
¿Qué es el complejo enzima-sustrato (ES) y su papel en la catálisis?
Es un intermediario esencial que se forma al unirse el sustrato a la enzima; su descomposición en E + P es el paso que limita la velocidad de la reacción.
La constante catalitica, kcat
También conocida como número de recambio, es una constante de velocidad que describe la rapidez con la que una enzima puede catalizar una reacción.
k cat
Se define como el número de moléculas de sustrato convertidas en producto por molécula de enzima por unidad de tiempo.
¿Qué es la velocidad máxima (V_max) de una enzima?
Es la velocidad de reacción alcanzada a concentraciones saturantes de sustrato, cuando casi todas las moléculas de enzima están en el complejo ES ([ES] ≈ [E]_t).
¿Qué es la constante de Michaelis (K_m) y qué indica?
Es la concentración de sustrato a la que la velocidad de la reacción es la mitad de V_max. Indica la afinidad de la enzima por su sustrato:
K_m baja → alta afinidad, se necesita menos sustrato para alcanzar Vmax
K_m alta → baja afinidad.
¿Cuáles son los supuestos del modelo de Michaelis-Menten?
E, S y ES están en equilibrio rápido.
No existen formas de la enzima distintas de E y ES.
La conversión de ES en E + P es el paso irreversible que limita la velocidad.
¿Cómo se expresa la ecuación de Michaelis-Menten?
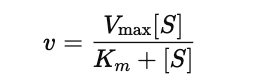
donde v es la velocidad de la reacción, [S] la concentración de sustrato, V_max la velocidad máxima y K_m la constante de Michaelis.
Las reacciones enzimáticas involucran la participación de:
Grupos funcionales de las cadenas laterales de aminoácidos, coenzimas, sustratos y productos.
La catálisis enzimática puede desarrollarse mediante distintos mecanismos:
Unión no covalente y reversible: El sustrato se une a la enzima de manera transitoria, sin formar enlaces covalentes, y se transforma en producto antes de liberarse.
Formación de intermediarios covalentes: La enzima forma un enlace covalente con el sustrato, que posteriormente se rompe para liberar el producto.
Catálisis mediada por coenzimas: Toda la acción catalítica ocurre sobre una coenzima que se enlaza covalentemente al sustrato.
¿Qué es una serina proteasa y cómo actúa?
Las serina proteasas, como la quimotripsina, escinden enlaces peptídicos en proteínas mediante la formación de un intermediario covalente con el sustrato. En estas enzimas, un residuo de serina en el sitio activo actúa como nucleófilo, atacando el carbono carbonilo del enlace peptídico.
La serina forma parte de una tríada catalítica (Asp 102, His 57 y Ser 195), donde los puentes de hidrógeno entre estos aminoácidos aumentan la nucleofilia de la serina, facilitando la escisión específica de enlaces peptídicos adyacentes a aminoácidos aromáticos como la fenilalanina.
El mecanismo comprende dos pasos principales:
Formación del intermediario covalente: El péptido carboxilo-terminal se libera y el péptido amino-terminal permanece unido a la serina.
Hidrólisis del intermediario: Se libera el péptido amino-terminal y la enzima se regenera para un nuevo ciclo catalítico.
Qué aminoácidos conforman la tríada catalítica de la quimotripsina?
Aspartato 102, Histidina 57 y Serina 195.
¿Cuál es la función de la tríada catalítica?
Aumentar la nucleofilia de la serina para facilitar el ataque al carbono carbonilo del enlace peptídico.
Diferencia entre hexocinasa y glucocinasa en cuanto a afinidad por la glucosa.
La hexocinasa tiene Kₘ baja (alta afinidad, actúa a concentraciones normales); la glucocinasa tiene Kₘ alta (actúa eficientemente solo a concentraciones elevadas tras la ingesta de glucosa).
Sitio activo
Son una bolsa o hendidura especiales, formadas por el pliegue de la proteína que participan en la unión del sustrato y la catálisis.
Otras definiciones:
Es la región de la enzima donde ocurren las reacciones.
Dentro del sitio catalítico, grupos funcionales provistos por coenzimas, metales fuertementes unidos y residuos de aminoácidos de la enzima participan en la catálisis
Sitio Regulador/Alosterico
Es un lugar de la enzima donde se unen otras sustancias, distintas del sustrato, que alteran la actividad de la enzima.
Cuando el sitio se encuentra alejado del sitio activo se dice que es ALOSTÉRICO.
Grupo prostético
Componentes no proteicos de las enzimas.
Cofactores
Componentes que se unen a la enzima sólo de forma transitoria.
Coenzimas
Son cofactores orgánicos, muchas enzimas dependen de estos
Vmax
velocidad máxima que puede alcanzar la enzima a un. Denota la eficacia de la enzima.
Inhibidor
Cualquier sustancia que pueda disminuir la velocidad de una reacción catalizada por una enzima se denomina inhibidor.
Inhibidores clasificacion
Reversible:
Competitivo: Se meten en el sitio activo. Si hay mucho sustrato, lo “desplazan” y la enzima vuelve a funcionar
No competitivo: Se unen en otro lugar y cambian la forma de la enzima, afectando tanto la velocidad máxima como la afinidad del sustrato.
Irreversible:
Acompetitivos: Solo se unen cuando la enzima ya está con el sustrato, haciendo que la reacción vaya más lenta.
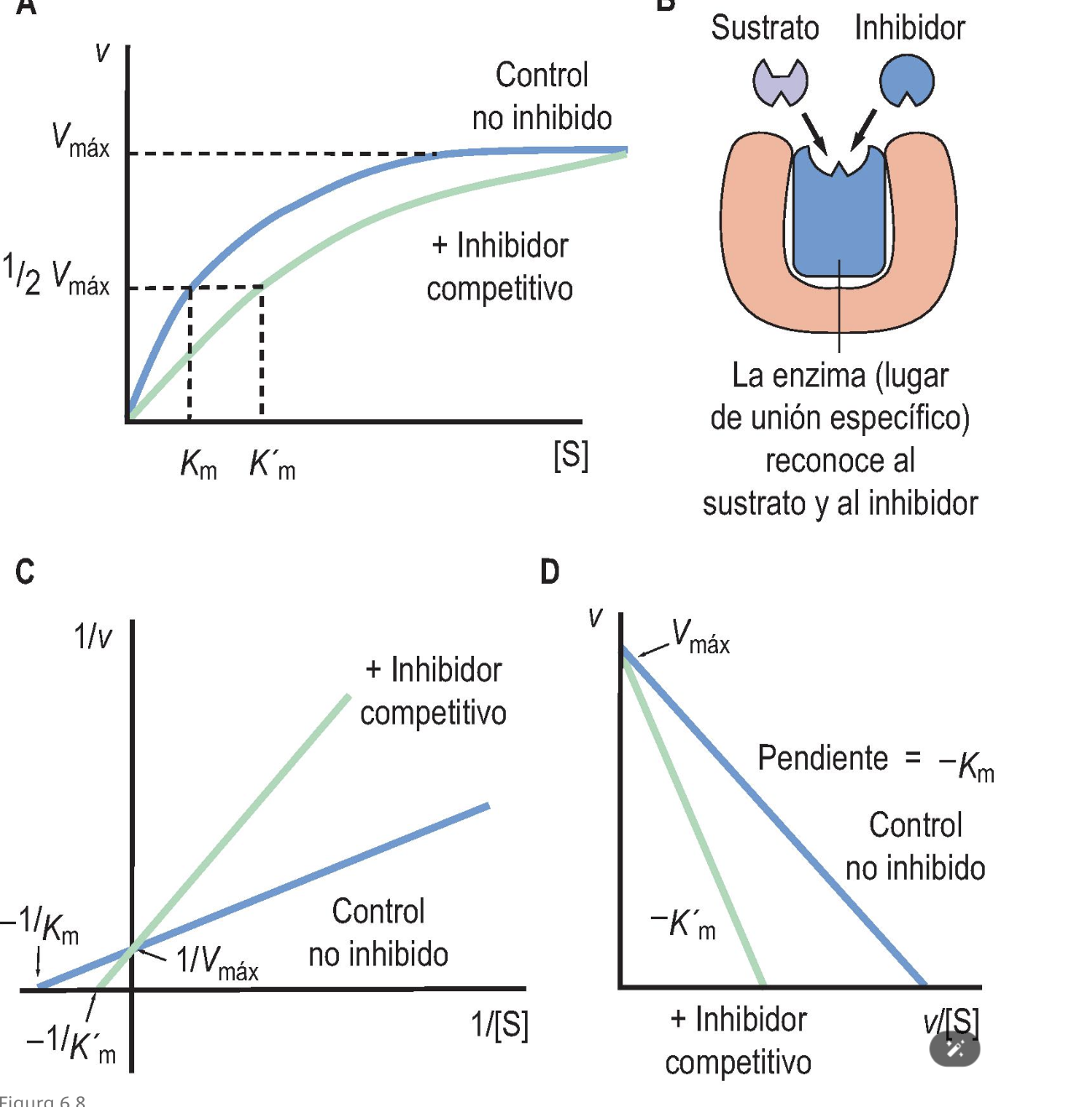
Inhibición competitiva:
El inhibidor compite con el sustrato por el sitio activo.
Esto aumenta la Kₘ aparente (disminuye afinidad aparente) pero no cambia Vₘₐₓ.
La inhibición puede superarse aumentando la concentración de sustrato.
Inhibición acompetitiva:
El inhibidor se une solo al complejo enzima-sustrato (ES) formando el complejo inactivo ESI.
Esto disminuye Vₘₐₓ y puede reducir Kₘ aparente (mayor afinidad aparente por el sustrato).
Inhibición no competitiva (mixta):
El inhibidor puede unirse a la enzima libre o al complejo ES en un sitio diferente al activo. Puede alterar Kₘ y Vₘₐₓ de manera variable.
Constante de inhibición (Kᵢ):
Es la medida de afinidad del inhibidor por la enzima o el complejo ES. Cuanto menor Kᵢ, más eficaz es el inhibidor.
V o F: Cuanto mayor Kᵢ, menos eficaz es el inhibidor.
V
Efecto de inhibidores sobre Kₘ y Vₘₐₓ:
Competitiva: Kₘ aparente aumenta, Vₘₐₓ no cambia.
Acompetitiva: Vₘₐₓ disminuye, Kₘ aparente disminuye.
No competitiva: Vₘₐₓ disminuye, Kₘ puede o no cambiar dependiendo del tipo (puede aumentar o permanecer igual).
Relación entre Kₘ y Vₘₐₓ
Definición de cada parámetro:
Kₘ (constante de Michaelis-Menten):
Representa la concentración de sustrato a la que la enzima alcanza la mitad de su velocidad máxima (Vₘₐₓ). Es una medida de afinidad:Kₘ baja → alta afinidad de la enzima por el sustrato.
Kₘ alta → baja afinidad.
Vₘₐₓ (velocidad máxima):
Es la velocidad máxima que puede alcanzar una reacción catalizada por la enzima cuando el sitio activo está completamente saturado de sustrato.
Relación en la cinética enzimática:
La ecuación de Michaelis-Menten describe cómo la velocidad de reacción (v) depende de la concentración de sustratoA concentraciones bajas de sustrato ([S] ≪ Kₘ), la velocidad depende principalmente de [S].
A concentraciones altas de sustrato ([S] ≫ Kₘ), la velocidad se aproxima a Vₘₐₓ.
En general, en la regulación de la actividad enzimática intervienen cinco mecanismos independientes:
Regulación génica: Variación de la expresión de la enzima según el entorno o la demanda metabólica.
Activación/inactivación proteolítica: Enzimas precursora inactivas (cimógenos) pueden activarse irreversible mediante proteólisis, como ocurre con el tripsinógeno en el intestino.
Modificaciones covalentes reversibles: Por ejemplo, la fosforilación de enzimas para activarlas o inhibirlas temporalmente.
Regulación alostérica: Un efector se une a un sitio distinto del activo y modifica la afinidad (Kₘ) o la velocidad catalítica (k_cat). Puede ser homótropa (el propio sustrato actúa como efector) o heterótropa (otro compuesto actúa como efector).
Degradación enzimática: La semivida de la enzima, determinada por proteasomas o autofagia, regula la actividad a largo plazo.
¿Qué son los cimógenos y cómo se activan?
Son enzimas precursora inactivas que se almacenan en compartimentos subcelulares y se activan proteolíticamente, por ejemplo, el tripsinógeno se convierte en tripsina mediante enteropeptidasa.
¿Qué es la regulación alostérica?
Es la modulación de la actividad de una enzima por la unión de un efector en un sitio distinto al sitio activo, afectando la afinidad (Kₘ) o la velocidad catalítica (k_cat).
Diferencia entre efecto homótropo y heterótropo en enzimas alostéricas.
Homótropo: el propio sustrato actúa como efector.
Heterótropo: un compuesto distinto del sustrato actúa como efector
¿Qué indica la cooperatividad positiva y negativa en enzimas alostéricas?
Positiva: la unión de un sustrato facilita la unión de otros.
Negativa: la unión de un sustrato dificulta la unión de otros.
¿Qué es el coeficiente de Hill (H)?
Medida de cooperatividad; H > 1 indica cooperatividad positiva, H < 1 indica cooperatividad negativa.
Diferencia entre análisis cinético y de punto final en glucosa sanguínea.
Punto final: se mide el producto al final de la reacción.
Cinético: se mide la velocidad inicial de la reacción, más rápido y preciso.
Desnaturalizacion por pH
A un pH bajo (acido): Los puentes salinos y los puentes de hidrogeno formados por grupos carboxilato se interrumpen
A un pH alto (alcalino): Los puentes salinos y de hidrógeno formados por los aminoácidos se interrumpen
El pH no rompe uniones peptidicas, pero la alteracion de la conformacion nativa si afecta su funcion
Desnaturalización por temperatura
La temperatura incrementa las energías vibratorias y rotacionales en las uniones, de modo tal que se afecta el equilibrio de energía que le confiere estabilidad a una conformación tridimensional.
Desnaturalizacion por solventes
Las moléculas hidrófobas pueden desnaturalizar a proteínas al modificar sus interacciones hidrofobas.
Sitio de unión de las enzimas
Sitio en donde se unen los sustratos en la enzima a través de interacciones con residuos de aminoácidos de la enzima.
La geometría espacial requerida para las interacciones entre el sustrato y la enzima hace que cada enzima sea selectiva por su sustrato y asegura que únicamente se formen productos específicos
Estrategias cataliticas empleadas por las enzimas:
Catalisis acido-base general
Formacion de intermediarios covalentes
Estabilizacion del estado de transicion (electronica)
Los inhibidores mas potentes son los ________, que son compuestos que forman enlaces covalentes con un grupo reactivo en el sitio activo de la enzima, o ____________ que remedan el complejo del estado de transición
Inhibidores covalentes, analogos del estado de transicion.
Las reacciones catalizadas por enzimas tiene tres pasos basicos:
Union del sustrato: E + S → ES
Conversion del sustrato unido a producto unido: ES → EP
(Generacion y ruptura de enlaces requeridos para la formacion de productos)
Liberacion del producto: EP → E + P
Especificidad de la enzima
Es la capacidad de la enzima para reaccionar con un solo sustrato
-Resulta del arreglo tridimensional de los residuos de aminoácidos especificos en la enzima que forma sitios de union para el sustrato y activan a este durante el curso de la reaccion.
El modelo de Michaelis-Menten se basa en los siguientes supuestos:
E, S y ES están en equilibrio rápido.
No existen formas de la enzima distintas de E y ES.
La conversión de ES en E + P es el paso irreversible que limita la velocidad. Aunque todas las reacciones catalizadas por enzimas son en teoría reversibles, las velocidades iniciales se miden normalmente cuando la concentración de producto, y, por tanto, la velocidad de la reacción inversa, es despreciable.
V o F: Los inhibidores competitivos provocan un aumento aparente de la K m sin modificar la V máx
V
*La inhibición es el resultado de un efecto no sobre la función de la enzima, sino sobre el acceso del sustrato al sitio activo:
V o F: Los inhibidores acompetitivos causan una disminución aparente de la V máx .
V:
*El inhibidor disminuye la V máx porque una fracción del complejo enzima-sustrato es desviada por el inhibidor al complejo inactivo ESI. La unión del inhibidor y el aumento de la estabilidad del complejo ESI también pueden afectar a la disociación del sustrato, lo que provoca una disminución aparente de la K m (es decir, un aumento aparente de la afinidad por el sustrato).
V o F: Los inhibidores no competitivos pueden unirse a lugares situados fuera del sitio activo y alterar tanto la K m como la V máx de la enzima.
V:
Un inhibidor no competitivo (mixto) puede unirse a la enzima libre o al complejo enzima-sustrato, normalmente en un lugar situado fuera del sitio activo. Los inhibidores no competitivos presentan efectos más complejos y pueden alterar tanto la K m como la V máx de una reacción enzimática. La siguiente ecuación muestra el esquema de reacción observado en la inhibición no competitiva:
En la catálisis general ácido-básica
Un grupo funcional en la proteína dona un protón (catálisis ácida) o acepta un protón (catálisis básica general) durante el curso de la reacción.
Ej: Durante el curso de esta reacción, la histidina 57 actúa como un catalista básico general y acepta protones de la serina 195, activando a la serina para actuar como un nucleó filo.
En la catálisis covalente
El sustrato está unido en forma covalente durante el curso de la reacción con una cadena lateral del aminoácido en el sitio activo de la enzima.
Catálisis metal-ion
Muchas enzimas contienen los iones metálicos requeridos para que se presente la catálisis.
En el caso de la anhidrasa carbónica, una enzima unida al cinc en el sitio activo se une y orienta el agua en forma adecuada de manera que se pueda precipitar en la reacción. En ausencia del sitio activo del cinc, la reacción se presenta en forma muy lenta, si es que lo hace.
La catálisis por aproximación
Se refiere a la enzima que fuerza (por medio de la formación de enlaces de hidrógeno e interacciones iónicas entre la enzima y el sustrato) sustratos a que se unan en una manera que coloquen los sitios reactivos en la orientación adecuada para que se lleve a cabo la reacción.
En la catálisis por cofactor,
Un factor que es necesario para una enzima por lo general forma un enlace covalente con el sustrato durante el curso de la reacción.
Ej: Las enzimas involucradas en el metabolismo del aminoácido usan piridoxal fosfato (derivado de la vitamina B6) para
formar un enlace covalente durante el curso de la reacción.
Las coenzimas activadoras de transferencia
Usualmente participan de manera directa en la catálisis al formar un enlace covalente con una porción del sustrato; la porción de sustrato fuertemente unida es entonces activada para la transferencia, adición de agua, o alguna otra reacción.
Coenzimas de óxido-reducción
Un gran número de coenzimas están involucradas en reacciones de óxido-reducción, catalizadas por enzimas categorizadas como oxidorreductasas, transfiriendo electrones conjuntamente.