AB II: H3 elektrochemie - biosensoren
1/85
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
86 Terms
Wat is elektrochemie?
De studie van de wisselwerking tussen chemische en elektrische verschijnselen aan elektroden in elektrolytoplossingen.
Wat gebeurt er in elektrochemie met chemische energie?
Die wordt omgezet in elektrische energie die meetbaar is (zoals stroom, spanning of lading).
Wat onderzoekt de analytische elektrochemie?
Het kwantitatieve verband tussen een elektrisch signaal (zoals potentiaal, stroom, weerstand) en de concentratie van elektroactieve stoffen.
Wat is een elektrode?
Een geleider die stroom toelaat in of uit een elektrolytoplossing.
Welke materialen worden gebruikt voor elektroden?
* Metalen: kwik, platina
* Niet-metalen: grafiet, halfgeleiders zoals GaAs
Waar vinden elektrodereacties plaats?
Aan het grensvlak tussen elektrode en elektrolyt.
Wat gebeurt er bij oxidatie?
Een stof verliest elektronen en dit gebeurt aan de anode.
Wat gebeurt er bij reductie?
Een stof neemt elektronen op en dit gebeurt aan de kathode.
Wat is een indicatorelektrode?
Een elektrode die gebruikt wordt om de potentiaal te meten in een galvanische cel.
Wat is een werkelektrode?
De elektrode waar de te volgen redoxreactie plaatsvindt in een elektrolytische cel.
Wat is een referentie-elektrode?
Een elektrode die een stabiele en gekende potentiaal biedt als ijkpunt in metingen.
Wat beschrijft de Wet van Ohm?
Het verband tussen spanning (U), stroom (I) en weerstand (R):
U = R × I
Wat beschrijft de Wet van Faraday?
Het verband tussen stroom en de hoeveelheid stof die wordt omgezet aan een elektrode:
Q = I × t
en
m = (M × I × t) / (z × F)
waar:
m = massa stof
M = molaire massa
z = aantal elektronen
F = Faraday-constante
Wat beschrijft de Wet van Nernst?
Het verband tussen elektrodepotentiaal en concentraties van redoxstoffen:
E = E⁰ + (0,059 / z) × log([Ox]/[Red])
Wat is een elektrolyt?
Een stof die elektrische stroom geleidt in oplossing door te dissociëren in ionen (kationen en anionen).
Waarom blijft de lading van een elektrolytoplossing neutraal?
Door de ionenbalans: het aantal positieve en negatieve ladingen is altijd gelijk.
Wat is een elektrochemische cel?
Een systeem dat een elektromotorische kracht (emk) opwekt via twee halfcellen (anode & kathode).
Wat is het verschil tussen een galvanische en een elektrolytische cel?
Galvanische cel: spontane redoxreactie → levert elektrische energie
Elektrolytische cel: niet-spontane reactie → vereist externe spanning
Wat gebeurt er bij elektrolyse van CuCl₂-oplossing aan de kathode?
Cu²⁺ + 2e⁻ → Cu
Koperionen worden gereduceerd tot koper → afzetting op de elektrode.
Wat gebeurt er bij elektrolyse van CuCl₂-oplossing aan de anode?
2Cl⁻ → Cl₂↑ + 2e⁻
Chloride-ionen worden geoxideerd tot chloorgas.
Wat is elektronegativiteit (EN)?
De neiging van een atoom om elektronen aan te trekken / gereduceerd te worden.
Hoe verandert elektronegativiteit in het periodiek systeem?
EN stijgt van links naar rechts en van onder naar boven.
Wat zegt de metalenreeks over reductietendens?
Metalen van K → Pt hebben afnemende neiging tot reductie.K wil heel graag elektronen afstaan, Pt nauwelijks.
Wat is elektrodepotentiaal?
Het potentiaalverschil tussen een metaal en de oplossing waarin het ondergedompeld is, veroorzaakt door evenwicht tussen oxidatie en reductie aan het metaaloppervlak.
Wat is oplossingsdruk (P)?
De neiging van een metaal om ionen in oplossing te brengen (oxidatie):
Zn → Zn²⁺ + 2e⁻
Wat is ionendruk (p)?
De neiging van ionen in oplossing om te neerslaan als metaal (reductie):
Zn²⁺ + 2e⁻ → Zn
Wanneer is het elektrodepotentiaal stabiel?
Wanneer oplossingsdruk = ionendruk → het systeem is in evenwicht.
Wat gebeurt er als P > p?
Meer oxidatie dan reductie → negatief elektrodepotentiaal → onedele metalen
Wat gebeurt er als P < p?
Meer reductie dan oxidatie → positief elektrodepotentiaal → edele metalen
Wat is de standaard elektrodepotentiaal (E°)?
Het elektrodepotentiaal gemeten t.o.v. de standaard waterstofelektrode (SHE) bij 1 M, 1 atm, 25°C.
E°(H⁺/H₂) = 0,00 V
Wat gebeurt er in een galvanische cel met Zn en SHE?

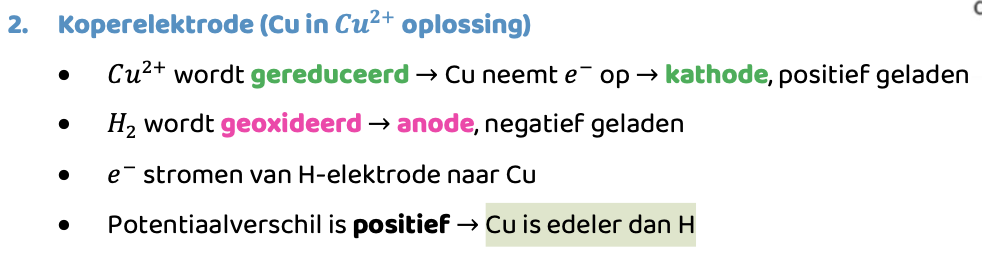
Wat gebeurt er in een galvanische cel met Cu en SHE?
Wat doet de zoutbrug?
Verbindt de twee elektrolytoplossingen en maakt ladingstransport mogelijk zonder directe menging.
Wat zegt de spanningsreeks van metalen?
Metalen met E° < 0 (links van H₂) oxideren makkelijk → onedele metalen
Metalen met E° > 0 (rechts van H₂) reduceren makkelijk → edele metalen
Nernstvergelijking voor Zn-elektrode (metaal)?
E = E° + (0,059 / 2) × log[Zn²⁺]
(concentratie van vast Zn verandert niet, dus geen invloed)
Nernstvergelijking voor Cl₂-gaselektrode?
E = E° + (0,059 / 2) × log(1 / [Cl⁻]²)
Aangezien [Cl₂] ≈ constant
Wat is een galvanische cel?
Een elektrochemische cel waarin een spontane redoxreactie plaatsvindt die chemische energie omzet in elektrische energie.
Wat is een elektrolysecel?
Een cel waarin een niet-spontane redoxreactie wordt afgedwongen door een extern spanningsverschil.
Wat gebeurt er altijd aan de kathode?
Reductie: elektronen worden opgenomen.
Wat gebeurt er altijd aan de anode?
Oxidatie: elektronen worden afgegeven.
In welke richting stromen elektronen in een galvanische cel?
Van de anode (zink) naar de kathode (koper).
Wat is de rol van de zoutbrug in een galvanische cel?
Zorgt voor ionenuitwisseling om ladingsneutraliteit te behouden, zonder directe vermenging van de oplossingen.
Wat is het verschil tussen elektronenstroom en conventionele stroom?
Elektronenstroom: van anode naar kathode
Conventionele stroom: van kathode naar anode
Wat is de formule voor de celpotentiaal van een galvanisch element?
E_cel = E_kathode - E_anode
Wat gebeurt er bij de Daniell-cel?
Zink wordt geoxideerd (Zn → Zn²⁺ + 2e⁻)
Koperionen worden gereduceerd (Cu²⁺ + 2e⁻ → Cu
e⁻ stromen van Zn naar Cu
Wat is de voorwaarde voor een elektrolyse om te verlopen?
Het aangelegde spanningsverschil moet groter zijn dan de EMK van de cel.
Noem industriële toepassingen van elektrolyse.
Synthese van chloorgas
Aluminiumwinning
Elektrolytische zuivering van koper
Galvanisatie (vb. vergulden, verzilveren)
Waarom kan de gemeten celspanning lager zijn dan berekend?
Door de inwendige weerstand van de cel en spanningsverliezen.
Wat is potentiometrie?
Potentiometrie is het meten van het potentiaalverschil (spanning) tussen twee elektroden in een galvanische cel zonder dat er stroom loopt.
Noem drie toepassingen van potentiometrie.
pH-meting
pCO₂-meting
Meting van elektrolyten zoals Na⁺, K⁺, Cl⁻, Ca²⁺
Wat is de functie van een referentie-elektrode in potentiometrie?
De referentie-elektrode heeft een constante bekende potentiaal en maakt het mogelijk om het potentiaal van de meettelektrode te meten.
Beschrijf de zilver/zilverchloride-elektrode (Ag/AgCl).
Notatie: Ag | AgCl | KCl || testoplossing
Bestaat uit zilverstaaf bedekt met AgCl, ondergedompeld in KCl
Werkt via evenwicht: AgCl ↔ Ag⁺ + Cl⁻
Wat is een glaselektrode en waarvoor wordt ze gebruikt?
Een pH-elektrode gebaseerd op een gehydrateerde glasmembraan die gevoelig is voor H⁺-ionen. Wordt gebruikt voor pH-meting.
Wat is de werkingsformule van de glaselektrode bij 25 °C?
E_glaselektrode = E*' + 0,059 × log[H⁺]
Of
pH = (E_gemeten − 0,283 + E*) / 0,059
Wat is de asymmetriepotentiaal (E*)?
Een afwijking in het uitgangspotentiaal van de glaselektrode, veroorzaakt door verschillen in glas, voorbehandeling of hydratie van het membraan.
Wat zijn ion-selectieve elektroden (ISE's)?
Elektroden met een membraan (glas of polymeer) dat specifiek reageert op een bepaald ion via een ionofoor (zoals valinomycin voor K⁺).
Hoe werkt een pCO₂-elektrode?
CO₂ diffundeert door gasdoorlatend membraan en reageert met water tot H₂CO₃ → H⁺ + HCO₃⁻. pH-verandering wordt gemeten; die is ∝ pCO₂.
Wat is voltammetrie?
Meting stroom terwijl potentiaal van de werkelektrode wordt gevarieerd in de tijd
Wat is de grensdiffusiestroom (Idg)?
De maximale stroom waarbij de snelheid van aanvoer van de elektroactieve stof de snelheid van reactie bepaalt. Idg ∝ concentratie.
= stroomplateau die optreedt bij verzadiging van elektrode met elektroactieve stof
Wat is de diffusielimiet?
= oorzaak van de grensdiffusiestroom (Idg)
→ De stof bereikt de elektrode niet sneller dan dat het wordt omgezet
Wat is de halfwaardepotentiaal (E₁/₂)?
De elektrodepotentiaal waarbij de stroom de helft van de grensdiffusiestroom bereikt. Is karakteristiek voor een analyte.
Wat is amperometrie?
Stroommeting bij constant potentiaalverschil
Wat is coulometrie?
Meting totale lading die nodig is om stof volledig om te zetten
Wat is polarografie?
Een vorm van voltammetrie met een druppelende kwikelektrode. De stroom wordt gemeten terwijl de potentiaal verandert.
Wat is stripping voltammetrie?
pre-concentratie: accumulatie analyt op elektrode
stripping: analyt wordt geoxideerd / gereduceerd → stroom evenredig concentratie
Wat is anodic stripping voltammetry (ASV)?

Wat is cathodic stripping voltammetry (CSV)?

Wat is amperometrie?
Een techniek waarbij de elektrodepotentiaal constant wordt gehouden en alleen de stroom wordt gemeten → stroom ∝ concentratie analyt.
Wat is de Clark-elektrode?
Een sensor voor pO₂ met een Pt-kathode (reductie van O₂) en Ag-anode, gescheiden van het monster door een zuurstofdoorlatend membraan.
Hoe werkt de NO-sensor (Clark-type)?
Pt-elektrode op +0,9 V oxideert NO tot NO₃⁻. Oxidatiestroom ∝ [NO], gebruikt voor monitoring van vasodilatatie en cellulaire NO-productie.
Wat is conductometrie?
Bepalen van analyteconcentraties via meting van de elektrische geleidbaarheid van een oplossing (uitgedrukt in Siemens).
Wat is het Coulter-principe?
Bloedcellen (RBC, WBC) beïnvloeden de geleidbaarheid van de suspensie → elke celpassage veroorzaakt een meetbare verandering.
Wat is coulometrie?
Een elektrochemische methode waarbij de totale elektrische lading (Q = I × t) wordt gemeten om hoeveelheid analyte te bepalen.
Wat is een voorbeeld van coulometrie in de kliniek?
Bepaling van Cl⁻ in bloed via neerslagreactie met Ag⁺. Zodra alle Cl⁻ is gecomplexeerd, detectie van Ag⁺-overschot via amperometrie.
Wat is een biosensor?
Een chemische sensor die een biologisch component (zoals een enzym of antilichaam) combineert met een fysicochemische transducer om een elektrisch signaal te genereren dat kan worden uitgelezen.
Wat zijn de twee hoofdtypes van biologische herkenning in biosensoren?
Biokatalytische reactie (bijv. enzym zet analyt om)
Bindingsproces (bijv. antilichaam, receptor, DNA bindt specifiek aan analyt)
Wat is de functie van de transducer in een biosensor?
De transducer zet de chemische of fysische verandering veroorzaakt door de biologische interactie om in een meetbaar elektrisch signaal.
Welke enzymatische reactie ligt aan de basis van de klassieke glucosebiosensor van Clark & Lyons?
Glucose + O₂ → Gluconzuur + H₂O₂ via glucoseoxidase
Hoe detecteert een PO₂-elektrode glucose in een enzym-gebaseerde amperometrische biosensor?
O₂ wordt verbruikt door glucoseoxidase; de PO₂-elektrode meet de afname in zuurstofdruk. Die afname is evenredig met de glucoseconcentratie.
Wat is het principe van de alternatieve detectiemethode voor glucose, gebaseerd op H₂O₂?
De geproduceerde H₂O₂ wordt geoxideerd aan een Pt-elektrode bij +0,7 V, en de gemeten oxidatiestroom is ∝ glucoseconcentratie.
Wat is een voordeel van H₂O₂-detectie bij glucosemeting?
De oxidatie van het reactieproduct (H₂O₂) laat een directe, alternatieve en betrouwbare meting van glucose toe.
Hoe kan de glucosebiosensor worden aangepast voor andere analyten?
Door het enzym glucoseoxidase te vervangen door een ander enzym dat specifiek is voor een andere analyt.
Wat meet een potentiometrische biosensor?
Een potentiaalverschil tussen twee elektroden, veroorzaakt door een verandering in ionenactiviteit, bijvoorbeeld NH₄⁺.
Hoe werkt een ureum-biosensor met een ammonium-selectieve elektrode?
Urease zet ureum om in NH₃, dat in water reageert tot NH₄⁺. NH₄⁺ wordt gedetecteerd door een ISE met nonactine-ionofoor, en de potentiaalverandering is ∝ [NH₄⁺] → ∝ ureum.
Welke vergelijking bepaalt het verband tussen potentiaal en ionconcentratie in een potentiometrische biosensor?
De Nernst-vergelijking:
E = E₀ + (0,059/n) × log [ion] bij 25°C
Waarom is het meten van ureum belangrijk in de kliniek?
Ureum is een afvalproduct van de stikstofstofwisseling; ophoping wijst op nierinsufficiëntie en is toxisch bij hoge concentraties.