QSPPS 11 (3e partie) : Les métiers et applications de la radioactivité en santé -> radioactivité en diagnostic
1/45
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
46 Terms
Radioactivité en diagnostic ?
→Imagerie médicale
Toutes les imageries médicales ne font pas appel à la radioactivité. On peut répartir les modalités d’imagerie médicale en 2 grandes familles :
Imageries morphologiques
Imageries fonctionnelles
Imageries morphologiques permet quoi
Les imageries morphologiques permettent d’obtenir des informations sur la taille, le volume, le positionnement des organes, la localisation de lésions tumorales ou traumatiques…
→Anatomie des organes
Imageries morphologiques : on y retrouve quoi ?
Chaque modalité d’imagerie repose sur un principe physique particulier
→On y retrouve :
Echographie qui repose sur la réflexion d’ondes ultrasonores (échographie prénatale, écho doppler…)
Radiographie/scanner X qui reposent toutes les deux sur l’absorption de rayons X → ici, on fait appel aux rayonnements ionisants
IRM →ne permet de voir tout à fait la même chose que le scanner, ça permet plutôt de voir les tissus mous (vs scanner = tissus durs) →l’IRM repose sur le principe des spins : c’est de la résonance magnétique nucléaire
Imageries fonctionnelles permettent quoi ?
Les imageries fonctionnelles ou moléculaires font toutes appel à des rayonnements ionisants. Elles ne donnent pas vraiment d’informations sur la taille, la morphologie, le volume des organes mais sur leur fonctionnement. Chaque médicament qu’on administre vont permettre de visualiser un processus biochimique ou métabolique particulier. Ce sont donc globalement des techniques qui ont une résolution spatiale pas terrible.
Ex : Si j’injecte du fluoro-déoxyglucose radiomarqué au fluor 18, je vais pouvoir faire de l’imagerie TEP et voir la consommation cérébrale de glucose plus précisément l’activité des transporteurs GLUT dans les différentes zones du cerveau
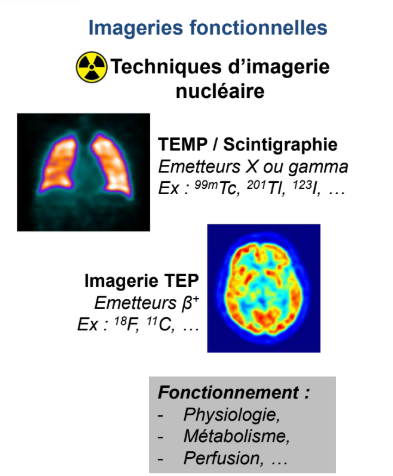
Imageries fonctionnelles : on y retrouve quoi ?
Tomographie par émission mono-photonique ou scintigraphie qui repose sur l’utilisation d’émetteurs X ou gamma (technétium 99m, thalium 201, Iode 123…)
Imagerie TEP (tomographie par émission de positons) qui repose sur l’utilisation d’émetteurs bêta plus (fluor 18, carbone 11…)
Imageries utilisant la radioactivité principe ?
Dans le scanner, imagerie TEP et la scintigraphie, le principe repose sur la détection de rayonnements électromagnétiques qui vont être émis
Rayonnements électromagnétiques ?
Les rayonnements électromagnétiques correspondent aux rayons X et gamma qui diffèrent par leur origine.
formule Energie des rayonnements X et gamma ?
plus un rayonnement a une fréquence élevée et donc une longueur d’onde faible plus il est énergétique.
ν →fréquence du rayonnement en Hertz
h → constante de Plank : 6,66×10-34 J.s
c → vitesse de la lumière : 2,998 ×108 m.s-1
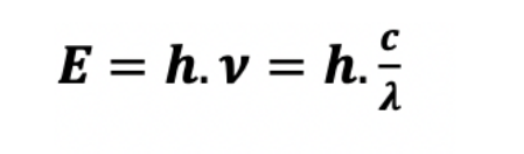
Longueur d’ondes des rayonnements ionisants ?
De la même manière, on considère que le seuil d’énergie pour qu’un rayonnement soit ionisant est d’environ 10 eV, la longueur d’onde correspondante est de 0,1 μm (en dessous de cette valeur de longueur d’onde les rayonnements seront ionisants).
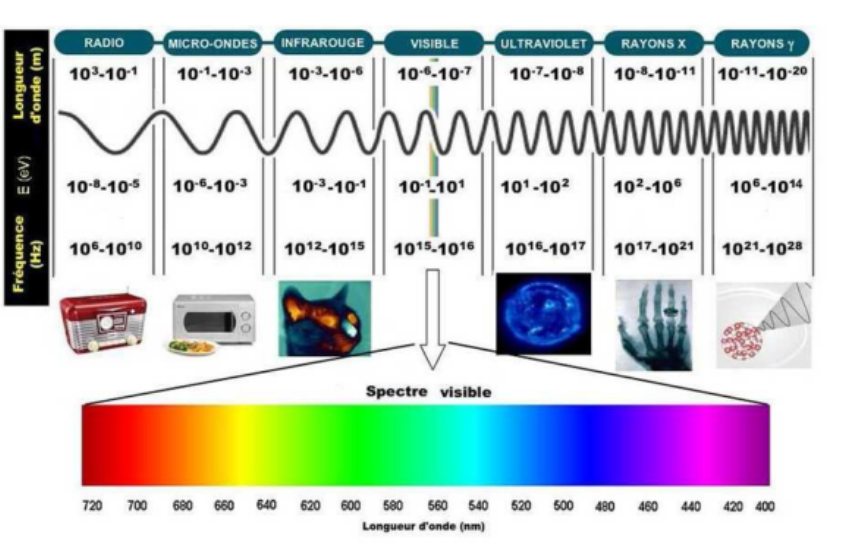
Spectre des rayonnements électromagnétiques et rayonnements ionisants ?
La zone dans laquelle on retrouve le passage de rayons non ionisants à ionisants, se situe en fin des ultraviolets. On a certains ultra-violet qui sont ionisants. Tout ce qu’on retrouve après, les rayons X puis les rayons gamma, sont ionisants.
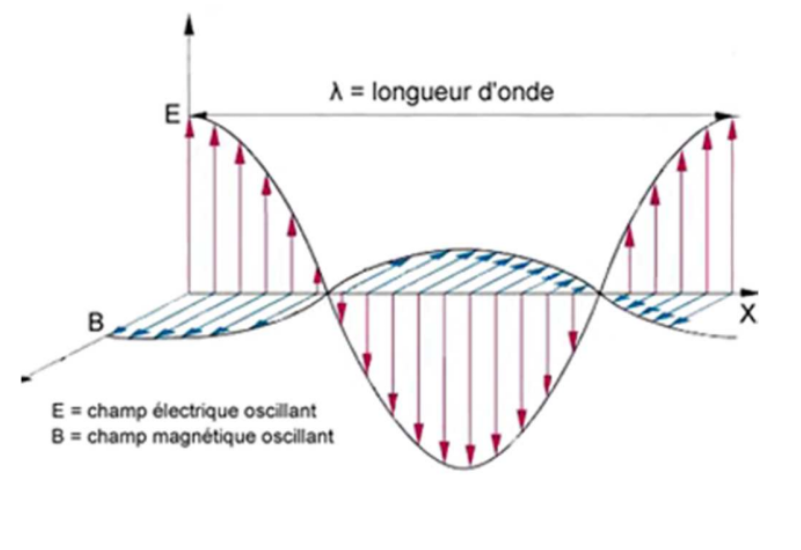
Physiquement qu’est-ce qu’un rayonnement électromagnétique ?
X et gamma c’est la même chose : C’est l’oscillation dans la même direction et sur des plans perpendiculaires d’un champ électrique et d’un champ magnétique.
Selon la théorie de rayonnement corpuscule (dualité onde-corpuscule), on peut associer une particule ou un corpuscule à un rayonnement électromagnétique ici le photon. Le photon est donc le vecteur de ces rayonnements électromagnétiques.
Photon c’est quoi ?
On considère que le photon est une petite quantité d’énergie qui se propage avec une masse nulle au repos et une charge nulle.
On le représente sous la forme d’un trait composé de quantas d’énergie.
Longueur d’onde c’est quoi ?
La longueur d’onde ça correspond à la distance entre 2 pics ou 2 creux.
Radiographie fonctionnement ?
On prend un générateur de rayon X, on met quelqu’un devant, puis on mesure ce qui traverse. On obtient des clichés numériques (avant c’était sur des films argentiques).
Quand on fait une radio ou un scanner, on fait une cartographie des coefficients d’atténuation linéique. Un coefficient d’atténuation linéique reflète la probabilité d’intéraction du rayonnement avec la matière traversée.
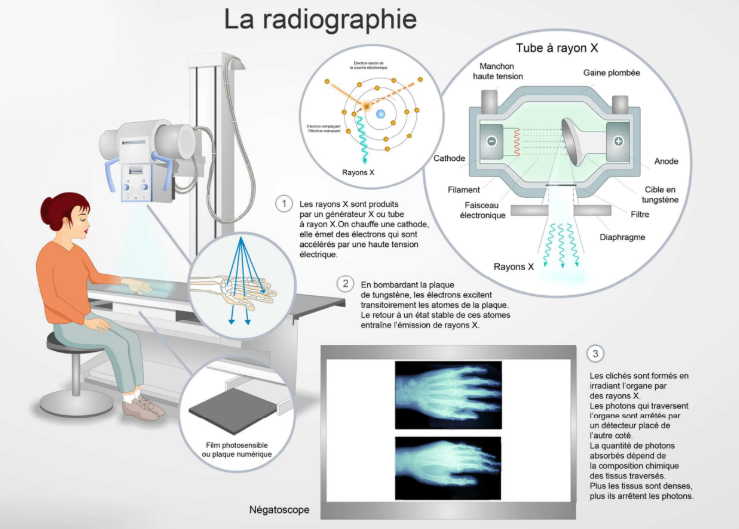
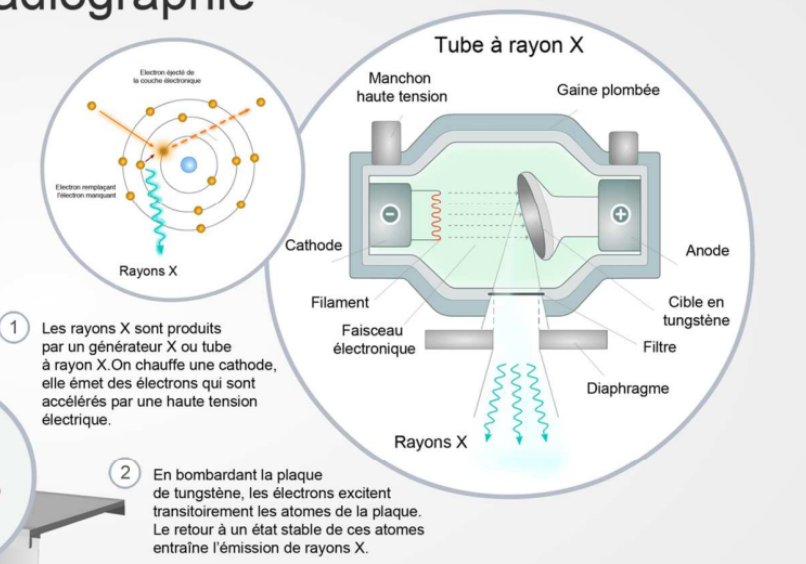
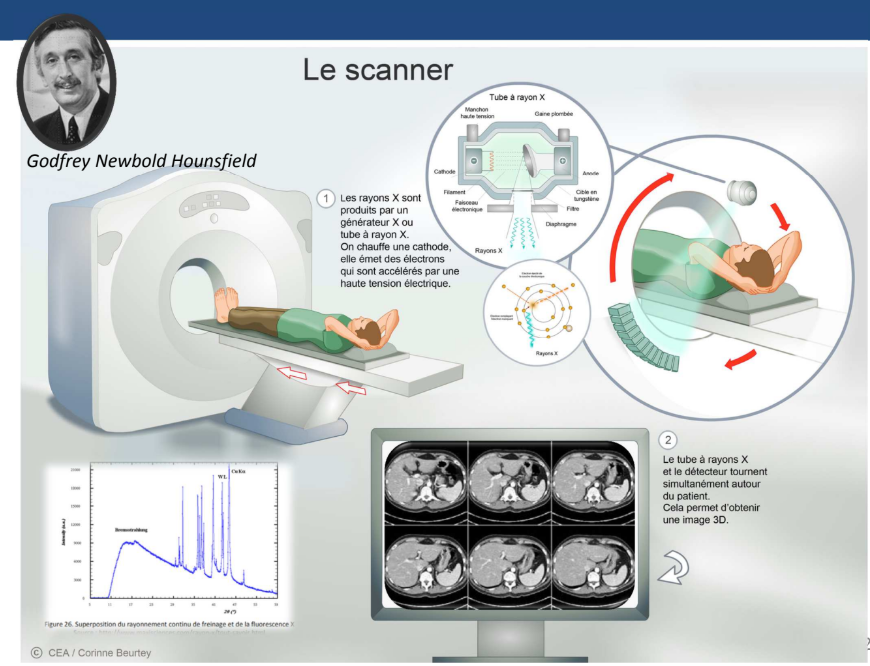
Générateur de rayon X fonctionnement ?
On a le filament métallique d’une cathode qui est chauffé et de l’autre côté on retrouve une anode avec une cible en tungstène.
La différence de tension et le fait que la cathode soit chauffée fait que les électrons des couches externes de la cathode vont être excités et par différence de potentiel, ils vont être attirés vers l’anode. Sur le chemin ils vont traverser un gaz, ce qui génère des rayonnements de freinage. Puis en frappant la cible en tungstène de l’anode, ça va générer des rayons X de fluorescence
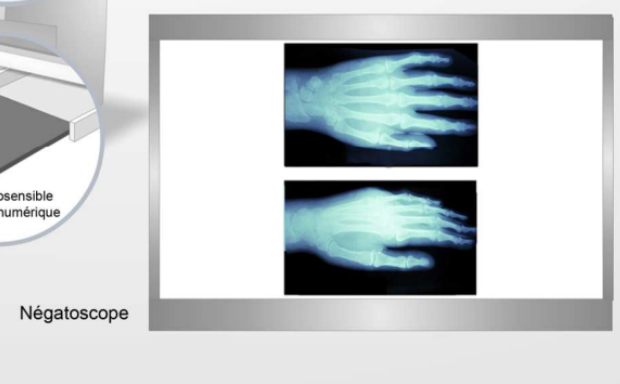
Radiographie image obtenue
La radiographie est une image en 2D. Ce qu'on voit, c’est une image avec un négatoscope : Si on met une main, normalement les rayons ne traversent pas là où il y a la main car ils ne traversent pas l’os donc la main est censée apparaître en noir. Mais une image radiologique est en fait une image en contraste inversé.
Donc ce qui apparait :
Blanc = Rayonnements qui ont été atténués
Noir = Rayonnement qui n’a pas été arrêté
Scanner fonctionnement ?
Le scanner a le même principe que la radiographie mais en un peu plus évolué. Le générateur de rayon X va tourner autour du patient et le patient avance dans le champ de vue →2 mouvements
→Ca va nous permettre de générer des tranches d’images en 2D. Par traitement informatique, on peut ensuite reconstituer une image en 3D.
Le scanner va plus vite. On obtient un contraste meilleur donc on peut voir plus de choses mais ça irradie plus
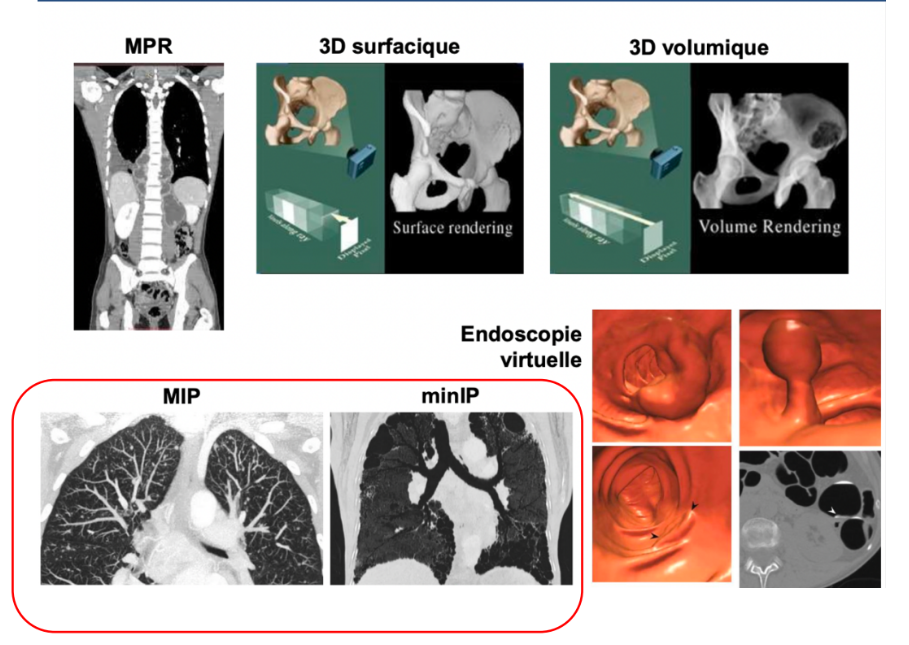
Le scanner fait-il des images en 3D ?
Le scanner génère des tranches d’images en 2D. Par traitement informatique, on peut ensuite reconstituer une image en 3D.
Que nous permet d’obtenir le scanner ?
En fonction de comment on règle le protocole d’imagerie, on peut voir :
Les zones qui atténuent au maximum les rayons comme les os →Multiplanar reconstruction (MPR)
Imagerie de surface (3D surfacique)
Imagerie volumique (3D volumique)
Endoscopie virtuelle : on peut reconstruire l’intérieur de l’intestin par exemple pour voir s’il y a des polypes→ça évite de faire des coloscopies ou des fibroscopies
Sur la même image, en fonction de si on fait ressortir le contraste de ce qui absorbe le plus ou inversement, au niveau des poumons, on va soit pouvoir voir l'arbre vasculaire pulmonaire (MIP) soit les alvéoles bronchiques (minIP) alors qu'il s'agit du même patient, on a juste réglé le contraste différemment.
MIP : Maximum Intensity Projection vs minIP : Minimum Intensity Projection
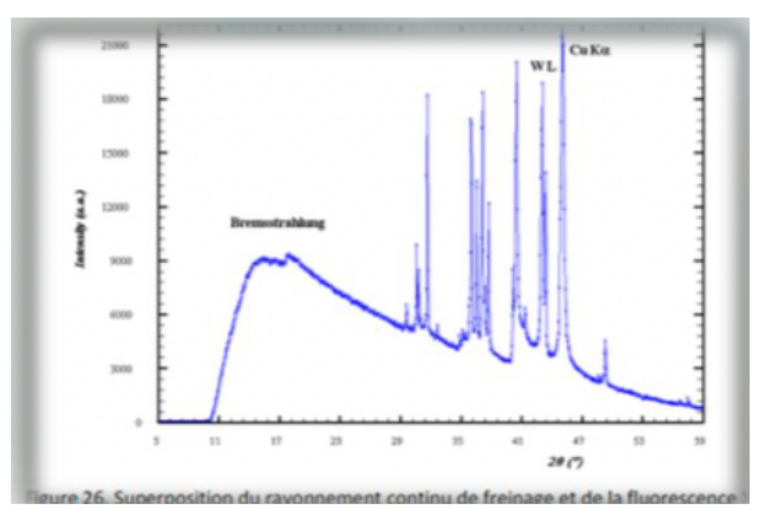
À la vue de ce spectre, est ce que c’est normal d’avoir ce spectre de rayon X en sortie de générateur ?
La réponse et oui mais pourquoi on obtient un trait continu et des pics ?
→L’électron est arraché de la cathode, il interagit avec le gaz, il va faire du rayonnement de freinage donc interaction d’un électron avec un noyau, il est dévié et cela génère une radiation, c’est un spectre d’énergie continu, c’est ce qu’on voit au début (freinage)
puis ensuite l’électron va venir taper dans l’anode dans la cible en tungstène, c’est-à-dire qu’il va transférer de l’énergie au x électrons de l’anode qui vont monter d’un cran et comme la matière n’aime pas être déstabilisé, ça va revenir à l’état le plus stable ce qui va réémettre l’énergie qui a été donnée, ce qui donne un spectre de fluorescence X qui est un spectre de raies.
Imagerie nucléaire
regroupe quoi ?
Dans l’imagerie nucléaire, on retrouve :
→Scintigraphie
→imagerie TEP
Imagerie nucléaire diff avec scanner et radio ?
La différence de ces 2 techniques par rapport à ce qu’on vient de voir avec la radiographie et le scanner c’est que la radiographie et le scanner sont des imageries dites de transmission, ce qui est radioactif est à l’extérieur du patient alors que pour l’imagerie nucléaire le patient est la source, c'est-à-dire qu'on injecte la source radioactive directement au patient. C'est donc de l'imagerie d'émission.
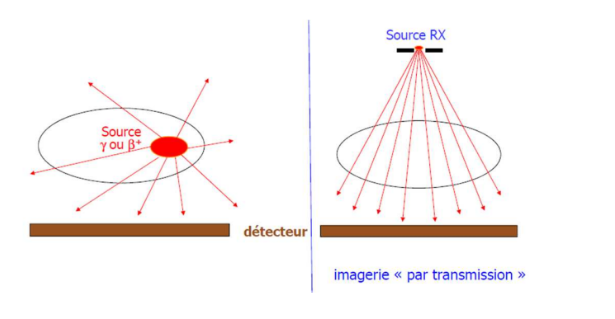
Imagerie d’émission fonctionnement ?
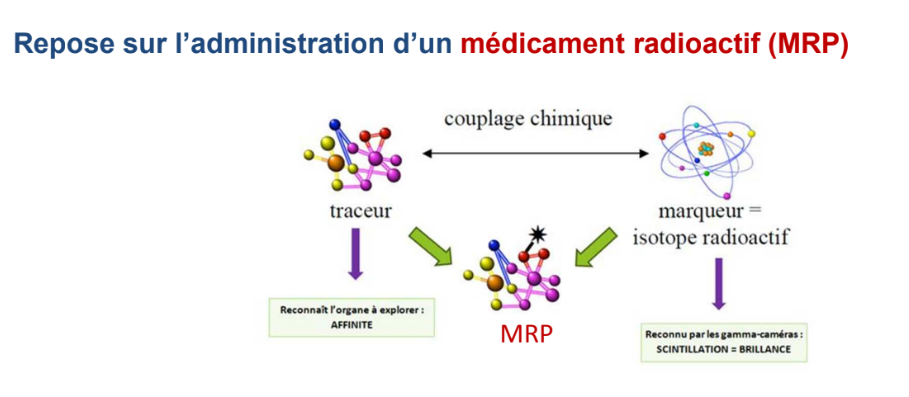
On rend le patient radioactif en lui administrant un médicament radiopharmaceutique qui est composé d’une molécule traceur/vecteur et d’un marqueur.
La molécule traceur permet de cibler un organe ou un processus métabolique particulier. Le marqueur correspond à un isotope radioactif qui va donc émettre des rayonnements gamma ou bêta plus détectables par la caméra.
Imagerie TEP
type d’émission ?
principaux isotopes utilisés ?
Emetteurs Beta+ → Tomographie par émission de positons :
Fluor 18
Carbone 11 (surtout en recherche car a une demi-vie physique de 20 minutes donc il faut être à proximité du site de production pour en faire et avoir un cyclotron pas loin mais pas tous les services de médecine nucléaire ont un cyclotron = accélérateur de particules circulaire)
Gallium 68, cuivre 69, zirconium 89 : demi-vie plus longue + ne se couple pas au vecteur par chimie covalente mais par chimie de coordination →sont très utiles pour marquer des structures peptidiques ou des anticorps thérapeutiques par exemple
Scintigraphie
type d’émission ?
principaux isotopes utilisés ?
Emetteurs gamma → Scintigraphie monophotonique
Technétium 99 métastable →le plus utilisé
Thallium 81 pour les imageries cardiaques
Indium 111 pour la détection des tumeurs neuroendocrines
Iode 123 pour la scintigraphie thyroïdienne
Krypton 81 métastable pour certaines explorations cérébrales →très peu utilisé
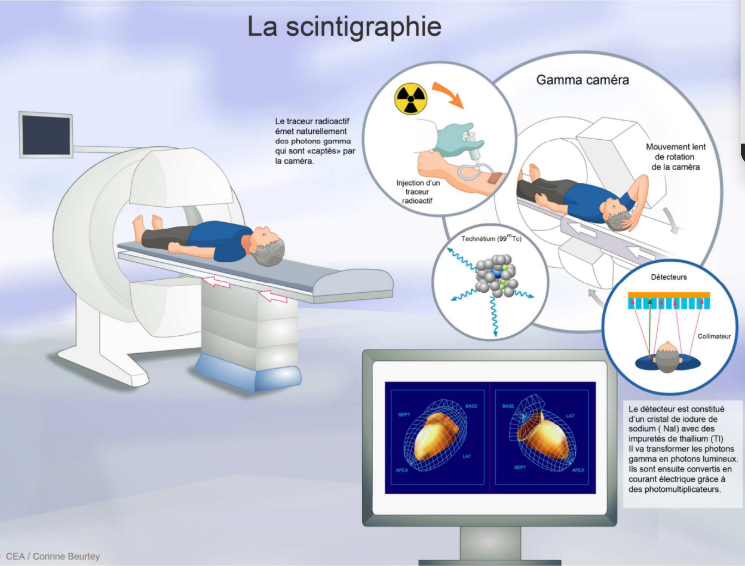
Scintigraphie fonctionnement ?
On administre une molécule vectrice à laquelle on a associé par chimie de coordination du technétium 99 métastable. Le patient devient radioactif. Le médicament va se distribuer dans les organes qui sont en lien avec la structure vectrice utilisée. On détecte ensuite les rayonnements qui sortent du patient
Intérêt de la scintigraphie ?
L’intérêt de la scintigraphie c’est de pouvoir faire ce que ne fait pas l’imagerie morphologique.
→ Aujourd'hui, on est plutôt dans une ère d'imagerie multimodale (on combine les modalités d'imagerie). On a des imageries morphologiques d'un côté et des imageries fonctionnelles de l'autre, l'idée c'est d'avoir les 2 informations.
Exemple/analogie du couplage de la scintigraphie avec une modalité morphologique ?
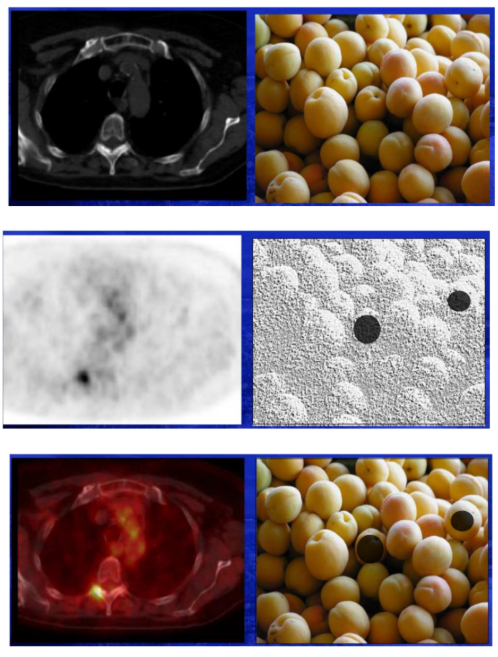
Si on fait un scanner sur un panier d’abricot, je vais voir que j’ai des abricots mais je vais pas voir s’ils sont pourris (me montre pas la dérégulation d’un processus métabolique). On va seulement avoir des infos sur la quantité d’abricots, leur taille, leur localisation.
Si on fait une scintigraphie sur ce même panier d’abricot, je vais pas avoir bcp d’infos sur leur taille, leur nombre, etc. car la résolution n’est pas bonne mais je vais pouvoir voir qu’il y en a deux qui sont pourris.
→Donc faire de l’imagerie hybride = de l’imagerie morphologique associée à de l’imagerie fonctionnelle permet de voir des sites cancéreux ET de les localiser
Couplage gamma caméra / Scanner X →Intérêt : Meilleure localisation de la lésion, du processus fonctionnel
Quelles types de scintigraphies peut-on faire ?
Des scintigraphies osseuses
Des scintigraphies rénales
Des scintigraphies thyroïdiennes
Des scintigraphies cardiaques
Des scintigraphies cérébrales
scintigraphies osseuses ?
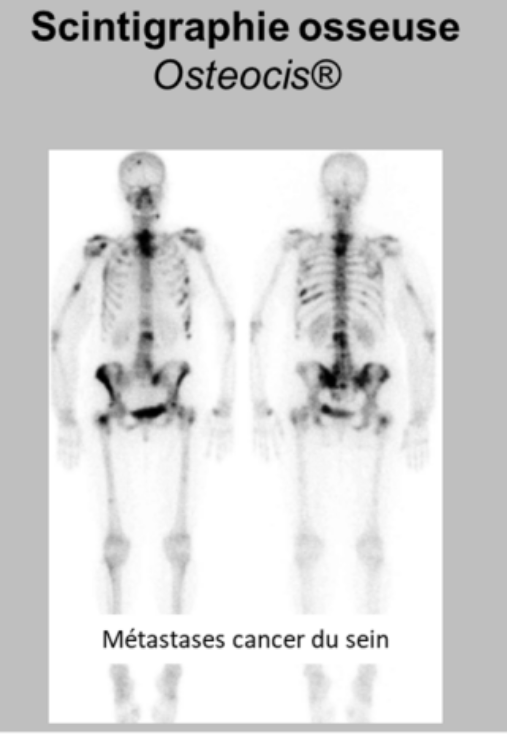
On peut faire des scintigraphies osseuses en utilisant des biphosphonates auxquels on va coupler le technétium 99 métastable →c’est bien pour détecter des métastases osseuses
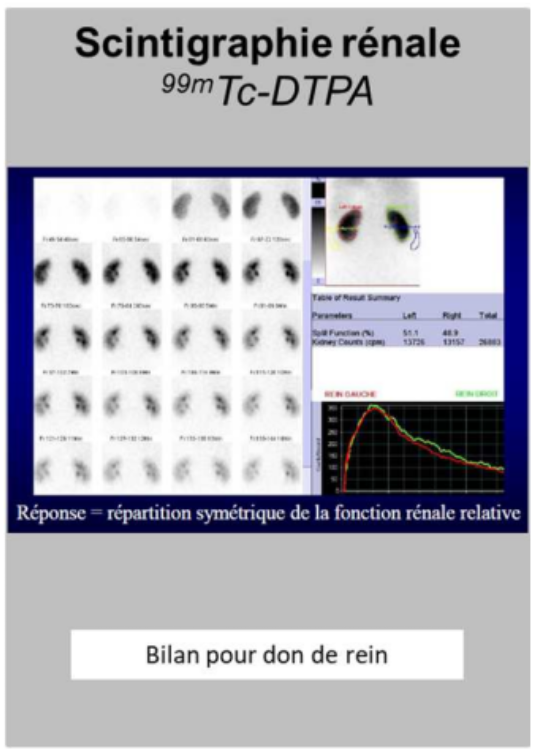
scintigraphies rénales ?
On peut faire des scintigraphies rénales avec le technétium 99 métastable pour voir si on n’a pas d’occlusions au niveau des artères par exemple
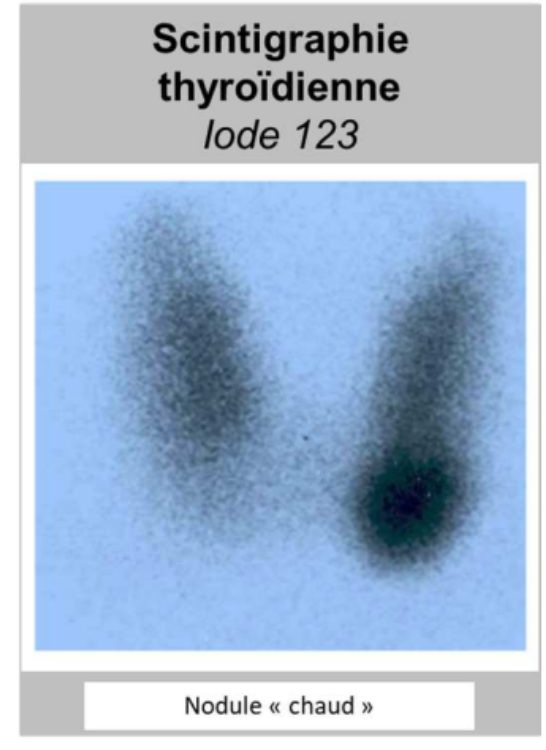
scintigraphies thyroïdiennes ?
On peut faire des scintigraphies thyroïdiennes avec de l’iode 123. On peut voir ici un nodule chaud, quelque chose qui va surproduire des hormones thyroïdiennes. Ce nodule chaud peut évoluer en adénome ou en adénocarcinome
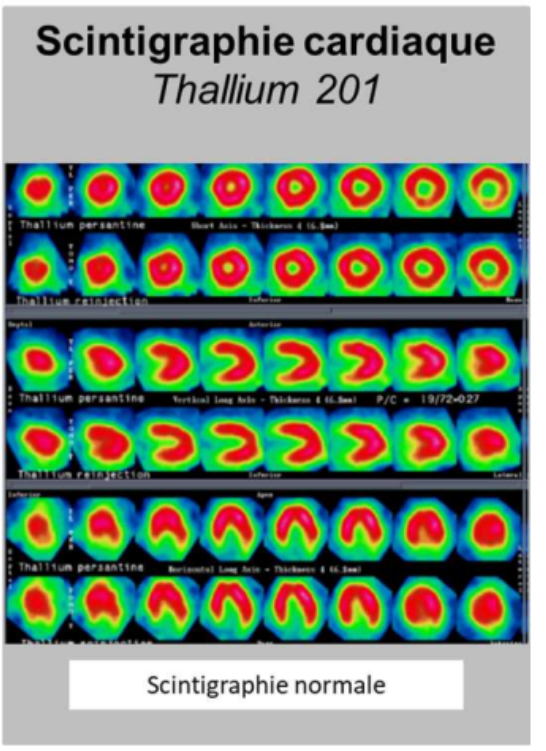
scintigraphies cardiaques
On peut faire de la scintigraphie cardiaque avec du thallium 201 pour voir si le muscle myocardique fonctionne normalement.
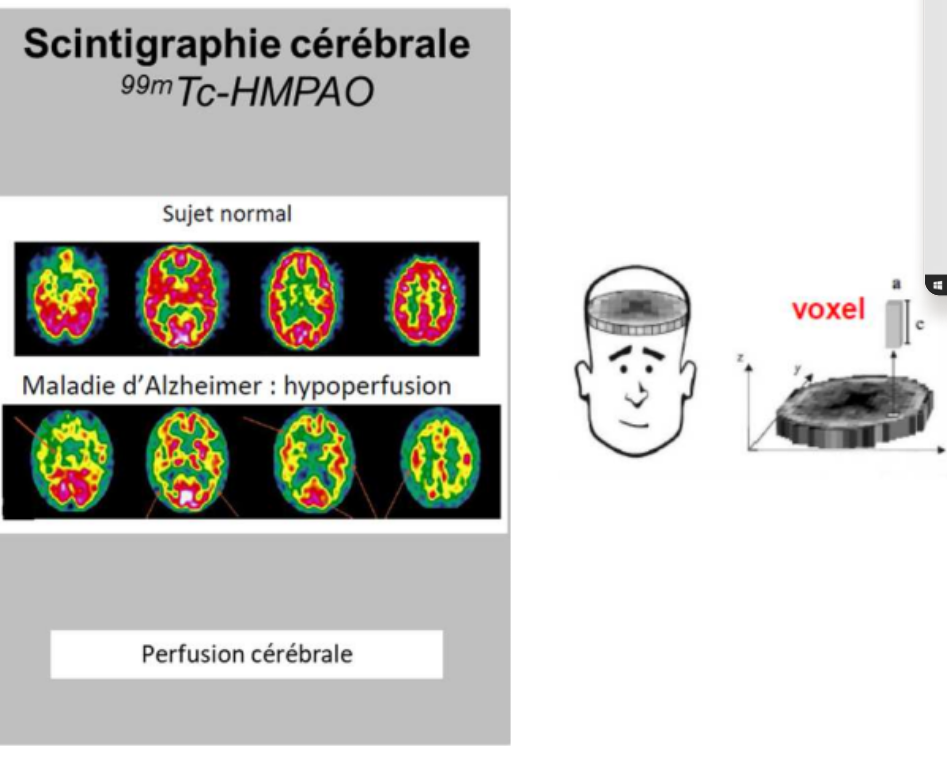
scintigraphies cérébrales ?
On peut faire des scintigraphies cérébrales avec le technétium 99 métastable. On étudie la perfusion du cerveau dans l’épilepsie ou les maladies neurodégénératives par exemple.
Dans la maladie d’alzheimer, on a certaines aires primaires qui sont hypoperfusées
Tomographie par émission de positons ?
C’est toujours le même principe avec le médicament radiopharmaceutique. On a une structure vectrice sauf qu’on le couple à un émetteur bêta + (fluor 18…). On met le patient sous la caméra, le médicament se distribue.
C’est la technologie qui est un peu différente : On a une couronne de détecteur qui entoure complètement le patient et qui permet de détecter des photons gamma.
→C’est de l’émission en coïncidence : on ne va pas détecter la particule bêta + émise car elle a un parcours relativement faible dans la matière (pic de Bragg). L’interaction matière-antimatière : quand un bêta + rencontre un électron, ils vont s’annihiler et ça donne lieu à l'émission incidente à 180° de 2 photons gamma de 511 keV. C’est ça que la caméra va détecter
Ce principe de double détection permet d’être beaucoup plus précis. → La tomographie par émission de positons a une sensibilité et une résolution spatiale bien supérieure à la scintigraphie grâce à ce phénomène.
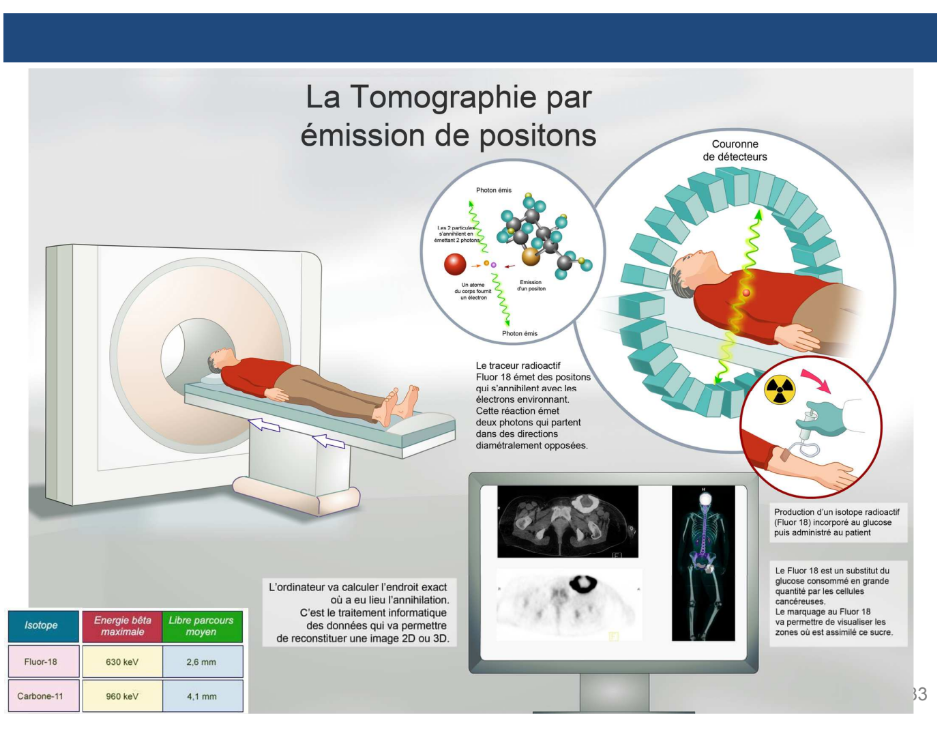
Radiopharmaceutique le plus utilisé en TEP ?
Le 18F-FDG (18F-fluorodéoxyglucose) est un médicament radiopharmaceutique. C’est du fluorodéoxyglucose radiomarqué au fluor 18. C’est un analogue du glucose sauf que sur une position, on a un fluor au lieu d’un hydroxyle. Il est capté par les transporteurs GLUT des cellules mais il ne peut pas ressortir ce qui permet d’avoir une imagerie indirecte des cellules ou des sites qui consomment beaucoup de glucose.
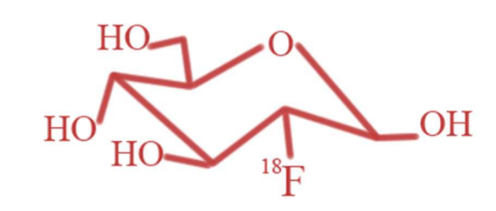
Dans quels domaines est utilisé le 18F-FDG ?
On utilise le 18F-FDG pour détecter les sites infectieux profonds
On utilise aussi en oncologie pour faire soit des bilans diagnostic soit des bilans d’extension pour voir s’il y a des métastases (car en général, les cellules cancéreuses aiment bien le glucose sauf le cancer de la prostate qu’on ne voit pas donc pas avec du 18F-FDG)
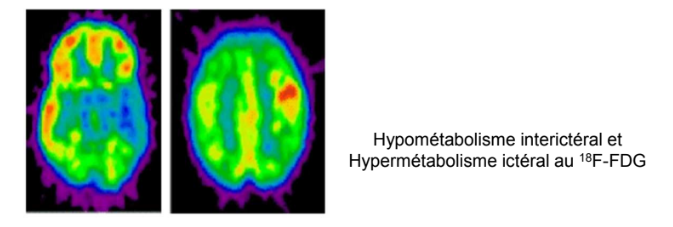
On utilise aussi en neurologie pour étudier certaines formes de démences et l’épilepsie
*Entre 2 crises (1ere image), on a une hypofixation métabolique et pendant une crise (2e image), on a une zone qui consomme énormément de glucose. Si on fait une soustraction de ces deux images, on peut avoir une délimitation très claire du foyer épileptique ce qui peut être très utile pour les chirurgiens ensuite pour faire par exemple une résection chirurgicale du foyer épileptogène.

Un homme de 25 ans a la maladie de Hodgkin au stade IV avec une atteinte pulmonaire. Qu’est-ce qu’on peut dire sur ses imageries ?
On fait toujours un bilan initial pour voir s’il y a des métastases (points noirs).
Au niveau du cerveau, on a un gros point noir mais c’est pas une métastase. Le cerveau consomme de base beaucoup de glucose (il faut donc faire une imagerie spécifique si on veut voir le cerveau). Pareil au niveau de la vessie car le glucose est éliminé dans les urines. C’est une fixation physiologique.
Ce patient est traité par un protocole ABVD (traitement de chimiothérapie): Adriamycine, Bléomycine, Vinblastine, Dacarbazine
D’après l’imagerie faite en fin de traitement, on a une rémission quasi complète du patient. On ne voit plus de foyers qui surconsomment du glucose →Régression de la polyadénopathie
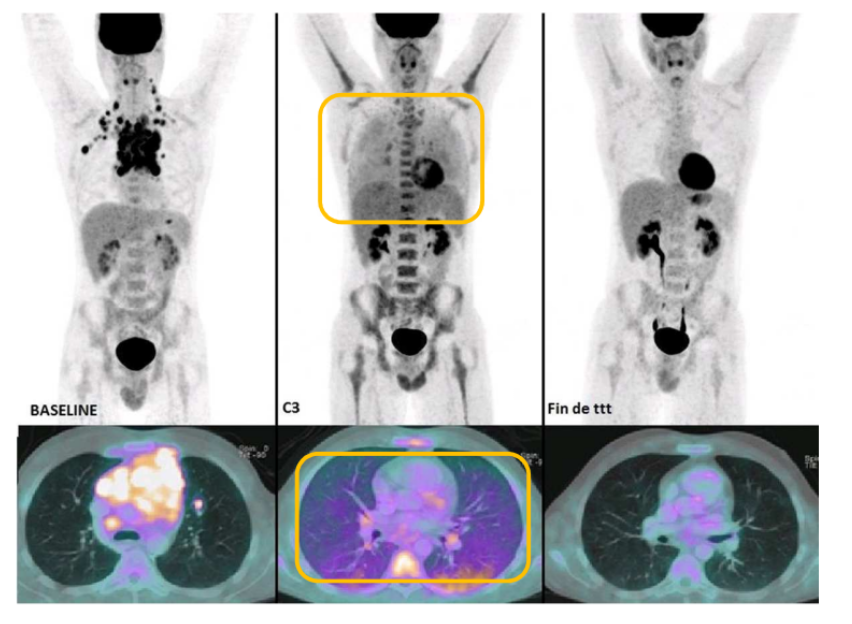
Qu’est-ce qu’on peut dire sur son imagerie en cours de traitement ?
Ces patients ne font pas qu'une imagerie avant et après traitement mais aussi des imageries au cours du traitement (examens de suivi).
Si on compare l’imagerie en cours de traitement à celles en début et en fin de traitement, on voit qu’il y a une surfixation au niveau pulmonaire.
Ce n’est pas une atteinte due au cancer. En fait, un des médicaments du traitement ABVD, la bléomycine, est connue pour faire des pneumopathies infiltrantes diffuses. C’est un effet iatrogène.
C’est assez fréquent : 18-28% mais ça disparait en fin de traitement. Il y a des facteurs de risques (dose totale, pathologie pulmonaire existante, radiothérapie...)
Imagerie TEP : autres médicaments radiopharmaceutiques ?
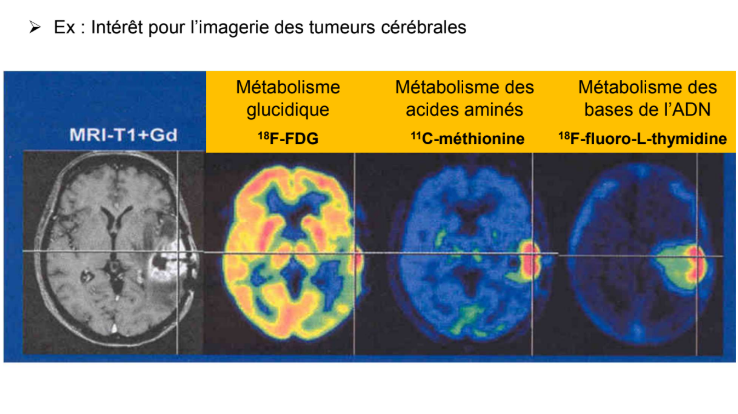
Par exemple, si on veut faire de l’imagerie de tumeur cérébrale, comme de base, le cerveau consomme beaucoup de glucose, si on veut voir quelque chose qui consomme du glucose dans un organe qui consomme beaucoup de glucose, il va y avoir un problème de contraste. Donc on peut utiliser des vecteurs spécifiques d’autres voies métaboliques :
Métabolisme des acides aminés : analogues de la méthionine → 11C-méthionine → on voit beaucoup mieux le site tumoral qu’avec juste du FDG car de base, le cerveau ne capte pas trop ces acides aminés
Métabolisme des bases de l’ADN : 18F-fluoro-L-thymidine. C’est un médicament qui rentre assez mal dans le cerveau. Donc si on a un gliome qui entraîne une rupture de la barrière hémato-encéphalique par exemple, il va y avoir une pénétration locale du médicament très définie →affine le diagnostic
Radioactivité en recherche intérêt ?
L’utilisation de ces méthodologies d’imagerie peut être un accélérateur de développement de nouveaux médicaments.
Par exemple, si je veux développer un médicament à visée cérébrale, il faudra que je vérifie si ça rentre dans le cerveau. Si j’ai qqch qui marche bien in vitro mais que in vivo, ça ne passe pas la barrière hémato-encéphalique, ça fait beaucoup d’investissements pour peu de résultats.
Comment vérifier qu’un médicament est rentré dans le cerveau ?
Une façon non-invasive de vérifier que ça rentre dans le cerveau est de prendre le médicament en développement, de le rendre radioactif sans modifier sa structure et de l’administrer à un animal (cerveau de macaque) ou à l’homme. L’avantage est qu’on travaille à dose traceuse
La radioactivité est tellement sensible qu’on peut travailler à dose traceuse = dose qui ne génère aucun effet pharmacologique donc aucun effet indésirable →on peut même utiliser des molécules toxiques pour faire de l’imagerie nucléaire
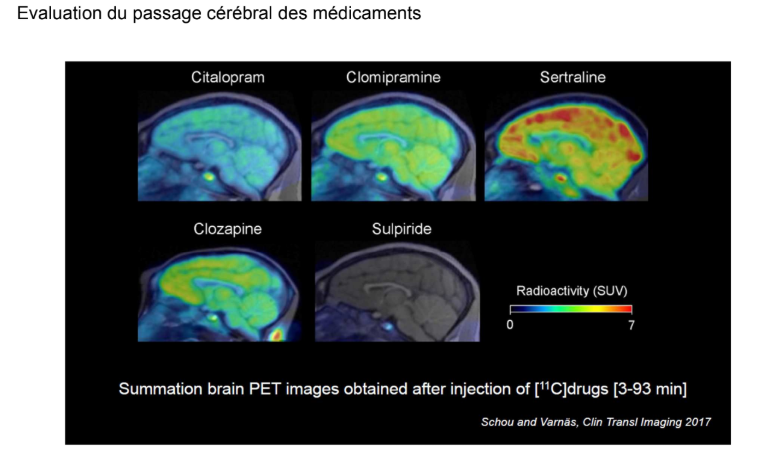
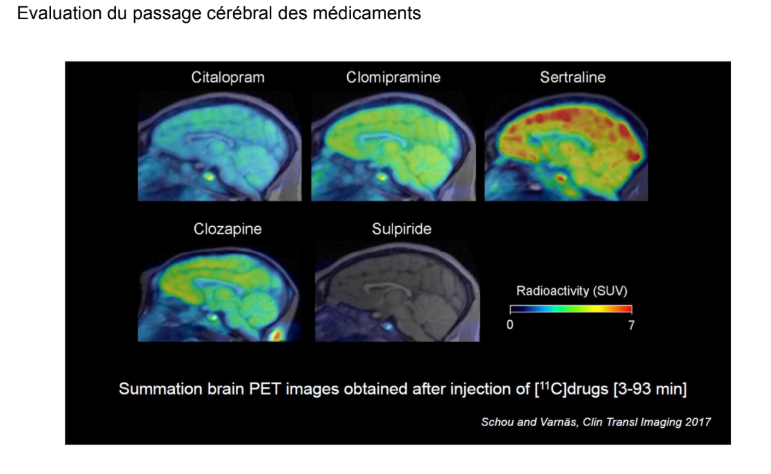
Voici des imageries permettant de voir si des médicaments sont entrés dans le cerveau :
qu’est-ce qu’on a fait pour voir ça ?
que peut-on en dire ?
Cet article permet d’apprécier la disposition cérébrale d’un certain nombre de psychotropes. Chacun de ces médicaments commercialisés ont été rendus radioactifs avec du carbone 11 et ont été administrés à des doses similaires.
On voit par exemple que la sertraline rentre très bien dans le cerveau mais se fixe un peu partout. Le citalopram rentre un peu moins dans le cerveau. La sulpiride rentre très très peu.
→Ca permet de comparer les profils cinétiques.
Il y a un petit point qu’on voit tout le temps dans ces imageries : c’est l’hypophyse. Elle fait partie des organes circumventriculaires qui ne sont pas protégés par la barrière hémato-encéphalique donc on la voit tout le temps
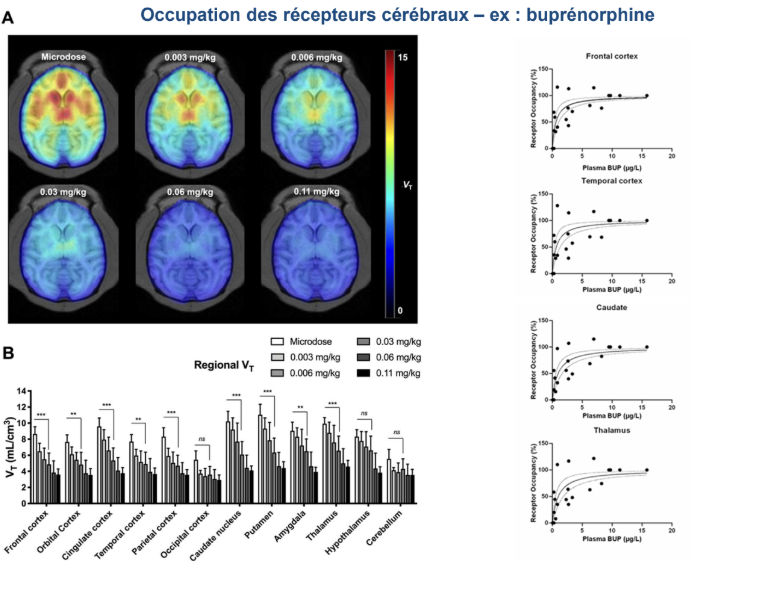
Qu’a t-on fait dans cette étude ?
On a rendu radioactive la buprénorphine. On a ensuite mesuré le taux d’occupation des récepteurs opioides après administration de buprénorphine. Au delà de 2mg pour un individu de 70 kg, on a quasiment une occupation totale des récepteurs opioïdes
→Ca permet de voir si on a des médicaments qui vont être efficaces à petite dose ou si on peut espérer avoir une augmentation de l’effet en augmentant les doses
→Avantage de cette technique : infos très précises sans avoir à découper des cerveaux
Qu’est-ce que la buprénorphine ?
La buprénorphine (subutex) est utilisée en tant que médicament substitutif pour traiter la dépendance aux opioïdes + analgésique
→c’est une molécule hyper affine pour les récepteurs opioïdes. Elle les occupe tous à faible dose.
Le seul intérêt d’augmenter les doses est d’augmenter le temps de résidence du médicament dans l’organisme et donc d’augmenter la durée de l’effet.
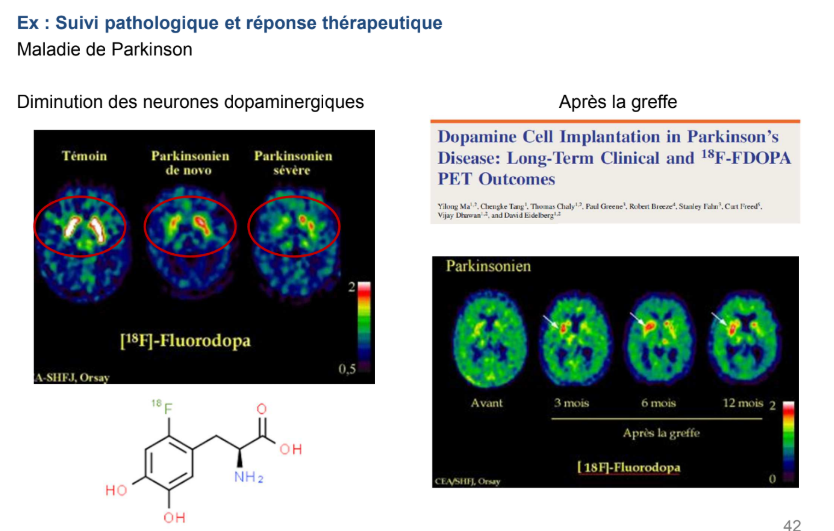
Qu’a-t-on fait dans cette autre étude ?
Approches de thérapie génique pour traiter la maladie de Parkinson (= neurodégénérescence des noyaux glies centraux dans lesquels on retrouve beaucoup de récepteurs neuro-dopaminergiques)
→ Si j’administre un médoc (18F-fluorodopa) qui se fixe sur ces récepteurs, je vais voir les noyaux glies centraux chez un individu sain mais pas chez un individu atteint → ça c’est pour le diagnostic
On peut aussi utiliser cette approche pour faire du suivi thérapeutique sur des traitements innovants :
Il y a des greffes de cellules souches dans les noyaux glies centraux de patients parkinsoniens. Au bout de 3mois, 6 mois et 1 an, on retrouve du signal au niveau de l’hémisphère implanté, ça veut qu’on a une régénération des noyaux glies centraux de façon locale