organische chemie
1/25
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
26 Terms
Ordnungszahl
Anzahl der Protonen (meist auch Elektronen; außer Ionen & Neutronen; außer Isotope)
Gruppen
senkrecht. 8 Hauptgruppen, kann Valenzelektronenzahl ablesen. Elemente der gleichen Hauptgruppe verhalten sich ähnlich
kovalente Bindung
“Elektronenpaarbindung”. Elektronen werden geteilt, bis 1,7 Elektronegativitätsunterschied
Kohlenstoff
4-wertig → geht vier Bindungen ein (weil 4 Valenzelektronen)
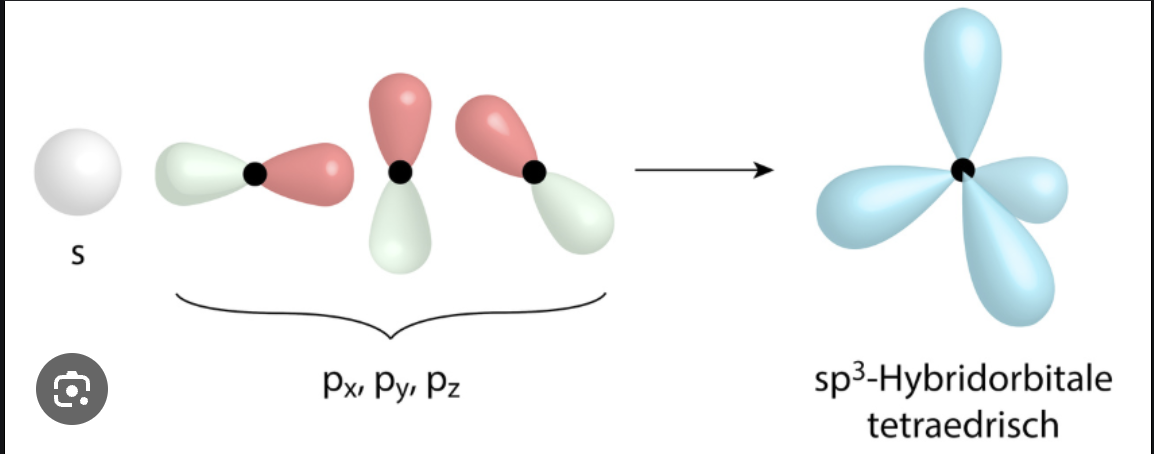
sp3-Hybridisierung
ein rundes s-Orbital & drei hantelförmige p-Orbitale ergeben vier keilförmige sp3-Orbitale die energetisch ident sind
bei Alkanen (Einfachbindungen), nur Sigma-Bindungen
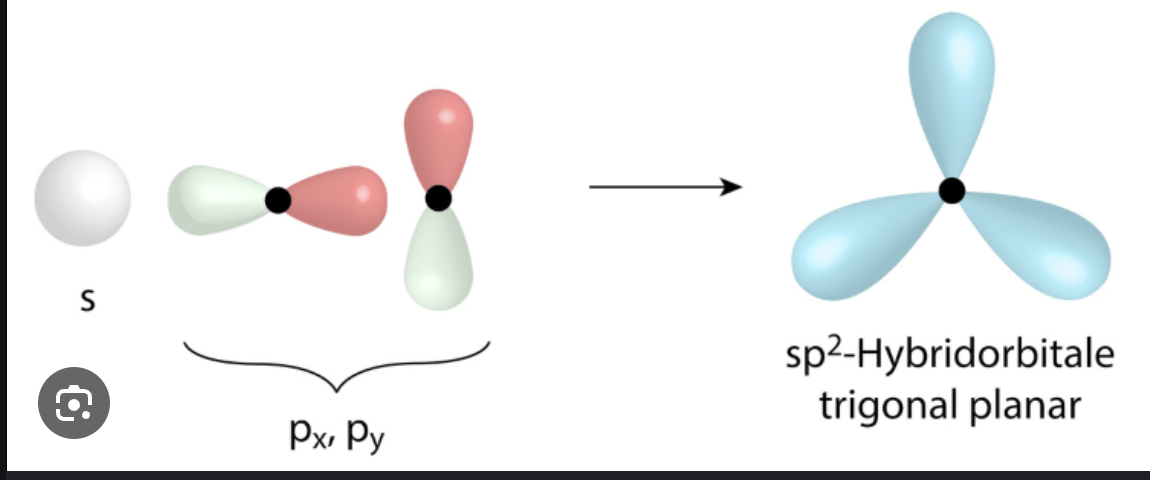
sp2-hybridisierung
ein s-Orbital & zwei p-Orbitale ergeben drei sp2-Orbitale & ein p-Orbital → ist übrig
bei Alkenen (Doppelbindungen), eine Sigma & eine Pi-Bindung
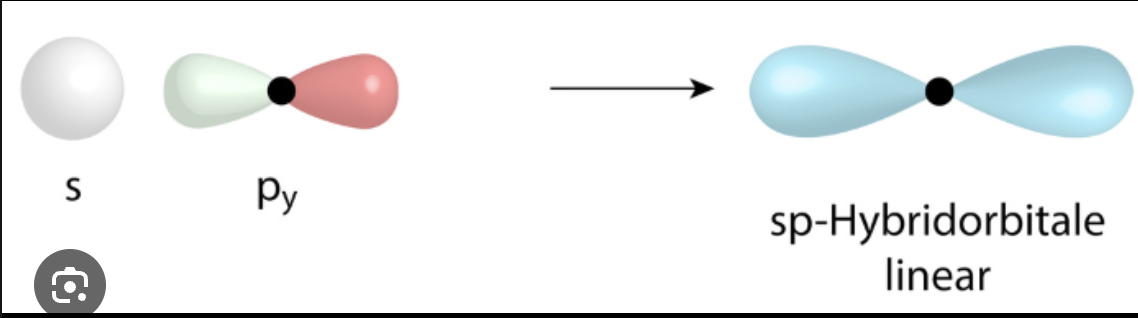
sp-Hybridisierung
ein s-Orbital & ein p-Orbital ergeben zwei sp-Orbitale & zwei p-Orbitale → sind übrig
bei Alkinen (Dreifachbindung), eine Sigma- & zwei Pi-Bindungen
Sigma-Bindung
rotationssymmetrisch, alle Einfachbindungen & erste Bindung bei Mehrfachbindungen
Pi-Bindung
nicht rotationssymmetrisch, bei Mehrfachbindungen ab der 2.
gesättigte Verbindungen
wenn Einfachbindung zwischen C`s & maximale Anzahl an H-Partnern
Alkane
ungesättigte Verbindungen
wenn Doppel- oder Dreifachbindung bei C´s (nicht nur C=C, auch C=O) & könnten mehr H haben
Doppelbindung → Alkene
Dreifachbindung → Alkine
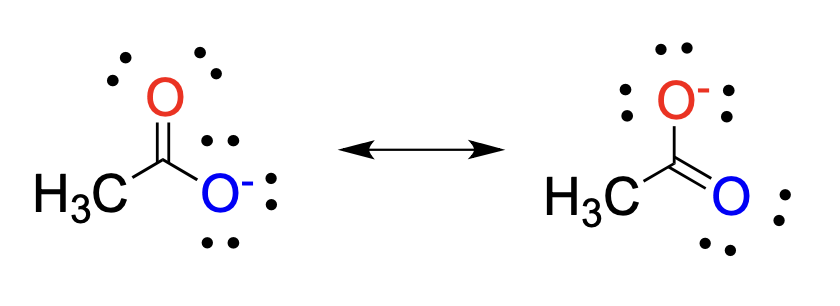
Mesomerie
wenn für eine Molekülstruktur mehrere Valenzstrukturen formuliert werden können
stabilisiert Verbindung
isolierte Doppelbindung
wenn zwischen den Doppelbindungen mindestens zwei Einzelbindungen liegen
konjugierte Doppelbindung
wenn zwischen Doppelbindungen nur eine Einzelbindung liegt
Aromatizität
zyklisch (ringförmig) -konjugierte (zwischen Doppelbindungen nur eine Einfachbindung), planare (flache) Moleküle, bei denen 4n+2 Pi-Elektronen, (wobei n ganze Zahl sein muss)
besonders stabil & damit reaktionsträge
Azyklische Verbindungen
kettenförmig
entweder gesättigt → Alkane
oder ungesättigt → Alkene & Alkine
Zyklische Verbindungen
Carbozyklen oder Heterozyklen
Carbozyklen
nur C-Atome im zyklischen Molekül (Seitengruppen können abweichen)
entweder Alizyklen → Zykloalkane, -ene, -ine
oder Aromaten
Heterozyklen
in der Hauptkette kommen andere Elemente vor (N,O)
entweder gesättigt, ungesättigt oder aromatisch
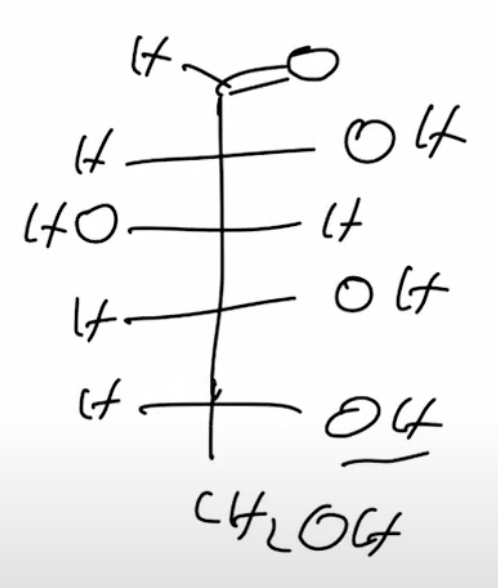
Fischer-Projektion
stellt 3D-Struktur eines Moleküls dar
v.a. bei langen Zuckern oder Aminosäuren
Fischer-Projektion Regeln
senkrecht → hinten
waagerecht (Seitenketten) → vorne
oben C mit höherer Oxidationszahl
Substituent an letztem chiralem Zentrum bestimmt ob L- oder D-Konfiguration (wenn OH rechts; D, wenn OH links; L)
Oxidationszahlen
C (C-C) → 0
H (C-H) → -1
O (C-O) → +1
wobei Doppelbindungen separat gelten (C=O → +2)
Chiralitätszentren
C sind chiral, wenn sie 4 verschiedene Bindungspartner haben
hier C2 bis C5 chiral
C2 mit C1 (COH), H, OH, & C3 (CHOH) → C1 & C3 unterschiedlich
C3 mit C2 (CHOH), H, OH & C4 (CHOH) → weil Umgebung von C2 & C4 unterschiedlich
Unterschied gesättigt & chiral
gesättigt: C-Atom geht 4 Bindungen mit 4 Bindungspartnern ein
chiral: C-Atom geht 4 Bindungen mit 4 unterschiedlichen Bindungspartnern ein
Isomerie
wenn Moleküle die selbe Summenformel haben aber unterschiedliche Atomsequenzen oder räumliche Anordnung
Stereoisomerie
Unterschied in räumlicher Anordnung (