Enlaces químicos 2
0.0(0)
Card Sorting
1/12
Earn XP
Description and Tags
Last updated 1:25 AM on 3/11/23
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
13 Terms
1
New cards
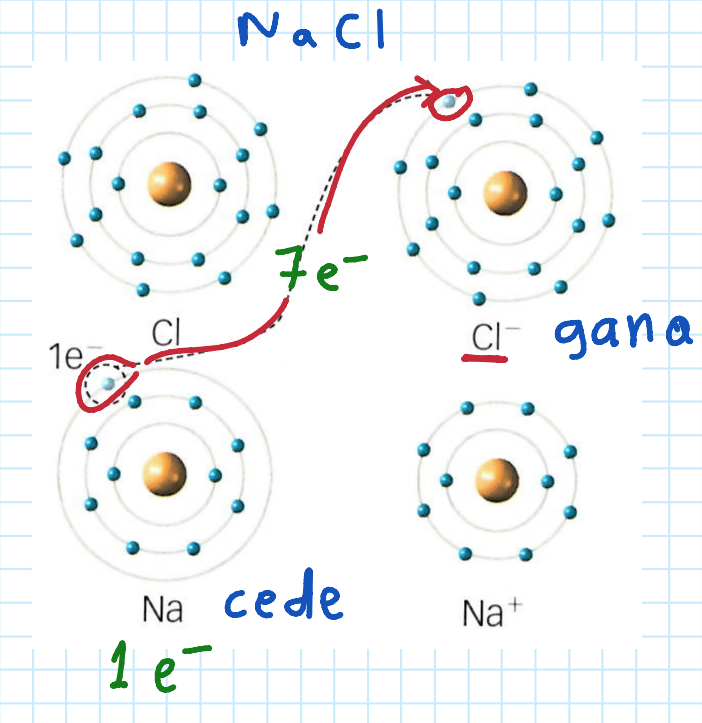
Enlace iónico
Se basa en __transferencia de__ __**e**____.__
Se produce entre @@metal (IA - IIA)@@ y no metal (VIA - VIIA).
Requiere que:
* El @@metal@@ se torne en @@catión.@@
* El no metal se torne en anión.
Se produce entre @@metal (IA - IIA)@@ y no metal (VIA - VIIA).
Requiere que:
* El @@metal@@ se torne en @@catión.@@
* El no metal se torne en anión.
2
New cards
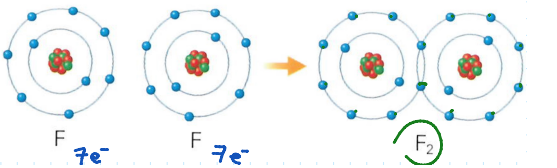
Enlace covalente
Se basa en la __compartición de__ __**e-**____.__
Se produce solo entre no metales.
Requiere que:
* C/átomo comparta sus e de valencia.
* Los elementos sean altamente electronegativos.
Se produce solo entre no metales.
Requiere que:
* C/átomo comparta sus e de valencia.
* Los elementos sean altamente electronegativos.
3
New cards
Moléculas diatómicas
* Hidrógeno (H2).
* Oxígeno (O2).
* Nitrógeno (N2).
* Cloro (Cl2).
* Flúor (F2).
* Bromo (Br2).
* Yodo (I2).
* Oxígeno (O2).
* Nitrógeno (N2).
* Cloro (Cl2).
* Flúor (F2).
* Bromo (Br2).
* Yodo (I2).
4
New cards
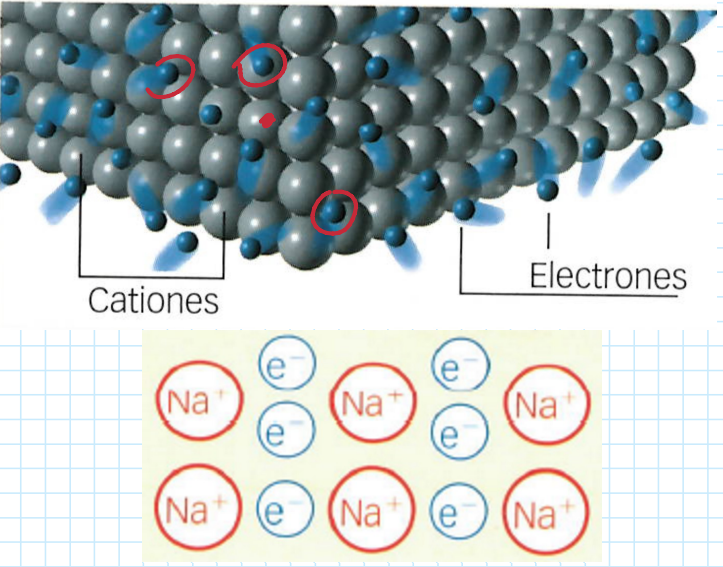
Enlace metálico
Se basa en la formación de cationes.
Se produce solo entre @@metales.@@
Requiere que:
* Metales cedan sus **e-.**
* Cationes se agrupen y formen una red cristalina.
Se produce solo entre @@metales.@@
Requiere que:
* Metales cedan sus **e-.**
* Cationes se agrupen y formen una red cristalina.
5
New cards
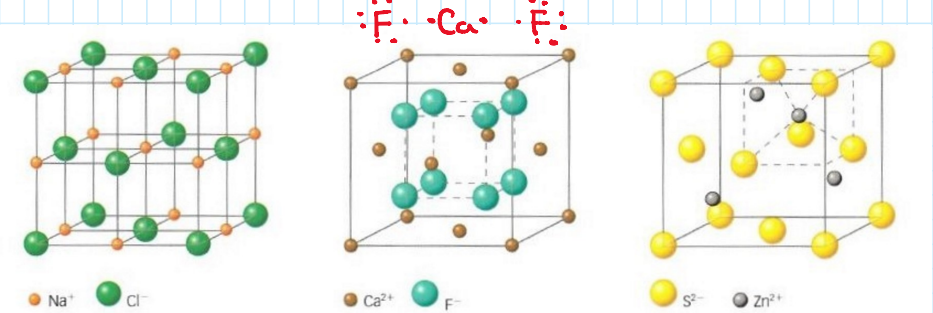
Enlace iónico
Unión de iones con cargas eléctricas **opuestas** por fuerzas de atracción electrostáticas.
El resultado es una *red cristalina compacta, tridimensional y neutra.*
El resultado es una *red cristalina compacta, tridimensional y neutra.*
6
New cards
Energía en redes iónicas
Para formar un red iónica se requiere:
**Energía reticular o de red (Ur):** Energía desprendida **-exotérmica (-)-** por los iones al combinarse para formar 1 mol de sólido cristalino.
\
**Energía reticular o de red (Ur):** Energía desprendida **-exotérmica (-)-** por los iones al combinarse para formar 1 mol de sólido cristalino.
\
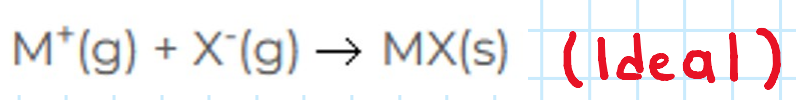
7
New cards
Cálculo de Ur
1. Ciclo de Born - Haber.
2. Ec. de Born - Landé.
\
8
New cards
Ciclo de Born - Haber
Punto de vista: termodinámico (Entalpía → Energía térmica a presión constante).
Se basa en la Ley de Hess.
Se requiere:
* Trabajar con especies gaseosas.
* Ionizar el metal. **(EI)**
* Disociar el no metal.
* Ionizar el no metal. **(AE)**
* Formar el enlace.
Se basa en la Ley de Hess.
Se requiere:
* Trabajar con especies gaseosas.
* Ionizar el metal. **(EI)**
* Disociar el no metal.
* Ionizar el no metal. **(AE)**
* Formar el enlace.
9
New cards
Ley de Hess
En una reacción química, la **E** involucrada es cte., independientemente si se realiza en otras etapas.
10
New cards
Procesos involucrados
1. **ΔHof o calor de formación (proceso directo):**
Calor desprendido por formación de 1 mol de compuesto a partir de sus elementos básicos.
2. **ΔHsub o calor de sublimación (proceso indirecto):**
Calor absorbido para pasar de estado sólido a gaseoso.
3. **Energía de Ionización (proceso indirecto):**
Energía mínima que absorbe un átomo gaseoso para perder un **e-**.
4. **ΔHdis o calor de disociación (proceso indirecto):**
Energía que absorbe una molécula diatómica para separarse en sus átomos correspondientes.
5. **Afinidad electrónica:**
Energía que desprende un átomo gaseoso al ganar 1 e-.
6. **Ur:**
Energía que desprenden los iones al combinarse.
11
New cards
Ec. Gral. de Energía
**Energía de formación del compuesto =** Energía de sublimación + Energía de ionización + Energía de afinidad electrónica + Energía de enlace iónico + Energía de red.
12
New cards
Cambios de estado
* **Fusión:** Sólido a líquido.
* **Solidificación:** Líquido a sólido.
* **Sublimación:** Sólido a gas.
* **Retrosublimación:** Gas a sólido.
* **Evaporación:** Líquido a gas.
* **Condensación:** Gas a líquido.
* **Solidificación:** Líquido a sólido.
* **Sublimación:** Sólido a gas.
* **Retrosublimación:** Gas a sólido.
* **Evaporación:** Líquido a gas.
* **Condensación:** Gas a líquido.
13
New cards
Diagrama de Lewis
**Cationes (IA - IIA)**
* Baja electronegatividad.
* Baja EI.
**-Enlace** @@**iónico-**@@
**Aniones (VIA - VIIA)**
* Alta electronegatividad.
* Alta EI.
* Baja electronegatividad.
* Baja EI.
**-Enlace** @@**iónico-**@@
**Aniones (VIA - VIIA)**
* Alta electronegatividad.
* Alta EI.