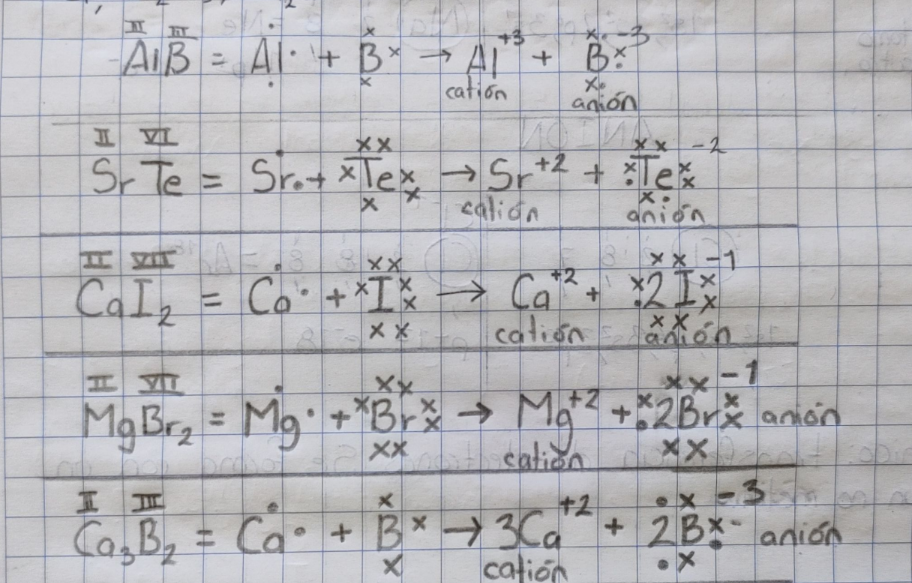Química 1er semestre - 2do parcial
5.0(1)Studied by 214 people
Card Sorting
1/58
Last updated 10:36 PM on 11/29/22
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
59 Terms
1
New cards
Aportaciones de Johann Wolfgang Döbereiner
Declaró las similutudes entre las propiedades de algunos elementos, relacionando sus pesos atómicos.
Se dió cuenta de la existencia de otras agrupaciones de tres elementos que tenían relación entre sí (las triadas de Döbereiner).
Se dió cuenta de la existencia de otras agrupaciones de tres elementos que tenían relación entre sí (las triadas de Döbereiner).
2
New cards
John Newlands
Clasificó los elementos en 11 grupos cuyos componentes presentaban propiedades parecidas y se observó que los pesos atómicos diferían en 8 unidades o en múltiplos de 8 unidades o en múltiplos de 8 (ley de las octavas).
3
New cards
Julius Lothar Meyer
Observó que si los elementos están dispuestos en el orden de sus pesos atómicos se clasifican en grupos que repiten propiedades químicas y físicas similares, a intervalos periódicos (antigua ley periódica).
Expuso las relaciones existentes entre las propiedades de los elementos químicos y sus pesos atómicos.
Expuso las relaciones existentes entre las propiedades de los elementos químicos y sus pesos atómicos.
4
New cards
Henry Moseley
Demostró que la tabla periódica debe ordenarse por su número atómico (ley de Moseley).
5
New cards
Dmitri Ivánovich Mendeléyev
Primera formulación de la ley periódica: las propiedades de los elementos se repiten periódicamente en función de su peso atómico.
Su primera tabla se basaba en el orden creciente de los pesos atómicos.
Su primera tabla se basaba en el orden creciente de los pesos atómicos.
6
New cards
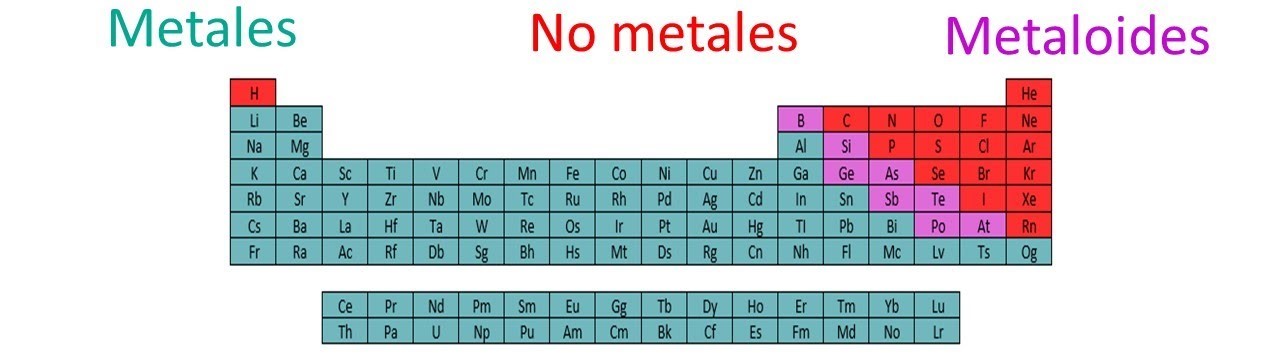
Características de los no metales
- No son maleables.
- No son dúctiles.
(No metales a color rojo en la tabla).
- No son dúctiles.
(No metales a color rojo en la tabla).
7
New cards
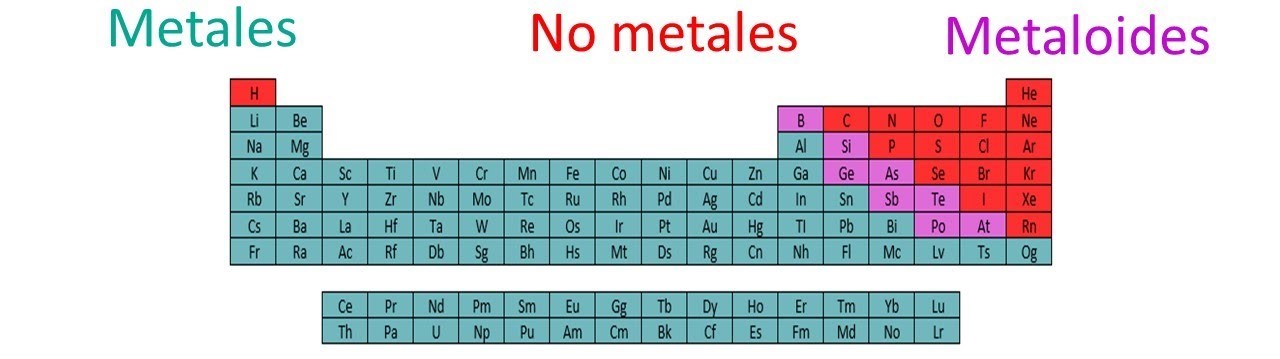
Características de los metales
- Son dúctiles
- Son maleables
- Buenos conductores de calor y electricidad.
(Metales a color azul en la tabla).
- Son maleables
- Buenos conductores de calor y electricidad.
(Metales a color azul en la tabla).
8
New cards
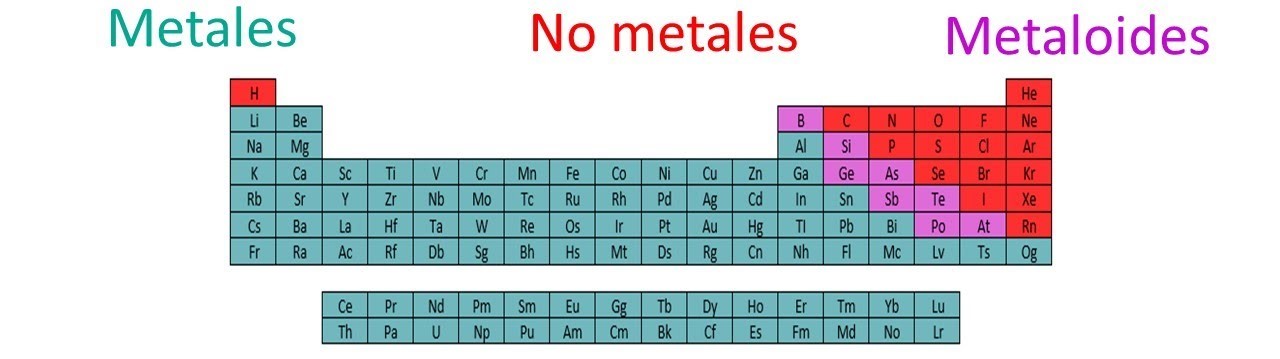
Características de los metaloides
- Son semiconductores.
(Metaloides a color morado en la tabla).
(Metaloides a color morado en la tabla).
9
New cards
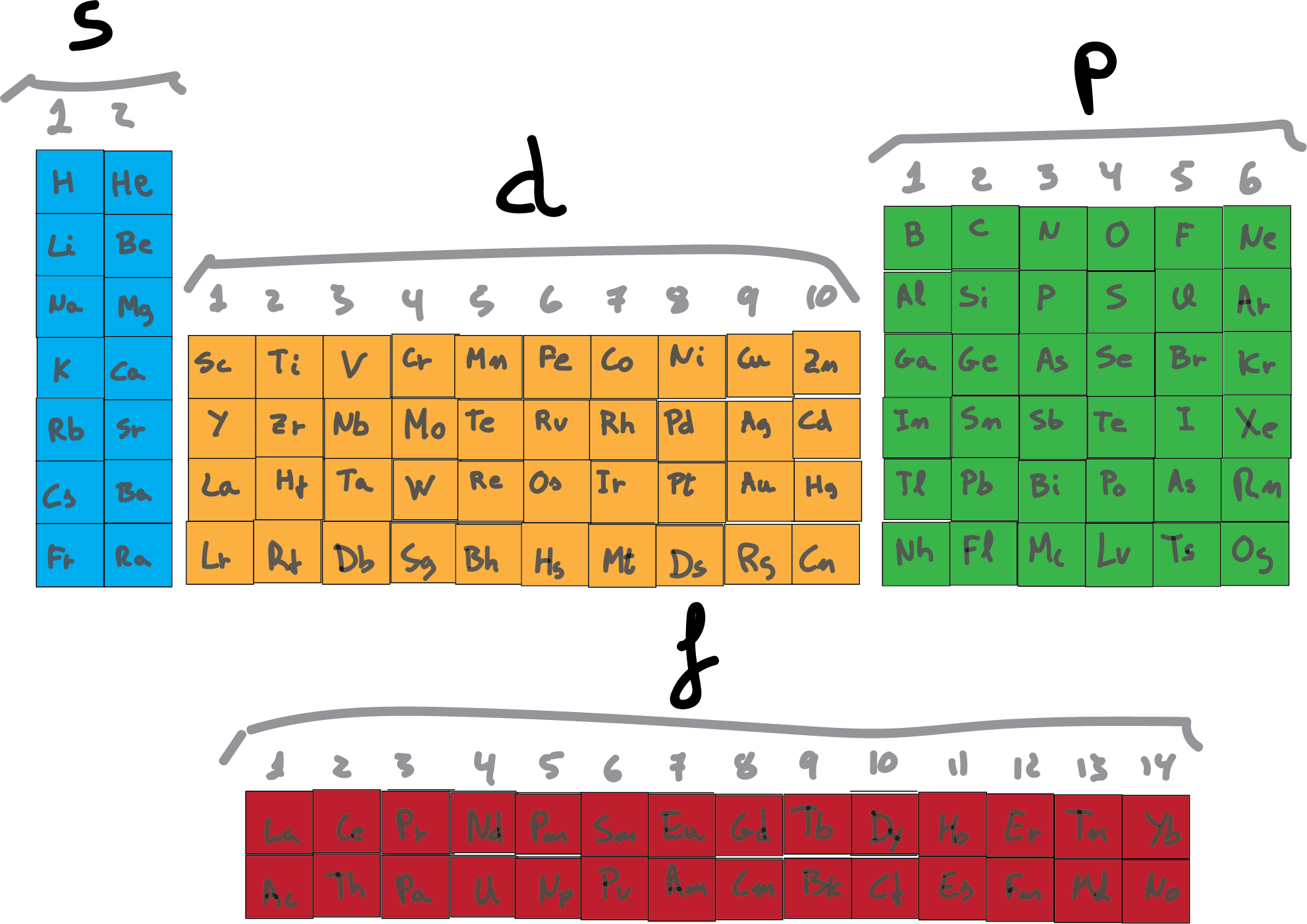
Bloques de la tabla periódica
Son indicados por el último subnivel de energía del elemento (dado por configuración electrónica).
10
New cards
Bloques s y p
Estos bloques conforman el grupo A.
11
New cards
Bloque d
El bloque d conforma el grupo B.
12
New cards
Bloque f
En el bloque f no se presentan grupos, sin embargo tienen familia y es la de los elementos de transición interna o tierras raras.
13
New cards
Periodos y columnas
La tabla tiene 7 periodos o niveles (filas horizontales). La tabla periódica se compone de 18 columnas, las cuales corresponden a ciertas familias.
14
New cards
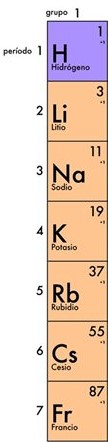
Grupo I A
Corresponde a los metales alcalinos, compuestos por los elementos de la primera columna de la tabla periódica.
15
New cards
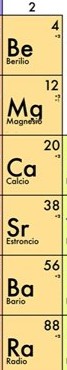
Grupo II A
Corresponde a los metales alcalinotérreos, compuestos por los elementos de la segunda columna de la tabla periódica.
16
New cards
Grupo B
Todo el grupo B es parte de la familia de los metales de transición interna.
17
New cards
Grupo III B
Corresponde a los elementos de la tercera columna de la tabla periódica.

18
New cards
Grupo IV B
Corresponde a los elementos de la cuarta columna de la tabla periódica.

19
New cards
Grupo V B
Corresponde a los elementos de la quinta columna de la tabla periódica.

20
New cards
Grupo VI B
Corresponde a los elementos de la sexta columna de la tabla periódica.

21
New cards
Grupo VII B
Corresponde a los elementos de la séptima columna de la tabla periódica.

22
New cards
Grupo VIII B
Corresponde a los elementos de la octava, novena y décima columna.

23
New cards
Grupo I B
Corresponde a los elementos de la onceava columna.

24
New cards
Grupo II B
Corresponde a los elementos de la doceava columna.

25
New cards
Grupo III A
Corresponde a los metales térreos o boroides, compuestos por los elementos de la treceava columna de la tabla periódica.
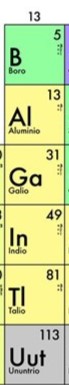
26
New cards
Grupo IV A
Corresponde a los carbonoides, compuestos por los elementos de la catorceava columna de la tabla periódica.

27
New cards
Grupo V A
Corresponde a los nitrogenoides, compuestos por los elementos de la quinceava columna de la tabla periódica.

28
New cards
Grupo VI A
Corresponde a los oxigenoides, compuestos por los elementos de la dieciseisava columna de la tabla periódica.

29
New cards
Grupo VII A
Corresponde a los halógenos, compuestos por los elementos de la diecisieteava columna de la tabla periódica.

30
New cards
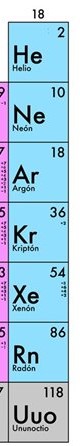
Grupo VIII A
Corresponde a los gases nobles, compuestos por los elementos de la dieciochoava columna de la tabla periódica.
31
New cards
Periodo (fila) de un elemento
El periodo de un elemento está determinado por el mayor nivel de energía.
P. ej. el periodo del boro es 4.
P. ej. el periodo del boro es 4.
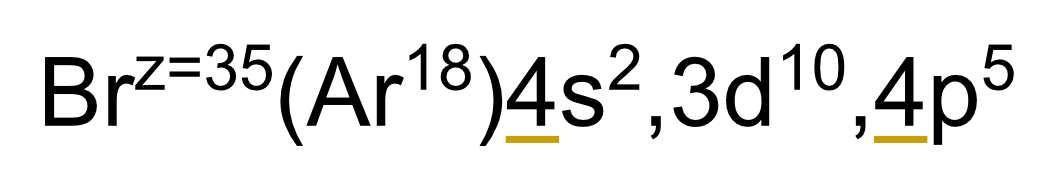
32
New cards
Bloque de un elemento
El bloque de un elemento es el último subnivel de energía que colocamos en nuestra configuración electrónica.
P. ej. el boro es del bloque p.
P. ej. el boro es del bloque p.
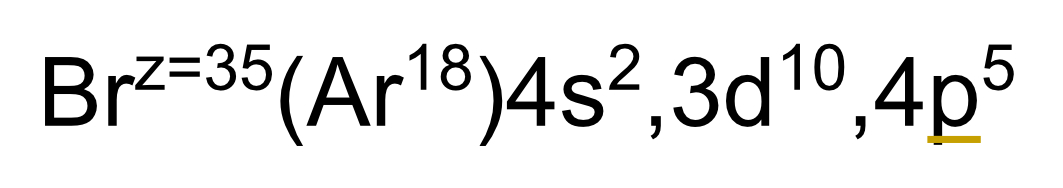
33
New cards
Grupo de un elemento
El grupo de un elemento es la suma del subnivel de energía s + el último subnivel de energía que colocamos en nuestra configuración electrónica.
P. ej. en el bromo el grupo es 2+5 = 7. El bloque del bromo es p, que entra en el grupo A, por lo que el grupo del bromo = VIIA
P. ej. en el bromo el grupo es 2+5 = 7. El bloque del bromo es p, que entra en el grupo A, por lo que el grupo del bromo = VIIA
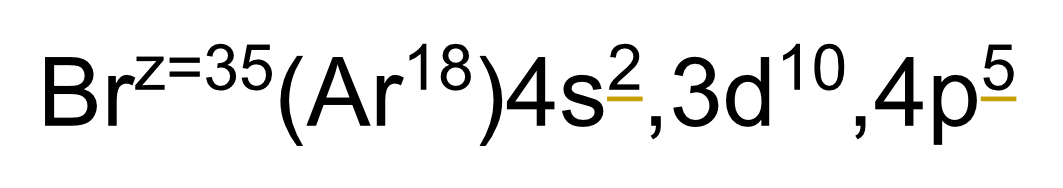
34
New cards
Valencia de un elemento
La valencia de un elemento de los bloques "s" o "p" es igual a su grupo, solo que sin convertir a número romano. Valencia del bromo = 7
En los bloques "d" o "f" es la suma de los niveles más altos. P. ej. con el Lawrencio los más altos son 7s2 y 7p1 lo que da como resultado 3, lo cual es la valencia del elemento.
En los bloques "d" o "f" es la suma de los niveles más altos. P. ej. con el Lawrencio los más altos son 7s2 y 7p1 lo que da como resultado 3, lo cual es la valencia del elemento.
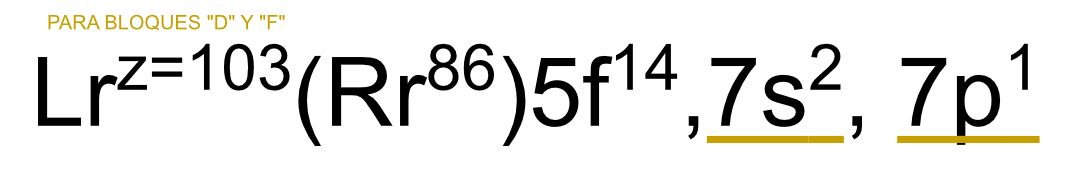
35
New cards
Familia de un elemento
Una vez que sacamos el grupo del elemento, hay que recordar el nombre de la familia que corresponde a ese grupo.
P. ej. el grupo del bromo es VIIA y este corresponde a los halógenos.
P. ej. el grupo del bromo es VIIA y este corresponde a los halógenos.
36
New cards
Columna de un elemento
Si es parte del grupo s o p: Es el mismo número que la valencia.
Si es parte del grupo d: Se saca de igual manera que el grupo. P. ej. en Tecnecio su grupo se sacaría como 2+5 lo que daría VII B (ya que acaba en d) y su columna va a ser la columna 7.
Si es parte del grupo d: Se saca de igual manera que el grupo. P. ej. en Tecnecio su grupo se sacaría como 2+5 lo que daría VII B (ya que acaba en d) y su columna va a ser la columna 7.
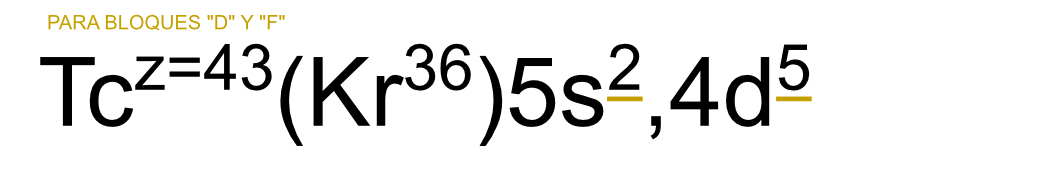
37
New cards
Configuración electrónica gráfica.
Dada nuestra configuración electrónica vamos a recordar que los subniveles tienen orbitales, y cada uno contiene 2 spins (recordar que el spin hacia arriba va antes que el spin hacia abajo). El subnivel s va a tener un orbital, el subnivel p va a tener 3 orbitales ("px", "py" y "pz"), el subnivel d va a tener 5 orbitales y el subnivel f va a tener 7 orbitales. Los orbitales se representan como fracción, arriba los spins y abajo el subnivel. Cada orbital va a representar una fracción.
P. ej. la configuración del carbono. El último subnivel del carbono es 2p2, por lo que se queda solo el orbital 2pz.
P. ej. la configuración del carbono. El último subnivel del carbono es 2p2, por lo que se queda solo el orbital 2pz.
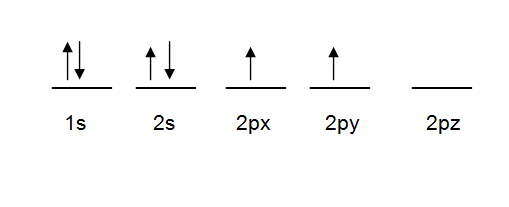
38
New cards
Excepciones con configuración electrónica gráfica del bloque d.
Para reconocer una excepción (presentadas en el bloque d) basta mirar a la representación gráfica que hicimos. Los elementos buscarán que sus orbitales estén vacíos, semillenos o llenos. Si está cercano a uno de estos estados pedirá un spín del orbital anterior.
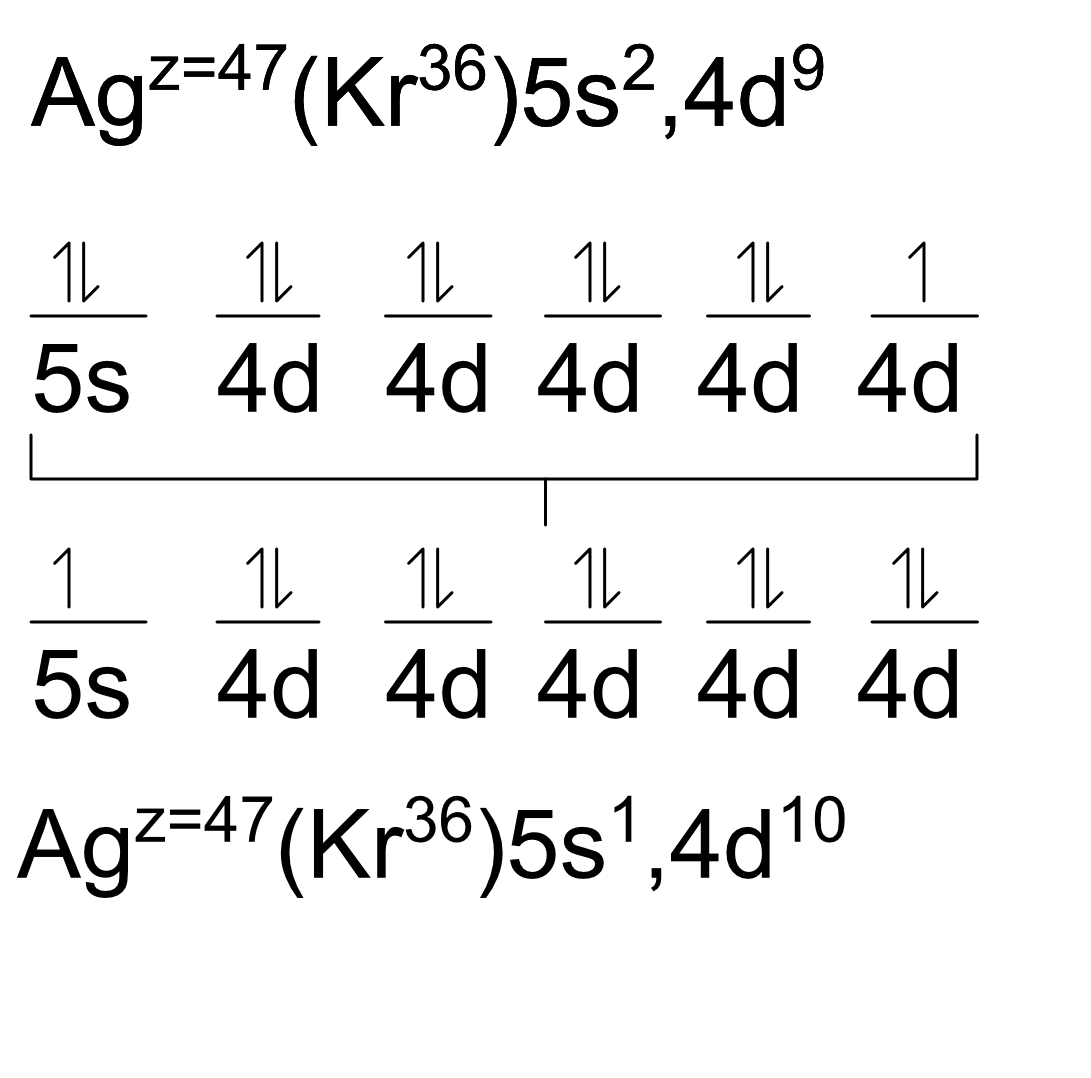
P. ej. A la Plata (Ag) solo le falta un spín a 4d9 para que sus orbitales estén llenos, por lo que pedirá prestado un spín a 5s2. Ahora queda 5s1 y 4d10. Hay que notar que esto hace que cambien características del elemento como su valencia.
P. ej. A la Plata (Ag) solo le falta un spín a 4d9 para que sus orbitales estén llenos, por lo que pedirá prestado un spín a 5s2. Ahora queda 5s1 y 4d10. Hay que notar que esto hace que cambien características del elemento como su valencia.
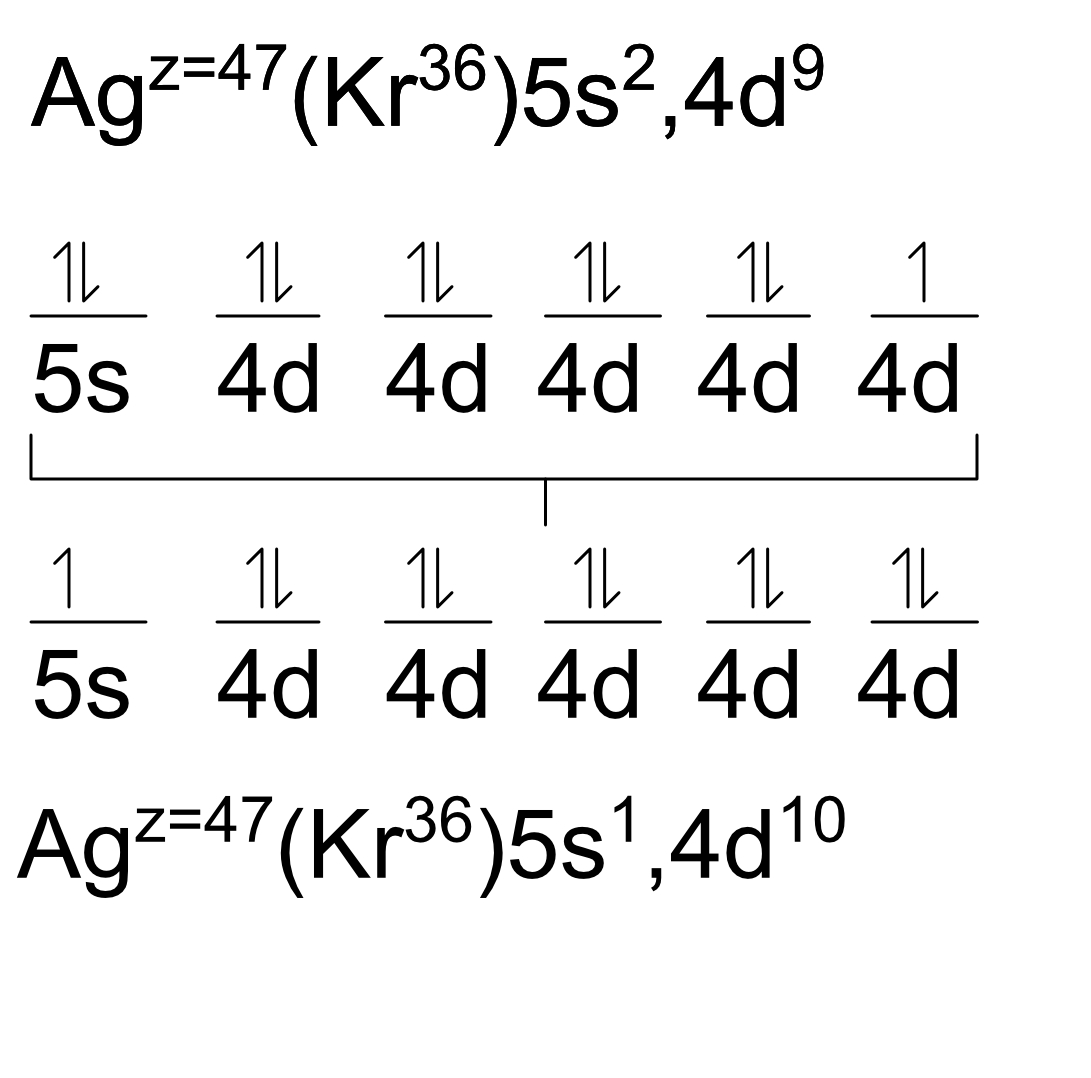
39
New cards
Ejercicio: Plata (Ag z=47)
(Sin corregir) Ag47 = (Kr36) 5s2, 4d9
(Corregido) Ag47 = (Kr36) 5s1, 4d10
Periodo: 5
Bloque: d
Columna: 11
Grupo: I B
Familia: Metales de transición
Valencia: 1
(Corregido) Ag47 = (Kr36) 5s1, 4d10
Periodo: 5
Bloque: d
Columna: 11
Grupo: I B
Familia: Metales de transición
Valencia: 1
40
New cards
Ejercicio: Galio (Ga z=31)
Ga31 (Ar18) 4s2, 3d10, 4p1
Periodo: 4
Bloque: p
Columna: 13
Grupo: III A
Familia: Metales térreos
Valencia: 3
Periodo: 4
Bloque: p
Columna: 13
Grupo: III A
Familia: Metales térreos
Valencia: 3
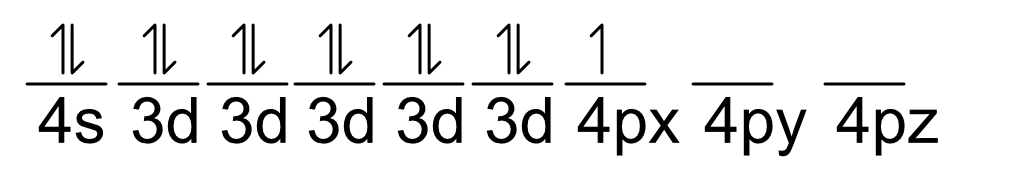
41
New cards
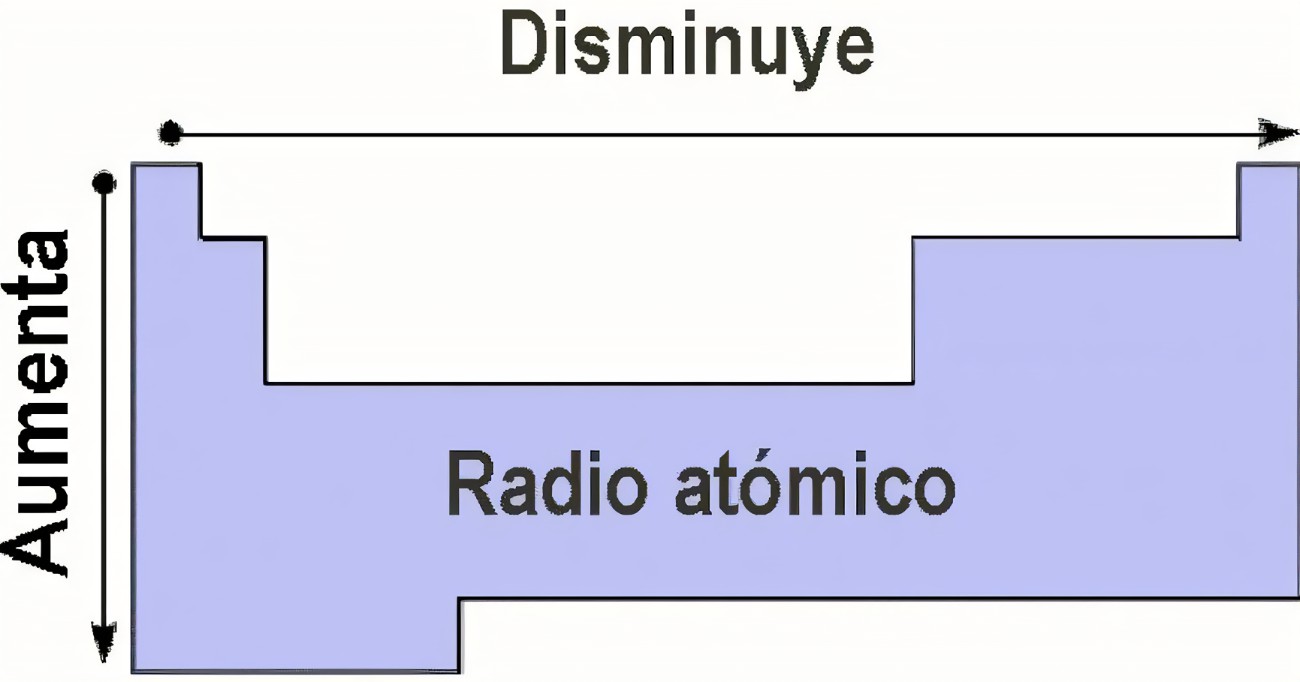
Radio atómico
El radio atómico en un periodo disminuye de izquierda a derecha. Aumenta de arriba a abajo.
42
New cards
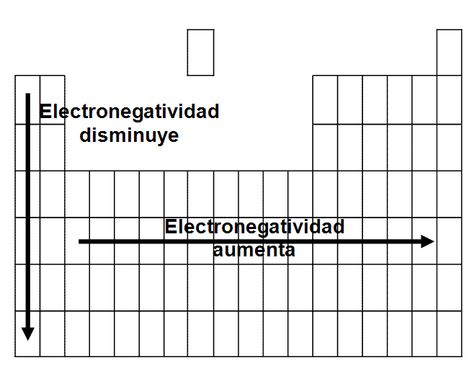
Electronegatividad
Capacidad para atraer electrones hacia su núcleo al estar unido a otro átomo. Aumenta de izquiera a derecha. Disminuye de arriba hacia abajo.
43
New cards
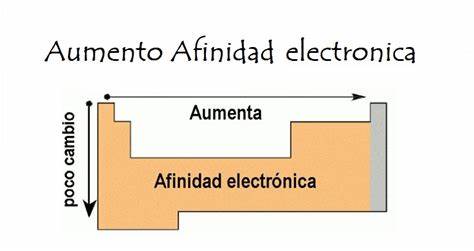
Afinidad electrónica
Cantidad de energía que libera o absorbe un átomo neutro. Se convierte en un ion negativo (anión)
44
New cards
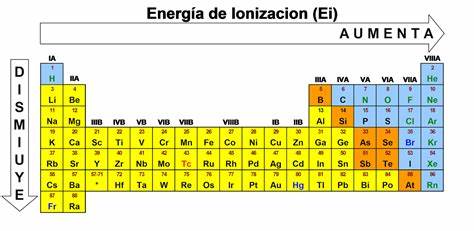
Energía de ionización
Energía necesaria para liberar un electrón de un átomo neutro.
45
New cards
Enlace químico
Son las fuerzas que unen a los átomos para formar moléculas
46
New cards
Capa de valencia
Último nivel de energía.
P. ej. Ga31 (Ar18) 4s2, 3d10, 4p1
En el Galio su último nivel de energía es el 4. Se suman los electrones de este nivel (2+1) y nos da por resultado 3. 3 Es el número de electrones en capa de valencia.
P. ej. Ga31 (Ar18) 4s2, 3d10, 4p1
En el Galio su último nivel de energía es el 4. Se suman los electrones de este nivel (2+1) y nos da por resultado 3. 3 Es el número de electrones en capa de valencia.
47
New cards
Estructura de Lewis
Representación mediante punto o cruces de los electrones de la capa de valencia. Se colocan los electrones en sentido horario y se va colocando primero uno en cada lado hasta que demos la vuelta e iniciemos a poner de nuevo.
48
New cards
Ejercicio: Estructura de Lewis de Ag
(Corregido) Ag47 = (Kr36) 5s1, 4d10
Un electrón en el primer espacio.
Un electrón en el primer espacio.

49
New cards
Ejercicio: Estructura de Lewis de Ga
Ga31 (Ar18) 4s2, 3d10, 4p1
Tres electrones distribuidos según las manecillas del reloj.
Tres electrones distribuidos según las manecillas del reloj.

50
New cards
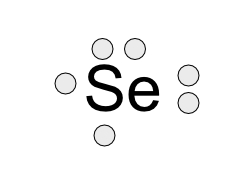
Ejercicio: Estructura de Lewis de Se
Se34 (Ar18) 4s2, 3d10,4p4
Los primeros cuatro electrones en su respectivo lugar y se vuelve a iniciar colocando los dos sobrantes en los espacios correspondientes.
Los primeros cuatro electrones en su respectivo lugar y se vuelve a iniciar colocando los dos sobrantes en los espacios correspondientes.
51
New cards
Ion
Partícula eléctricamente cargada.
52
New cards
Enlace iónico
Usual entre metales y no metales.
53
New cards
Catión
Partícula cargada positivamente. Presentado en metales.
54
New cards
Anión
Partícula cargada negativamente. Presentado en no metales.
55
New cards
Representación de enlace iónico mediante Lewis (1)
Primero hay que reconocer el compuesto. P. ej. Ca3B2 (subíndices). A la izquierda está calcio y a la derecha boro. Izquierda da y derecha recibe. Por tanto, calcio donará sus electrones al boro.
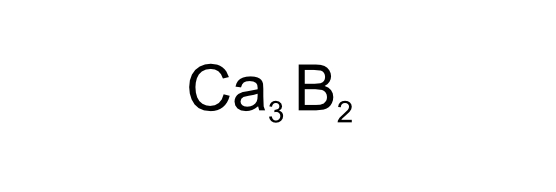
56
New cards
Representación de enlace iónico mediante Lewis (2)
Ahora hay que representar ambos elementos mediante lewis:
Ca20[Ar] 4s²
B5[He2] 2s² 2p¹
Por tanto:
Electrones de valencia de calcio: 2
Electrones de valencia de boro: 3
Ca20[Ar] 4s²
B5[He2] 2s² 2p¹
Por tanto:
Electrones de valencia de calcio: 2
Electrones de valencia de boro: 3
![Ahora hay que representar ambos elementos mediante lewis:
Ca20[Ar] 4s²
B5[He2] 2s² 2p¹
Por tanto:
Electrones de valencia de calcio: 2
Electrones de valencia de boro: 3](https://knowt-user-attachments.s3.amazonaws.com/8d3f2087dee9420391609c9b8498e153.jpeg)
57
New cards
Representación de enlace iónico mediante Lewis (3)
Nota: a diferencia de la mayoría de elementos, el boro buscará formar compuestos de 6 y no de 8 electrones.
Ahora, traspasemos los electrones de calcio a los de boro. Hay que notar que tenemos 3 calcios y 2 boros, por lo que tendremos un total de:
Electrones a usar de calcio (calcio*3)=6
Por tanto, habrá que distribuir los 6 electrones de calcio entre los dos átomos de boro.
Recordando que los electrones son una sub-partícula negativa, al perder electrones el calcio se convierte en un catión, y el boro al recibirlos en un anión. (sigue explicación en la siguiente)
Ahora, traspasemos los electrones de calcio a los de boro. Hay que notar que tenemos 3 calcios y 2 boros, por lo que tendremos un total de:
Electrones a usar de calcio (calcio*3)=6
Por tanto, habrá que distribuir los 6 electrones de calcio entre los dos átomos de boro.
Recordando que los electrones son una sub-partícula negativa, al perder electrones el calcio se convierte en un catión, y el boro al recibirlos en un anión. (sigue explicación en la siguiente)
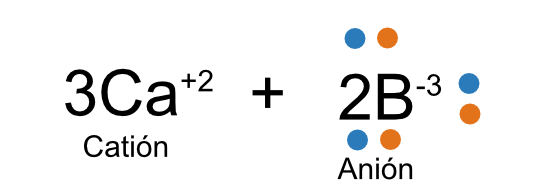
58
New cards
Representación de enlace iónico mediante Lewis (4)
La representación, aunque incluye varios átomos, se representará únicamente con un símbolo aunque los cambios se pueden ver en todos los átomos. Por ejemplo, al decir 3Ca+2, estamos entendiendo que cada uno de los tres átomos de calcio pierde dos electrones y se convierten en cationes. Y al decir 2B-3 nos referimos a que los dos átomos de Boro ganan tres electrones y se convierten en aniones.
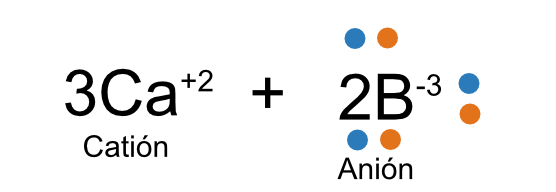
59
New cards
Ejercicios de enlace iónico
AlB
SrTe
CaI2
MgBr2
Ca3Br2
(Nota al pie de página: me dió flojera pegar la configuración electrónica búsquenla en google 😘)
SrTe
CaI2
MgBr2
Ca3Br2
(Nota al pie de página: me dió flojera pegar la configuración electrónica búsquenla en google 😘)