Cytoskeleton: F-actin and intermediate filaments - Uge 4
1/25
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
26 Terms
Hvad er cytoskelettets overordnede opbygning og funktion, herunder de tre filamenttyper og deres primære roller?
Cytoskelettet udgør ca. 20–35 % af cellens samlede proteinindhold og består af tre filamenttyper:
Intermediære filamenter: mekanisk styrke og stabilitet
Aktinfilamenter (F-actin): celleform, bevægelse og kontraktion
Mikrotubuli: intracellulær transport, mitose samt cilier/flageller
Hver filamenttype har associerede proteiner, der regulerer struktur og funktion.
Hvad er cytoskelettets hovedfunktioner i cellen?
Opretholdelse af celleform og cellepolaritet
Forankring af celle–celle-kontakter, celle–matrix-kontakter samt intracellulære organeller
Bevægelse, herunder cellemotilitet og intracellulær transport
Celledeling
Endocytose og exocytose
Muskelkontraktion
Hvad kendetegner intermediære filamenter, mikrotubuli og aktinfilamenter med hensyn til lokalisering og funktion?
Cytoskelettet består af tre filamenttyper med forskellig lokalisering og funktion:
Intermediære filamenter danner et stærkt netværk i cytoplasmaet, som via celleforbindelser forankrer cellen til naboceller og den omgivende matrix og giver modstandsdygtighed mod mekanisk stress.
Mikrotubuli udgår fra centrosomet nær kernen, danner radiale strukturer mod celleperiferien og er vigtige for intracellulær transport, organelplacering og celledeling.
Aktinfilamenter findes især i cellecortex tæt ved plasmamembranen, danner strukturer i mikrovilli og adherens junctions og er ansvarlige for celleform og bevægelse, sammentrækning.
Hvordan dannes intermediære filamenter?
Intermediære filamenter dannes ved, at α-helikale monomerer danner dimere, to dimere danner antiparallelle tetramerer, og tetramerer samles både side om side og ende mod ende til protofilamenter, som tilsammen danner et reb-lignende filament (~10 nm).
Hvilke fire undertyper af intermediære filamenter findes der, og hvad kendetegner dem?
Intermediære filamenter opdeles i fire undertyper baseret på placering og celletype. Keratinfilamenter findes i epitelceller. Vimentin filamenter findes i bindevævsceller, muskelceller og gliaceller. Neurofilamenter findes i nerveceller. Nuclear lamins findes i cellekernen i alle dyreceller.
Alle fire undertyper har en central α-helikal stavregion, men adskiller sig i deres N-terminale hoved og C-terminale hale.
Hvilken funktion har keratinfilamenter i epitelvæv?
Keratinfilamenter fordeler mekanisk stress mellem epitelceller via celle–celle- og celle-matrix forbindelser og sikrer dermed vævets mekaniske styrke og sammenhæng.
Hvordan indgår keratinfilamenter i desmosomer og hemidesmosomer?
Ved celle–celle bindinger (desmosomer) bindes keratin intracellulært til en proteinplade (plak), som er koblet til transmembrane cadheriner, der mekanisk forbinder naboceller.
Ved celle–matrix-bindinger (hemidesmosomer) bindes keratin intracellulært til en cytoplasmatisk plak, som er koblet til transmembrane integriner, der forankrer cellen til den extracellulære matrix. Disse kontakter sikrer mekanisk sammenhæng og stabilitet i epitelvæv.
Hvad er funktionen af vimentin- og neurofilamenter?
Mekanisk styrke, hvor de befinder sig
Hvad er nuclear laminer, og hvad er deres funktion?
Findes under den nukleære membran i alle dyreceller. De danner et støttende netværk på indersiden af kernemembranen.
Hvordan interagerer intermediære filamenter med andre cytoskeletelementer?
De forbindes til mikrotubuli og aktinfilamenter via accessoriske proteiner (plectin). Disse koblinger sikrer mekanisk sammenhæng og strukturel stabilitet i cellen.
Hvordan er det cytoplasmatiske og nukleære cytoskelet forbundet, og hvad er betydningen af denne kobling?
Det cytoplasmatiske og nukleære cytoskelet er mekanisk forbundet via accessoriske proteiner, som kobler den nukleære lamina til cytoskelettet i cytoplasmaet. Denne kobling muliggør overførsel af mekaniske signaler og stress til cellekernen og kan føre til ændringer i genekspression.
Hvad kendetegner aktin-cytoskelettet, og hvorfor er aktin et centralt cellulært protein?
Aktin-cytoskelettet består af tynde aktinfilamenter (~7 nm), der er koncentreret i cellecortex under plasmamembranen og er afgørende for celleform, organiseringen cytoskellet i cellecortex, bevægelse og intracellulær dynamik.
Hvordan indgår aktinfilamenter i cellekontakter?
Aktinfilamenter deltager i både celle–celle- og celle–matrix bindinger. Ved celle–celle-kontakter kobler adaptorproteiner cadheriner til aktinfilamenter og danner derved adherens junctions, som forbinder aktin filamenterne ved hinanden fra de to celler.
Ved celle–matrix-kontakter kobles integriner og aktinfilamenter via adaptorproteiner, hvorved der dannes fokale adhæsioner, som binder cellen til den ekstracellulære matrix.
Aktinbaserede kontakter er dynamiske og vigtige for celleform, kraftoverførsel og cellebevægelse.
Hvordan er aktinfilamenter opbygget og hvordan vokser de?
Aktinfilamenter består af to lange kæder af globulære aktinmonomerer (G-aktin), der er snoet om hinanden og danner F-aktin.
F-aktin er polariserede med en plus-ende og en minus-ende.
Filamentvækst sker primært ved plus-enden ved indbygning af ATP-bundet G-aktin, mens minus-enden er mindre stabil, fordi ATP efter indbygning hydrolyseres til ADP, som svækker affiniteten for F-aktinet.
Treadmilling er når hastigheden påsætning og fraspaltning af monomerer er den samme
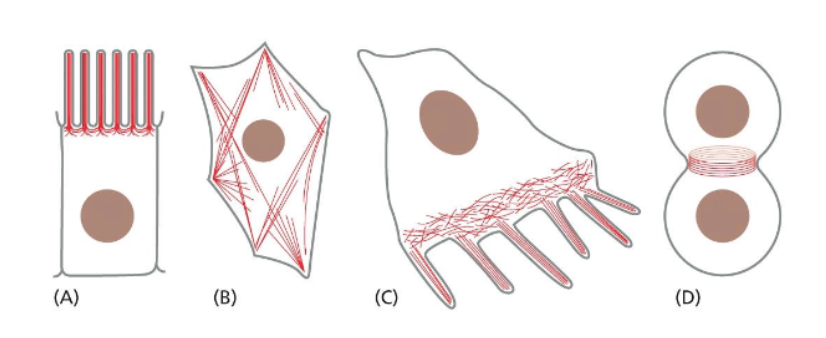
Hvilke aktinbaserede strukturer ses i celler, og hvad bruges de til?
Mikrovilli er tætte bundter af aktinfilamenter i epitelceller, som øger celleoverfladen og dermed absorption. Stressfibre er bundter af aktinfilamenter forbundet med myosin, som skaber kontraktil kraft, opretholder celleform og bidrager til celle–matrix-adhæsion. Lamellipodier og filopodier er aktinrige udløbere ved cellefronten, der er vigtige for cellebevægelse, udforskning af omgivelser og retningsbestemt migration. Den kontraktile ring består af aktin og myosin under celledeling og muliggør cytokinese ved at snøre cellen over i to datterceller.
Hvilken rolle spiller aktinbindende proteiner i reguleringen af aktin?
Aktinbindende proteiner regulerer aktin ved at styre mængden af frit G-aktin og filamentdynamik, herunder nukleation, vækst, afkapning og kløvning, hvilket muliggør hurtig omorganisering af aktin-cytoskelettet.
Hvad er cellemotilitet
Cellemotilitet er cellers evne til aktivt at bevæge sig ved hjælp af cytoskelettet, især aktinfilamenter. Bevægelsen sker ved, at cellen ændrer form og danner fremskud i membranen. Cellemotilitet bruges til migration i væv og er en grundlæggende cellulær mekanisme.
Hvilke tre hovedtrin indgår i cellemigration, og hvilken rolle spiller aktin?
Cellemigration foregår i tre overordnede trin, der er afhængige af aktin-cytoskelettet. Først sker aktinpolymerisering ved cellens forreste kant, som danner lamellipodier og filopodier og skubber membranen fremad. Dernæst dannes fokale kontakter mellem den extracellulære matrix og det nydannede aktin via integriner, som forankrer cellen til underlaget. Til sidst trækkes cellens bagerste del fremad ved aktin–myosin-medieret kontraktion, hvilket giver nettobevægelse fremad.
Hvad er lamellipodier og filopodier, og hvad er deres funktion?
Lamellipodier er brede, flade aktinbaserede udløbere ved cellens forreste kant, som driver fremadbevægelse under cellemigration. Filopodier er tynde, fingerlignende aktinbaserede udløbere, der bruges til at føle omgivelserne og styre bevægelsesretningen.
Hvilken rolle spiller Rho-familiens små GTPaser i reguleringen af aktin-cytoskelettet?
Små GTP-bindende proteiner i Rho-familien regulerer aktin-cytoskelettets organisation og bestemmer, hvilke aktinstrukturer der dannes. Rac aktiverer Arp2/3-komplekset og aktiverer dannelsen af lamellipodier. Cdc42 aktiverer formin-proteiner og starter dannelsen af Filopododier. Rho aktiverer myosinaktivitet og starter dannelsen af kontraktile aktinbundter
Dette gør det muligt for cellen at ændre form og bevægelsesmønster som respons på signaler.
Hvad er myosiner, og hvordan adskiller myosin I og myosin II sig?
Myosiner er aktin-bindende motorproteiner, der bevæger sig langs aktinfilamenter ved brug af ATP. Myosin I har ét hoveddomæne og kan transportere vesikler langs aktinfilamenter mod plus-enden samt bevæge aktinfilamenter langs plasmamembranen. Myosin II har to hoveddomæner og danner myosinfilamenter, som indgår i aktin–myosin-kontraktile strukturer, især i muskelceller. Ved bevægelse mod plus-enden trækker myosin II aktinfilamenter mod hinanden og skaber kontraktion.
Hvorfor er aktinfilamenter i sarkomerer stabile, og hvorfor sker der ikke aktin-treadmilling?
I sarkomerer (kontraktile enheder i muskelceller og består af ordnede aktin- og myosinfilamenter) er aktinfilamenterne fast forankret i Z-skiverne og capped i begge ender af stabiliserende proteiner. Derfor kan de hverken polymerisere eller depolymerisere frit. Muskelkontraktion sker derfor ved glidning mellem aktin og myosin – ikke ved opbygning og nedbrydning af aktinfilamenter
Hvordan er myofibriller og sarkomerer organiseret i muskelceller?
Hver myofibril består af mange sarkomerer arrangeret ende mod ende. En enkelt muskelcelle indeholder mange myofibriller, der løber parallelt gennem cellen og fylder størstedelen af cytoplasmaet.
Hvordan initieres muskelkontraktion ved Ca²⁺-frigivelse?
Muskelkontraktion initieres, når et aktionspotentiale i T-tubuli udløser frigivelse af Ca²⁺ fra det sarcoplasmatiske retikulum. Ca²⁺ strømmer ud i cytosolen og starter de molekylære processer, der muliggør glidning mellem aktin og myosin.
Hvad er de vigtigste kendetegn ved intermediære filamenter?
Intermediære filamenter dannes af α-helikale monomerer, som først danner dimere, derefter antiparallelle tetramerer, der samles i protofilamenter og til sidst i lange, reblignende filamenter med en diameter på ca. 10 nm. De er ikke polariserede og er de mest stabile komponenter i cytoskelettet, men kan nedbrydes midlertidigt, fx under celledeling. De forbindes både indbyrdes og med andre cytoskeletelementer via koblingsproteiner som plectin. Der findes fire hovedklasser: keratiner, vimentiner, neurofilamenter og nukleære laminer. Intermediære filamenter har primært strukturelle funktioner og bidrager til mekanisk styrke samt celle–celle- og celle–matrix-adhæsion.
Hvad er de vigtigste kendetegn og funktioner ved aktin og aktinfilamenter?
Aktinfilamenter består af to protofilamenter af globulært G-aktin, der er snoet i en coiled helix og danner F-aktin. De har en diameter på ca. 7 nm og er polariserede med en plus- og en minus-ende. Polymerisering sker ved tilføjelse af ATP-bundet G-aktin til plus-enden, mens depolymerisering forekommer efter ATP-hydrolyse, når aktin får lavere affinitet for filamentet. Aktinstrukturen i celler bestemmes af aktinbindende proteiner, som regulerer filamenternes længde, organisering og dynamik. Aktinfilamenter findes især i cellecortex, stressfibre, mikrovilli, filopodier og lamellipodier samt i celle–celle- og celle–matrix-kontakter. Aktins fysiologiske roller omfatter mekanisk stabilitet, regulering af celleform, intracellulær transport, cellemotilitet, celledeling og muskelkontraktion