Kemi - Kap 4
1/26
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
27 Terms
Vad är typiskt för en jonförening?
- Det finns negativa och psoitiva joner
- Hårda och spröda
- Hög smältpunkt och hög kokpunkt
- Leder ström när den blir upplöst i vatten
- Leder ström när den är i smält form och inte i fast
Jonföreningar leder elektrisk ström i smälta, men inte i fast form. Förklara detta.
I smältan av en jonförening är jonerna rörliga. Negativa joner vandrar mot pluspolen och positiva joner mot minuspolen. Smältan leder därför elektrisk ström. I kristaller av jonföreningar hålls jonerna kvar på sina platser i gittret. Då sker ingen laddningstransport.
Vilka krafter verkar mellan jonerna i en saltkristall?
Elektrostatisk attraktion, jonbindning.
En atomjon innehållar 18 elektroner, 19 protoner och 20 neutroner. Ange jonens kemiska tecken och redogör för elektronernas fördelnings på olika skal.
Det är en kaliumjon, K+, med 2 elektroner i K-skalet, 8 elektroner i L-skalet och 8 elektroner i M-skalet.
En atom av ett visst grundämne innehåller 12 protoner. Hur många elektroner finns det i de joner som grundämnet kan bilda.
Det är grundämnet magnesium. Magnesiumjoner, Mg2+, har 10 elektroner
Hur många elektroner finns totalt i var och en av följande joner?
a) Fe2+
b) Fe3+
c) K+
d) S2-
e) Al3+
a) Fe2+, 24e-
b) Fe3+, 23e-
c) K+, 18e-
d) S2-, 18e-
e) Al3+, 10e-
Skriv formeln för den förening som bildas av följande par joner
a) Na+ och S2-
b) Cu2+ och Cl-
c) Ga3+ och S2-
a) Na2S
b) CuCl2
c) Ga2S3
Skriv strukturformler för följande molekyler
a) N2
b) H2O
c) HCl
a) NH3
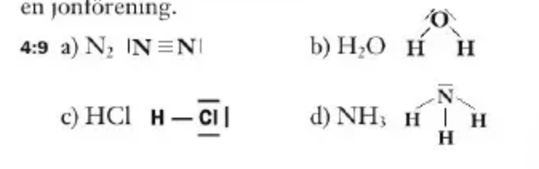
Vad kännetecknar en polär kovalent bindning
Elektronerna i det gemensamma elektronparet är förskjutna mot den mest elektronegativa atomen i bindningen.
Vilken typ av bindning är det i
a) magnesiumfluorid
b) en jodmolekyl
c) kalciumoxid
d) en ammoniakmolekyl
Differensen i elektronegativitet avgör bindningstypen.
a) MgF2 (2,8>2,1), jonbindning
b) I2(0.0) opolär kovalent bindning
c) CaO (2,5>2,1) Jonbindning
d) NH3 (0,9<1,7), polär kovalent bindning
Ordna följande föreningar efter deras grad av jonbinding och börja med den som har mest utpräglad jonbindning: HF, CaCl2,Al2S3, SCl2, Mg3N2, LiCl, N2O5, MgBr2 och KCl
Differensen i elktronegativitet mellan grundämnenas atomer avgör bindningstypen. KCl (2,2), LiCl (2,0), HF(1,9), Mg3N2, (1,8), MgBr2 (1,6), Al2S3 (1,0), N2O5 (0,5)
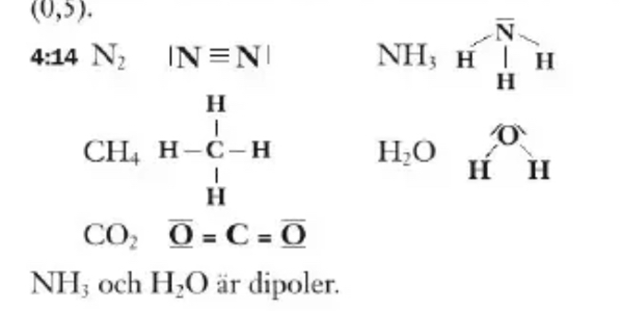
Rita fullständiga strukturformler för N2, NH3, CH4, H2O och CO2. Avgör om de är dipoler eller ej.
Hur bedömer man med hjälp av en molekyls strukturformel om den är en dipol?
En molekyl är en dipol om centrum för positiv laddning och centrum för negativ laddning befinner sig på olika platser.
Atomerna i en svaveldioxidmolekyl bildar en vinklad molekyl. Är molekylen en dipol? Motivera svaret
Ja differensen mellan grundämnenas elektronegaviteter är 1,0. Det innebär att bindningarna är polära kovalenta bindningar. Svavelatomen har två elektronpar gemensamt med var och en av syreatomerna och molekylen är vinklad. Centrum för negativ laddning ligger mellan syreatomerna. Centrum för positiv laddning ligger hos svavelatomen.
Föreningarna A, B, C och D har smältpunkterna +700 °C, -10 °C, +55°C och 650°C. Vilken eller vilka av dessa föreningar är sannolikt jonföreningar? Förklara ditt svar.
A och D, eftersom Jonföreningar brukar ha höga smältpunkter.
Förekommer vätebindningar mellan molekylerna i följande ämnen? Motivera dina svar.
a) PH3
b) NH3
c) H2S
d) H2
e) H2O
f) Ar
Differensen i elektronnegativitet är bara tillräckligt stor hos b) ammoniak, NH3 0,9 och e) vatten, H2O 1,4. Dessa molekyler har också en ojämn laddningsfördelning.
Hur uppstår van der waalsbindning?
Van der Waalsbindningar uppstår mellan tillfälliga dipoler, dvs. när elektroner under korta ögonblick ögonblick fördelar sig ojämt i elektronmoln hos närbelägna molekyler
Varför har kolväten med många kolatomer höga smältpunkter medan kolväten med få kolatomer har låga smältpunkter?
Mellan stora kolvätemolekyler är van der Waalsbindningar starkare. I stora molekyler finns i fler elektroner vilket ger en mer ojämn laddningsfördelning i elektronmolnet.
Vilka bindningar bryts, när följande ämnen smälter
a) Kaliumklorid
b) Jod
c) Is
d) Argon
e) Etanol
f) Diamant
a) Jonbindningar
b) Van der Waalsbindningar
c) Vätebindningar (starka dipol-dipolbindningar)
d) Van der Waalsbindningar
e) Vätebindningar
f) Opolära kovalenta bindningar
Sammanställ egenskaper som är karaktäristiska för
a) Jonföreningar
b) Molekylföreningar
a) Jonföreningar har höga smält- och kokpunkter. De har fast form vid rumstemperatur och leder då inte elektrisk ström. De leder ström i smälta och i vattenlösning
b) Molekylföreningar leder inte ström. Ämnen med små molekyler har låga smält- och kokpunkter
Vilka bindningar gör att isen på en sjö håller?
Vätebindningarna mellan vattenmolekylerna.
Vilka bindningar bryts när vatten sönderdelas i väte och syre
De kovalenta bindningarna mellan syreatomen och de båda väteatomerna i vattenmolekylen.
a) Vilka bindningar bryts när natriumklorid löses i vatten?
b) Vilka bindningar bildas?
c) Vad menas med en hydratiserad jon?
a) Jonbindningar mellan natrium- och kloridjoner samt vätebindningar mellan vattenmolekyler.
b) Jondipolbindningar mellan jonerna och vattenmolekyler.
c) En hydratiserad jon är en jon som är omgiven av ett hölje av vattenmolekyler. Mellan vattenmolekylerna och jonen finns det jon-dipolbindningar.
Varför är vatten ett bra lösningsmedel för salter?
Vatten är ett opolärt lösningsmedel. Joner attraheras (pga sina laddningar) av de polära vattenmolekylerna.
Förklara varför metaller har en viss formbarhet.
I en metallkristall kan enskilda metallatomer ändra läge utan att bindningar brister. När atomlagren förflyttas vid formning av ett metallföremål, följer elektronmolnet med. Metallbindningen påverkas inte nämnvärt.
Förklara varför salter är hårda och spröda.
I en jonförening hålls positiva och negativa joner ihop av starka jonbindningar. Därför är jonföreningar hårda. Vid ett slag med en hammare förskjuts lager av joner i förhållande till varandra. Följden blir att joner med samma laddning kommer nära varandra och stöter bort varandra. Kristallen splittras.
Förklara varför natrium, klor och natriumklorid har så olika smältpunkter.
Natriumklorid har den högsta smältpunkten, därefter, därefter natrium och sedan klor. I fast natrium är det metallbindning som håller ihop metallen. Denna bindning är svagare än jonbindningen i natriumklorid. I fast och flytande klor binds klormolekylerna till varandra med den svaga van der Waalsbindningar.