Transduction du signal 3
1/93
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
94 Terms
C est quoi RTK ?
Famille de recepteurs → recepteurs a activite tyrosine kinase
Ou sont situes les RTK ?
A la surface cellulaire
Quels choses de la cellule controlent les RTK ?
Recepteurs qui controlent la croissance, la differentiation, la survie et le metabolisme cellulaire
Quels sont les types de molecules de signalisation que RTK detecte ?
Des peptides ou proteines solubles ou lies a la membrane :
insuline et insulin-like growth factor 1 (IGF-1)
epidermal growth factor (EGF)
platelet-derived growth factor (PGDF)
Quelle est la structure generale des RTK ?
un ou plusieurs domaines extracellulaires de liaison au ligand
une helice transmembranaire
un a deux domaines cytoplasmiques a activite tyrosine kinase
des sites de liaison cytoplasmiques pour d autres proteines de signalisatio
Comment est initie la signalisation cellulaire dans le cas des RTK ?
Autophosphorylation du domaine tyrosine kinase intracellulaire du RTK
Quelle est la premiere etape de l activation des RTK ?
dimerisation des RTK monomeriques
Decris le processus de dimerisation des RTK
Deux facons de dimeriser le recepteur :
liaison du ligand → induit la dimerisation des RTK, ligand agissant comme pont entre les deux
ligand → induit changements conformationnels du domaine extracellulaire d un RTK → permet la dimerisation
exceptions rares → certains RTK forment des dimeres inactifs preexistants, qui suite a un changement de conformation, s activent


Une fois dimerises, que font les RTK ? (processus)
Avec leur faible activite kinase du domaine kinase cytosolique du RTK, les deux domaines kinases se phosphoryler l un l autre a un des Tyr dans leur levre d activation
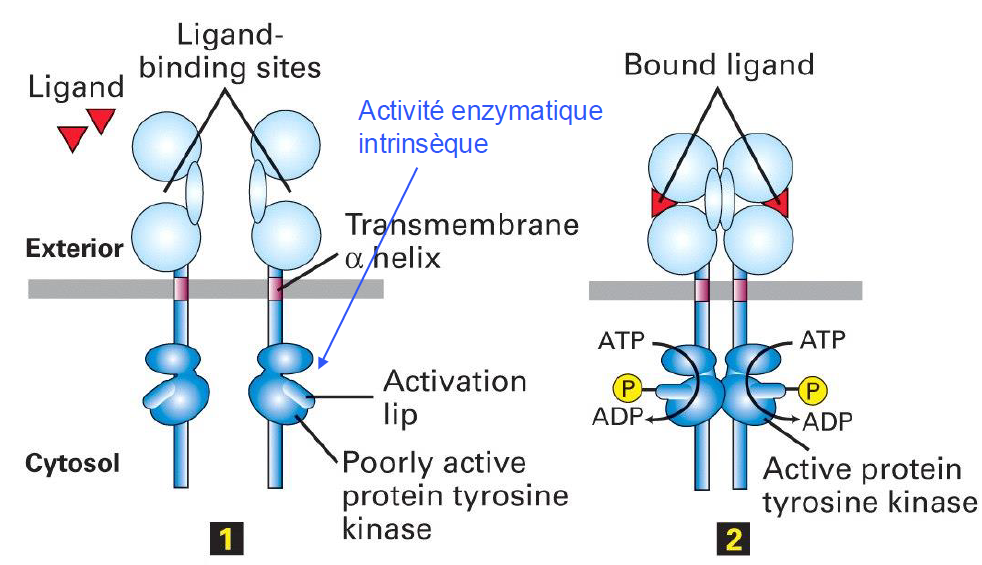

Que provoque la phosphorylation des levres des proteines kinases RTK ?
Cette phosphorylation ouvre la levre d activation. ce qui augmente l activite des domaines kinases en permettant une meilleure liaison a l ATP ou du substrat
Une fois les levres actives de la RTK, que fait la RTK ?
La kinase peut s auto phosphoryler d autres Tyr dans la partie cytosolique
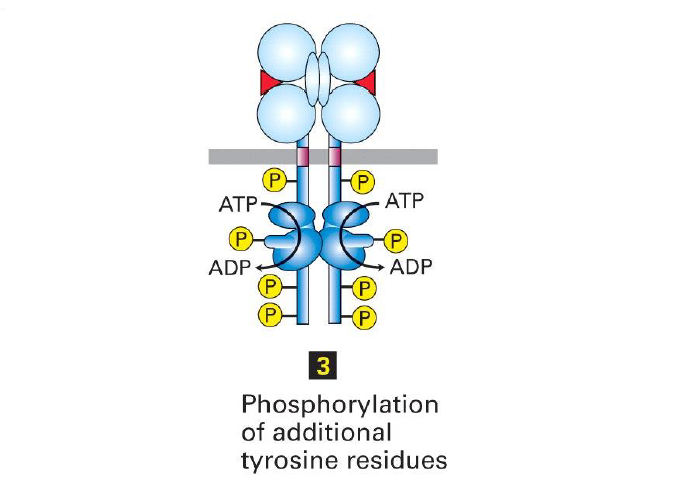

Que permet l autophosphorylation des tyrosines du recepteur RTK ?
La phosphorylation des residus sur d autres sites les convertit en sites de liaison pour d autres proteines de signalisation → formation d un complexe de signalisation
Quelles sont les types de proteines de signalisations recrutes via les domaines de liaison des RTK ?
Principalement des domaines SH2 et PTB qui se lient aux residus tyrosines phosphates
Lorsque SH2 et PTB se lient aux domaines de liaison du RTK, comment d autres proteines non directement lies a RTK font parti du complexe ? exemple
IRS-1 sont elles memes phosphorylees sur Tyr et reconnues par les proteines contenant les domaines SH2 ou PTB


Combien de domaines de liaison phosphotyrosines possede PDGF et que permet cela ?
5 sites d autophosphorylation → active 3 voies de signalisation
Quelles sont les voies de signalisation que PDGF peut activer ?
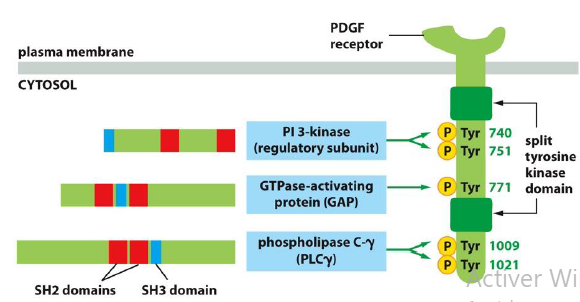

Quelles sont les cascades majeures de signalisation induites par RTK ?
Ras-MAPK kinase
Phospholipase C
Pl3 kinase
C est quoi Ras (structure) ?
Proteine G monomerique avec une activite GTPase, similaire a Galpha
Quelle type de modifications post-traductionnelles recoivent les proteines Ras et pourquoi ?
Ajout de groupes lipidiques :
farnelysation
palmitoylation
Cela permet de s accrocher a la MP → important pour leur activite
Quelles sont les membres de la famille Ras et leurs fonctions ? (parle pas de GEF ou quoi)


Comment est active Ras dans le cas des RTK ?
GRB2 contient un domaine SH2 se liant a RTK
GRB2 contient 2 domaines SH3 qui se lient a la sequence poly-proline de SOS (Ras-GEF)
SOS permet d echanger le GDP pour un GTP
Se dissocie de SOS et active la signalisation en aval

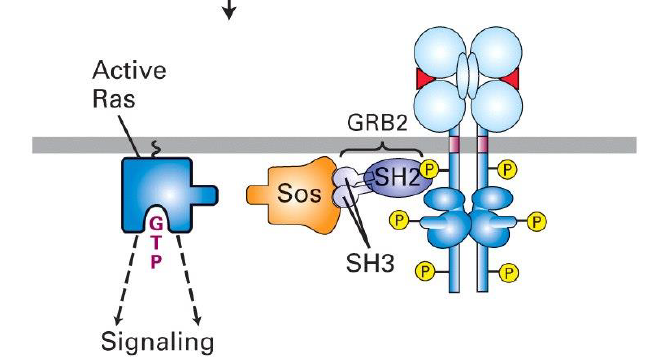
Quand Ras est actif, que fait il ? (processus) Ou se lie t il ?
Ras-GTP lie le domaine regulateur N-terminal de Raf et induit sa translocation a la membrane et son activation
Il s hydrolyse se qui induit leur dissociation


Qu est ce que Raf ?
Famille des Ser/Thr kinases cytosoliques
Que fait Raf une fois la dissocitation a Ras ?
Raf active phosphoryle et active une proteine kinase intermediaire MEK
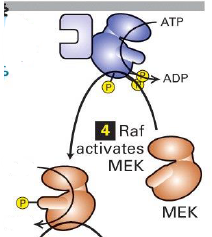

Qu est ce que MEK ?
Kinase avec double specificite Ser/Thr et Tyr
Une fois que MEK est active, que fait il ?
MEK active MAPK par phosphorylation de la levre aux residus Tyr et Thr
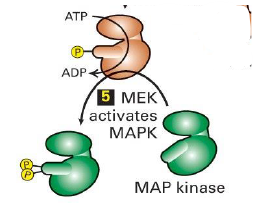

Que fais MAPK une fois phosphorylee par MEK ?
A) Se dimerise et est transloque au noyau ou elle active le facteur de transcription specifique TCF (T-cell factor) par phosphorylation directe
OU
B) phosphoryle et active la kinase p90RSK qui est transloquee au noyau ou elle phosphoryle et active un autre FT : SRF, qui controle la transcription en synergie avec TCF
Transcription du gene SRE → serum response element


Comment se fait l activation de la voie PLC-gamma ?
PlC-gamma se lie a RTK via son domaine SH2 et domaines p-Tyr de RTK
RTK phosphoryle Tyr de PLC-gamma → activation
PLC-gamma produit IP3 et DAG comme l autre
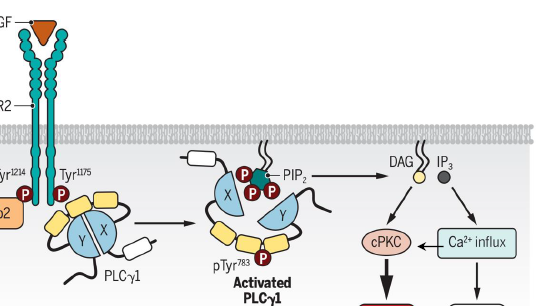

Quelles sont les voies de signalisation induites par PLC-gamma apres la formation de DAG et IP3 ?
MAPK, via PKC
NFAT, via le calcium


Qu est ce que NFAT ?
Facteur de transcription regule par la caclineurine et implique dans la reponse immunitaire
Que sont les Pl3K ? (importance)
famille d enzymes importante pour la proliferation et la survie cellulaire
Quelles sont les classes de la famille Pl3K et pourquoi la famille est divisee ?
Classe I, II, III, IV. La classification repose sur la structure primaire, la regulation et la specificite du substrat lipidique
C est quoi les Pl3K de classe I ? (structure)
Heterodimeres composes d une sous unite regulatrice p85 contenant des domaines SH2 et d une sous unite catalytique p110
Quelle est le processus de la fonction des Pl3K ?
RTK active Pl3K par phosphorylation. Pl3K actif permet de catalyser la phosphorylation des phosphoinositols en position 3 du cycle
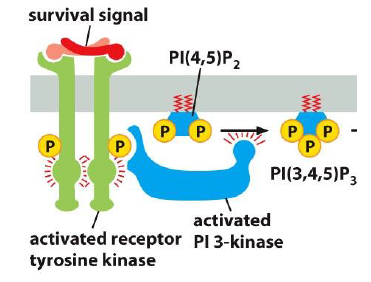

A quoi servent les PlP3 ? (phosphoinositides)
Ancrent des proteines de signalisation a la membrane plasmique
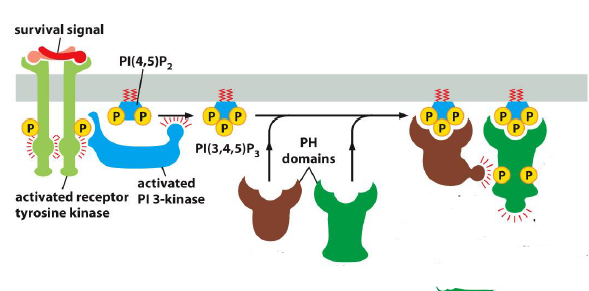

En particulier, quels types de proteines est ce que les PlP3 fixent a la MP ?
Proteine kinase B (PKB = Akt) et PDK1 (phosphoinositide dependant kinase-1)
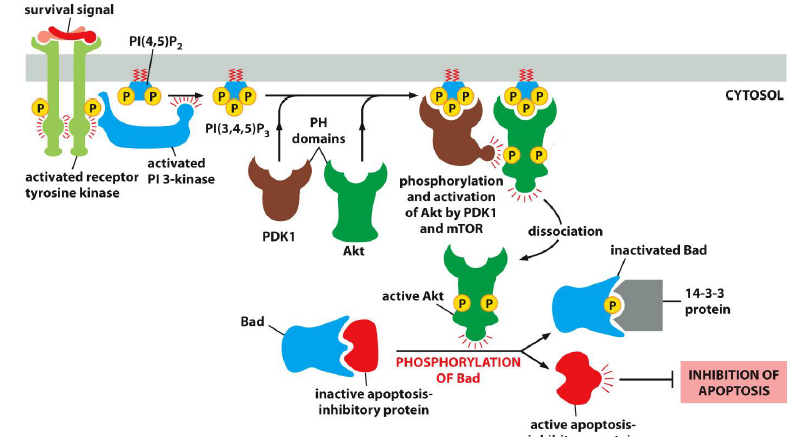
Quelles sont les voies de signalisation via PDK1 et Akt ?
Cette voie de signalisation peut :
inhiber la mort cellulaire
activer m-TORC1
Quel est le processus de l inhibation de la mort cellulaire ?

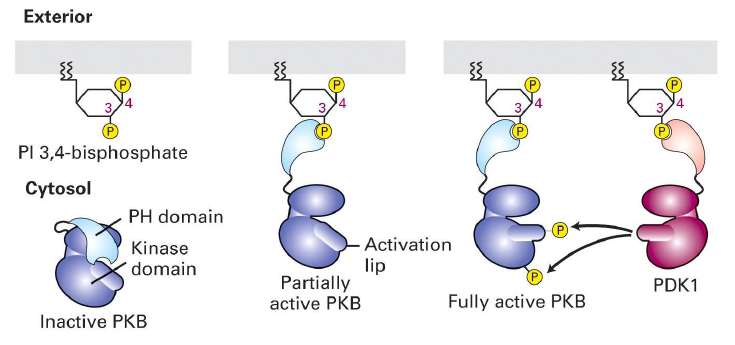
Quelle est la structure de PKB et quel type de kinase ?
Kinase serine threonine
possede un domaine PH
Comment se lie PKB au Pl ?
Grace au groupe PH
Comment s active PKB ?
Recrutee a la MP ou elle devient partiellement activee ou elle se lie au Pl
PDK1 est aussi recrutee a la MP ou elle se lie au Pl
PDK1 phosphoryle PKB au niveau de la levre → activation complete
2 phosphorylations

Que fais PKB une fois activee ?
Se dissocie de la membrane et phosphoryle des proteines cles impliquees dans l apoptose, inhibant leur fonction et favorisant la survie cellulaire
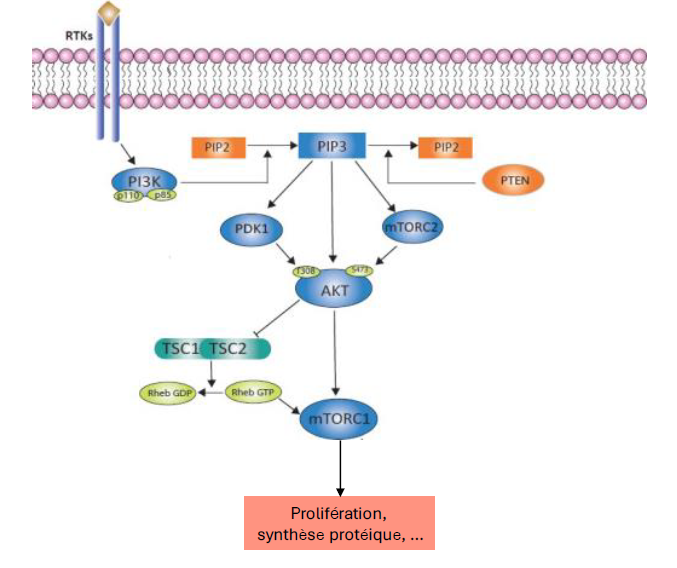
Quel est le processus impliquant les RTK dans l activation de mTORC1 ?
activation de Pl3K par RTK → catalyse formation de PlP3 a partir de PlP2
Recrutement et activation d’Akt (PKB) a la membrane
Akt phosphoryle et inhibe TSC2 (inhibiteur de Rheb)
Rheb-GTP active mTORC1, stimulant la synthese proteique et la croissance cellulaire

C est quoi les cytokines ?
Proteines solubles environ 160 aa, impliquees dans :
la regulation de la physiologie cellulaire
croissance
differenciation
systeme immunitaire
Combien de familles de recepteurs aux cytokines ?
5
Exemples de cytokines et leur fonction
Prolactine : différenciation de la glande mammaire
Érythropoïétine (EPO) : production d’érythrocytes
G-CSF : production de granulocytes
IL-2 : activation des cellules T
IL-4 : activation des cellules B
Interférons : réponse antivirale
TNF-α : inflammation
C est quoi les recepteurs de cytokines de type I ?
Proteines transmembranaires sans activite enzymatique
A quoi sont associes les recepteurs de cytokines type I ?
Associes a des tyrosines kinases cytosoliques de la famille JAK
Que provoque la liaison du ligand au recepteur de cytokine type I ?
Entraine une dimerisation et une signalisation en aval.
Phosphorylation des proteines JAK a la levre puis autophosphorylation des residus tyrosines
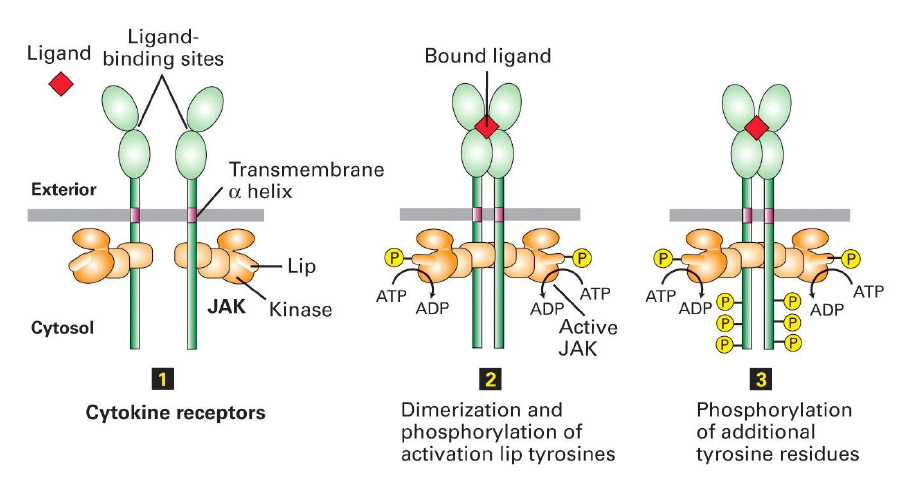

Que peut on dire de la signalisation produit par les RTK et les cytokines type I ?
La signalisation en aval presente de nombreuses similitudes
Que sont les interleukines ?
C est un groupe de cytokines exprimees et secretees par les leucocytes ainsi que par d autres cellules de l organisme → epithelium
Combien de cytokines differentes ?
Plus de 50
Quelle est la structure de la majorite des cytokines ?
Structure basee sur 4 helices pliees ensemble
Quelle est la structure similaire entre tous les recepteurs de cytokine type I ?
Ont un domaine extracellulaire compose de deux sous domaines, chacun compose de 7 brins beta
Qu induit la liaison de la cytokine au recepteur ?
Dimerisation des recepteurs monomeres
Comment s appellent les recepteurs de l erythropoietin ?
EpoR
Quelles voies peuvent etre declenchees suit a l activation des recepteurs de cytokine de type 1 ?
3 voies en commun avec les recepteurs RTK et une a elle :
GRB2 ou SHC
PLC-gamma
Pl3 kinase
STAT5
Apres les auto-phosphorylations des proteines JAK, que se passe t il ?
Facteurs de transcription Stat, pourvus d un domaine SH2, se lient au sites phosphoryles sur le site de cytokine
JAK phosphoryle la tyrosine de Stat
Stat se dimerise grace a un mecanisme de liaison SH2-phopsho-tyr
Dimerisation de Stat expose un signal de localisation nucleaire des dimeres de Stat qui sont alors transloques au noyau ou ils activent la transcription
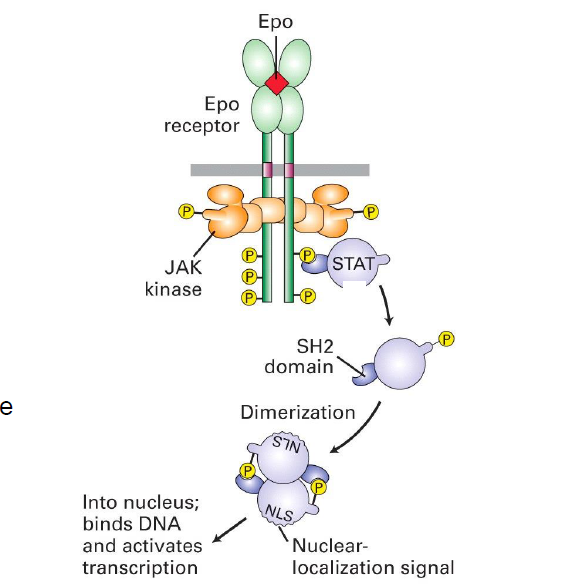

Exemple de recepteur de cytokine de type I ?
Epo recepteur (Erythropoietin)
Exemple de recepteurs de cytokines de type II ? (tous literalement)
Les recepteurs des interferons (IFN)
IFN type I
IFN-α
IFN-β
IFN-ω
IFN type II
IFN-γ
Ou se lient les IFN de type I et l’IFN-γ ?
IFN type I : Ils se lient tous a un recepteur commun a la surface des cellules → IFNAR1 et IFNAR2
l’IFN-γ : se fixe a un recepteur distinct pour initier la signalisation → IFNGR1 et IFNGR2
Qu’induit la liaison des IFN au recepteur ?
Dimerisation des deux sous unites du recepteur
Quelles sont les kinases associees aux recepteurs IFNAR ?
TYK2 et JAK1
Quelles sont les kinases associees aux recepteurs IFNGR ?
JAK
Qu induit la dimerisation des recepteurs des IFN ?
Induit l’activation des kinases associees et la phosphorylation de residus tyrosine sur la face cytosolique des recepteurs
Quelles sont les proteines de signalisations recrutees apres la phosphorylation des recepteurs des IFN ?
Creer des motifs p-Tyr capables de recruter les proteines :
IFN type I → STAT1 ou STAT2
IFN type II → STAT1
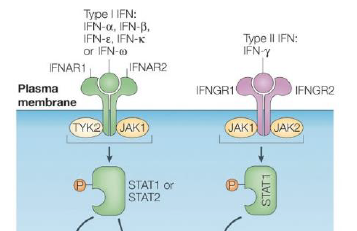

Quelle est la fonction des STAT une fois recrutes par les recepteurs d IFN ?
Ils se font phosphoryles puis se detachent avant de se dimeriser. Ils peuvent ensuite controler l expression des ISG → indispensables a la defense antivirale et antibacterienne
C est quoi les TNF ?
Tumor Necrosis Factor qui appartient a une superfamille comprenant 19 ligands qui interagissent avec 29 recepteurs partageant une structure similaire
Quelle est la structure des recepteurs TNF ?
Recepteur transmembranaires avec un domaine extracellulaire riche en cysteines pour la liaison du ligand. Domaine s appelle CRD.
Pas d activite enzymatique
Qui recrute les recepteurs TNF afin d avoie l activite enzymatique ?
Recrutent des adaptateurs intracellulaires : TRADD, TRAF, FADD
Quelles sont les voies activees par les recepteurs TNF ?
NF-kB
MAPK
induction de l apoptose via les caspases
Quelle est la structure des ligands qui se lient aux recepteur TNF ainsi que le nom des ligands ?
peut etre extracellulaire ou transmembranaire, souvent trimerique
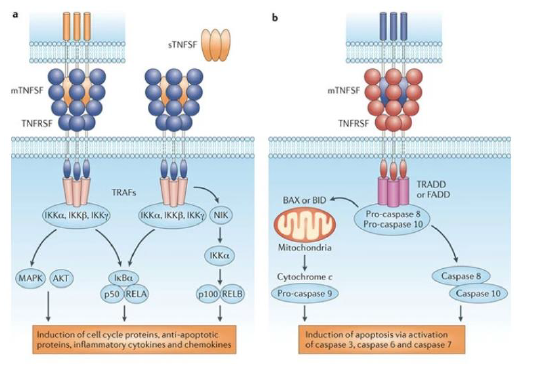

Tall est un ligand extracelluliare ou transmembranaire ? Et quelle voie de signalisation induit il ?
Transmembranaire (sur une autre cellule ducoup) et induit la voie de l apoptose
Quelles sont les fonctions physiologiques de la TNF receptor family ?
Regulent le developpement et l activite des systemes immunitaires, nerveux, osseux et ectodermique chez les mammiferes
C est quoi la famille TGF-beta ?
Grande famille de proteines dimeriques solubles
Quels sont les roles de la famille TGF-beta ?
Jouent un role dans
proliferation-differenciation
developpement
migration
matrice extracellulaire
regulation du systeme immunitaire
controle du developpement de la tumeur
Exemples de TGFbeta et comment ils ont ete identifies ?
Transforming Growth Factors (facteurs de croissance TGFbeta 1, 2, 3) → originellement identifies lors d etudes de croissance de tumeur
Bone Morphogenetic Proteins (BMP-2, 4, 6) → originellement identifiees comme facteurs inducteurs d os
Activins et Inhibins → identifies comme membres de l axe pituitaire
Quelle est la structure de TGFbeta ?
deux monomeres lies par un pont disulfure
chaque sous unite comporte 3 ponts disulfures intra-chaine
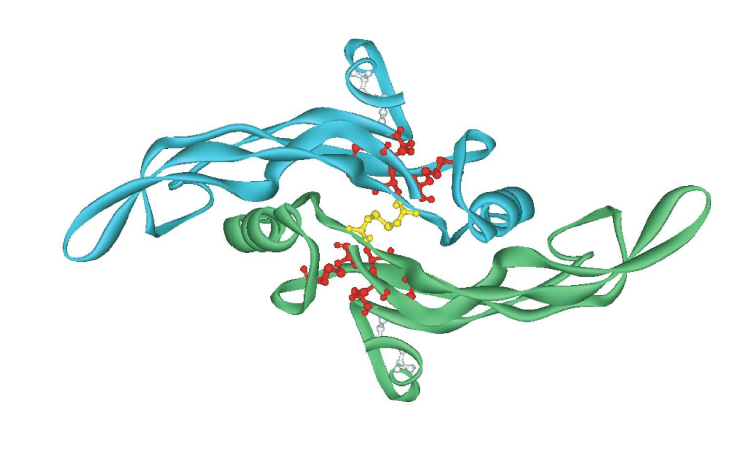

Comment peut etre inactive TGFbeta ?
Inactive par des agents reducteurs qui cassent les ponts disulfures
Quels sont les types de recepteurs TGFbeta ?
Recepteurs de type I
Recepteurs de type II
Recepteurs de type III
Quelles sont les caracteristiques et role des recepteurs de type III ?
proteoglycane >300 000 Da
pas d activite catalytique
Role → concentrer le TGF-beta a la surface cellulaire
Quelles sont les caracteristiques et role des recepterus de type I ? (activite catalytique precise, type d enzyme)
proteines transmembranaires dimeriques
possedent une activite serine/threonine kinase intrinseque non constitutivement active → essentielles pour la signalisation intracellulaire
Quelles sont les caracteristiques et role des recepterus de type II ?
proteines transmembranaires dimeriques
possedent une activite serine/threonine kinase intrinseque constitutivement active → essentielles pour la signalisation intracellulaire
Quel est le processus d activation des recepteurs des TGF-beta ?
TGF-beta se concentre sur RIII
TGF-beta se passe ensuite sur RII qui se dimerise → forme complexe ligand-recepteurs
RI (dimerise) s associe au complexe TGF-beta-RII
RII phosphoryle et active RI
(l’ajout de RIII au complexe est facultatif)
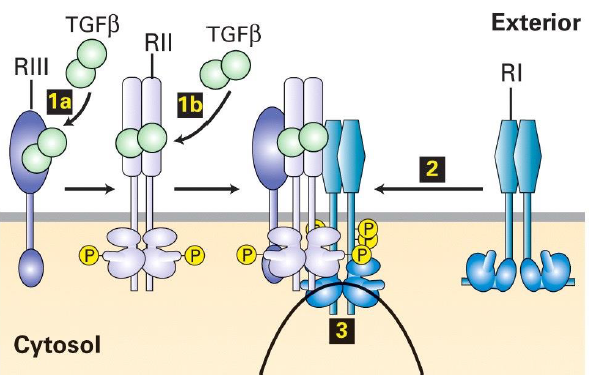

Apres activation des recepteurs RI, II et III, que se passe t il ?
RI phosphoryle des substrats en aval, notamment les proteines SMAD qui transmettent le signal vers le noyau pour reguler la transcription
Quels sont les etapes de la signalisation TGFbeta ?
phosphorylation des residus serine a l extremite C-term (sur le domaine MH2) de SMAD3 par RI
formation d un complexe avec Smad3 phosphoryle dimerise avec Smad4 → formation d un complexe actif
translocation nucleaire → le complexe expose un signal de localisation nucleaire (NLS) et migre vers le noyau
le complexe se fixe sur les elements de liaison Smad (SBE) dans les promoteurs des genes cibles
Regulation de l expression des genes impliques dans la proliferation, la differenciation, la production de matrice extracellulaire et parfois l apoptose


Quelles parties du complexe forme de Smad3 et 4 ont :
le signal NLS
la region de liaison a l’ADN
region responsable des interactions entre proteines
region responsable de la formation des complexes ?
MH1 → N terminal de Smad3 :
le signal NLS
la region de liaison a l’ADN
MH2 → extremite C-terminal de Smad3 :
region responsable des interactions entre proteines
region responsable de la formation des complexes
Comment peut etre controle TGFbeta ?
transcriptionnellement → lors de la production de TGFbeta. (
post transcriptionnellement → lors de sa secretion et sa maturation
Quel est le processus de la maturation de TGFbeta ?
Processus proteolytique : (voir les tailles etc sur dessin et liaisons disulfures)
TGFbeta est produit sous forme d un precurseur de large poids moleculaire
TGFbeta precurseur est forme d un pro-domaine et d un domaine mature
clivage entre pro-domaine et domaine mature → formation d un TGF-beta latent, complexe constitue du TGF-beta mature dimerique et de son prodomaine precurseur et d une troisieme proteine de liaison : LTBP
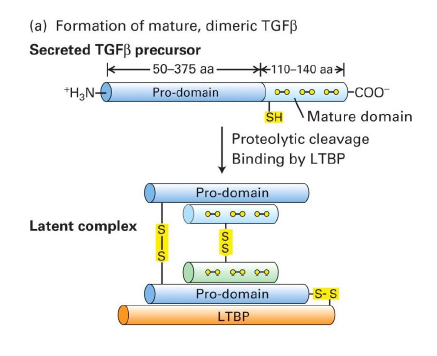

Apres combien de temps a lieu la maturation du TGF-beta ?
Tres rapidement apres sa secretion
Comment est formee la forme mature de TGFbeta ?
Suite a son activation apres liberation du dimere TGF beta
Qui peut provoquer la liberation du dimere TGF-beta ?
clivage proteolytique de la proteine LTBP dans la MEC
ET/OU
changement conformationnel, a cause de par exemple un changement du pH
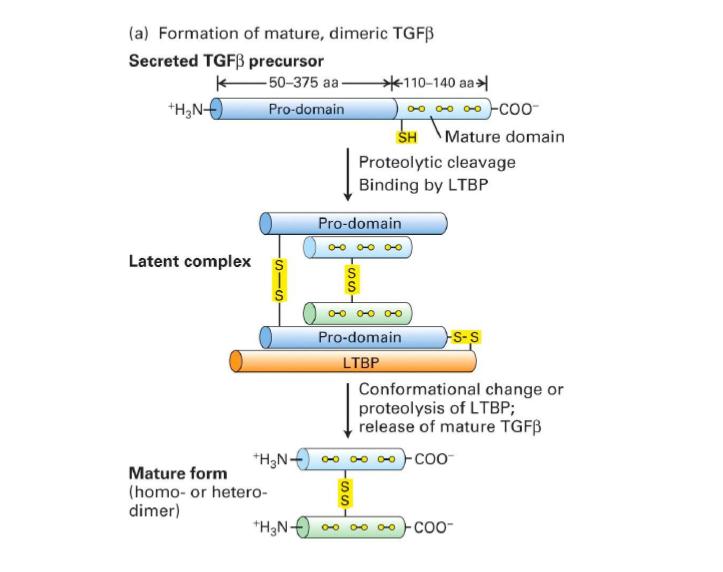

Comment a lieue la desactivation de TGF-beta ?
Liaison du dimere TGFbeta libre a des proteines extracellulaires
Comment se forment les ponts disulfides du complexe latent ?
Le milieu oxydant le permet