Kaarten: Biochemie: H6 enzymen | Quizlet
1/51
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
52 Terms
Hoe noemt de toestand waarbij een reactie niet in evenwicht is maar niet genoeg energie heeft om op te gaan?
Metastabiele toestand bv:
-een suikerklontje op tafel
-een liter benzine in een bidon
Op welke manieren kan een reactie worden versneld?
-verhoging concentratie reagentia (meer kans om te botsen)
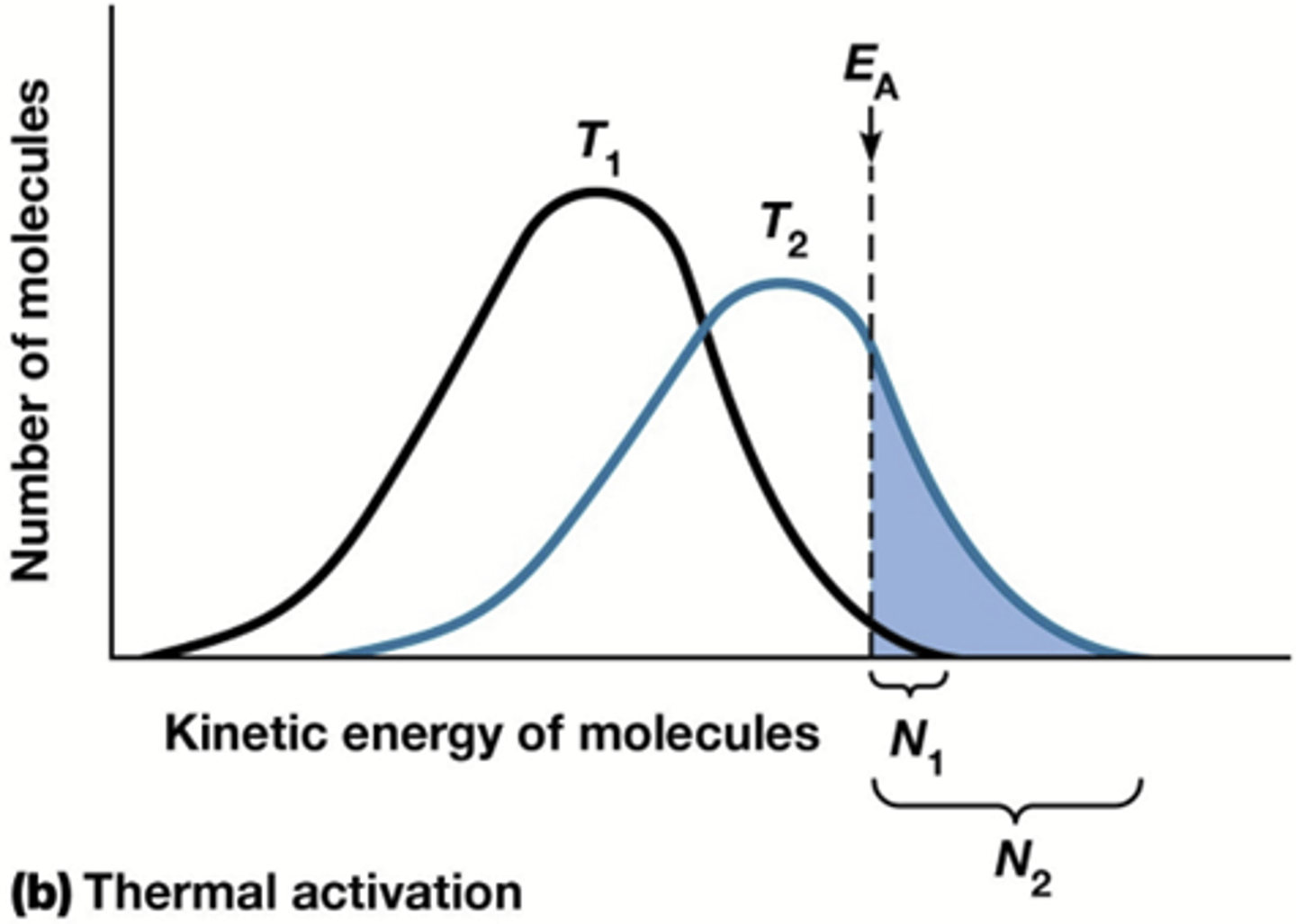
-verhoging temperatuur: verhogen gemiddelde kinetische energie ->onmogelijk voor mensen want onze temp is constant (zie foto)
-verlagen van Ea (toevoeging katalysator)
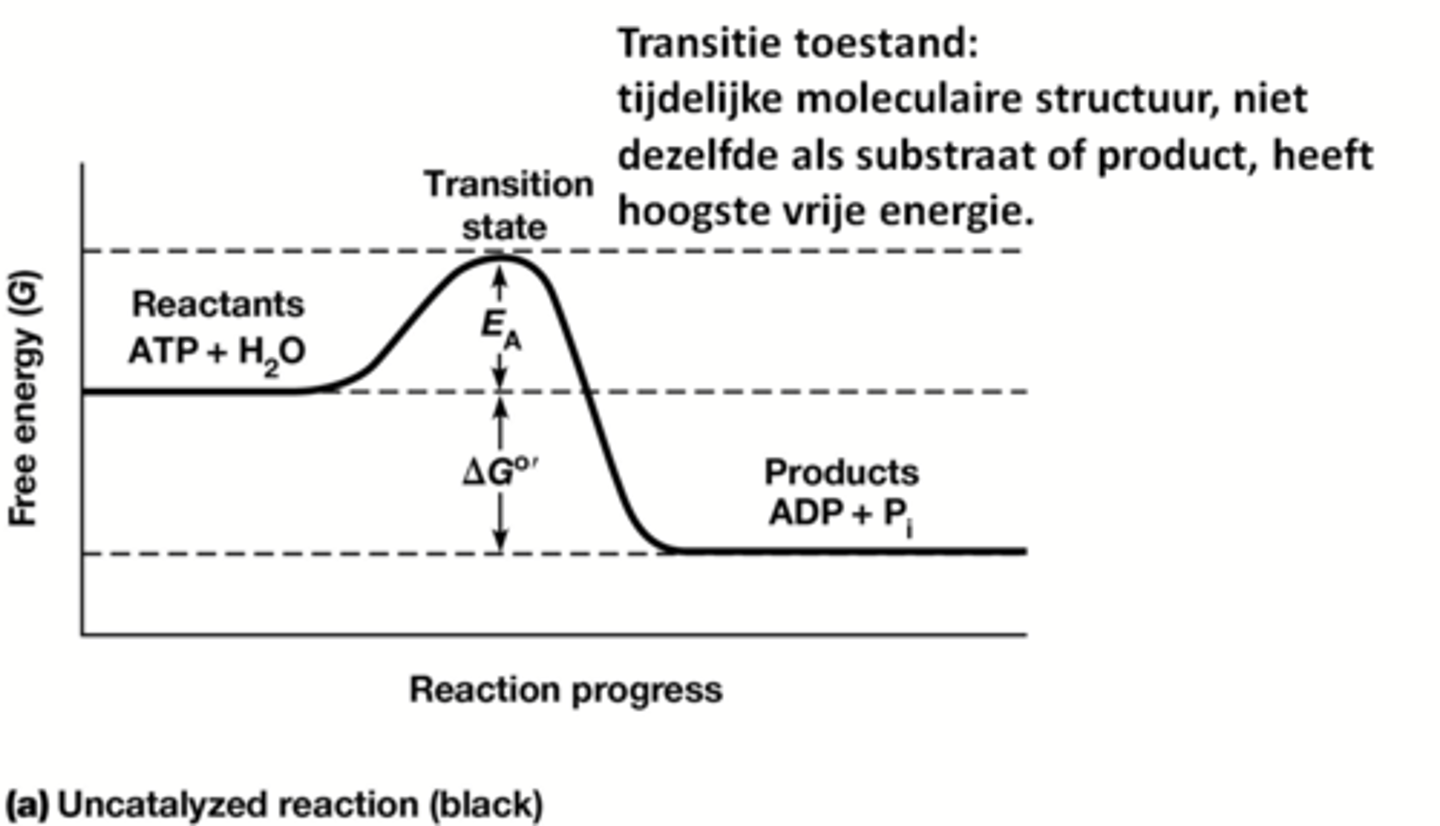
Wat is de transitietoestand?
een tijdelijke moleculaire structuur, niet dezelfde als substraat of product, heeft hoogste vrije energie.
foto legt het beter uit eigenlijk
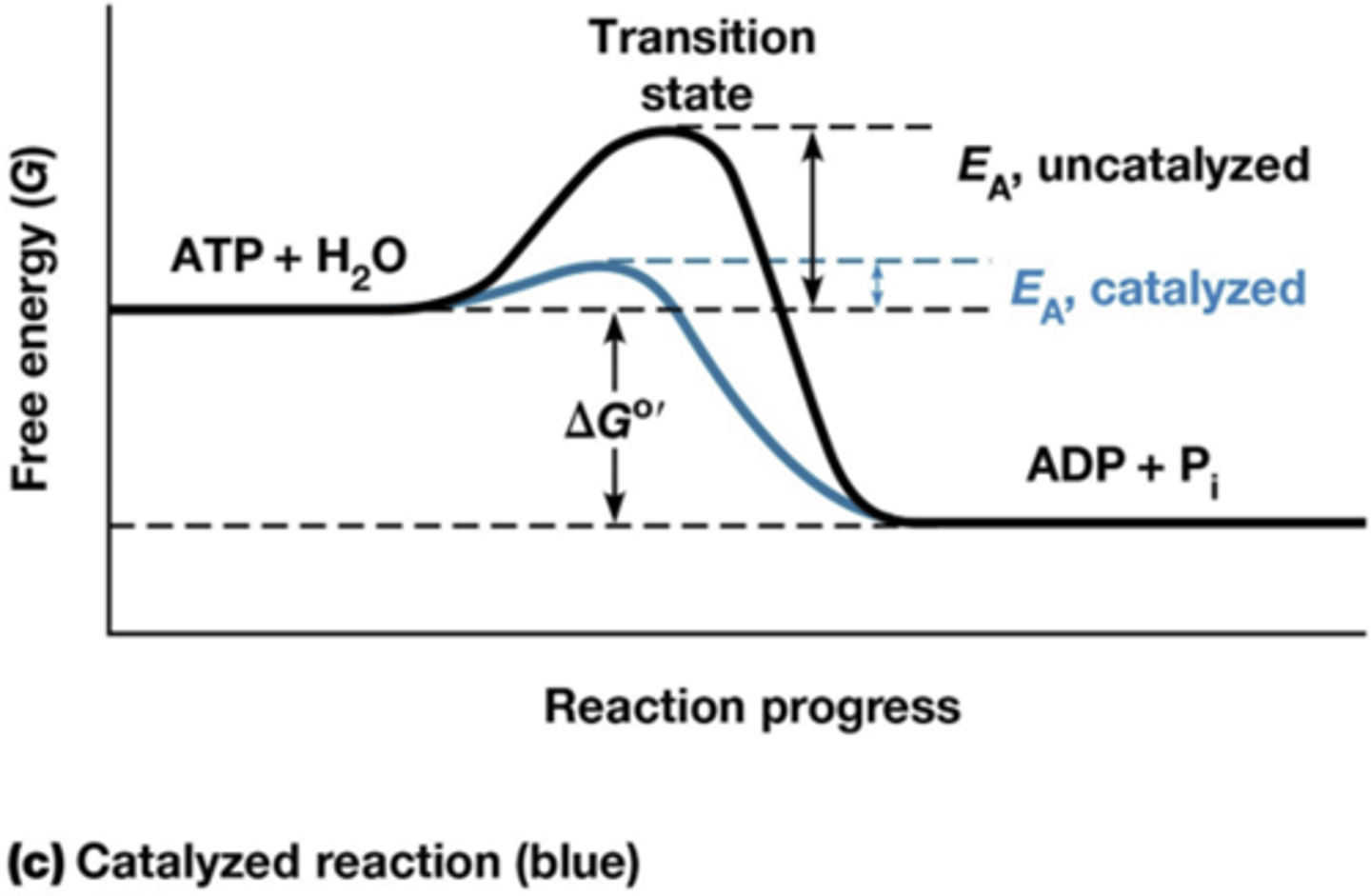
op welke manieren gaan enzymen de activeringsenergie te verlagen
-bindt substraten zodat reactie niet afhangt van toevallige botsing
-bindt substraten in bijna-transitietoestand
-omgeeft substraten door strategisch gepositioneerde groepen die het optreden van reactie bevorderen
eigenschappen enzymen hun impact op de reactie
-geen effect op de ligging van het evenwicht (of evenwichtsconstante)
-kan een reactie in beide richtingen versnellen (verschillende naam per richting)
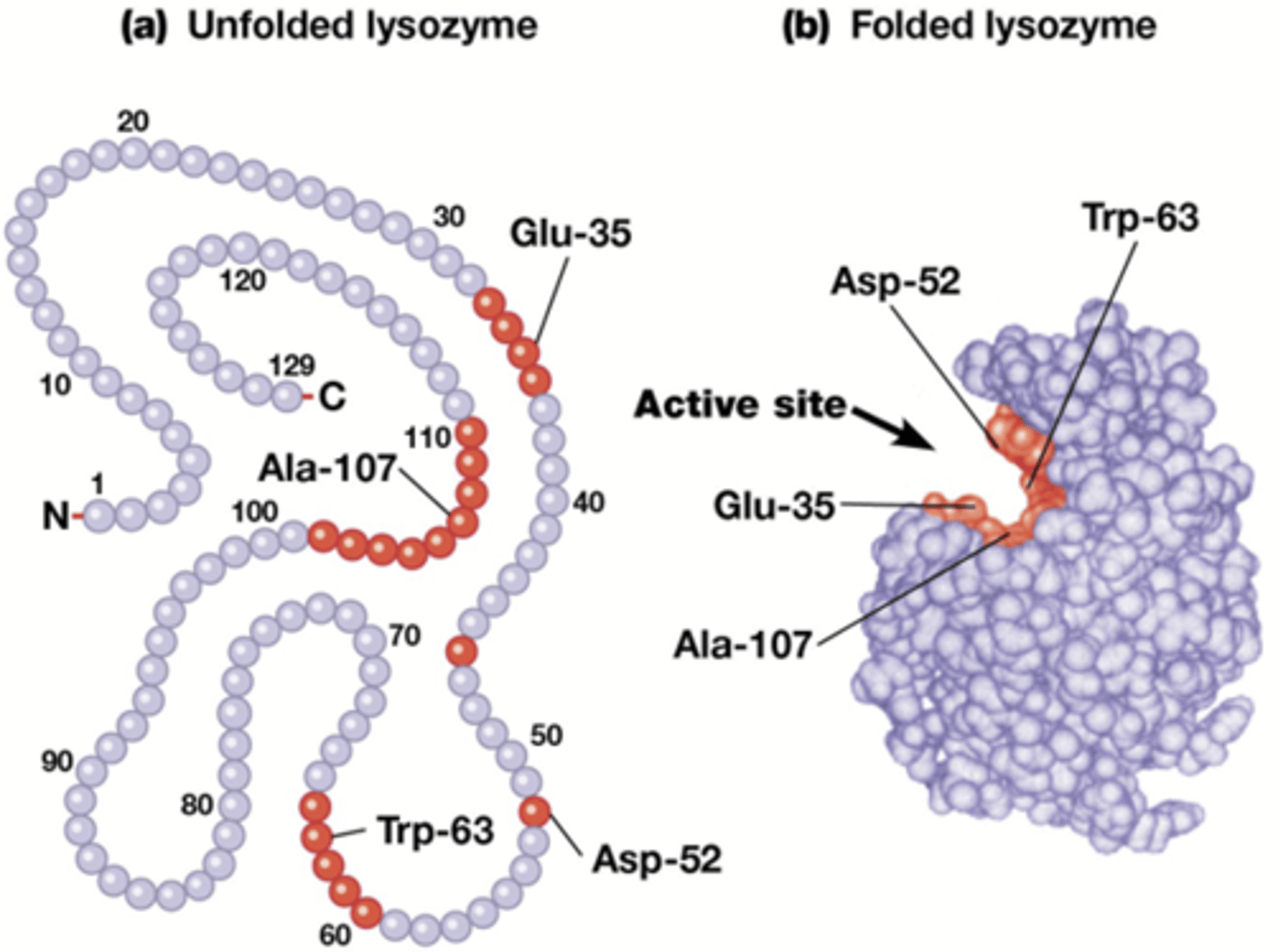
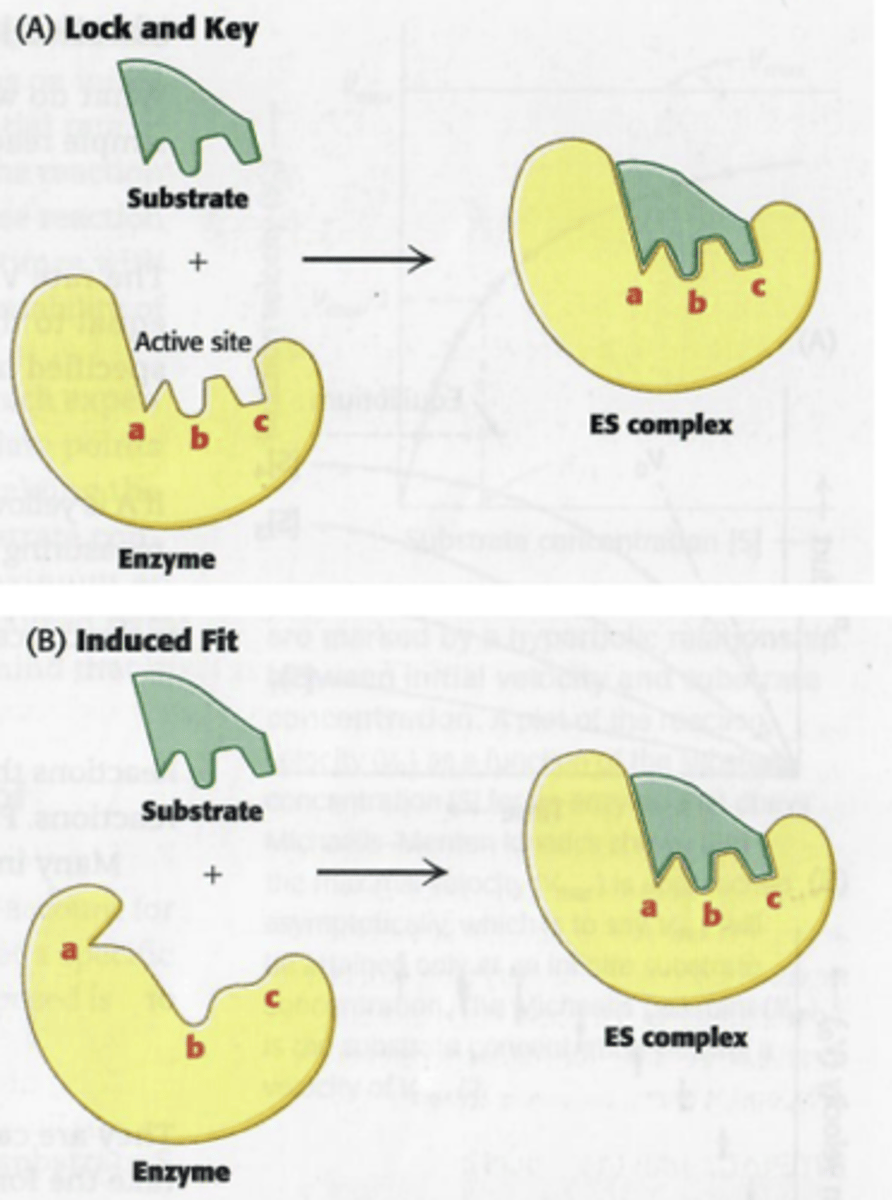
Wat zijn de kenmerken van een actieve site
-3 dimensionele holte gevormd door R-groepen afkomstig van verschillende delen van de aminozuursequentie
-gebaseerd op niet-covalente bindingen
-de geometrie van de H-bruggen is zeer belangrijk voor de specificiteit
-het substraat moet passen, vroeger dacht men dat het een sleutel-slot principe was, na onderzoek is het eerder induced fit (zie volgende slide)
Leg induced-fit uit + geef de Nederlandse naam
dynamische herkenning
conformatieverandering van actieve site na de binding met het substraat. Het enzyme blijft veranderen van vorm waardoor het substraat uiteindelijk in de transitietoestand komt.
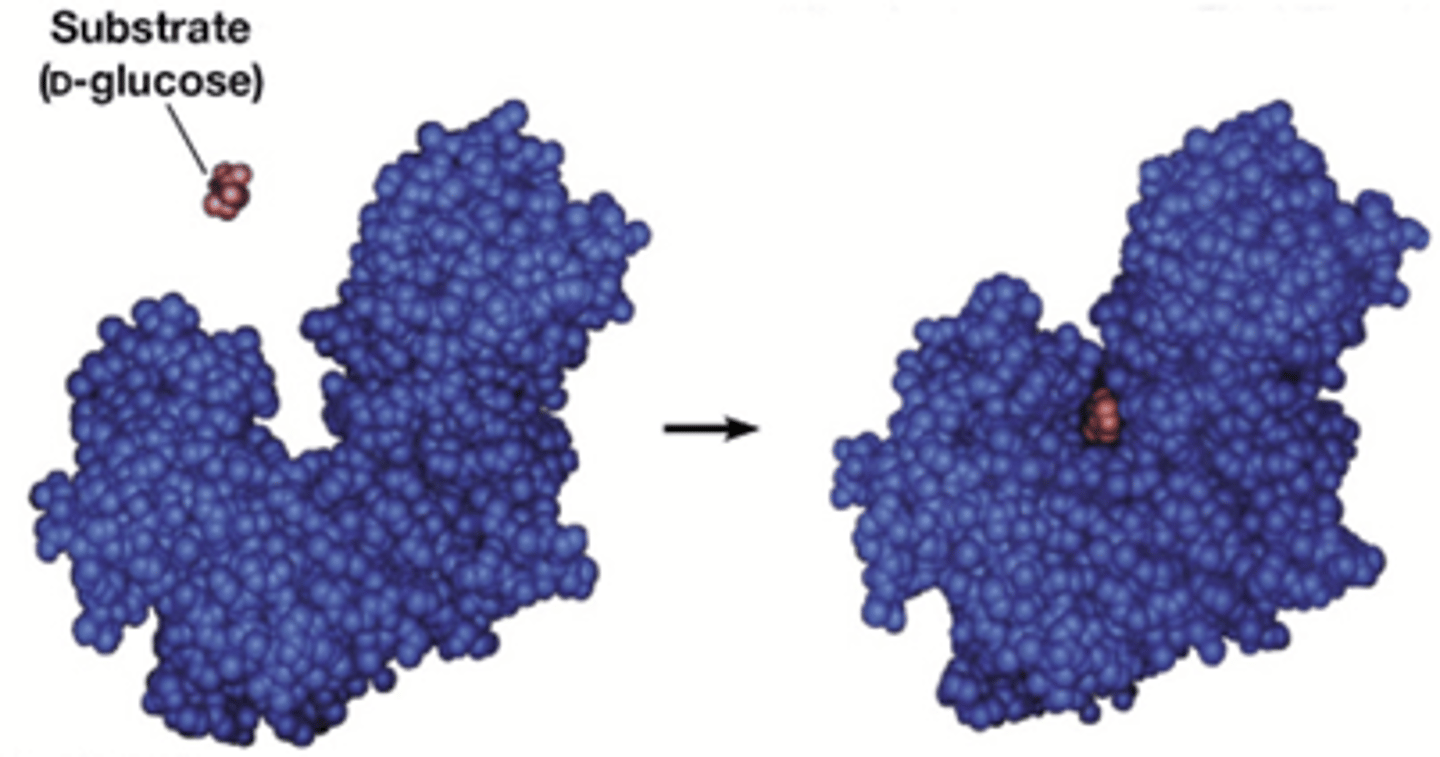
Hoe gaat er vrije energie worden vrijgezet tussen het enzyme en substraat
Vrije energie wordt vrijgezet door de vorming van een groot aantal niet- covalente interacties tussen enzyme en substraat (dit is de bindingsenergie). Alleen het correcte substraat kan deelnemen aan alle interacties met het enzyme en dus de bindingsenergie maximaliseren. De bindingsenergie wordt verder gemaximaliseerd als het substraat omgezet is naar de transitietoestand.
De vrijzetting van deze bindingsenergie kan beschouwd worden als verlaging van de activeringsenergie.
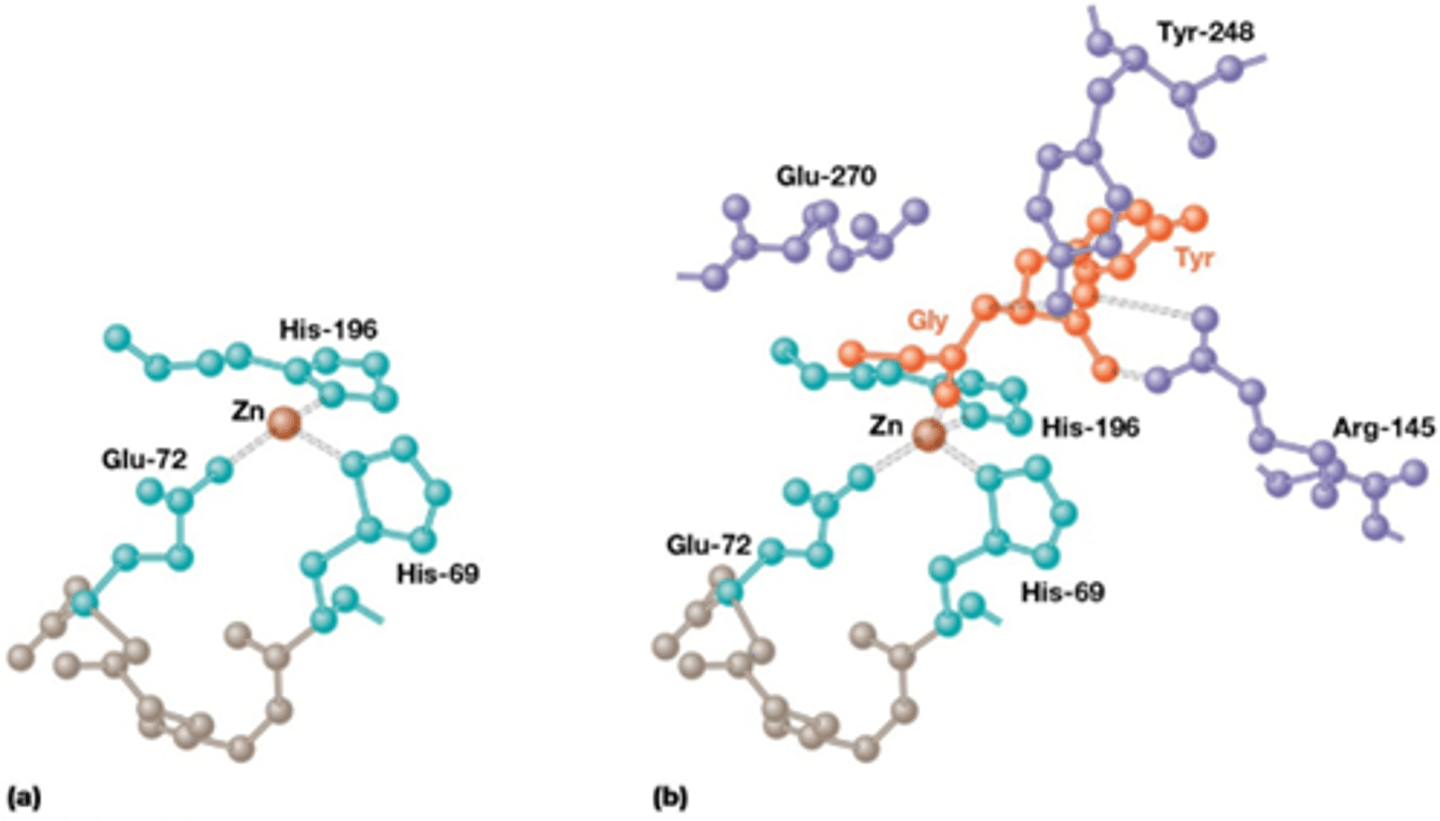
Op de actieve site gebeurt meer dan alleen substraat binding via induced fit. welke verschillende katalytische strategieën zijn er nog zodat substraten omgezet kunnen worden tot product?
-covalente katalyse vb. chymotrypsine
-zuur-base katalyse vb. chymotrypsine
-samenbrengen van substraten, zorgt voor hydraties
-metaal ion katalyse vb een zinkion dat zorgt voor conformatieverandering en de binding van substraat en enzyme (zie foto)
Wat is chymotrypsine
Een protease, het verlaagt de activeringsenergie voor de hydrolyse/klieving van peptide binding (zie foto)
->thermodynimisch gunstig maar zeer traag door de partieel dubbel bindingskarakter
->activeringsenergie moet verlaagd worden
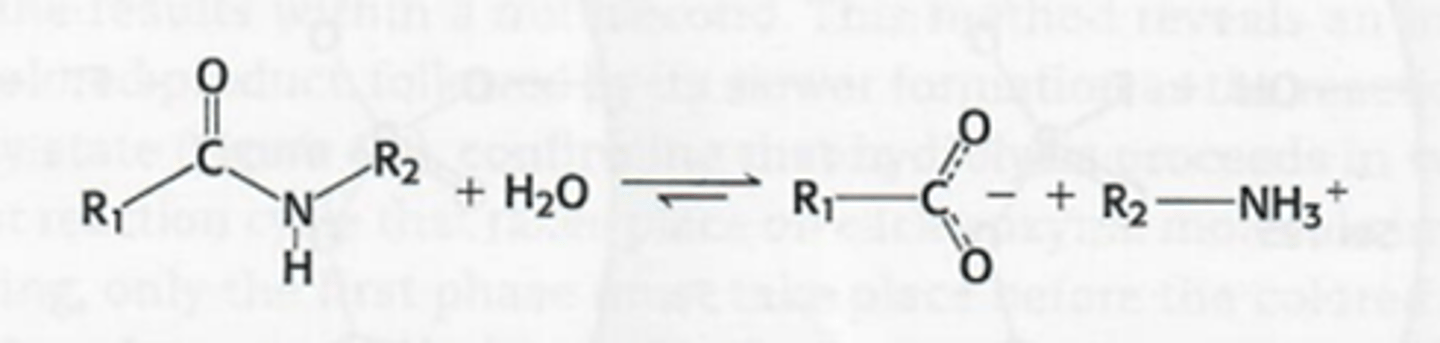
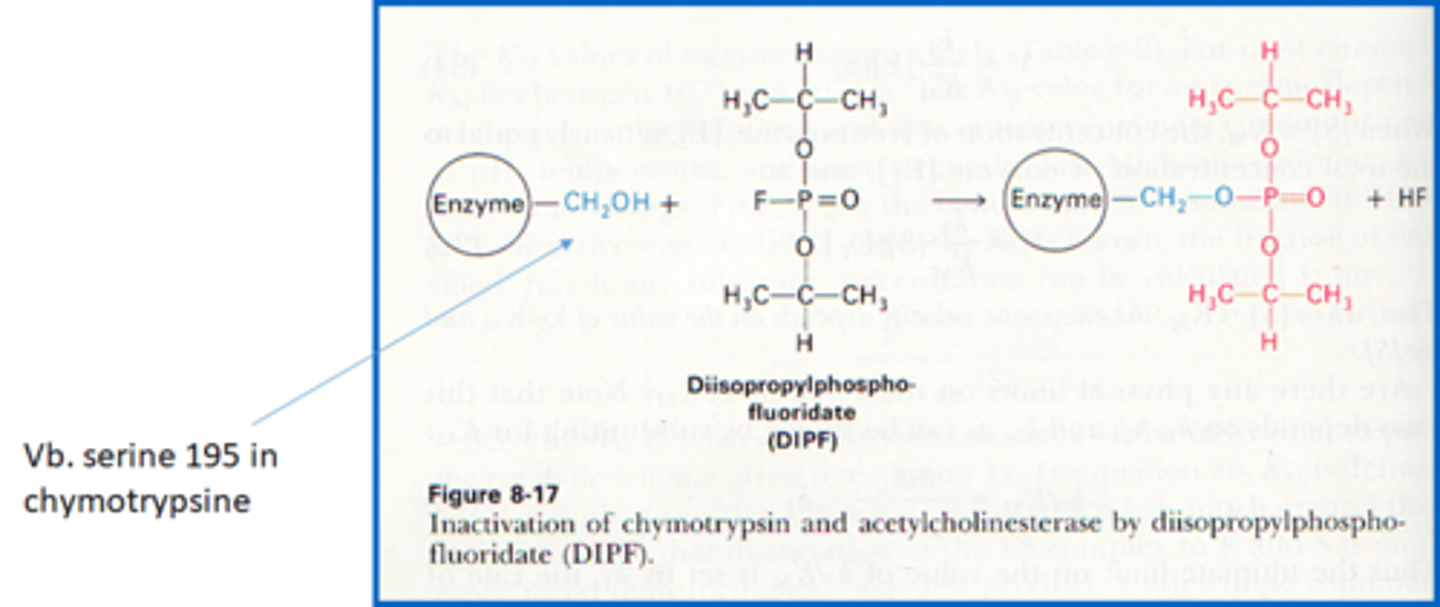
Welk nucleofiel gaat chymotrypsine gebruiken om de peptide binding te klieven?
Serine 195, het bevat een histidine die fungeert als base waardoor je een O- (alkoxide groep) krijgt, deze is reactief genoeg om de peptide binding te breken.
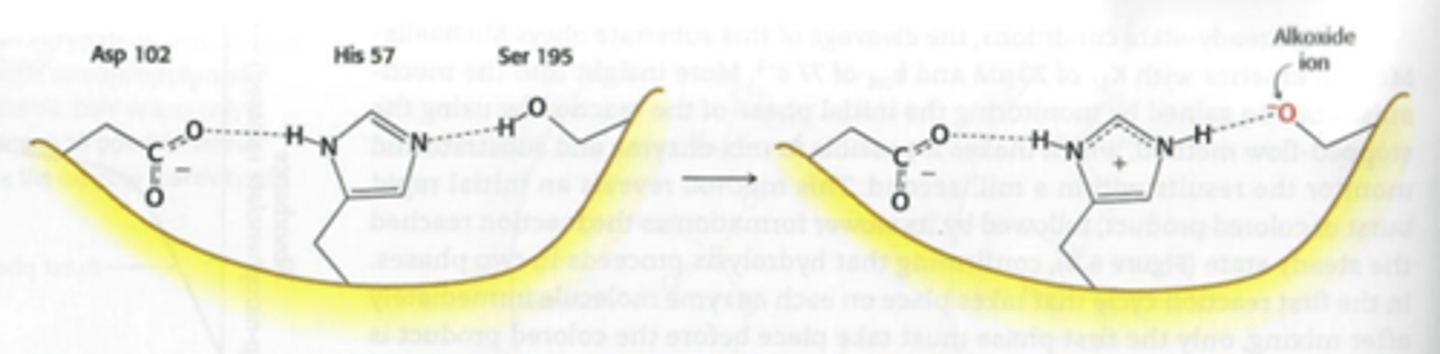
welke soort katalyse gaat chymotrypsine gebruiken? + welk soort binding gaat er ontstaan tussen enzyme en substraat?
1) Covalente katalyse
2) Transient covalente binding (transient = tijdelijk)
Leg de werking van Chymotrypsine uit + hoe kan het dat Histidine de proton van Serine kan afnemen?
1) de peptidebinding gaat loskomen doordat de koolstof en stikstof uit elkaar worden "getrokken" door de alkoxide groep van serine 195. dan gaat de koolstof gebonden staan met het enzyme en de acyl-enzyme vormen. De binding tussen het substraat en enzyme kunnen uit elkaar worden gehaald door water (hydrolyse). De peptidebinding is uit elkaar gehaald.
2) Histidine is positief maar gaat worden gestabiliseerd door de negatieve zijketen van aspartaan. Hierdoor kan het de proton van serine opnemen.
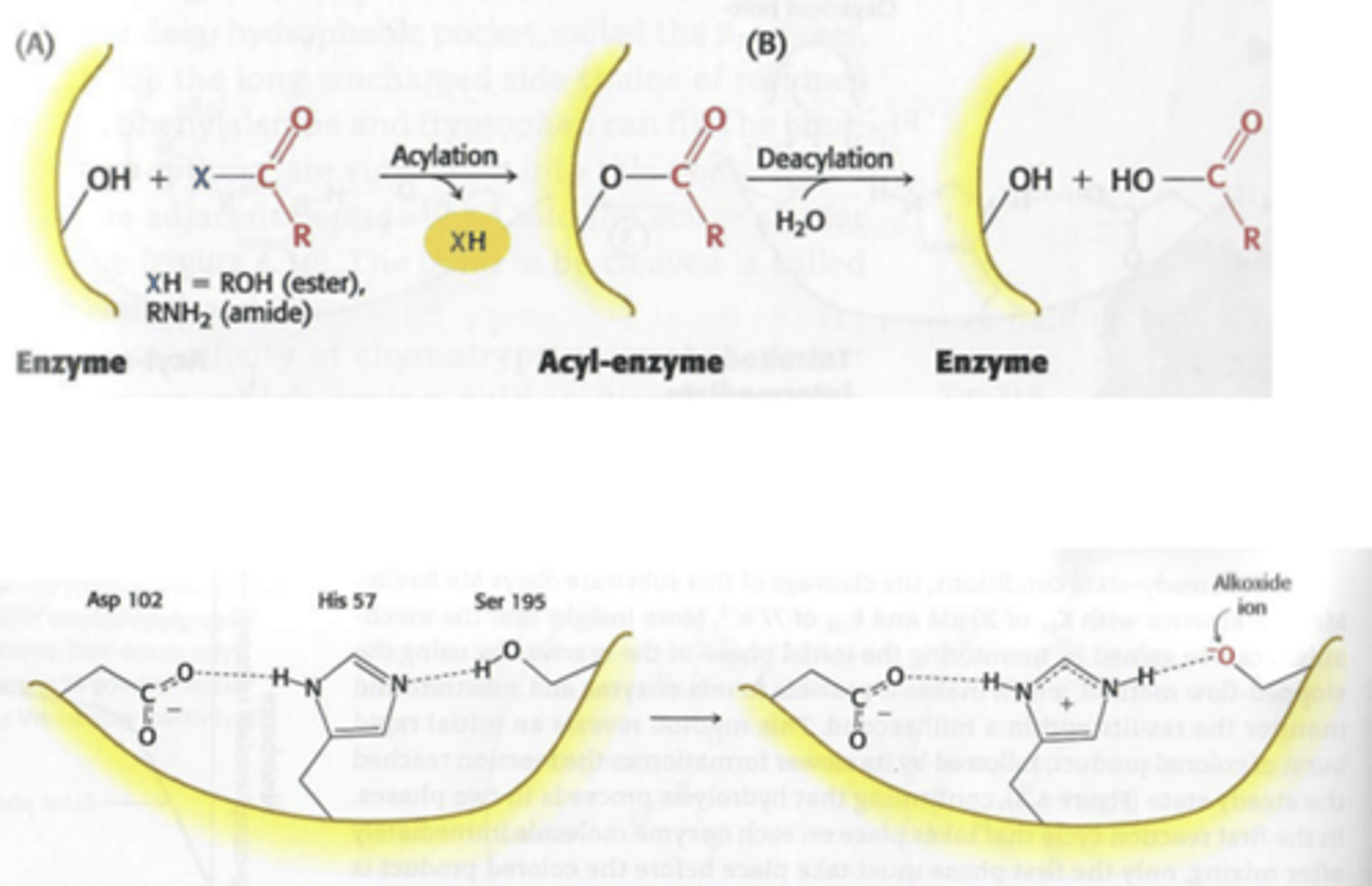
Een foto van de slide over chymotrypsine zodat het een beetje duidelijker is
Wat zijn de twee soorten cofactoren
1) metaalionen (Fe2+, Cu2+, ...)
2) co-enzymen = kleine organische molecule , vaak afgeleid van vitamine (cfr belang vitamine), zwakke associatie met enzyme (NAD, FAD) (cosubstraten)
2.1) als ze sterk gebonden zijn met het enzyme worden het heemgroepen of prostethische groepen genoemd bv bij hemoglobine
extra info:
•apo-enzym + cofactor = holo-enzym
voor metaalionen hebben we mineralen nodig in onze voeding!
Waar zijn enzymen gevoelig aan?
-temperatuursverandering (niet elk enzyme)
-pH verandering (pH optimum kan sterk verschillen
-ionische sterkte (concentratie ionen)
-inhibitoren en activatoren
verschil poikilothermen en homeothermen
Poikilothermen worden ook wel ectothermen genoemd, omdat ze hun lichaamswarmte uitsluitend uit de externe omgeving halen .
de lichaamstemperatuur altijd constant is, en een kleine afwijking kan al gevaarlijk zijn voor het functioneren van het dier
-Temperatuursgevoelige (koorts) en temperatuursongevoelige enzymen (thermofiele en cryofiele organismen)
Op welke drie vlakken gaat de pH het enzymen beïnvloeden
1) lading van de zijketens van aminozuren op de actieve site
2) lading vh substraat
3) tertiaire structuur (indien extreme ∆pH)
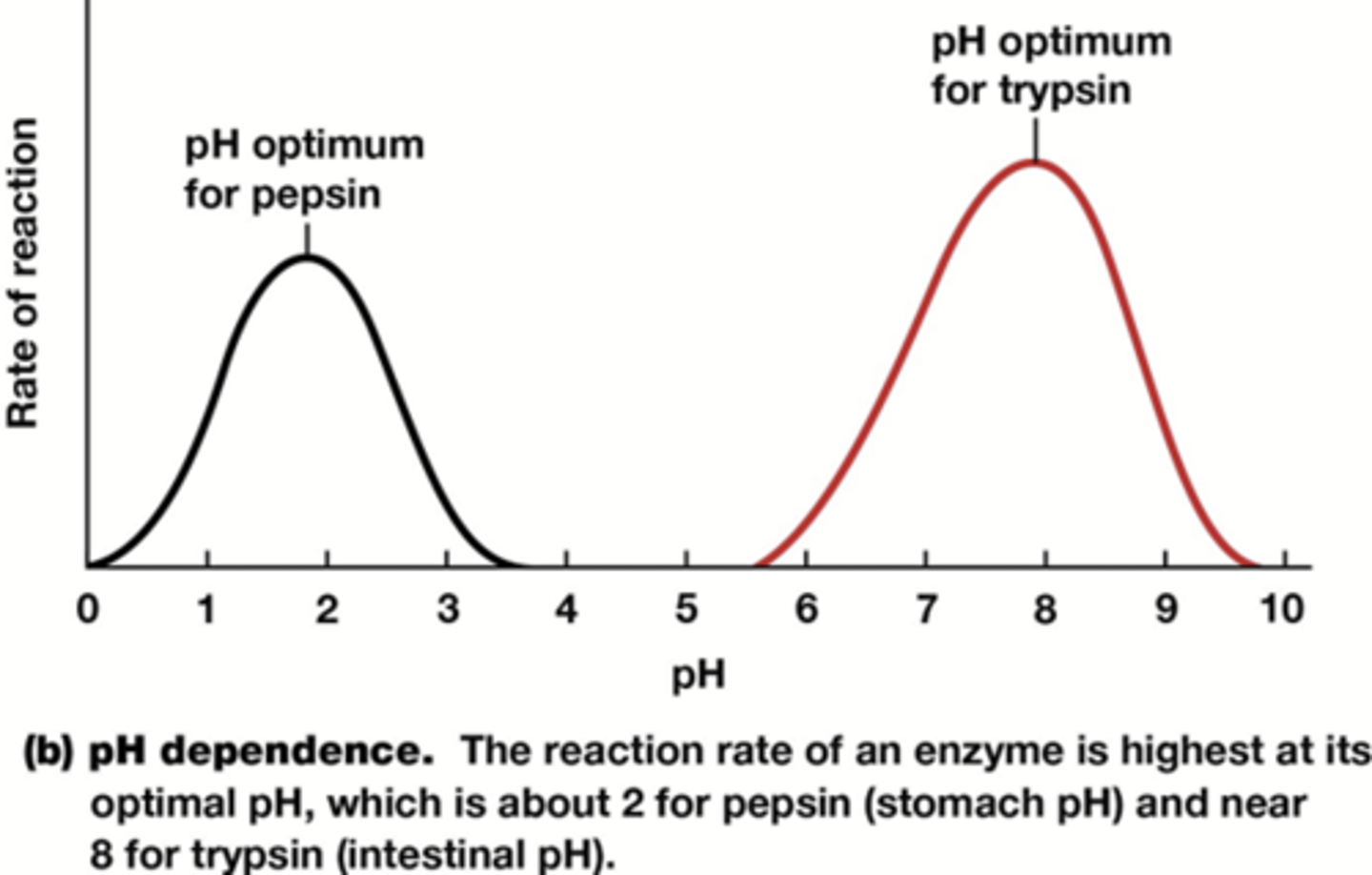
Wat gaat ionische sterkte beinvloeden
de waterstofbruggen in zowel de tertiaire structuur als tussen het substraat en actieve site
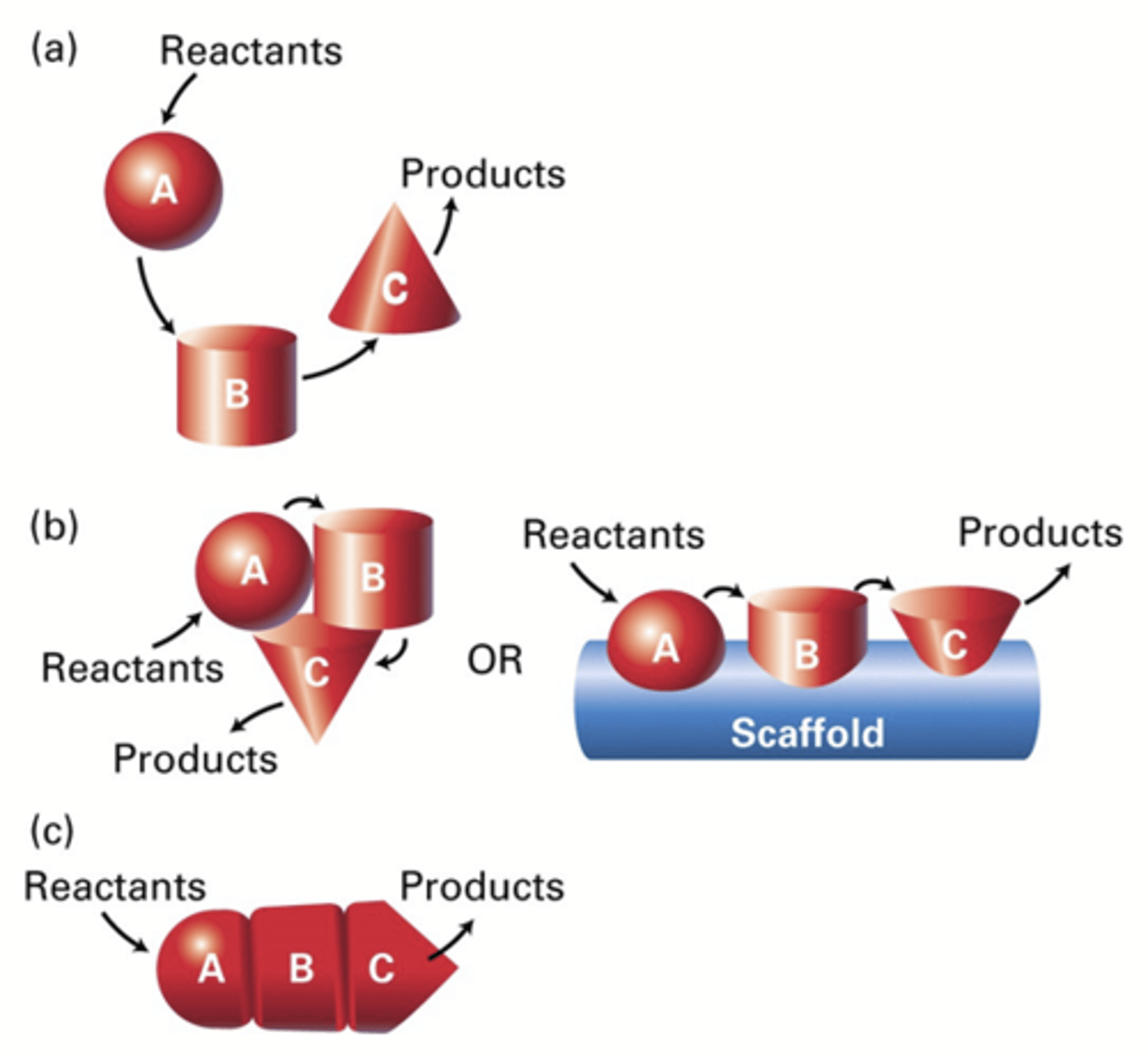
Hoe gebeurt de organisatie in supramoleculaire complexen?
a) Substraten komen vrij
b) Georganiseerd (door een scaffold/sterk eiwit)
c)Supramoleculair complex: minimale diffusie –>maximale efficiëntie
*Een supramoleculair complex is een georganiseerde structuur die wordt gevormd door de niet-covalente interactie tussen twee of meer moleculaire eenheden. Deze complexen worden bij elkaar gehouden door wel of niet covalente interacties
Wat zijn de 7 verschillende klassen van enzymen
1) oxidoreductase
2) transferase
3) hydrolase
4) lyase
5) isomerase
6) ligase
7) translocase
zoek hier elk enzym op dat je wil...
https://www.enzyme-database.org/contents.php

Welke soort reactie gaan oxidoreductase versnellen?
Ze katalyseren redox reacties (reducties en oxidaties)
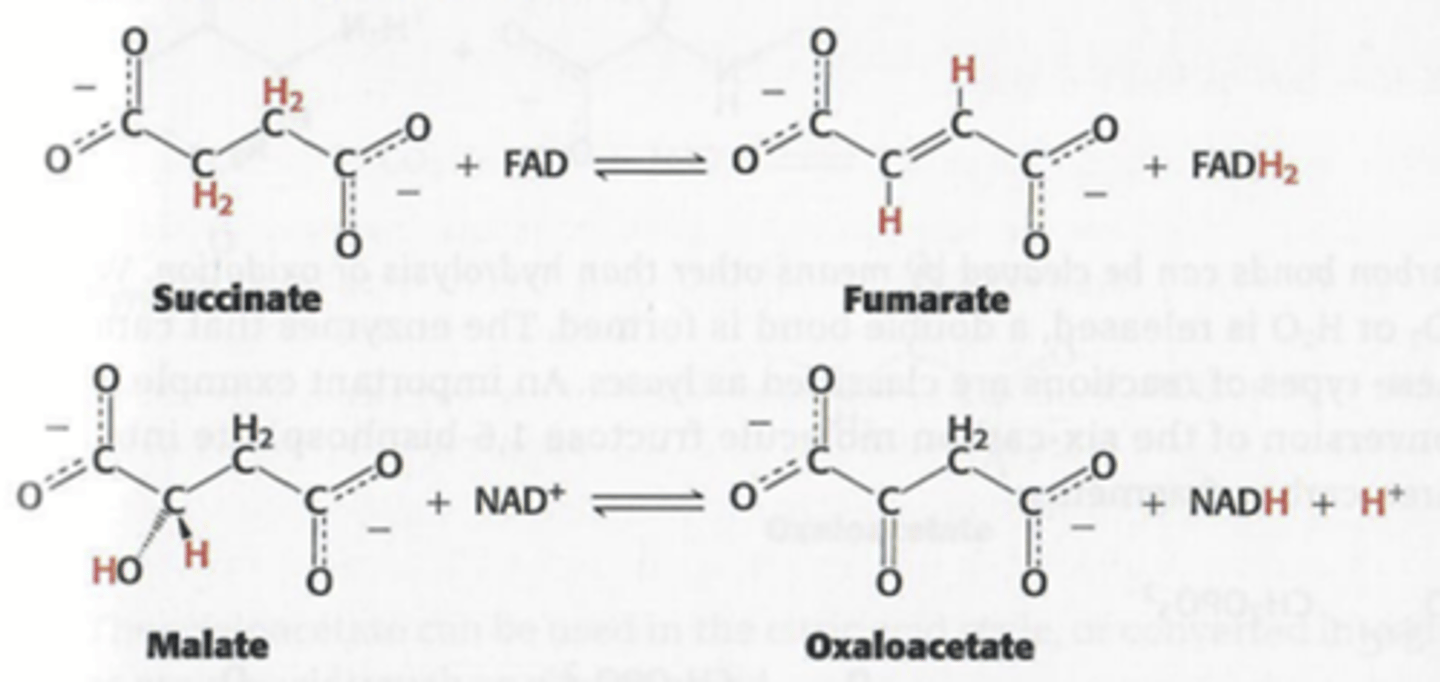
Wat gaan transferase doen?
transfer van functionele groepen naar andere molecule
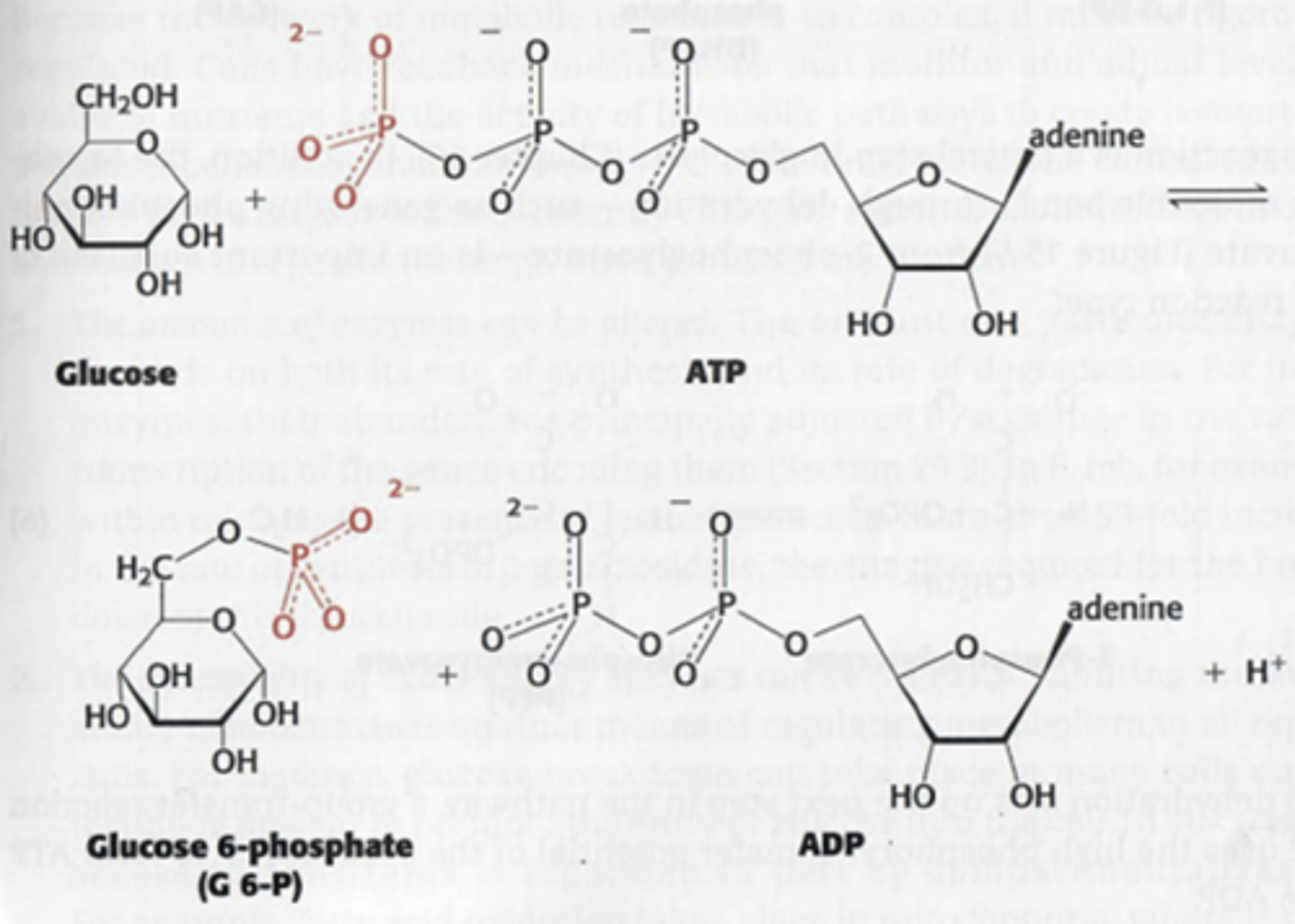
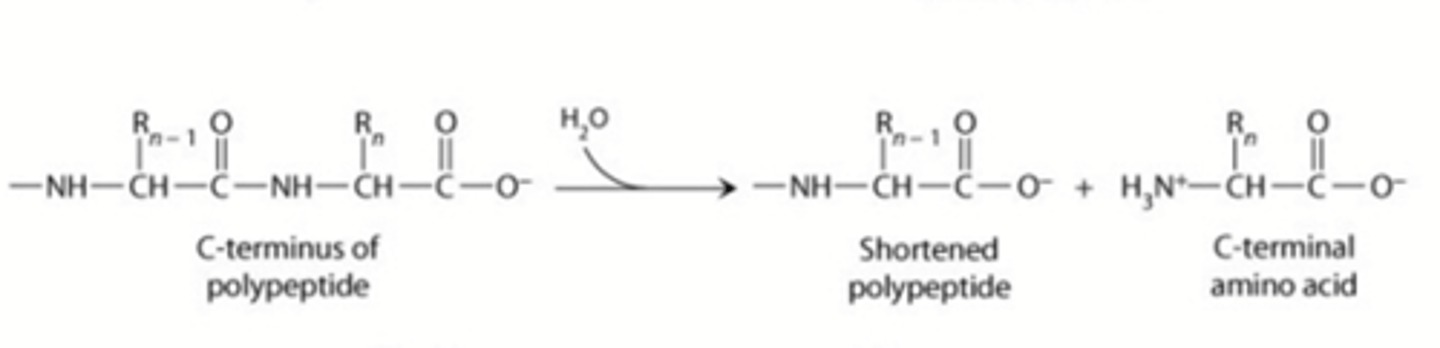
Wat gaan hydrolase doen?
verbreking van covalente binding door hydrolyse
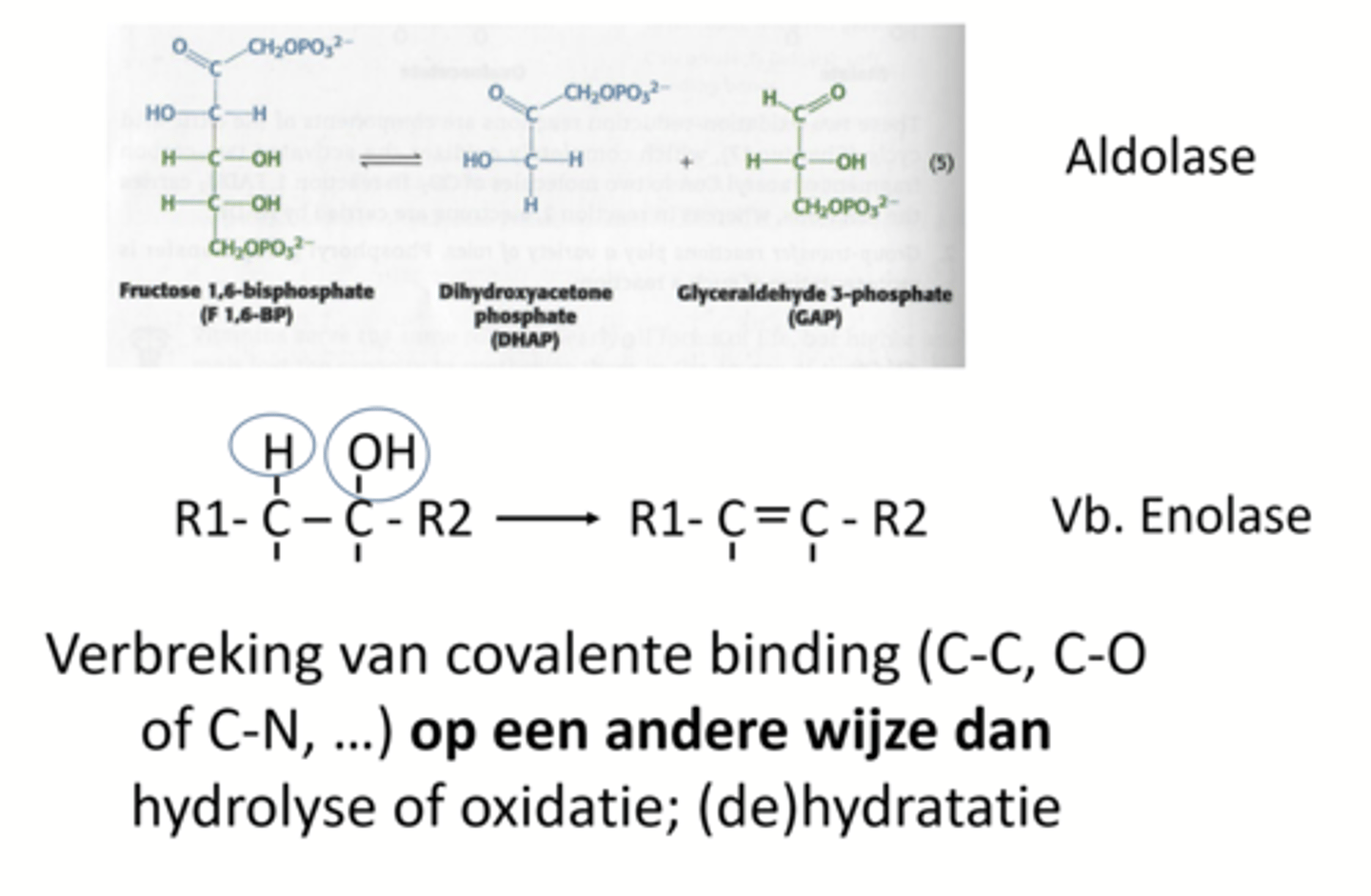
Wat gaat lyase doen?
verbreking van covalente binding op een andere wijze dan hydrolyse of oxidatie
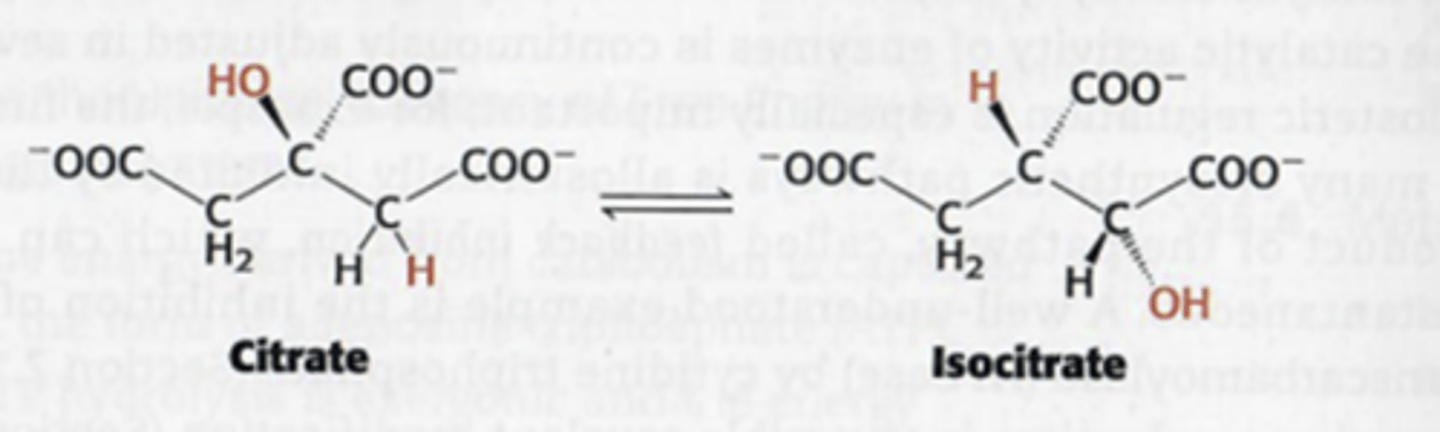
Wat gaat isomerase doen?
verplaatsing van functionele groep binnen een molecule
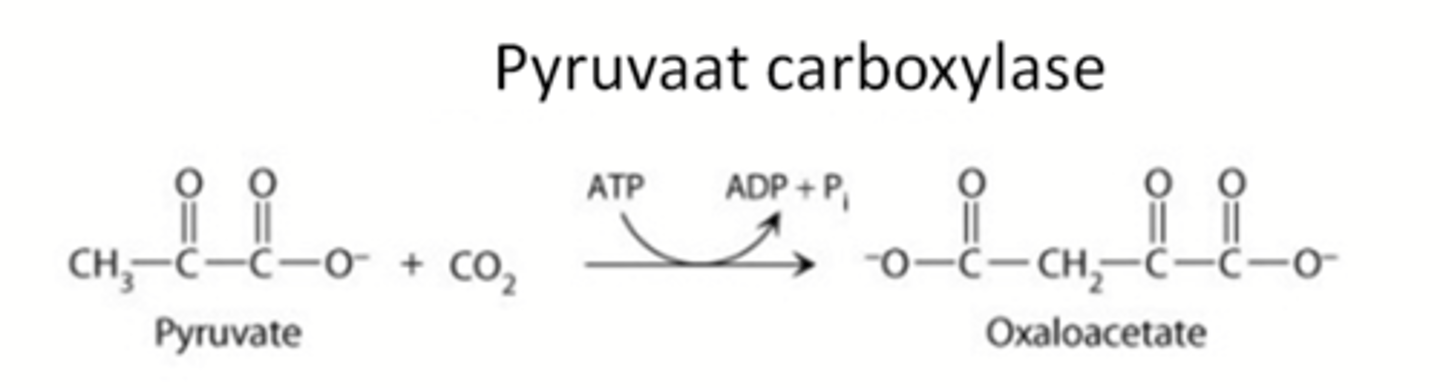
Wat gaat ligase doen?
vorming van covalente binding met verbruik van ATP
Wat gaan translocase doen?
transfer van ionen of molecule doorheen of binnen een membraan

wanneer kan men spreken over de initiële reactiesnelheid?
Zolang men in de lineare periode van de curve zit.
Wat is de formule van Michaelis-menten
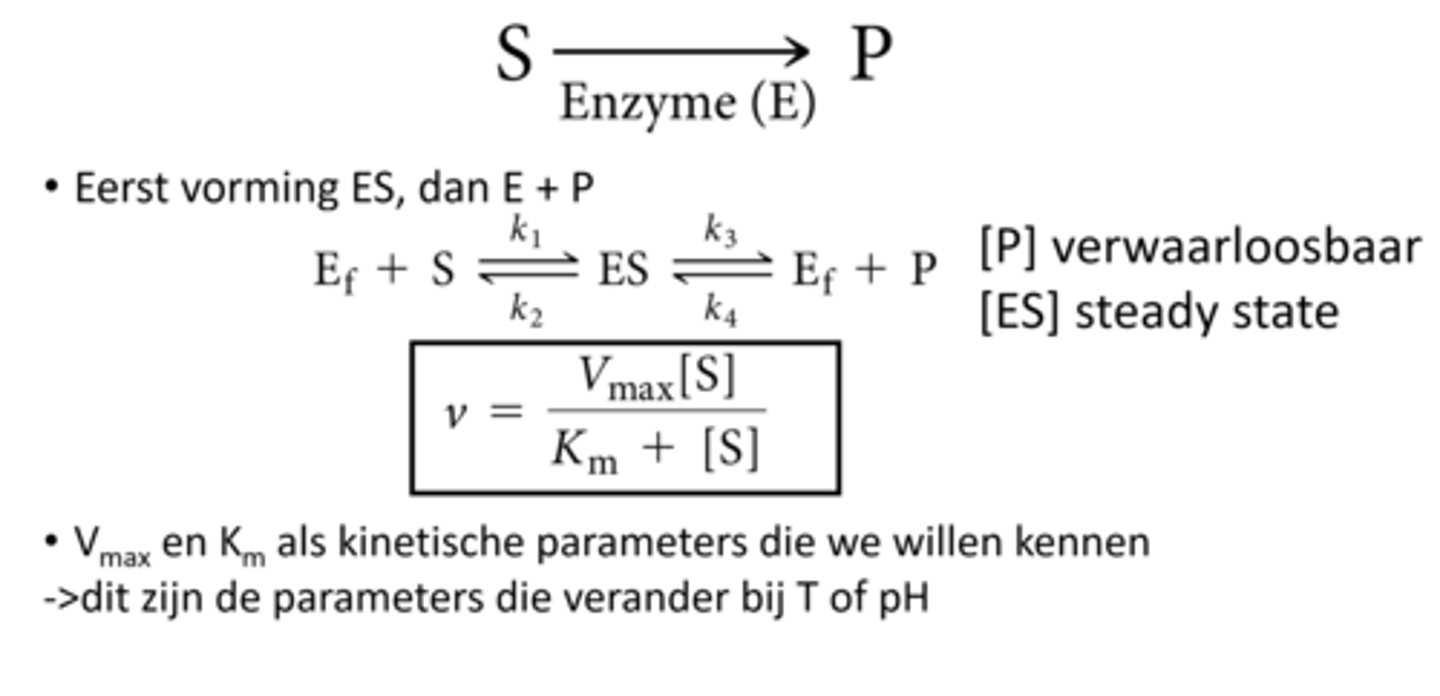
wat is de snelheid op de Km waarde
1/2 Vmax
Waarom is de Km waarde van belang?
Meeste fysiologische waardes gaan in de buurt liggen van de Km waarde doordat de snelheid van de reactie relatief hoog ligt maar de cel voldoende gevoelig blijft voor concentratieveranderingen
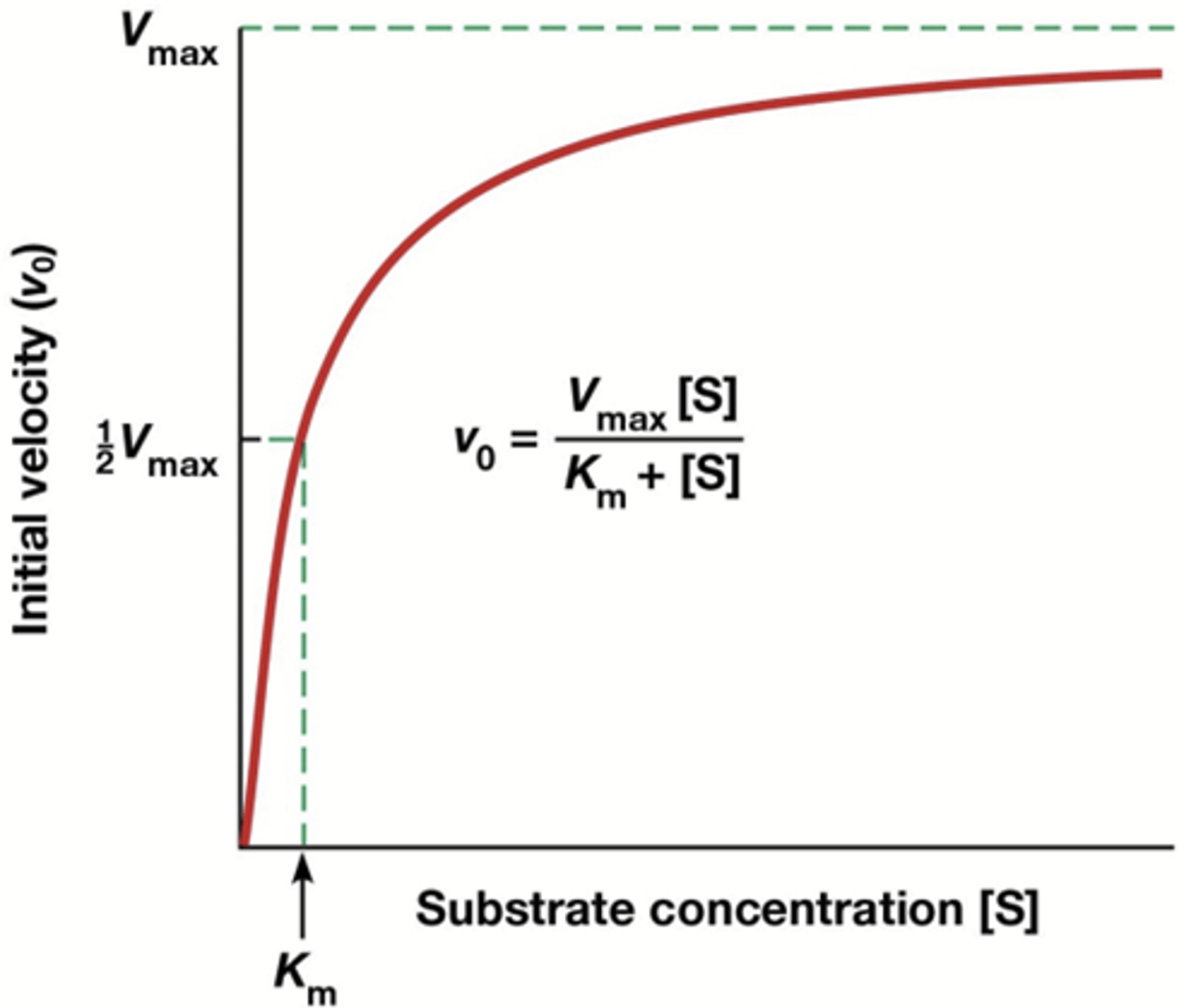
Hoe ziet de grafiek er uit dat het verband weergeeft tussen de snelheid en de enzymeconcentratie?
lineair
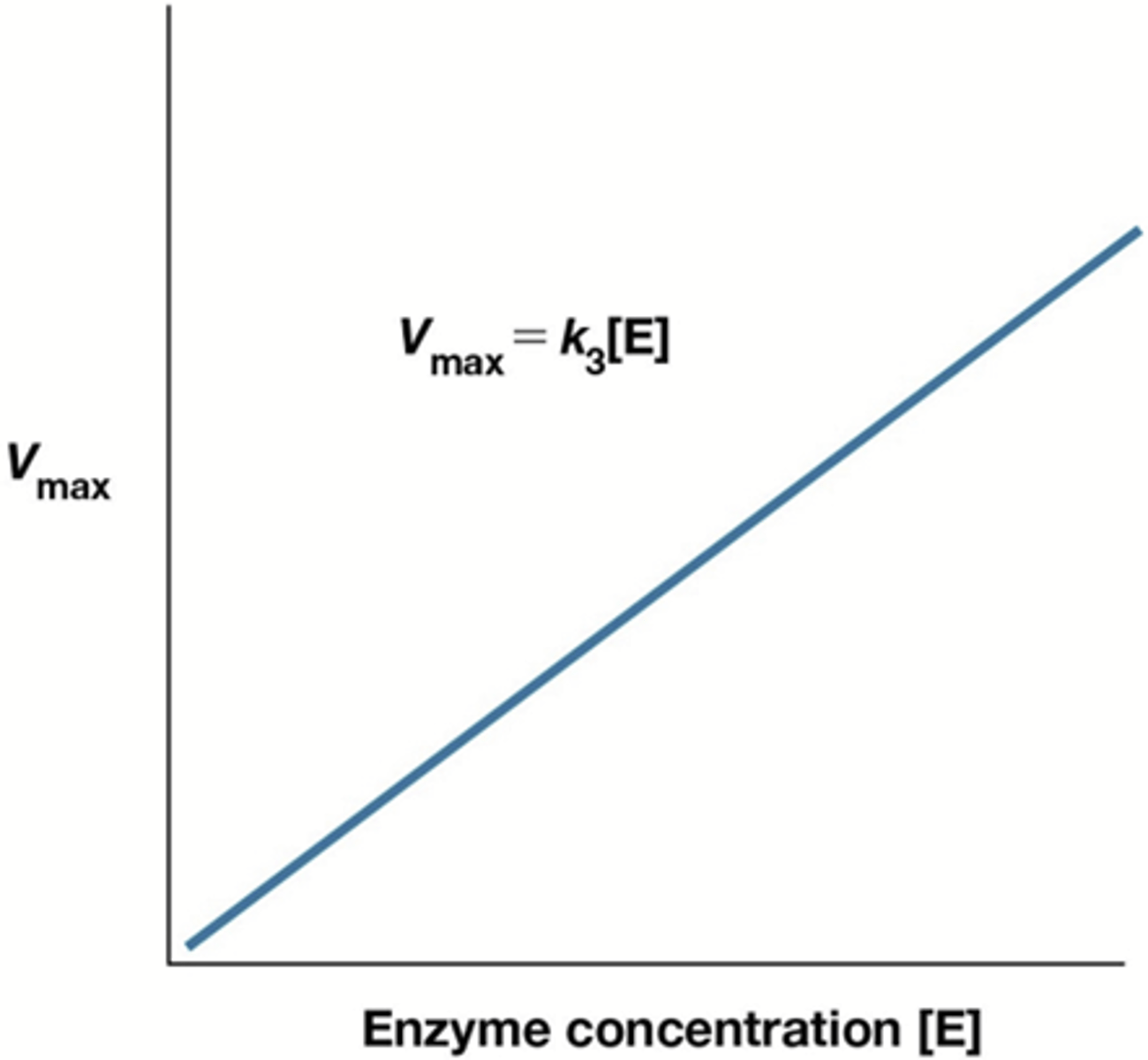
Wat geeft de Kcat weer?
Het aantal molecule dat 1 enzyme kan omzetten per tijdseenheid (Hoe goed een enzyme werkt)
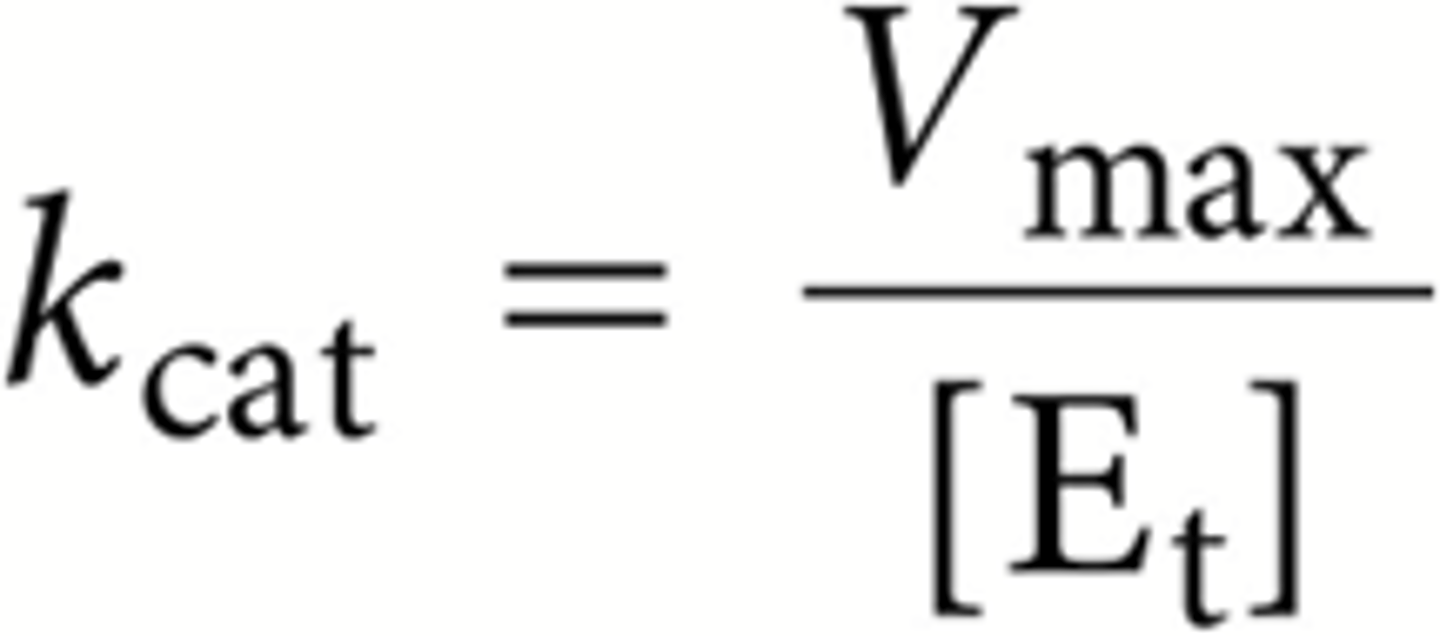
Hoe de Km en de Vmax bepalen?
-via hyperbolische regressie: computer programma of formule
-via het lineair verband: het snijpunt met de x-as = -1/Km , snijpunt y-as = 1/Vmax
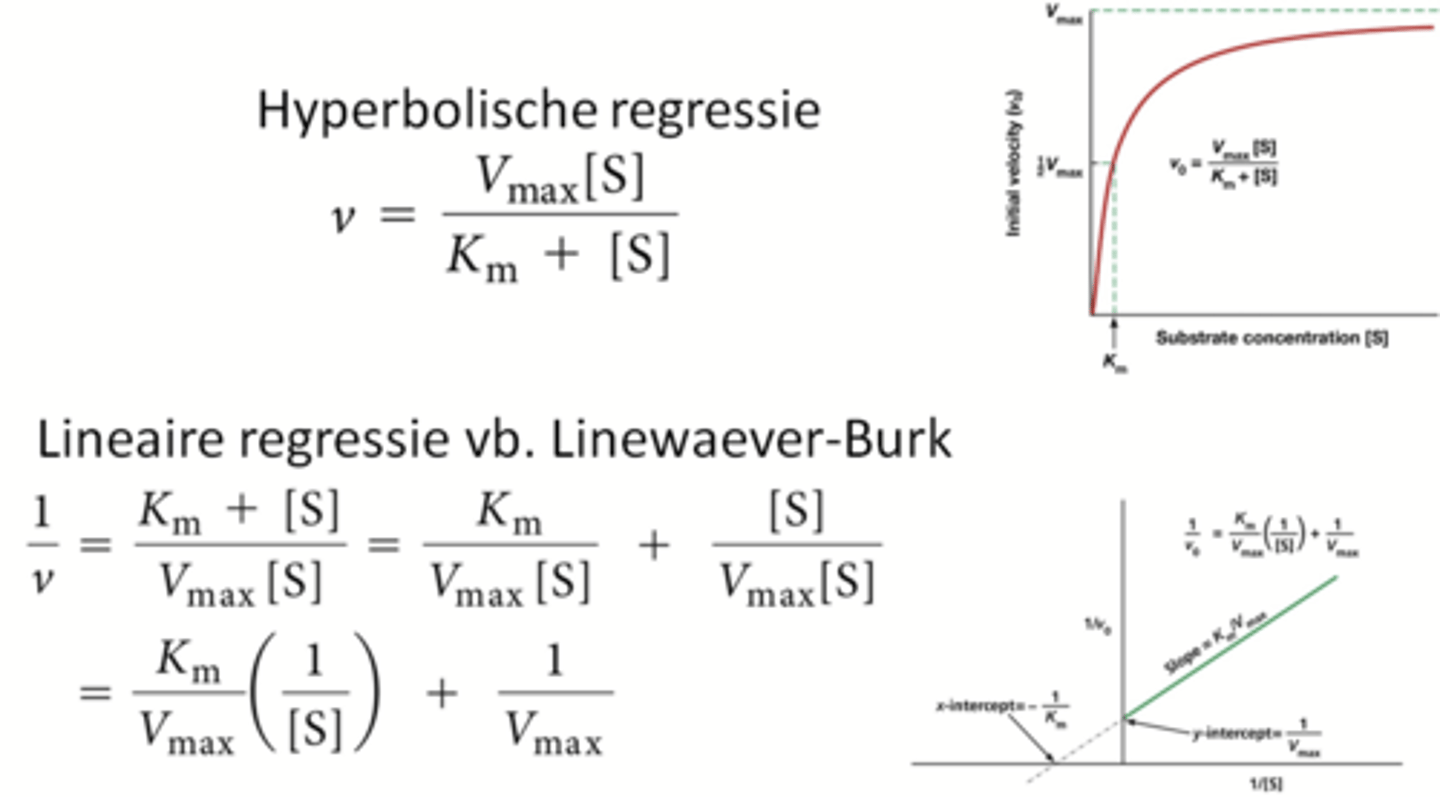
key technique: Experimentele bepaling van Km en Vmax
verschillende hoeveelheden glucose in een testbuis en dan telkens de beginsnelheid meten, zo krijg je grafieken*.
*rechter grafiek is 1/[substraat] op de x-as
p166 en 167 BWC
![<p>verschillende hoeveelheden glucose in een testbuis en dan telkens de beginsnelheid meten, zo krijg je grafieken*.</p><p>*rechter grafiek is 1/[substraat] op de x-as</p><p>p166 en 167 BWC</p>](https://knowt-user-attachments.s3.amazonaws.com/39b8fb85-e2d7-4e0a-aafe-91c21e9a2edb.png)
Ahv welke binding gaan onomkeerbare inhibitoren binden? + wat is het effect op het enzyme?
1) via covalente bindingen
2) permanent verlies van activiteit
Sommige onomkeerbare inhibitoren worden gebruikt als medicijn.
ahv welke binding gaan omkeerbare inhibitoren binden?
via niet-covalente bindingen (kunnen gedissocieerd worden)
Welke soorten omkeerbare inhibities zijn er?
1) competitieve inhibitie
2) niet competitieve inhibitie
3) oncompetitieve inhibitie
Geef 3 voorbeelden van onomkeerbare inhibitoren
1) organofluorofosfaten = reageren met serine uit chemotrypsine en acetylcholinesterase (verlamming vitale functies als gevolg)
2) aspirine inhibeert een enzyme: het bindt covalent met prostaglandine synthase, prostaglandines veroorzaken ontstekingen en contraheren gladde spieren in bloedvaatjes
3) penicilline
eerste antiobioticum, inhibeert een sleutel enzym ('cross-linking transpeptidase') dat instaat voor de cross-linking van de peptidoglycaan ketens in de bacteriële celwand.
->bacteriele celwand gaat kapot, wij hebben geen celwand dus weinig side effects
leg de werking van competitieve inhibitie uit
De inhibitor staat in competitie met het substraat voor binding aan de actieve site. Inhibitie kan opgeheven worden door de substraat concentratie te verhogen.
Effect op kinetica:
->apparent Km neemt toe (snijpunt met de x as= 1/Km)
-> Hoge [S]->Vmax blijft gelijk (last van de inhibitor) (snijpunt met de y-as=1/Vmax)
![<p>De inhibitor staat in competitie met het substraat voor binding aan de actieve site. Inhibitie kan opgeheven worden door de substraat concentratie te verhogen.</p><p>Effect op kinetica:</p><p>->apparent Km neemt toe (snijpunt met de x as= 1/Km)</p><p>-> Hoge [S]->Vmax blijft gelijk (last van de inhibitor) (snijpunt met de y-as=1/Vmax)</p>](https://knowt-user-attachments.s3.amazonaws.com/fbbe5de3-1137-4809-8c3d-6baacb7c3c18.png)
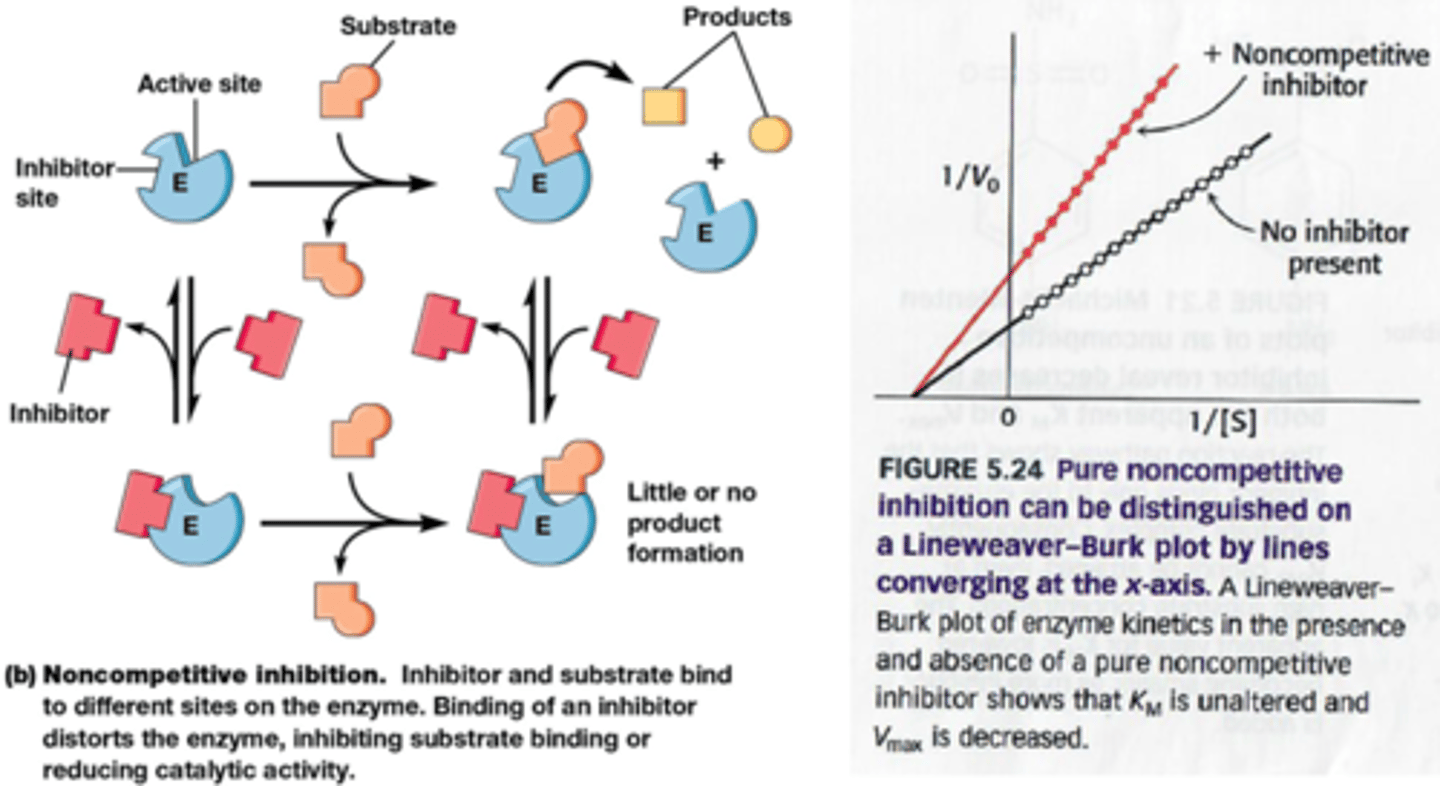
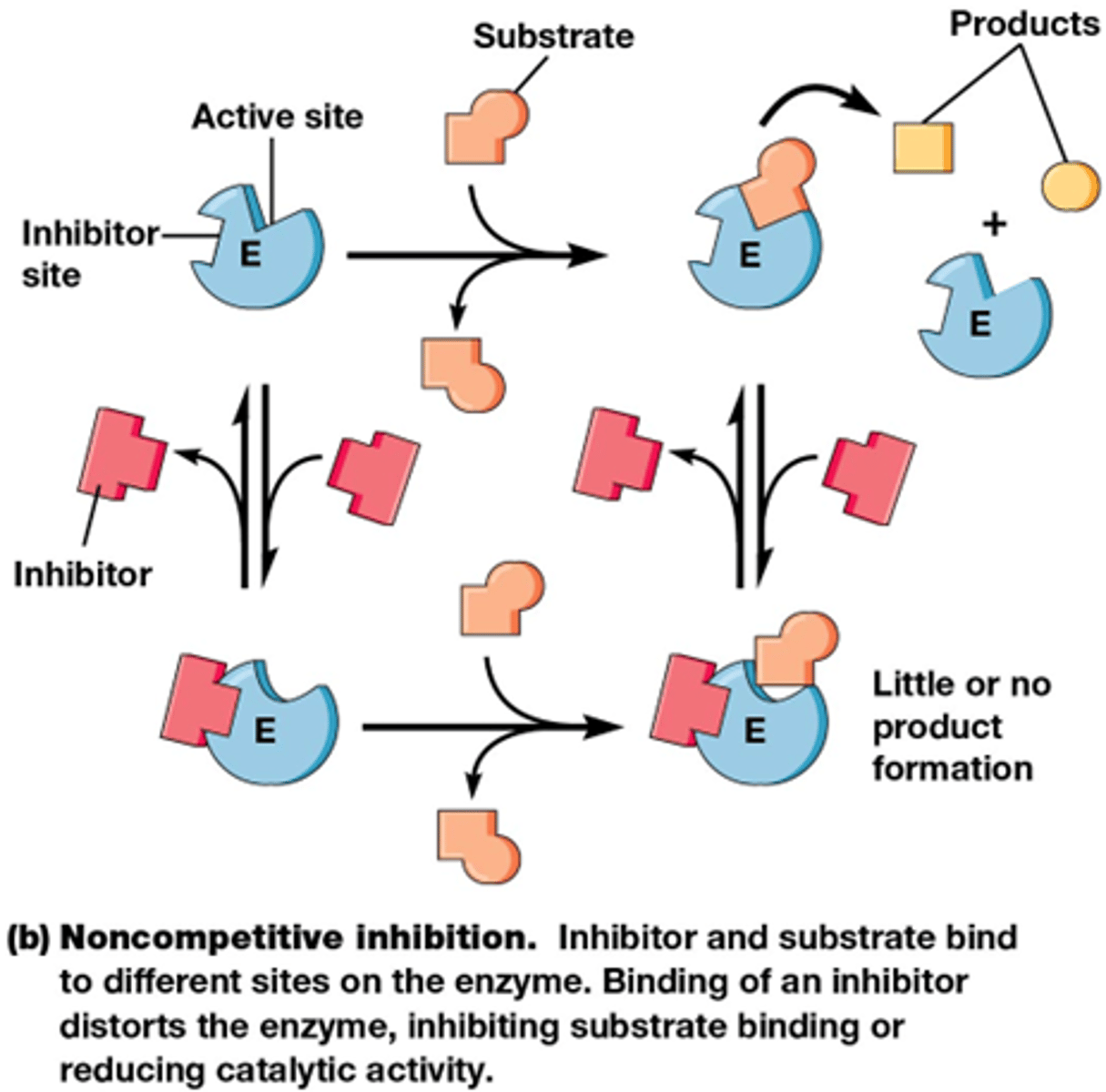
Wat is de werking van zuivere niet-competitive inhibitie
zuiver niet-competitief:
inhibitor bindt even goed aan E als aan ES*
inhibitor bindt niet aan actieve site maar aan eigen site en induceert conformatieverandering
=> 'apparent' Vmax daalt (want 1/Vmax stijgt)
=>Kcat daalt ook
Bij onomkeerbare inhibitie gebeurt hetzelfde maar op een andere manier maar via covalente bindingen: het vermindert het aantal goeie enzymen
=>Vmax daalt en Kcat ook
*ES = enzymesubstraatcomplex
wat is de werking van gemengde niet-competitieve inhibitie
inhibitor bindt preferentieel aan E of aan ES (maar bindt beiden)
Wat is de werking van oncompetitieve inhibitie
De inhibitor bindt enkel aan het ES complex.
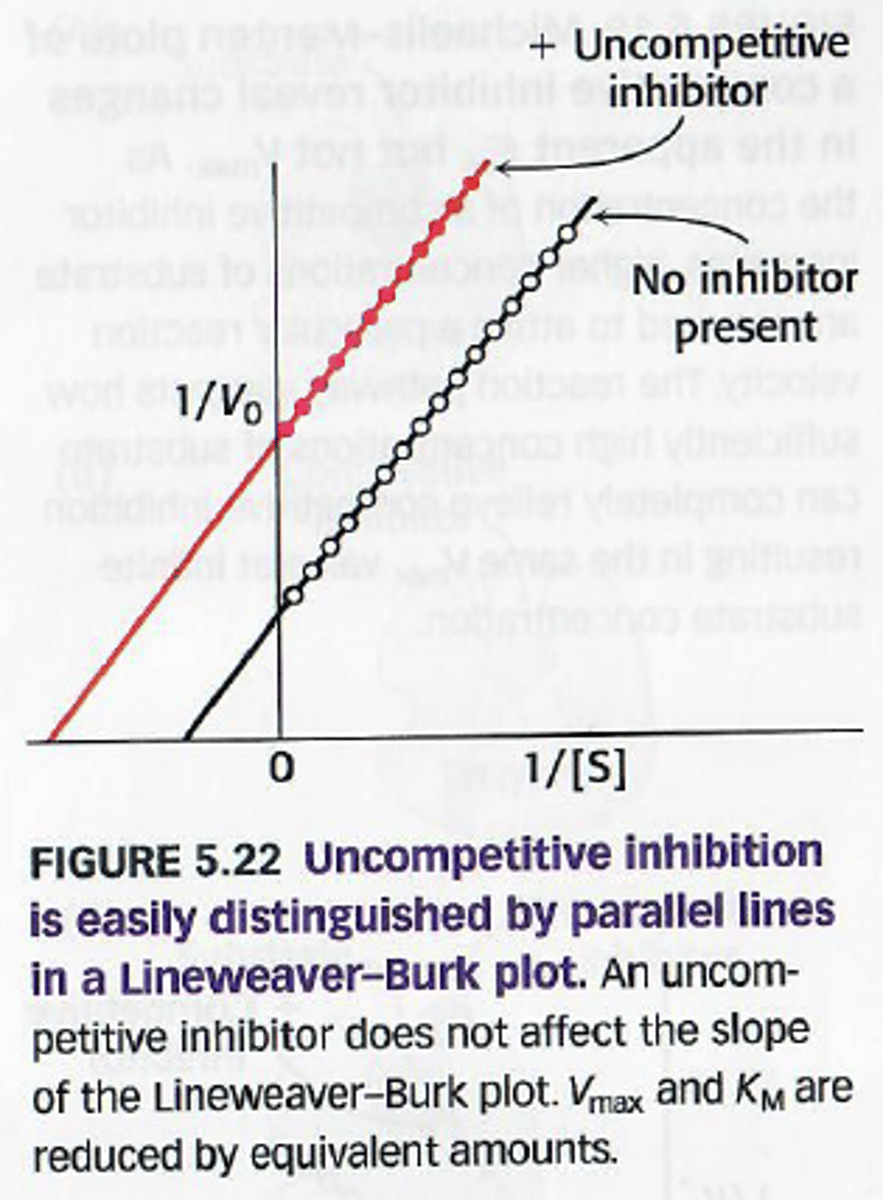
Wat is allosterische inhibitie?
Allosterische inhibitie is een proces waarbij een molecuul (de allosterische inhibitor) bindt aan een enzym op een andere plaats dan de actieve site, de zogenaamde allosterische site. Deze binding veroorzaakt een verandering in de driedimensionale vorm van het enzym.
Dit mechanisme is een manier voor cellen om enzymactiviteit te reguleren en is vaak omkeerbaar. Het is van cruciaal belang voor de fijne afstemming van metabole routes. (chatgpt)
Wat zijn de 3 soorten van allosterische regulatoren
1) allosterische inhibitie (klein molecule bindt aan allosterische site op enzyme) => conformatie verandert stopt product ontwikkeling
2) allosterische activatie (het enzyme gaat van lage affiniteit naar substraat naar hoge affinitiet naar substraat door binding molecule aan allosterische site
3) regeling via terugkoppelingsinhibitie (feedback inhibition)
De allosterische inhibitor is een product gevormd op een ander moment van de keten
(De allosterische inhibitor is noch substraat, noch product van het enzyme dat geïnihibeerd wordt)
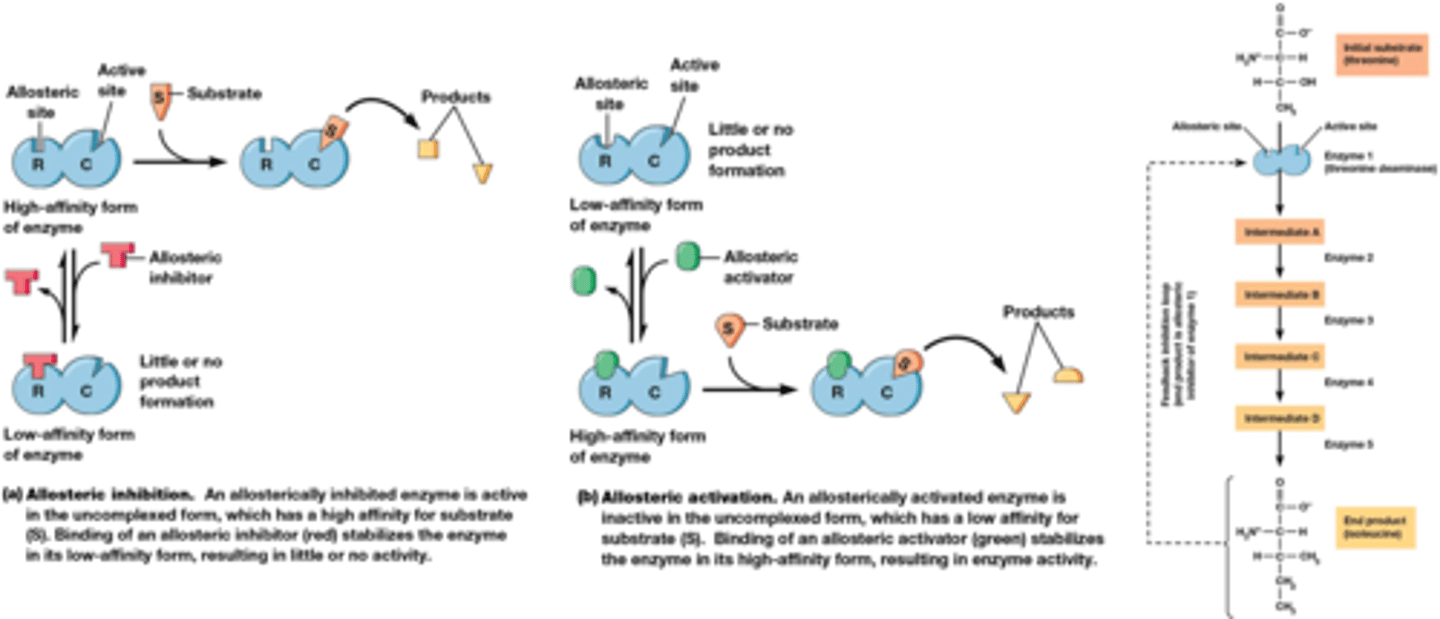
Wat zijn drie eigenschappen van allosterische inhibitoren
- actieve sites en regulatorische (allosterische) sites bevinden zich vaak op verschillende eiwitketens (multi-subeenheid complexen)
- Allosterische effectoren (inhibitoren, activatoren) regelen enzymactiviteit door het stabiliseren van een actieve of een inactieve conformatie van het enzyme.
- De meeste allosterische enzymen volgen de Michaelis- Menten kinetica niet: vaak sigmoïdale kinetica als gevolg van coöperativiteit tussen subeenheden. 'Coöperativiteit' is ook van toepassing op niet-enzymen (vb. hemoglobine).
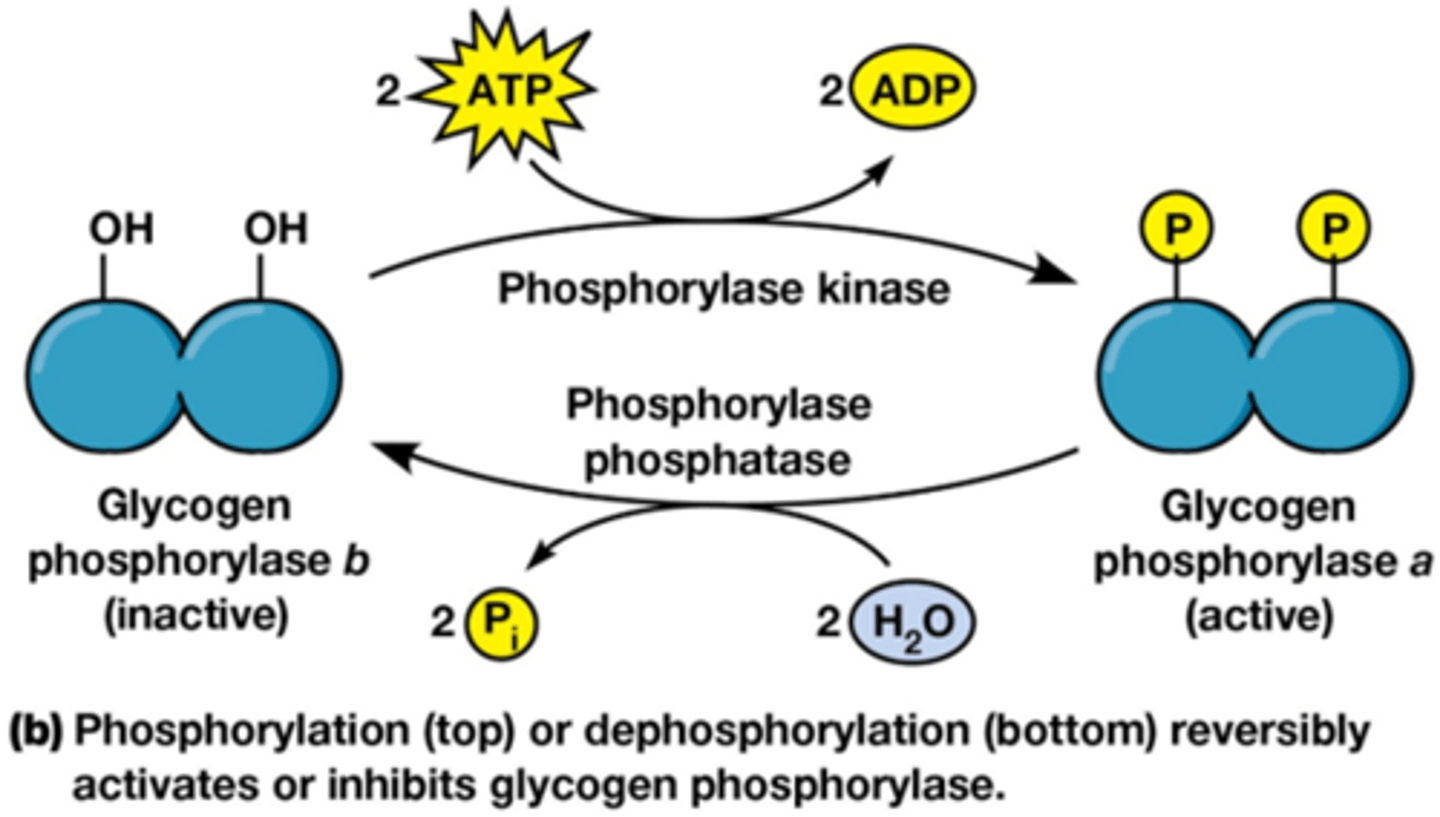
Covalente modificatie: fosforylatie
=omkeerbaar
de activiteit van enzymen kan gereguleerd worden door de gamma fosfaat te binden op de zijketens van enzymen door kinasen: substraat + ATP -> ADP + gefosforyleerde substraat
Defosforylatie is door fosfatasen! Product + H2O -> substraat + Pi
2 totaal verschillende reactievergelijkingen, ze zijn wel beide onomkeerbaar daarom dat ze elkaar nodig hebben
(anders verwaarloosbare snelheid)!
• Betrokken aminozuren hebben een hydroxyl (-OH) in R-groep.
• Fosforylatie en defosforylatie reacties zijn niet elkaars omgekeerde en zijn ieder essentieel onomkeerbaar
hoe verloopt de fosforylatie van glycogeen?
Glycogeen wordt actief door de afbraak via het enzyme glycogeen fosforylase, het is geen hydrolyse!
fosforylase: fosfaat wordt overgedragen op de C1 van het linkse glucose molecule van glycogeen (het is geen kinase reactie, het is een transferase!)
verschil kinase en fosforolyse
Kinase: het zorgt voor de transfer van gamma fosfaat naar het substraat
Fosforolyse: de binding wordt gekliefd door fosfaat ipv van water bij de hydrolyse
Komt voor in de skeletspier, daar worden ze geregeld door dit mechanisme maar in de lever ook nog door allostere regeling (het kan dat een enzyme meerdere regelingsmechanismen heeft)
In de spiercel zal de glucose-1-fosfaat via de glycolyse verbrand worden
in de lever zal die glucose gebruikt worden om de bloedsuikerspiegel te laten stijgen (belangrijk voor rode bloedcellen en hersencellen)
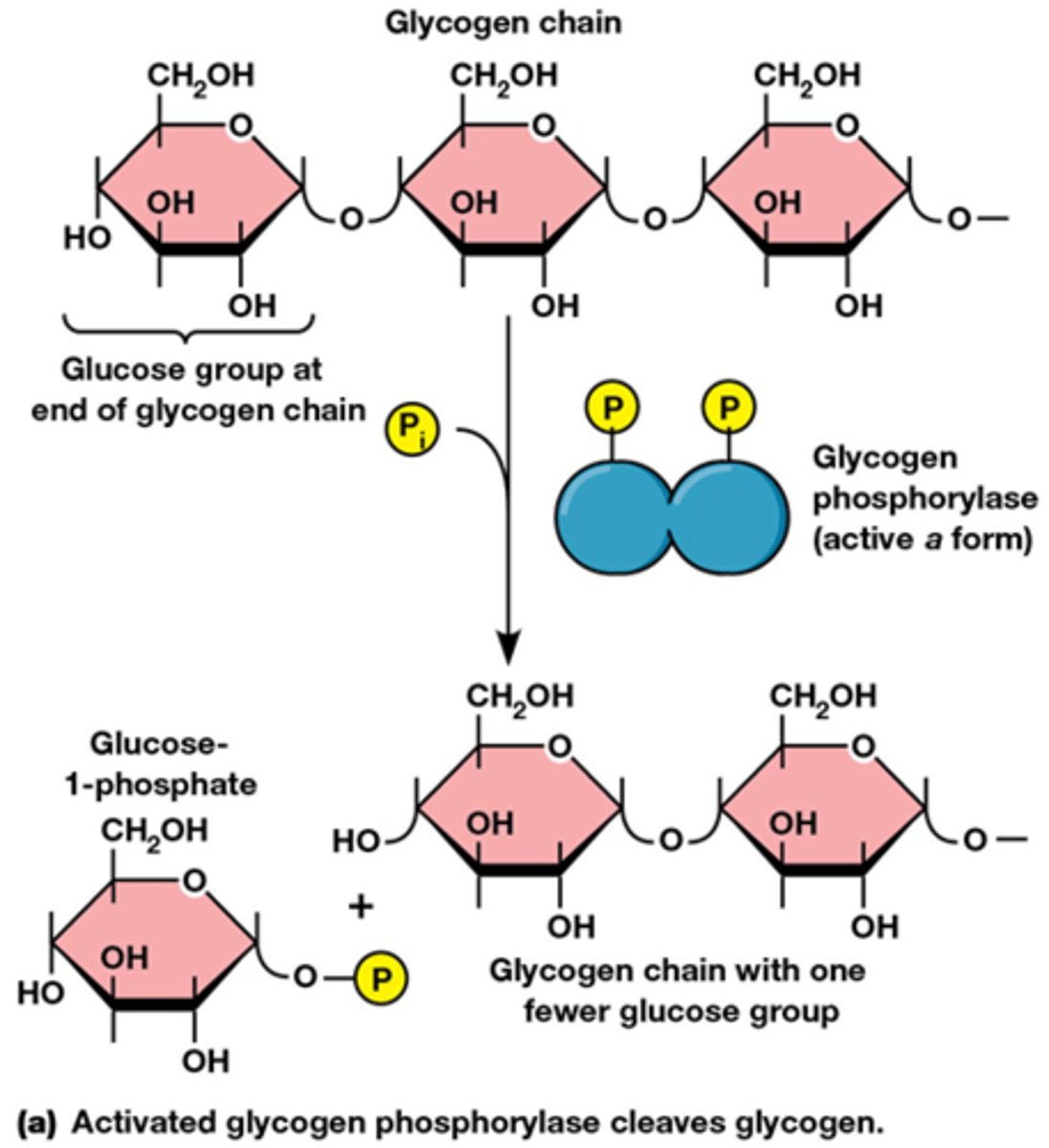
Hoe gebeurt de regeling van glycogeen fosforylase
Lever glycogeen fosforylase is onderworpen aan 2 niveaus van regeling:
1) Allosterische regeling: inhibitie door glucose en ATP, activering door AMP
2) Covalente modificatie (fosforylatie)
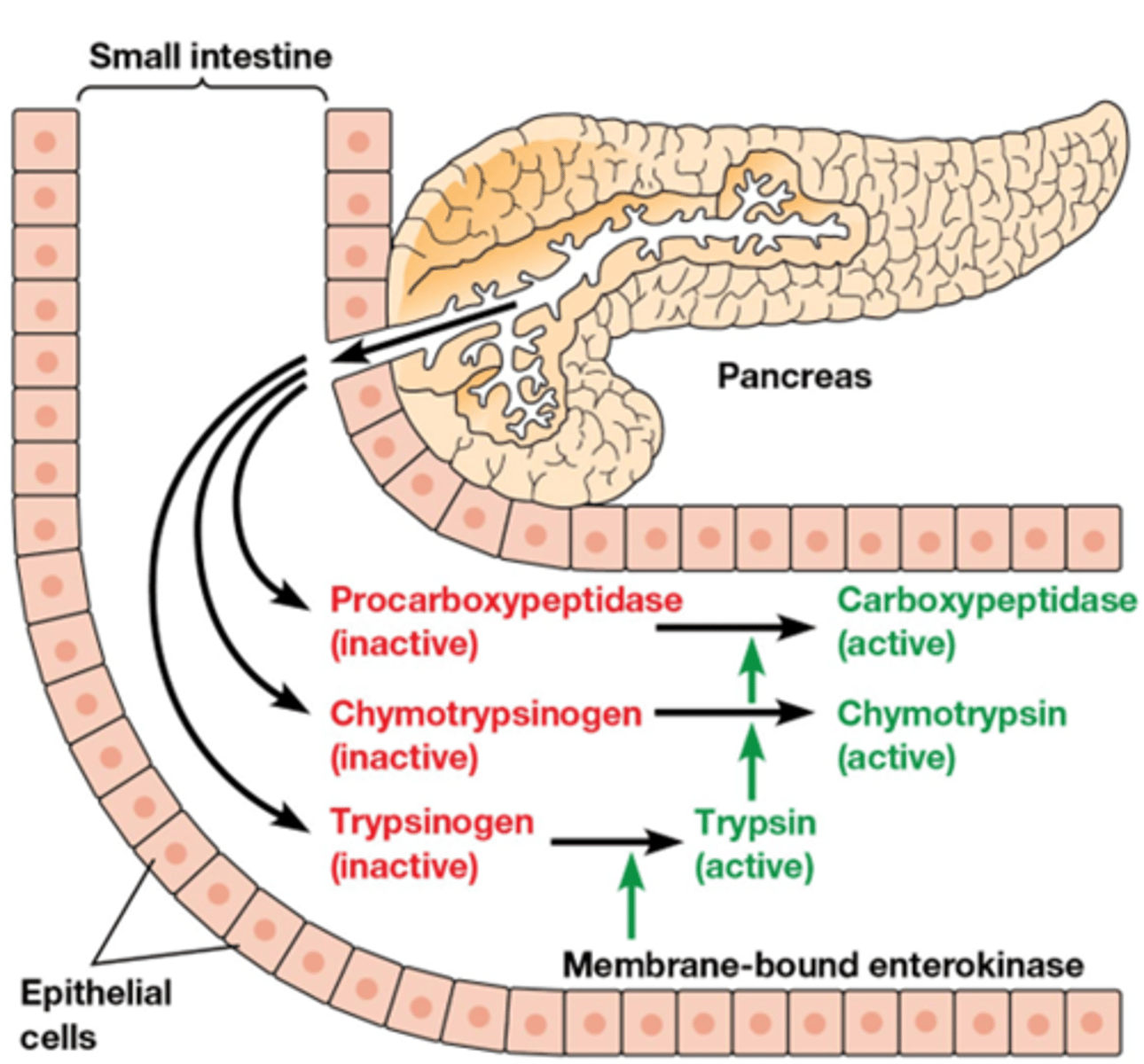
welke soort modificatie gebeurt bij proteolyse
- covalent (onomkeerbaar)
- Deze verteringsenzymen worden gesynthetiseerd als zymogeen (=pro-enzyme) in de pancreas.
Ze worden katalytisch actief na klieven van één enkele peptide binding.
welke enzymen katalyseren reacties in de trascriptie/translatie?
Ribozymen:
-spelen een belangrijke rol bij de katalyse van peptidebindingen tijdens translatie (rRNA)
-kunnen RNA polymerisatie katalyseren
-kunnen hun eigen splicing katalyseren (niet in vertebraten)