Коллоидная химия
1/185
Earn XP
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
186 Terms
Предмет коллоидной химии. Почему поверхностные явления и дисперсные системы изучаются в рамках одной дисциплины – коллоидной химии? Значение коллоидной химии для технологии
Коллоидная химия - это наука о поверхностных явлениях и гетерогенных дисперсных системах. Поверхностные явления возникают на любых поверхностях, независимо от их протяженности.
Увеличение дисперсности приводит к увеличению роли поверхностных явлений в системе.
В химической технологии, такие про- цессы и явления, как дробление, растворение, кристаллизация, флотация, гетерогенный катализ основаны на глубоком изучении поверхностных явлений.
Признаки объектов коллоидной химии: гетерогенность и дисперсность
Гетерогенность указывает на качественную сторону объектов коллоидной химии - наличие межфазной поверхности и качество этой поверхности. Дисперсность или раздробленность является количественным признаком объектов коллоидной химии. Применяются следующие количественные параметры раздробленности: размер частиц a , дисперсность D, удельная поверхность S, диаметр частицы d
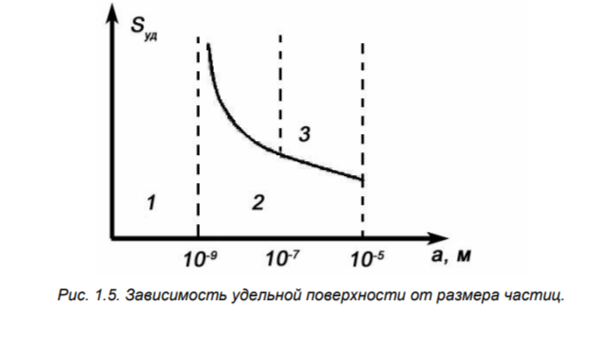
Классификация дисперсных систем по размерам частиц дисперсной фазы
истинные растворы (< 10-9 м)
ультрадисперсные (коллоидные) (10-9 - 10-7 м)
микрогетерогенные (10-7 - 10-5 м)
грубодисперсные (>10-5 м)
График sуд = f(a) – гиперболический, асимптотически приближается к 10-9 м, при уменьшении размера частиц граница раздела фаз исчезает, и система становится гомогенной.
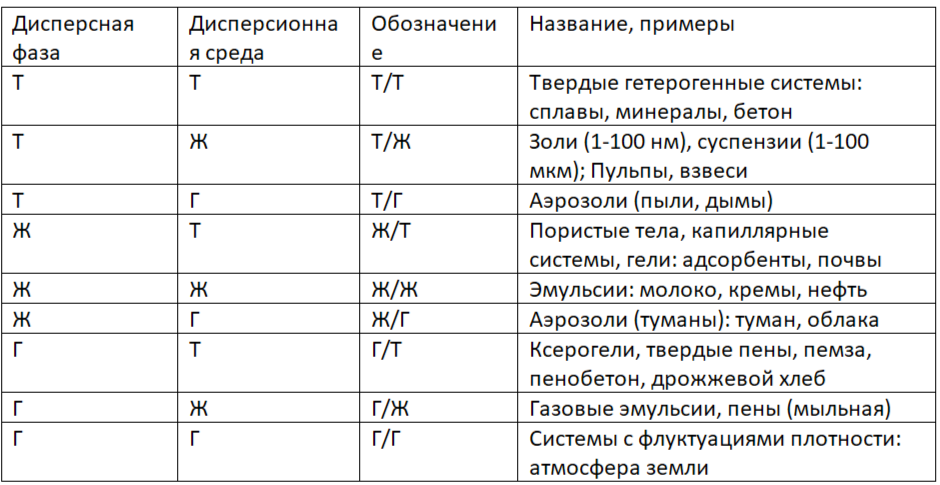
Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
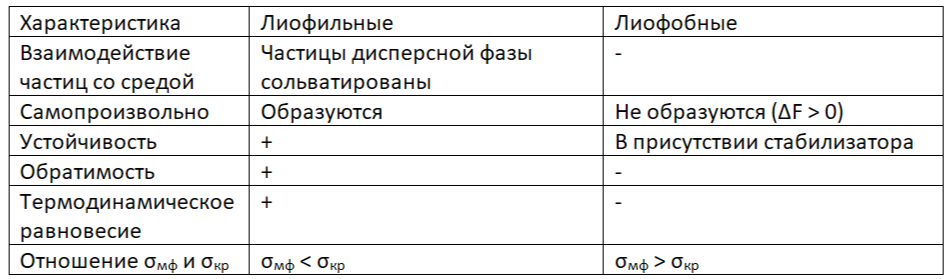
Классификация дисперсных систем по взаимодействию дисперсной фазы и дисперсионной среды
Лиофильные – фаза и среда хорошо взаимодействуют. Лиофобные – фаза и среда плохо взаимодействуют.
Классификация дисперсных систем по взаимодействию частиц дисперсной фазы
Свободнодисперсные: частицы дисперсной фазы не взаимодействую друг с другом, система пластичная, текучая, бесструктурная: эмульсии, разбавленные суспензии, золи, аэрозоли.
Связнодисперсные (пористые): частицы взаимодействуют друг с другом, система структурирована, имеет прочность: концентрированные эмульсии, порошки, высококонцентрированные суспензии.
Общие причины отличия состояния поверхностного слоя от объемных фаз. Изменение плотности свободной энергии на границе раздела в лиофобных и лиофильных системах.
Удельная внутренняя энергия слоя отличается от объемных фаз, так как в фазах взаимодействуют одинаковые молекулы, а в поверхностном слое – разные.
2. Взаимодействие молекул в поверхностном слое происходит в несимметричном силовом поле: при увеличении поверхности происходит вывод молекул из объема на поверхность, при этом затрачивается работа против межмолекулярных сил: . Эта работа равна увеличению поверхностной энергии Fs. Плотность свободной энергии в объемных фазах и поверхностном слое различна.
Вследствие избытка свободной поверхностной энергии происходит изменение концентрации компонентов в поверхностном слое, его состав отличается от состава фаз.
В поверхностном слое концентрируется компонент, уменьшающий избыток свободной поверхностной энергии.
Значения удельной энтропии межфазного слоя и фаз различны.
При контакте газа с жидкостью или твердым телом поверхностный слой разрыхлен. Из-за возможности выхода молекул в менее плотную фазу их число степеней свободы увеличено, поэтому Sудs > Sудβ. При контакте жидкости с твердым телом происходит ориентация молекул жидкости, энтропия уменьшается,
Sудs < Sудβ.
Поверхностное натяжение, его определения и размерности
1. Поверхностное натяжение - это изменение свободной энергии поверхностного слоя, приходящееся на единицу увеличения поверхности.
2. Поверхностное натяжение - это обратимая изотермическая работа образования единицы поверхности, которая затрачивается на преодоление сил межмолекулярного взаимодействия и переходит в свободную поверхностную энергию.
3. Поверхностное натяжение есть частная производная от любой характеристической функции по площади межфазной поверхности при постоянных соответствующих параметрах.
4. Поверхностное натяжение – сила, действующая на единицу длины контура, направленная тангенциально к нему и стремящаяся этот контур сократить.
Размерности:
Дж/м2=(Н*м)/м2=Н/м
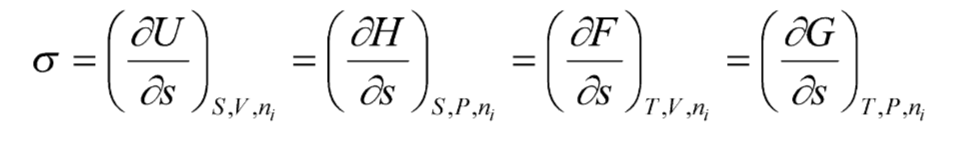
Интенсивные и экстенсивные свойства гетерогенных систем. Примеры
Интенсивными свойствами называются такие свойства, которые выравниваются при составлении сложной системы из более простых систем, численные значения этих свойств не зависят от количества вещества.
К интенсивным свойствам относится:
давление, температура, химический потенциал, удельная энергия или плотность энергии
Экстенсивными называются такие свойства, которые при составлении сложной системы из более простых систем суммируются, численные значения зависят от количества вещества.
К экстенсивным свойствам относятся:
масса, объем, поверхность, количество любого компонента, внутренняя энергия, свободная энергия, энтропия
Метод избыточных величин Гиббса.
Основные положения метода:
Поверхность разрыва – поверхностный слой – неоднородный тонкий слой, разделяющий объемные фазы и обладающий конечной толщиной и объемом. При переходе от реальной системе к идеальной поверхностный слой заменяется на разделяющую поверхность, проводимую внутри слоя.
Разделяющая поверхность – математическая поверхность, воспроизводящая форму поверхности разрыва и располагающаяся параллельно ей: на ней происходит разрыв непрерывности в плоскостях m, F, S, n(состав). Каждая точка вещества на поверхности находится в одинаковых условиях (эквипотенциальна). Положение поверхности фиксируется.
Фазы α и β включают часть поверхностного слоя и считаются однородными вплоть до разделяющей поверхности.
Все изменения термодинамических параметров в слое относят к разделяющей поверхности, не имеющей объема и толщины.
Разность между экстенсивными величинами реальной и идеальной систем – избыточная величина, относимая к разделяющей поверхности.
Вывод фундаментального уравнения Гиббса для свободной энергии системы с плоской границей раздела фаз

Вывод фундаментального уравнения Гиббса для свободной энергии плоского поверхностного слоя, его анализ

Анализ фундаментального уравнения Гиббса для свободной энергии плоского поверхностного слоя

Понятие об адсорбции. Причины адсорбции. Количественные характеристики адсорбции
Адсорбция – процесс выравнивания химических потенциалов компонентов между поверхностью и объемом, приводящий к изменению концентрации на поверхности.
Причина адсорбции - уменьшение свободной поверхностной энергии в гетерогенной системе.
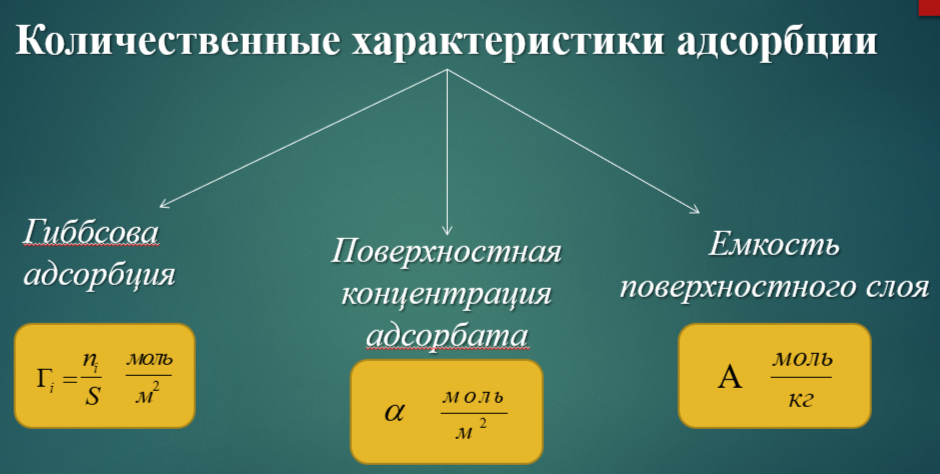
Количественные характеристики адсорбции:
Гиббсовская, или абсолютная адсорбция Гi – избыточная концентрация i-го компонента, рассчитанная на единицу площади разделяющей поверхности
Поверхностная концентрация адсорбата α – общая концентрация вещества в поверхностном слое, рассчитанная на единицу площади, моль/м2. При малых концентрациях адсорбата Г и α совпадают, при больших – различаются.
Емкость поверхностного слоя а – общее количество вещества в поверхностном слое на единицу массы, моль/кг.
Вывод адсорбционного уравнения Гиббса для разбавленных растворов

Анализ адсорбционного уравнения Гиббса для разбавленных растворов
Поверхностная активность по Ребиндеру. Графическое определение поверхностной активности.

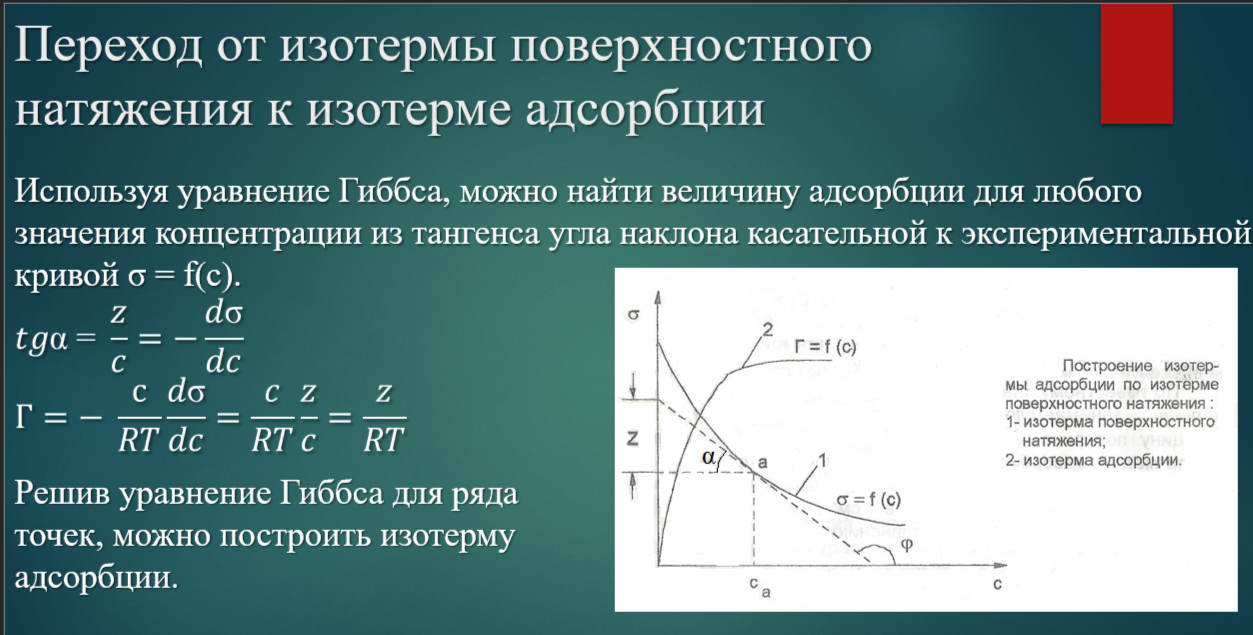
Переход от изотермы поверхностного натяжения к изотерме адсорбции графическим методом
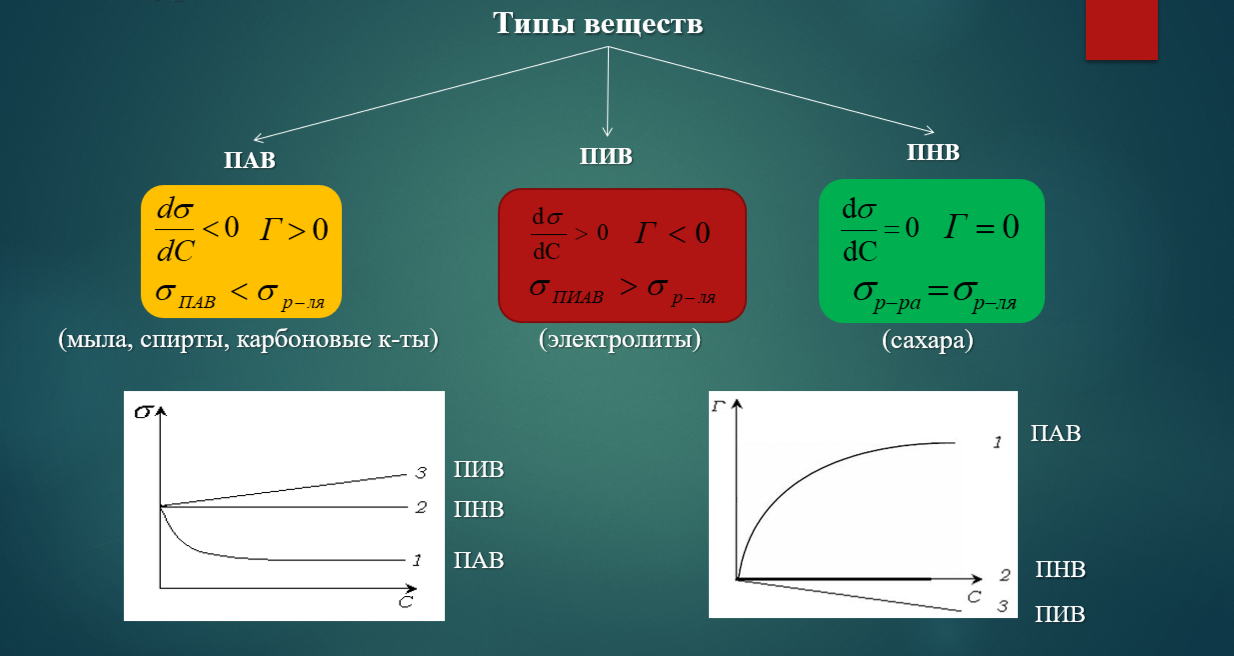
Влияние на адсорбцию на границе раствор-газ строения и размера молекул ПАВ.
ПАВ состоят из полярной и неполярной частей, то есть они дифильны. Молекулы растворителя сильнее взаимодействуют между собой, чем с молекулами растворенного вещества, поэтому последним энергетически выгоднее находиться не в объеме, а на поверхности, т.е. ПАВ концентрируются на поверхности (Г > 0), а поверхностное натяжение раствора уменьшается по сравнению с чистым растворителем: σр-р < σo
Правило Траубе, его аналитическое выражение и физическое обоснование.
Правило Траубе: при увеличении в гомологическом ряду алифатических ПАВ длины цепи на одну группу CH2 поверхностная активность увеличивается в 3,2 раза.
Правило Траубе относится только к границе водный раствор - воздух.
Сущность правила Траубе: работа адсорбции на группу CH2 постоянна и равна 690 калорий на моль этой группы.
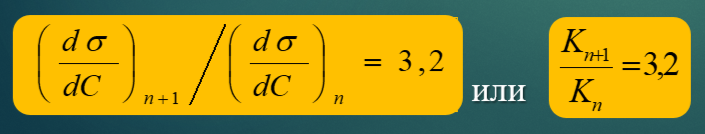
Уравнение Шишковского

Построение изотермы адсорбции по изотерме поверхностного натяжения расчетным путем с помощью уравнения Шишковского
Определив графически константы уравнения Шишковского, вычисляют константы уравнения Ленгмюра и строят изотерму адсорбции

Связь с помощью уравнения Шишковского уравнений Ленгмюра и Гиббса

Строение адсорбционных пленок на жидкой поверхности.
Пленки ПАВ, образующиеся на поверхности воды, могут находиться в трех агрегатных состояниях: твердом, жидком, газообразном.
Агрегатное состояние пленки зависит от концентрации ПАВ и длины углеводородного радикала. Взаимодействие молекул ПАВ на поверхности приводит к возникновению поверхностного давления.
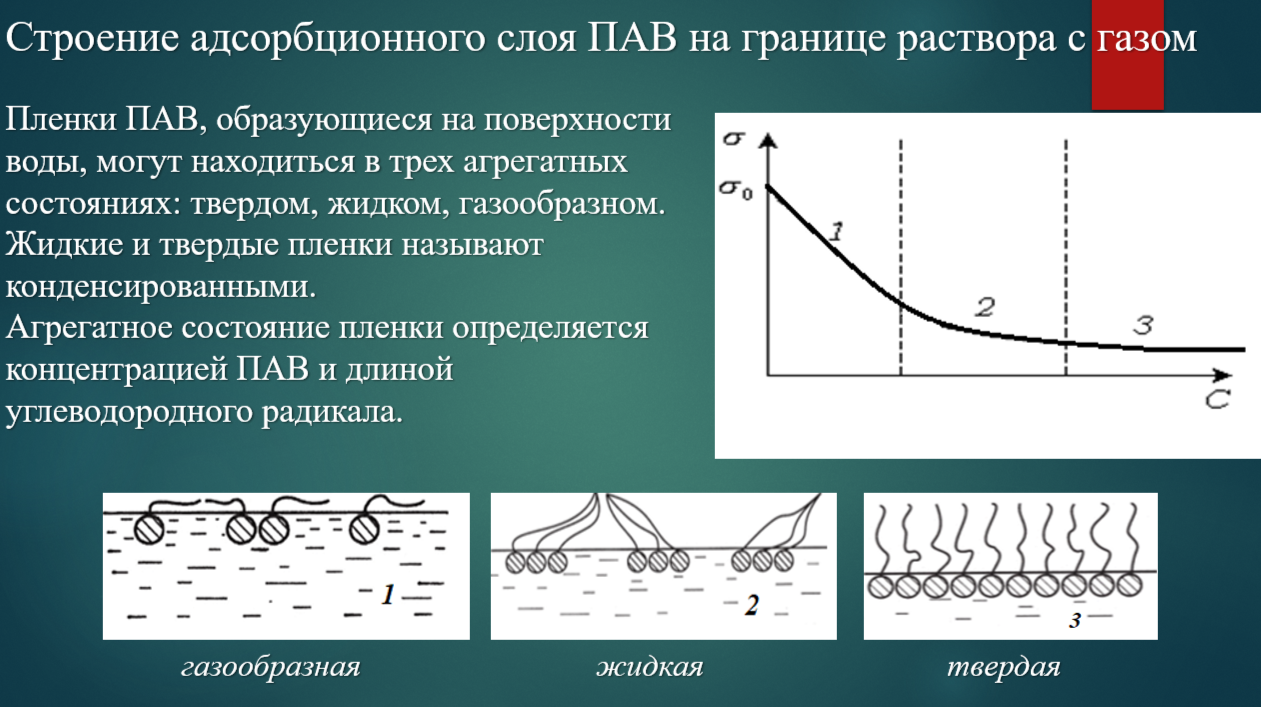
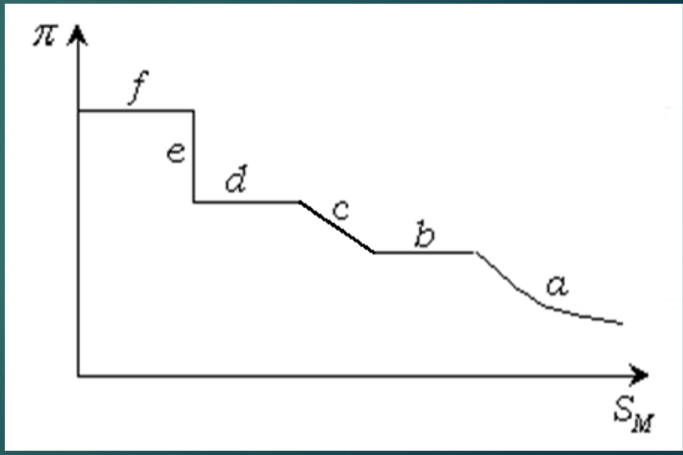
Диаграммы состояния поверхностных пленок.
Фазовое состояние поверхностных пленок описывается диаграммой состояния, или изотермой сжатия, которая построена в координатах π – SM.
Участок a – двумерный газ, кривая сжатия газа.
Участок b – конденсация, растянутая жидкая пленка.
Участок c – сжатие пленки.
Участок d – фазовый переход, е – конденсированная твердая пленка.
Участок f – разрушение мономолекулярной пленки.
Вывод уравнение состояния двухмерного газа.

Уравнение Фрумкина для реального двухмерного газа.

Адсорбция на границе твердое тело - газ.
В адсорбционном слое молекулы газа способны к перемещению лишь в двух измерениях, поэтому адсорбция газа сопровождается уменьшением энтропии, ΔS < 0. Условием протекания адсорбции как самопроизвольного процесса является уменьшение энергии Гиббса: ΔG < 0 . Из термодинамической зависимости ΔG = ΔH – TΔS следует, что теплота адсорбции должна быть отрицательной, т. е. адсорбция газов или паров на твердом теле всегда является экзотермическим процессом.
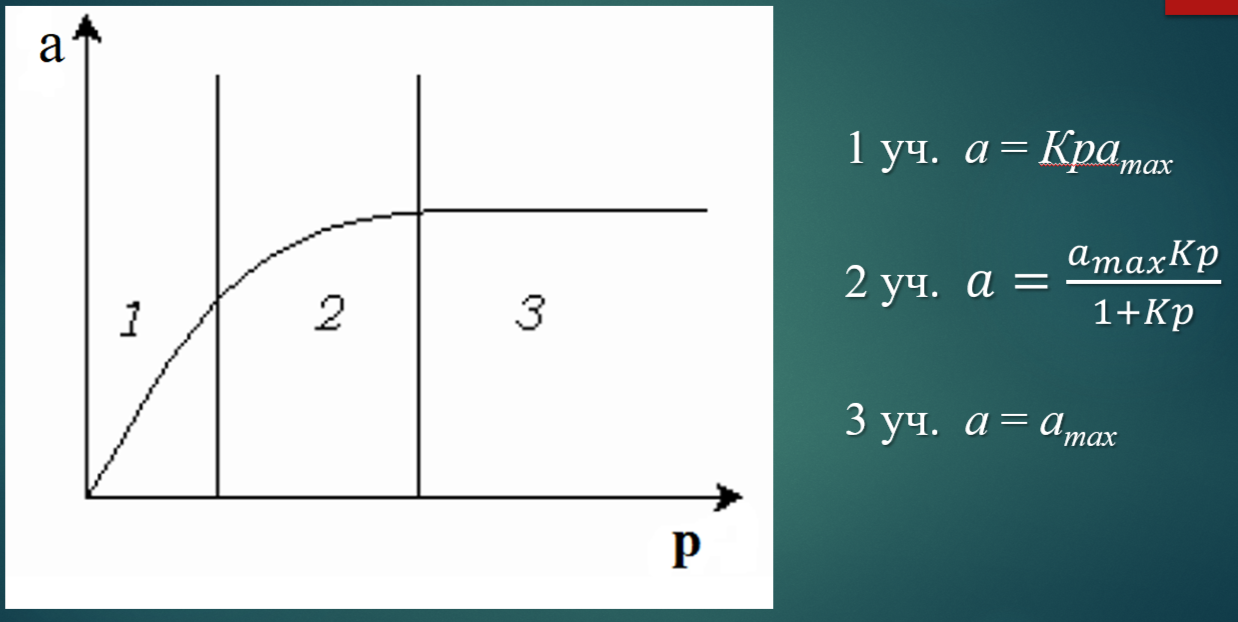
Теория мономолекулярной адсорбции Ленгмюра.
Адсорбция локализована, адсорбционные силы близки к химическим;
Адсорбция происходит на активных центрах адсорбента, энергетически эквивалентных;
Радиус действия адсорбционных сил мал, один активный центр адсорбирует одну молекулу адсорбата, образуя мономолекулярный адсорбционный слой;
Устанавливается динамическое равновесие адсорбция <-> десорбция;
Между адсорбированными молекулами отсутствует взаимодействие, вследствие чего время пребывания на поверхности не зависит от занятости соседнего активного центра.
Адсорбция рассматривается как квазихимическая реакция
м-ла газа + активный центр <-> адсорбц. комплекс
Вывод уравнения изотермы мономолекулярной адсорбции Ленгмюра.
Физический смысл констант уравнения Ленгмюра: Amax – максимальная адсорбция при образовании мономолекулярного слоя, или емкость монослоя; K – константа адсорбционного равновесия.

Анализ уравнения изотермы мономолекулярной адсорбции Ленгмюра.
Линейная форма уравнения Ленгмюра.
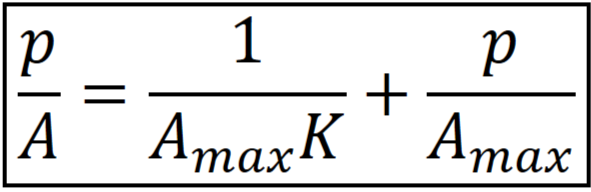
Нахождение констант уравнения Ленгмюра графическим методом.
Строят график в координатах p/A = f(p). Котангенс наклона – Amax, а отрезок, отсекаемый на ординате, будет равен величине 1/(Amax*K).
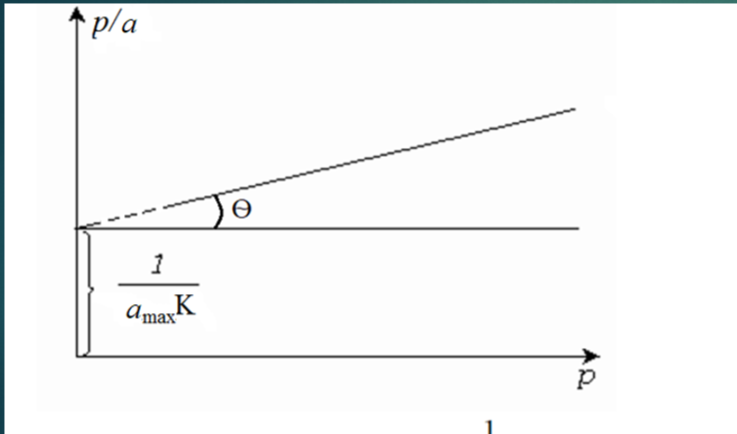
Определение удельной поверхности адсорбента.
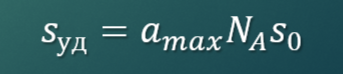
Адсорбция как обратимый экзотермический процесс. Интегральная и дифференциальная теплота адсорбции.
Интегральная теплота адсорбции – общее количество тепла, выделившееся при адсорбции данного количества адсорбата на 1 кг адсорбента:
Зависимость интегральной теплоты адсорбции от величины адсорбции не линейна, так как поверхность адсорбента энергетически неоднородна: сначала адсорбция идет в более активных центрах с бОльшим выделением тепла, затем оно снижается.Дифференциальная теплота адсорбции – тепло, выделившееся при дополнительной адсорбции малого количества адсорбата в расчете на моль адсорбата. Дифференциальная теплота характеризует не весь процесс адсорбции, а некоторую его стадию.
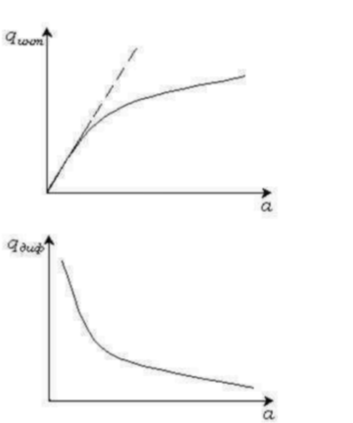
Сравнительная характеристика физической адсорбции и хемосорбции
Кривые потенциальной энергии для физической адсорбции и хемосорбции
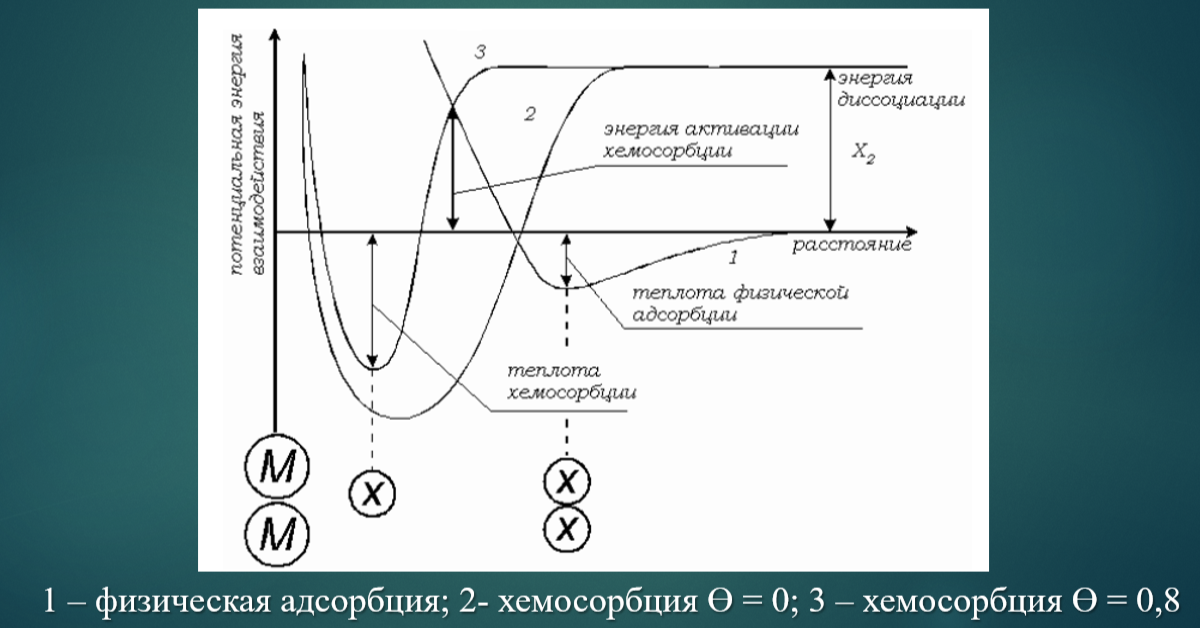
Природа адсорбционных сил.
Физическая адсорбция происходит под действием Ван-дер Ваальсовых сил межмолекулярного взаимодействия, которое складывается из ориентационных, индукционных и дисперсионных сил.

Уравнение Леннард – Джонса.
Полная энергия межмолекулярного взаимодействия описывается уравнением Леннарда-Джонса, где C – константа электромагнитных характеристик частиц, B – константа борновского отталкивания, происходящего при перекрывании электронных орбит, r – расстояние между центрами частиц
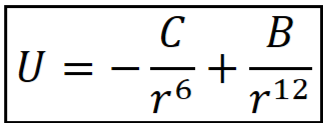
Теория полимолекулярной адсорбции БЭТ
Теория Брунауэра, Эммета и Теллера:
На поверхности адсорбента имеются активные центры.
Взаимодействием молекулами адсорбата в слое пренебрегают.
В отличие от теории Ленгмюра, адсорбция рассматривается как многослойная, и допускается, что молекулы адсорбата на поверхности взаимодействуют с молекулами адсорбата в объеме.
состояние молекул во втором и последующих слоях подобно жидкости и отличается от i-го слоя.
Теплота адсорбции первого слоя есть теплота адсорбции Qад, а теплоты адсорбции всех последующих слоев одинаковы и равны теплоте объемной конденсации L<Qад.
Полимолекулярная адсорбция рассматривается как протекание множества химических реакций: Молекула газа + свободный активный центр ↔ единичный адсорбционный комплекс
Молекула газа + единичный адсорбционный комплекс ↔ двойной адсорбционный комплекс
Уравнение изотермы адсорбции БЭТ, его анализ
где αмакс – емкость монослоя, pi – давление насыщенного пара при данной температуре. Данное уравнение описывают всю изотерму полимолекулярной адсорбции.
При p/ps <<1 и C>>1, 1-p/ps≈1 уравнение переходит в уравнение Ленгмюра
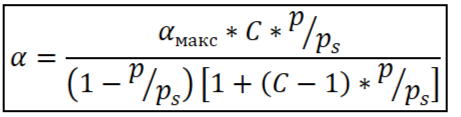
Линейная форма уравнения БЭТ.
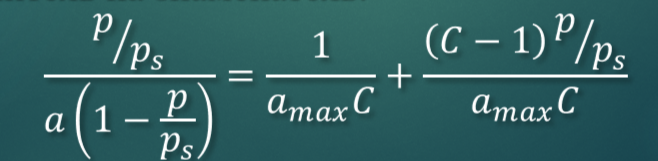
Нахождение констант уравнения БЭТ графическим методом. Определение удельной поверхности адсорбента.
Удельная поверхность в теории БЭТ: sуд=αмакс*Na*s0

Кинетика адсорбции. Динамическое уравнение адсорбции.
Кинетические закономерности адсорбции определяют скорость установления адсорбционного равновесия или скорость адсорбции. При столкновении с поверхностью, молекула либо отражается от нее под углом равном углу падения, либо некоторое время остается на поверхности, затем десорбируется. Чем больше времени молекула находится на поверхности, тем дольше устанавливается равновесие.
Динамическое уравнение адсорбции: a=nτ.
где a - величина адсорбции, τ врея пребывания молекулы на поверхности, n - число молекул, контактирующих с поверхностью.
Кинетические кривые адсорбции при разных температурах.
Скорость процесса адсорбции зависит от скорости двух процессов: диффузии адсорбтива к поверхности и собственно адсорбции.
С ростом температуры скорость адсорбции растет, а равновесная адсорбция уменьшается вследствие активизации процесса десорбции.
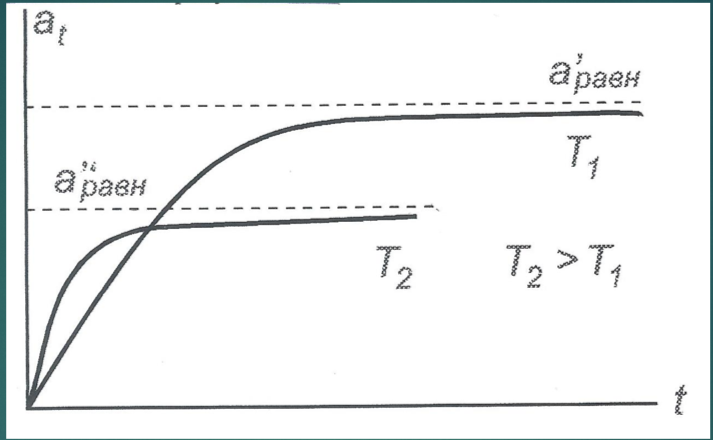
Уравнение Френкеля.
где τ0 – константа равная периоду колебаний атомов в решетке адсорбента, порядка 10-13 с, qa – молярная теплота адсорбции
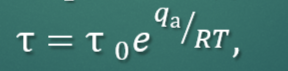
Явления, наблюдаемые при взаимодействии видимого света с веществом
Гомогенные системы — прохождение света,
Наноразмерные (коллоидные) системы, (a < λ) — рассеяние света
Микрогетерогенные и грубодисперсные (a > λ и a >> λ) — преломление и отражение света
Помимо этого все системы могут поглощать свет - абсорбция света
Виды рэлеевского рассеяния света и его условия. Физическая сущность рассеяния света.
Рассеяние – преобразование светового потока одного направления в световые потоки разных направлений.
Рассеяние мутными средами. При рэлеевском рассеянии среда является оптически неоднородной, распространение света сопровождается его рассеянием вследствие различия показателей преломления. Рассеяние мутными средами является интенсивным.
Молекулярное рассеяние – характерно для истинных растворов и газов. Оно происходит за счет флуктуации плотности в газах и жидкостях, флуктуации концентрации в растворах. Рассеяние света коллоидными системами приводит к мутности, наблюдаемое в виде эффекта Тиндаля.
Условия рэлеевского рассеяния: λ = const, отсутствует поглощение.
Уравнение Рэлея, условия его применения
Условия применимости:
дисперсионная среда химически не взаимодействует с дисперсной фазой;
частицы дисперсной фазы сферической формы;
n0 ≠ n1;
d < λ;
чтобы исключить или минимизировать вторичное рассеяние - разбавленные коллоидные растворы;
частицы не проводят электрический ток, иначе световая энергия переходит в электрическую (фотоэффект), а затем в тепловую.
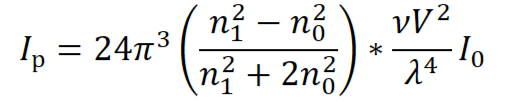
Анализ уравнения Рэлея
в разбавленных коллоидных растворах можно определить численную концентрацию коллоидных частиц.
Уменьшение объема частицы в x раз вызывает уменьшение интенсивности рассеянного света в x2 раз. При коагуляции происходит увеличение объема, а следовательно интенсивности рассеянного света.
При равенстве показателей преломления дисперсной фазы и дисперсионной среды образуются прозрачные, не рассеивающие свет системы
в случае видимого света синие лучше рассеиваются, а красные лучше проходят.
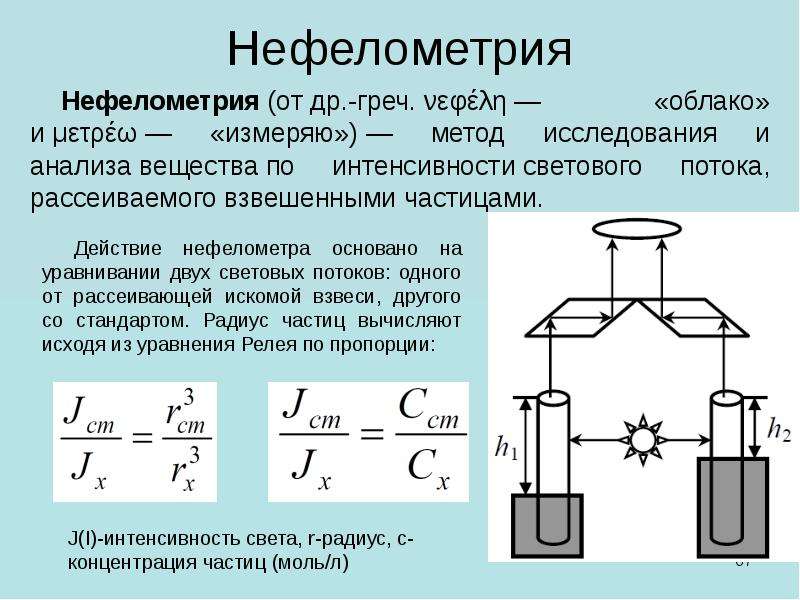
Нефелометрия. Схема нефелометра. Определение размера коллоидных частиц методом нефелометрии.
Методом нефелометрии измеряют непосредственно интенсивность света, рассеянного под некоторым углом к падающему лучу света. Нефелометрия позволяет измерять не только концентрацию и размер частиц, но и их форму и межчастичные взаимодействия.
Турбидиметрия. Определение размера коллоидных частиц методом турбидиметрии.
Метод базируется на фотометрических измерениях, основанных на способности частиц ослаблять интенсивность проходящего света в результате светорассеяния. Используются фотоколориметры, фотоэлектроколориметры, фотометры или спектрофотометры, позволяющие измерить оптическую плотность
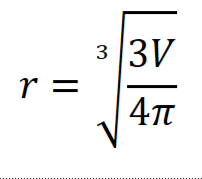
Микроскопия. Предел разрешения светового микроскопа.
Световой микроскоп работает на основе поглощения света. Любой микроскоп характеризуется пределом разрешения δ – минимальным расстоянием между точками, которые различимы при наблюдении в микроскоп.
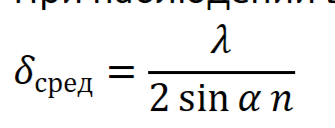
Электронная микроскопия. Предел разрешения электронного микроскопа.
Изображение в электронном микроскопе формируется при помощи электронного пучка. Электрон обладает свойствами и волны, и частицы. Электроны, рассеянные вследствие упругих соударений принимают участие изображения микроскопа.
Принцип темнопольной микроскопии. Щелевой ультрамикроскоп, конденсор темного поля. Определение численной концентрации и размера коллоидных частиц.
В объектив при темнопольном освещении попадает не прямой свет, а свет, рассеянный объектом. Если n дисперсной фазы и дисперсионной среды сильно различаются и освещение достаточно интенсивно, то частицы наблюдаются в виде крупных светлых пятен на темном фоне.
Два технических варианта темнопольного освещения: щелевой ультрамикроскоп и конденсор темного поля. В щелевом ультрамикроскопе образец освещается сбоку интенсивным пучком света от дуговой лампы.
Если образец однороден, в микроскопе будет темное поле, и коллоидный раствор на нем будет виден в виде светлых точек.
Конденсор темного поля – оптическое устройство для получения пустотелого конического пучка света. Световой пучок блокирован круглым экраном, предотвращающим попадание прямого пучка в объектив. Образец помещается в вершине конуса, где интенсивность света максимальна.
Определение размера частиц и их численной концентрации: в окуляр микроскопа вставляют окулярную сетку со стороны ячейки, равной l. Если h – глубина изображения, то объем ячейки l2h, а численная концентрация ν=n/l2h, n – число частиц.
Уравнение Бугера - Ламберта – Бера для истинных растворов.
где I0 – интенсивность падающего света, Iпр – интенсивность прошедшего света, c – концентрация, l – толщина слоя, ε – молярный коэффициент поглощения
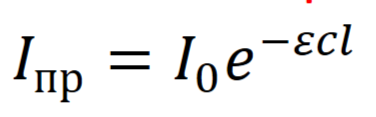
Оптическая плотность, мутность и светопропускание растворов.

Фиктивная абсорбция света в коллоидных системах.
В коллоидных растворах ослабление пучка света проходит не только за счет поглощения, но и рассеяния света, тогда в уравнении БЛБ появляется k – коэффициент ослабления света вследствие рассеяния, фиктивной абсорбции света.
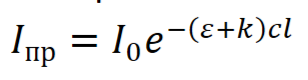
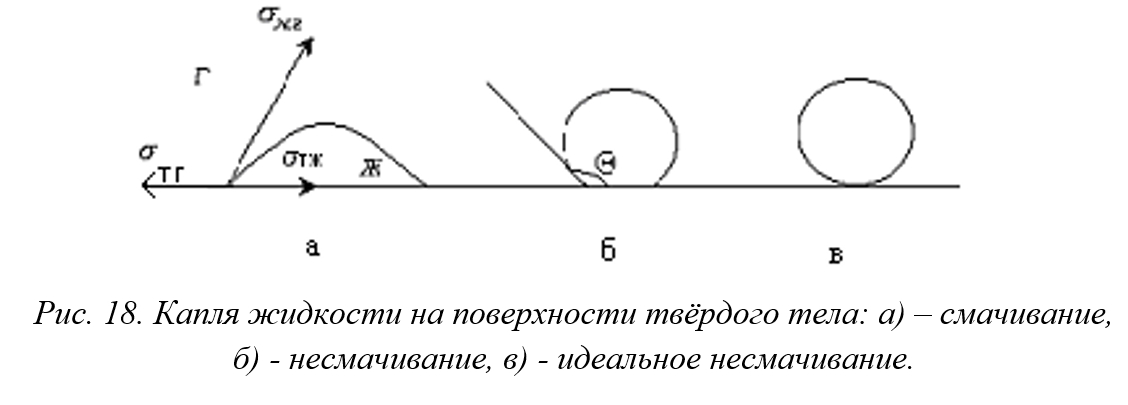
Смачивание
Смачивание - совокупность поверхностных явлений, происходящих на границе раздела трех контактирующих фаз, т.е. на линии трехфазного контакта. Оно зависит от взаимодействия молекул внутри каждой из фаз и между фазами и сопровождается убылью свободной энергии
Краевой угол.
Краевой угол или угол смачивания - равновесный угол, который капля жидкости образует с поверхностью. Он образован твердой поверхностью и касательной в точке соприкосновения трех фаз.
Возможные ситуации:
а) θ < 90° - поверхность смачивается жидкостью; при θ = 0 происходит полное смачивание, жидкость растекается по поверхности;
б) θ > 90° - поверхность не смачивается жидкостью;
в) θ = 180° - полное несмачивание, капля имеет сферическую форму.
Теплота смачивания
Теплота смачивания – изменение энтальпии при взаимодействии жидкости с другой жидкостью или твердым телом. Смачивание – самопроизвольный процесс, идущий с уменьшением поверхностной энергии. Энтальпия системы до смачивания больше энтальпии после, поэтому идет выделение теплоты
Уравнения Юнга. Влияние ПАВ на смачивание.
Условие равновесия, когда капля перестает растекаться, выражается правилом Юнга
ПАВ увеличивают смачивание гидрофобных поверхностей водой, так как снижают поверхностное натяжение, и капля лучше растекается на поверхности.
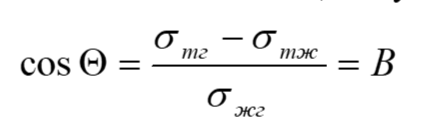
Когезия и адгезия.
Когезия – сцепление молекул в объеме однородного тела. Также под термином когезия понимают идеальную прочность тела.
Адгезия – явление взаимодействия двух разнородных конденсированных фаз, состоящее в приведении их в контакт и в образовании связей между ними за счет сил притяжения
Характер разрушения адгезионного соединения. Условие адгезионного разрушения.
Если разрыв произошел по первоначальной границе раздела, то такой характер разрушения называют адгезионным. Если разрыв произошел по одному из элементов, то такой характер разрушения называют когезионным. При когезионном разрушении разрыв происходит не по межфазной границе, а по менее прочной фазе, часть которой остается на более прочной фазе после разрушения.
Условие разрушения: Pадг < Pког
P - адгезионная прочность, P=F/s; F – значение силы при разрушении, s – площадь контакта
Уравнение Дюпре для работы адгезии.
Работа адгезии тем больше, чем больше поверхностное натяжение исходных компонентов, взятых для образования адгезионного соединения, и чем меньше конечное межфазное натяжение в адгезионном соединении. Работа адгезии характеризует родственность контактирующих фаз
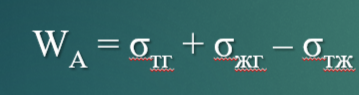
Условие растекания жидкостей.
Условие растекания жидкости выполняется при значении θ = 0, то есть cosθ = 1
Коэффициент растекания по Гаркинсу.
Если коэффициент растекания «+», то жидкость растекается по поверхности, а если «-», то не растекается.
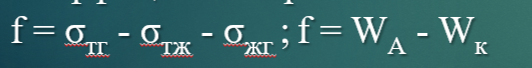
Эффект Марангони
Растекание жидкости с меньшим поверхностным натяжением по поверхности жидкости с большим поверхностным натяжением – эффект Марангони. Под ним понимают течение жидкости по поверхности вследствие градиента поверхностного натяжения, возникающего из-за локальных неоднородностей состава и температуры в разных участках межфазной поверхности. Течение происходит из области малых в область больших поверхностных натяжений.
Связь адгезии и смачивания. Вывод уравнения Дюпре – Юнга, его анализ

Правило Антонова
Межфазная энергия двух жидкостей (σ12) равна разности между поверхностными натяжениями более полярной (σ1) и менее полярной (σ2) жидкостей.
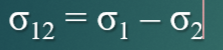
Обращение правила Траубе при адсорбции из водных и углеводородных растворов
Чем меньше растворимость вещества, тем сильнее оно адсорбируется.
При адсорбции из органических жидкостей правило Траубе обращается, т. к. при увеличении длины цепи растворимость увеличивается, а адсорбционная способность уменьшается.
Другой причиной обращения правила Траубе является пористость адсорбента. Мелкие поры становятся недоступными для молекул с длинными углеводородными радикалами, которые не могут туда проникнуть.

Правило уравнивания полярностей Ребиндера.
Процесс адсорбции идет в сторону выравнивания полярностей фаз и тем сильнее, чем больше первоначальная разность полярностей. При выполнении этого условия уменьшается межфазное натяжение и свободная поверхностная энергия, что и является причиной адсорбции.
Правило Ребиндера выполняется только для физической адсорбции и не выполняется для хемосорбции.
Ионная адсорбция.
Микроучастки поверхности, несущие определенный заряд, адсорбируют часть противоположно заряженных ионов, при этом другая часть ионов электролита, несущих противоположный знак, непосредственно не адсорбируется. Эти ионы под действием сил электростатического притяжения остаются вблизи адсорбированных ионов, образуя с ними на поверхности адсорбента так называемый двойной электрический слой.
Влияние радиуса и валентности ионов на величину адсорбции
Чем меньше кристаллохимический радиус иона, тем сильнее гидратирован такой ион и тем хуже он адсорбируется.
Чем больше валентность иона, тем сильнее он притягивается противоположно заряженными микроучастками поверхности, т.е. лучше адсорбируется.
Классификация ПАВ по химическому строению
Анионные – диссоциируют в воде с образованием органического аниона с поверхностной активностью. Содержат гидрофильные функциональные группы -COO-, -SO32-‑, -SO42-.
Катионные – диссоциируют в воде с образованием органического катиона с поверхностной активностью. Содержат гидрофильные функциональные группы -NH3+, -NR3+.
Амфолитные – содержат и кислотную (карбоксильную), и основную (аминную) группы. Свойства зависят от pH среды. К ним относятся аминокислоты и белки.
Неионогенные – содержат гидрофильные функциональные группы -OH, (-CH2-CH2-O-)H. Неионогенные ПАВ растворимы как в кислой, так и в щелочной среде соединениями, не диссоциирующими в воде.
Мицеллообразование, строение мицелл в водной и углеводородной среде
В разбавленных растворах ионные ПАВ ведут себя как нормальные электролиты. При достижении определенной концентрации (ККМ) резко изменяются все физико-химические свойства, что объясняется образованием агрегатов или мицелл ПАВ. Образование мицелл, подобно адсорбции, приводит к уменьшению межфазной энергии раствора ПАВ.
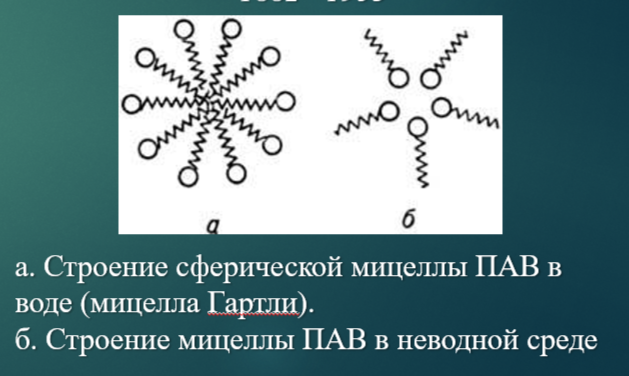
Две модели мицеллообразования.
При квазихимическом подходе мицелла рассматривается как большая молекула, состоящая из многих малых молекул ПАВ. Мицеллообразование можно рассматривать как быструю обратимую квазихимическую реакцию, протекающую по схеме: m (ПАВ) ↔ (ПАВ)m, где m – число агрегации, то есть число молекул в мицелле.
При фазовом подходе мицелла рассматривается как микрофаза, а мицеллообразование – как явление разделения фаз. Однако это не истинное разделение фаз, так как размер мицелл мал по сравнению с макрофазами, и кроме того мицеллы существуют в единстве с окружающей жидкой средой и не могут быть из нее выделены
Термодинамика образования прямых и обратных мицелл.
Причиной мицеллообразования в водной среде являются гидрофобные взаимодействия. Вода стремится к выталкиванию гидрофобных тел, т.к. они нарушают структуру воды и увеличивают свободную энергию системы. Изменение энтальпии незначительно, определяющее значение имеет изменение энтропии. Энтропия молекул ПАВ в данном процессе уменьшается, следовательно движущей силой мицеллообразования является значительное увеличение энтропии воды при переходе углеводородных радикалов в ядро мицеллы.
Мицеллообразование в неполярных средах имеет энергетическую природу. Она заключается в выгодности замены связи полярная группа – углеводород при молекулярном растворении, на связь полярная группа – полярная группа в ядре мицеллы.
Критическая концентрация мицеллообразования (ККМ). Методы определения ККМ.
Критическая концентрация мицеллообразования (ККМ) – концентрация ПАВ, выше которой начинается образование мицелл.
На графике в осях C – свойство в области ККМ происходит перегиб свойств.
Методы определения ККМ основаны на регистрации резкого изменения физико-химических свойств растворов ПАВ в зависимости от концентрации: поверхностного натяжения σ, мутности τ, эквивалентной электропроводимости λ, осмотического давления π, показателя преломления n).
Влияние различных факторов на величину ККМ.
все факторы приводящие к улучшению растворимости ПАВ в данном растворителе повышают ККМ, наоборот, все факторы приводящие к ухудшению растворимости – снижают ККМ.
Величина ККМ зависит от:
Длины углеводородного радикала. Чем больше углеводородный радикал, тем выше склонность к мицеллообразованию и поверхностная активность, и тем меньше ККМ.
Строения углеводородного радикала. Наличие ароматических циклов, кратных связей и гетероатомов уменьшает гидрофобность радикала и повышает ККМ.
Добавки электролитов. Введение электролитов в раствор ПАВ уменьшает гидратацию полярных групп ионов ПАВ и подавляет диссоциацию ПАВ
Для неионогенных ПАВ добавление электролитов слабо влияет на ККМ и размер мицеллы.
Полярных органических веществ. Длинноцепочечные спирты уменьшают ККМ, возрастает размер мицелл и вязкость раствора, что объясняется образованием смешанных мицелл ПАВ+спирт. Низкомолекулярные добавки (метанол, ацетон) понижают ККМ за счет их хорошей растворимости.
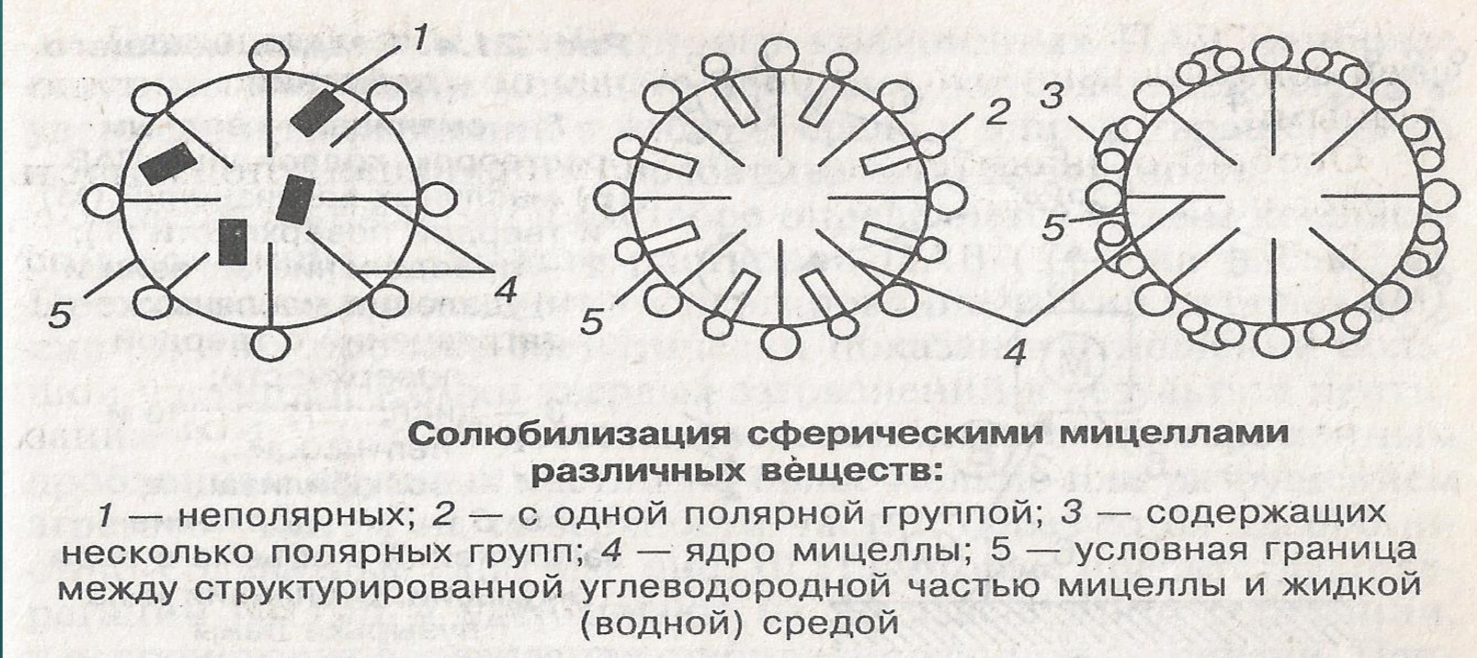
Солюбилизация в растворах мицеллообразующих ПАВ.
Солюбилизацией называется растворение в мицеллах ПАВ веществ нерастворимых в данном растворителе.
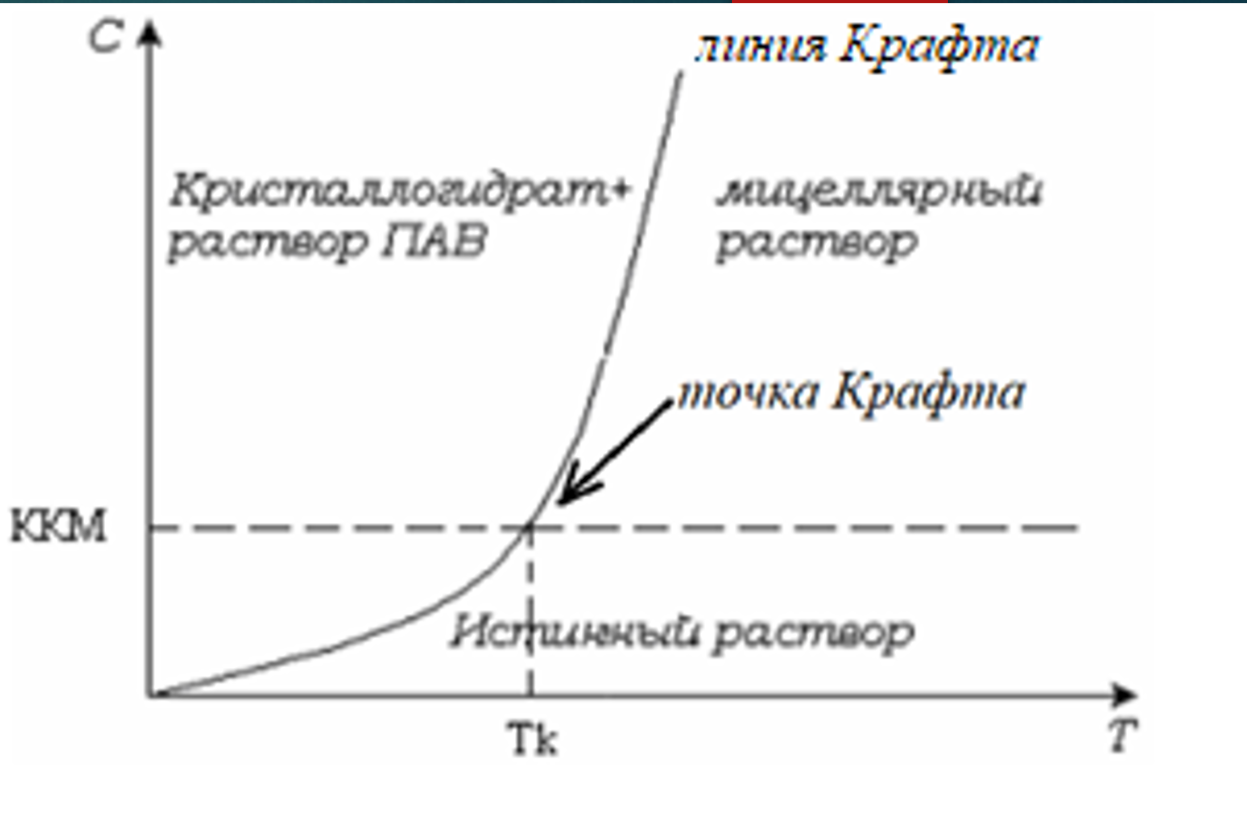
Влияние температуры на растворимость ионогенных ПАВ. Диаграмма состояния системы. Точка Крафта.
Растворимость ионогенных ПАВ в воде увеличивается с ростом температуры. Их фазовое состояние определяется точкой Крафта.
Влияние температуры на растворимость неионогенных ПАВ. Точка помутнения и точка высаливания.
Растворимость неионогенных ПАВ уменьшается с повышением температуры. Связано это с тем, что растворимость таких ПАВ обусловлена образованием гидратов.
При нагревании происходит дегидратация молекул ПАВ, т.е. уменьшение их растворимости, что приводит к агрегации молекул и к появлению опалесценции, а затем и к помутнению раствора. Это состояние характеризуется точкой или температурой помутнения. При дальнейшем нагревании этого раствора происходит укрупнение частиц вплоть до выделения капелек ПАВ в виде отдельной фазы, то есть происходит их “высаливание” из раствора, что характеризуется точкой или температурой высаливания
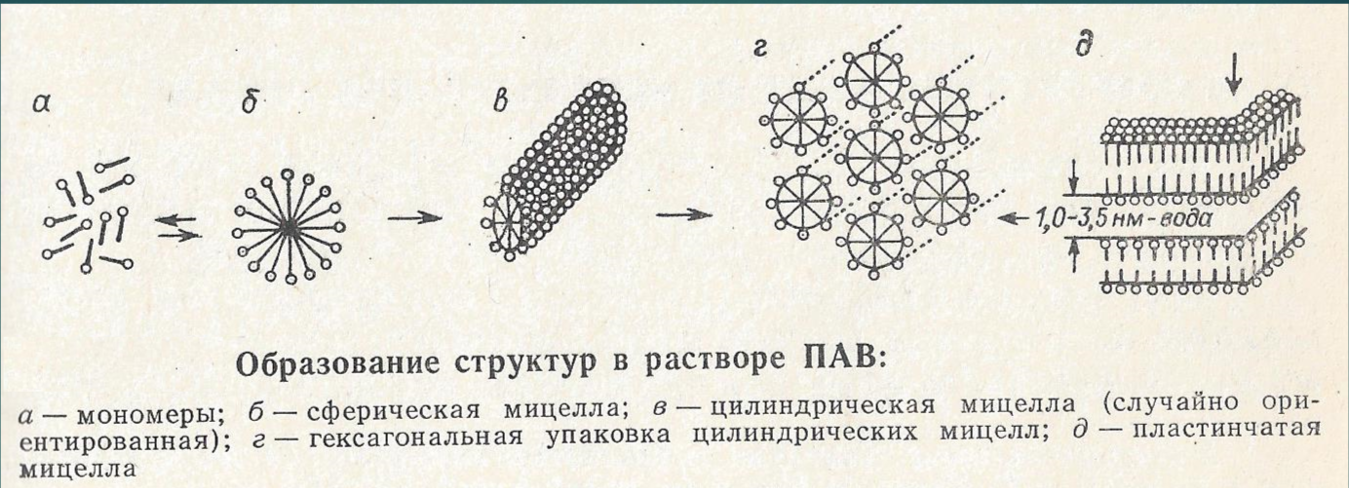
Полиморфные превращения мицелл коллоидных ПАВ. Лиотропные жидкие кристаллы
При достижении ККМ, молекулы объединяются в сферические мицеллы. При переходе к гексагональной упаковке цилиндрических мицелл, раствор становится анизотропным, то есть свойства зависят от направления оптической оси.
Последние два состояния называют лиотропными жидкими кристаллами, так как упорядоченные кристаллоподобные структуры существуют в жидкой среде.
Количественные характеристики свойств ПАВ. Числа ГЛБ. Расчет чисел ГЛБ по методу Дэвиса.
ГЛБ - гидрофильно-липофильный баланс, характеризует соотношение масс гидрофильной полярной группы и липофильного радикала.
Число ГЛБ для данного ПАВ можно рассчитать по аддитивной формуле, зная числа ГЛБ для каждой структурной единицы – метод Дэвиса: ГЛБ ПАВ=7+∑(ГЛБ)Г + ∑(ГЛБ)Л
Методы диспергирования.
Диспергирование - методы получения дисперсных систем, основанные на механических способах преодоления межмолекулярных сил (измельчение, дробление, истирание и т.д.).
Уравнение Ребиндера для работы измельчения.
Работа, необходимая для диспергирования равна сумме работы объемного деформирования тела и работы образования новой поверхности.
К – коэффициент пропорциональности, равный работе объемного деформирования единицы объема конденсированного тела, V – объем тела, σ – поверхностное натяжение, s – площадь межфазной поверхности.

Адсорбционное понижение прочности (эффект Ребиндера).
В основе понижения механических свойств твердых тел под влиянием ПАВ, лежит снижение свободной поверхностной энергии и, как следствие, снижение работы, необходимой на образование новой поверхности.
Прочность как поверхностное свойство материалов.
Реальная прочность твердого тела пропорциональна корню квадратному из величины поверхностной энергии и обратно пропорциональна корню квадратному из длины трещины (соотношение Гриффитса)
Е – модуль Юнга, l – размер трещины,
σ – поверхностное натяжение
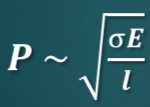
Конденсационное образование лиофобных дисперсных систем.
Конденсация – возникновение новой фазы путем соединения молекул, ионов или атомов в гомогенной среде.
В основе конденсационных методов лежат два процесса:
Возникновение зародышей, являющихся минимальным скоплением новой фазы и находящихся в равновесии с окружающей средой;
Рост зародышей, приводящий к образованию частиц дисперсной фазы
зародыш - минимальное скопление новой фазы, находящееся в равновесии с окружающей средой
Термодинамические основы гомогенного зародышеобразования.
Процесс самопроизвольный, за исключением стадии образования зародышей, т.к. эта стадия сопровождается увеличением свободной поверхностной энергии вследствие образования новой поверхности. После того , как зародыш достигнет определенного размера (rкр), дальнейший процесс совершается самопроизвольно.

Уравнение для работы образования критического зародыша
Работа образования критического зародыша обратно пропорциональна квадрату пересыщения, поэтому для самопроизвольного возникновения новой фазы в гомогенной системе необходимо заметное пересыщение.
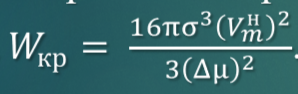
Химические и физические методы создания метастабильности в системе.
Физические – это изменение давления или температуры, например, охлаждение пара, раствора или расплава, замена растворителя.
Химические – основаны на протекании химических реакций, в результате которых образуются слаборастворимые вещества, в случае конденсированных фаз – летучие или наоборот нелетучие при взаимодействии газов.(ОВР, реакции обмена, гидролиз солей)
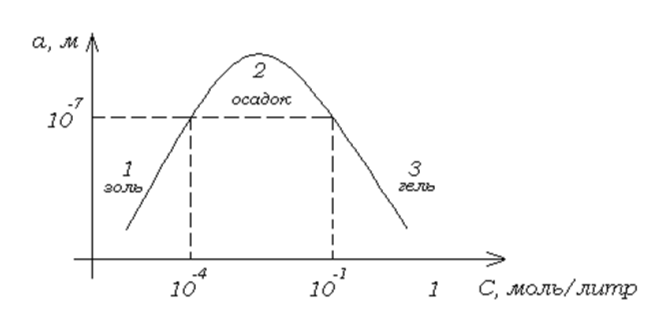
Зависимость размера частиц от различных факторов.
Размеры образующихся частиц зависят от соотношения между скоростями двух одновременно идущих процессов: образования зародышей (нуклеации) Vн и их роста (кристаллизации) Vк.
Область 1 – Vн достаточна, но Vк невелика, так как C небольшая. Образуется золь.
Область 2 – Vк увеличивается, частицы быстро укрупняются и оседают. Образуется осадок.
Область 3 – C вещества дисперсной фазы высока, вязкость возрастает, скорость диффузии вещества из раствора к поверхности зародыша уменьшается. При высокой скорости нуклеации Vн образуется много мелких частиц, соединяющихся друг с другом. Образуется структурированная коллоидная система – гель.
Гетерогенная конденсация
Гетерогенное зародышеобразование происходит при наличии поверхностей, на которых с достаточной скоростью может происходить образование и рост зародышей новой фазы.
Форма некристаллических зародышей будет определяться, тем какая из фаз – новая или исходная – лучше смачивает поверхность включения.
Наличие поверхностей, избирательно смачиваемых новой фазой в присутствии старой, приводит к сильному уменьшению работы образования зародышей и облегчению возникновения новой фазы.
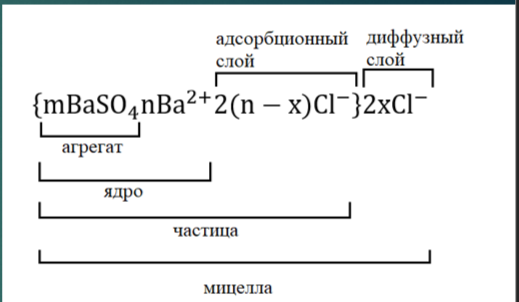
Принципы построения мицелл ионностабилизованных золей.
Агрегат мицеллы должен быть нерастворимым соединением.
Потенциалопределяющим ионом может быть любой ион, способный достраивать кристаллическую решетку нерастворимого соединения (ион входит в состав агрегата/ имеет близкое строение по отношению к ионам кр. решетки/ орг. ион большого размера с высокой адсорбц. способностью).
Противоионы образуют с потенциалопределяющими ионами растворимое соединение.
Мицелла в целом электронейтральна.
Пример мицеллы
На примере реакции хлорида бария с сульфатом натрия:
Избыток одного из компонентов действует как стабилизатор коллоидного раствора - в избытке находится BaCl2. Вначале образуется агрегат мицеллы, являющийся мельчайшим кристалликом.
На поверхности кристалла BaSO4 имеются вакантные места, которые занимают ионы Ba2+, достраивая кр. решетку. Они придают положительный заряд поверхности ядра и называются потенциалопределяющими ионами.
Часть противоионов (n – x), находящихся в непосредственном близости от ядра, связаны с ним помимо электростатических сил адсорбционными силами. Другая часть противоионов x находится на некотором удалении от ядра, образуя диффузионный слой. Таким образом, вокруг мицеллы существует двойной электрический слой, стабилизирующий мицеллу.
Заряды потенциалопределяющих ионов и противоионов полностью скомпенсированы, поэтому мицелла электронейтральна.
Пептизация как физико-химический метод получения коллоидных систем. Механизмы пептизации.
Пептизация – расщепление агрегатов, возникающих в результате обратимой коагуляции дисперсных систем, на первичные частицы под действием внешней среды.
Существует три способа пептизации и все они связаны либо с образованием ДЭС, либо с его восстановлением.
Адсорбционная пептизация. Отталкивание частиц осадка друг от друга вызывается ДЭС, образующимся на поверхности частиц при адсорбции ионов добавляемого электролита-стабилизатора.
Пептизация путем поверхностной диссоциации. Пептизатор способствует процессу диссоциации с поверхности, вызывая образование растворимых соединений на поверхности частиц.
Пептизация путем промывания осадка. Применяется в том случае, когда на поверхности частиц в осадке есть двойные электрические слои, но они сжаты вследствие большой концентрации электролита. При промывании такого осадка водой концентрация электролита в нем уменьшается, двойные слои увеличивают свою толщину; силы электростатического отталкивания между частицами будут действовать на более далеких расстояниях и вызовут коллоидное растворение осадка.
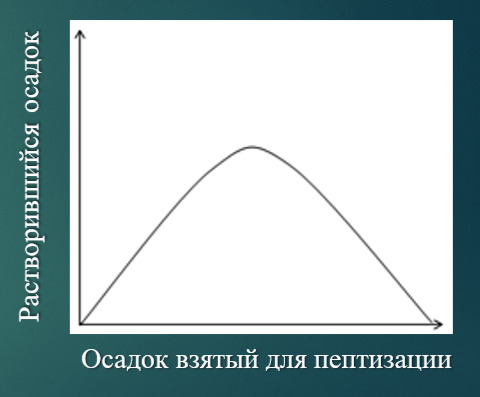
Правило осадков Оствальда
При постоянном содержании пептизатора с возрастанием количества взятого для пептизации осадка количество осадка, перешедшего в раствор, сначала увеличивается, а затем уменьшается.
Для диспергирования необходимо определенное количество пептизатора. С увеличением содержания осадка, доля пептизатора, приходящегося на 1 частицу, уменьшается, поскольку пептизатор перераспределяется между большим количеством частиц. Его перестает хватать для пептизации, поэтому может выпасть ранее диспергированный осадок.
Получение лиофильных коллоидных систем путем самопроизвольного диспергирования.
Образование лиофильных дисперсных систем происходит самопроизвольно, с уменьшением свободной энергии (ΔF < 0). Изменение свободной энергии при самопроизвольном диспергировании: ΔF = ΔU + Δs12 σ12 - TΔS