kyslíkaté deriváty
1/36
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
37 Terms
kyslíkate derivaty
OZ obshaujuce vo svojich molekulach vazbu atomu uhlika s atomom kyslíka
O je vzdy dvojvazbovy: C-O-, C=O
hydroxyderivaty
kyslíkate derivaty uhlovodikov ktore vo svojej molekule obsahuju charakteristicku jednovazbovu hydroxylovu skupinu OH
typy hydroxyzluceniny
alkoholy - -OH viazana na nasyteny alebo nenasyteny uhlovoikovy retazec
fenoly - -OH viazana na aromaticke jadro
rozdelenie hydroxyzlucenin
podla poctu oh skupin: jednosytne, dvojsytne, trojsytne, viacsytne
podla typu C: primarne, sekundarne, terciarne
fyzikalne vlastnosti alkholov
skupenstvo:
nižšie (do 3C) - bezfarebne, prchave kvapapliny, s prijemnou vonou
vyssie - bezfarebne olejovite kvapaliny s neprijemnych zapachom
rozpustnost:
rozpustne v org. rozp.
dobre rozpustadlá
rozpustne vo vode (klesa s rastucim C a OH
Tt, Tv
vyššie ako ich uhlovodiky
VV stažuju prechod z kvapaliny na plyn
fenoly fyz vlastnosti
skupenstvo - bezfarebne krystalicke latky, charaktericticky zapach, na bzduchu sa farbia dp červena až hneda
rozpustnost: málo rozpustne vo vode (prevláda nepolarny charakter benzenu), rozpustne v eteroch a etanole
Tt, Tv - vyssie ako ich uhlovodiky (kvoli VV)
chcemicke vlastnosti alkholov
zavisi od pritomnosti jednej alebo viac -OH skupin
amfoterne zluceniny

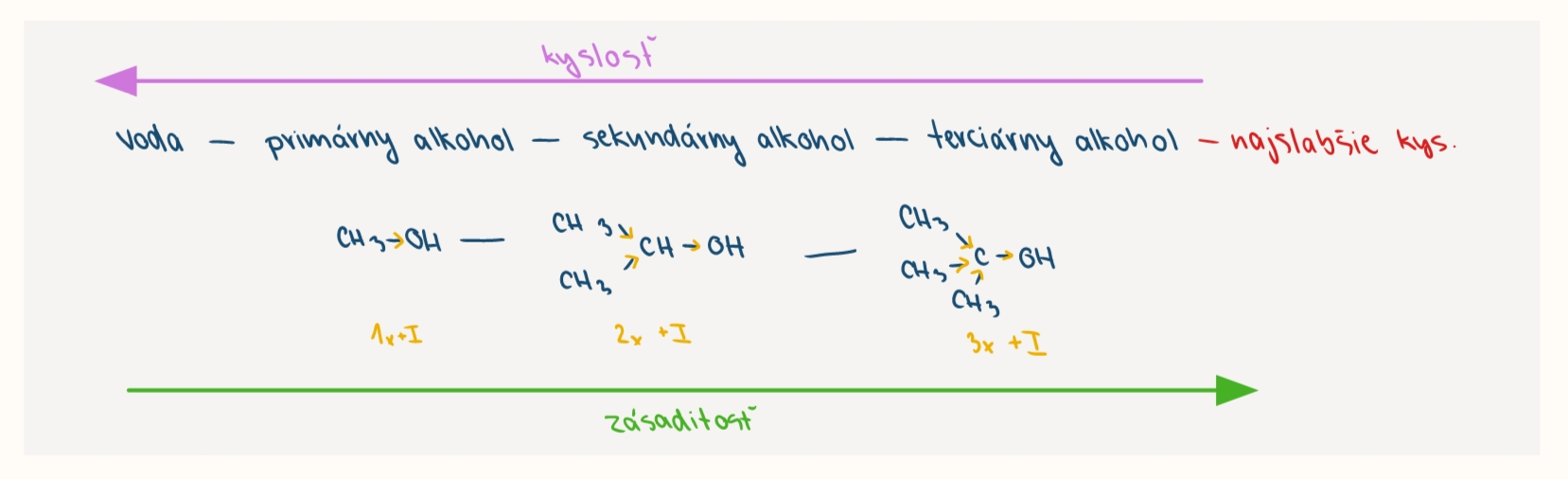
kysle vlastnosti alkoholov
kyslost v porovnani s vodou je nižšia (alkoholy maju nizsiu polaritu vazby O-H)
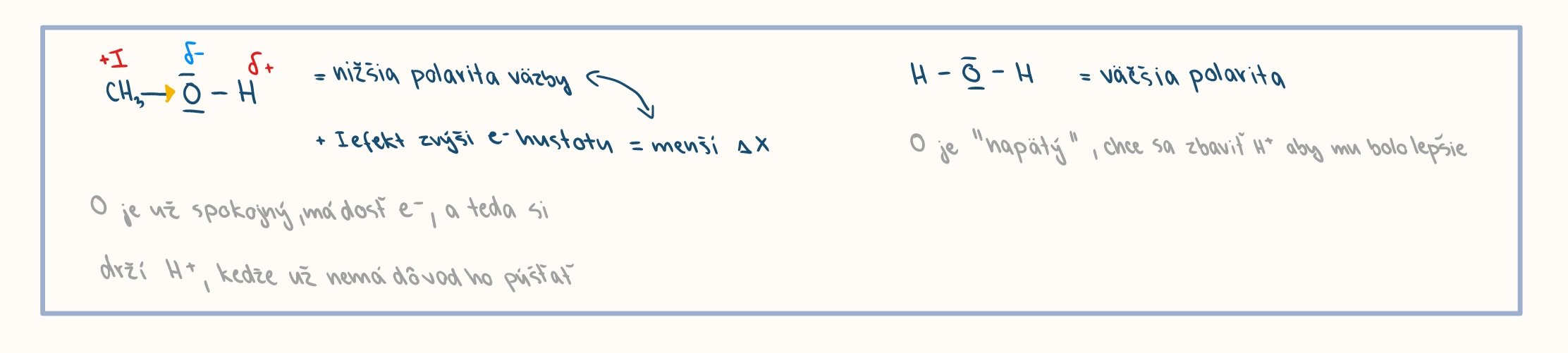
zasadite vlastnosti alkoholov
umožnuje naviazanie protonu na volny e- par na atome kyslika
porovnanie kyslosti a zasaditosti alkholov a vody
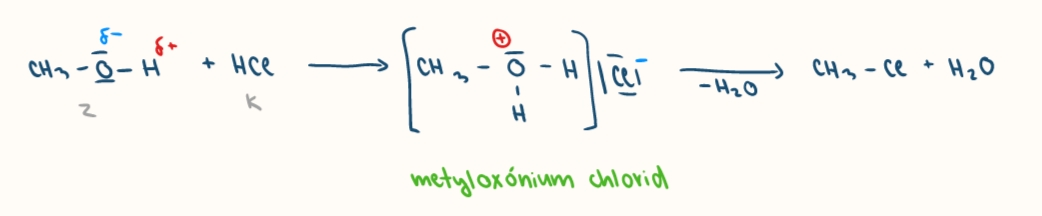
reakcia alkholov s kyselinami
vznika oxoniova sol / alkoxoniove soli
reakcia alkoholov so zasadami
vznika alkoholat, alkoxid
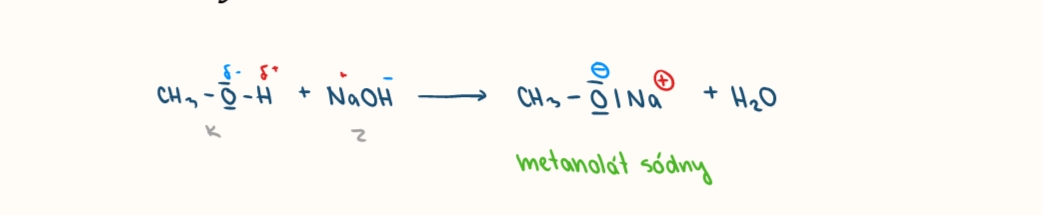
typicke reakcie alkhoolov
reakcia s kyselinami a zasadami, nukleofilne substitucie, eliminacie, oxidacie, esterifikacia
nukleofilne substitucie alkholov
polarity vazby C-O umožnuje atak nukleofilu na atom C
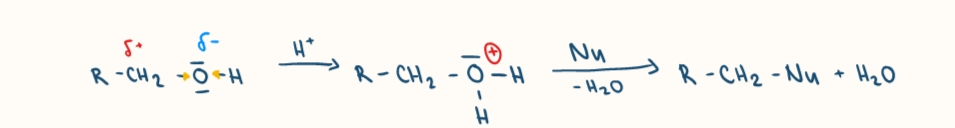
eliminacia alkoholu
dehydratacia - odstiepenie vody
posobenim dehydratacnyh cinidiel (h2so4, al2o3)
vznik alkenov a vody, Zajcevovo pravidlo
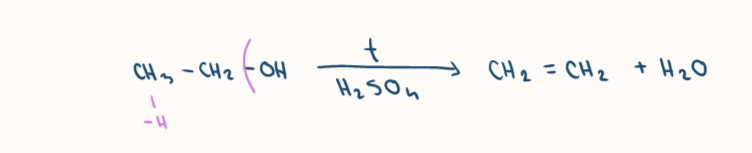
oxidácia alkoholov
oxidacne cinidla kmno4, hclo3 - prosdukt zavisi od struktury alkhoolu
primarne: alkhool - aldehyd - KK
sekundárne: alkhool - keton
terciarne: nereaguju
kysle a zasadite vlastnosti fenolov
silnejsie kyseliny ako alkoholy a voda
jeho kyselost zvysuju elektron akceptorove skupiny (-I) znižuju ju +I skupiny
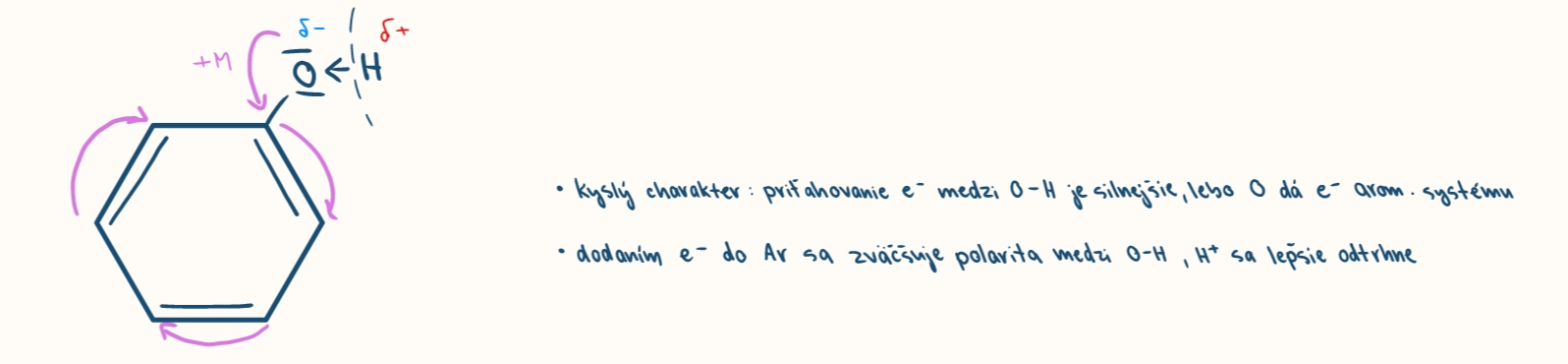
reakcia fenolov so zasadami
vznik fenolatov
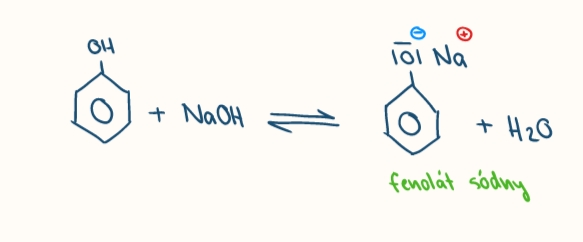
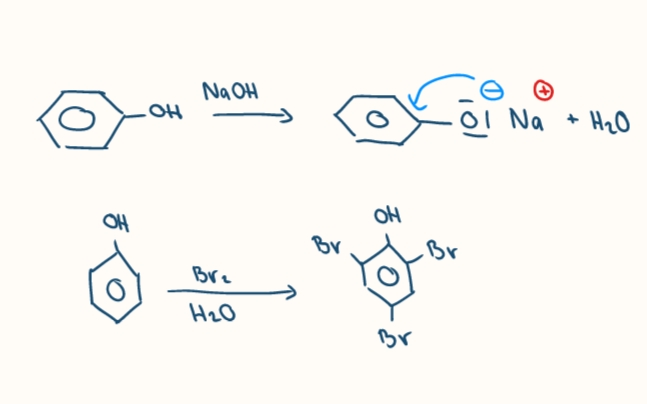
reakcie fenolov
reakcia so zasadami, elektrofilne substitucie (nitrácia), oxidácie, kopulácia
elektrofilne substitucie fenolov
vdaka +M efektu -OH skupiny, elektrofil vstupuje do o a p poloh
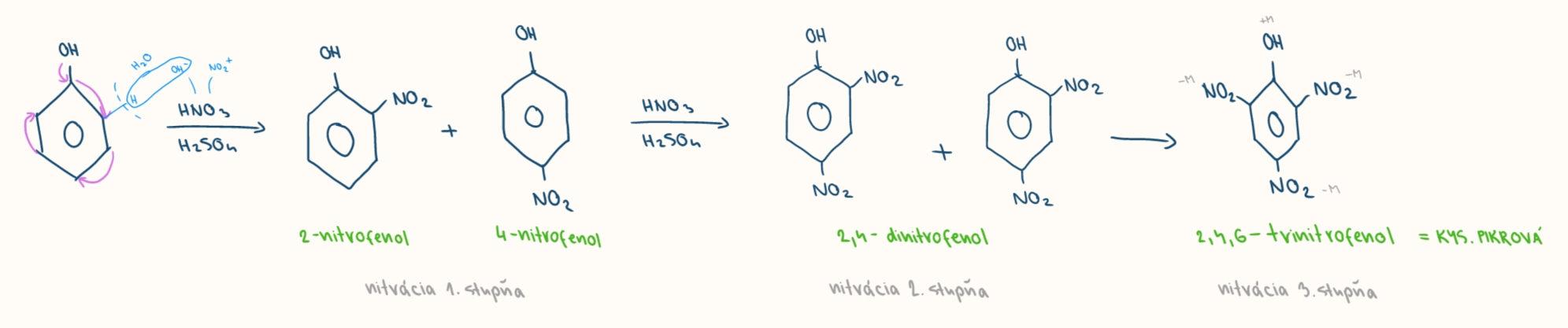
nitracia fenolov
nitracna zmes hno3 + h2so4
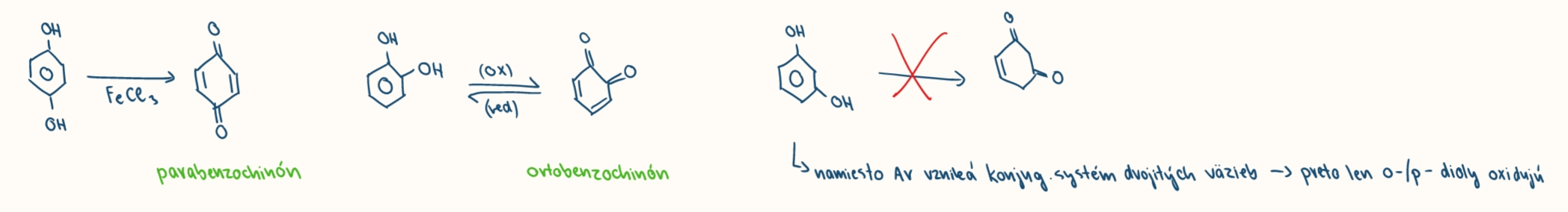
oxidacie fenolov
vplyvom oxidacnych cinidiel (FeX3, V2O5)
prebiehaju lahsie ako oxidacie arenov
vznik chinónov
zánik aromatickosti je kompenzovany vznikom konjugavenho systemu dvojitych vazieb = oxiduju iba orto a para dioly
vplyv alkoholu na ludsky organizmus
skodlivy, može viest k chronickemu alkoholizmu
zhubne nasledky - poskodenie zdravia, rozvrat rodiny…
metanol
bezfarebna kvapalina
toxicky, horlavy, neobmedzene miesatelny s vodou
vyborne rozpustadlo
toxicky pre cloveka - oslepenie až smrť - v pečeni sa metabolizuje na formaldehyc a nasledne na kyselinu mravciu
prvá pomoc: 2 deci 40% etanolu - vytlaci metanol, nepremeni sa
etanol
najvyznamnejsi alkhool
dezinfekcia, vyborne rozpustadlo
dobre rozpustny v tukoch (lahko napada mozgove bunky)
vyroba
alkoholove kvasenie
synteticky hydrataciou etylenu - ma menej necistot ako kvaskovy, neodporuca sa kvasti doma, moze vzniknut jedovaty metanol
nepriaznivy vplyv na cloveka
alhokol v tele odburava alkoholdehydrogenaza
etylenglykol
olejovita skupiny, sladkasta chut
toxicky
nemrznuca zmes, plasty
glycerol
viskozna kvapalina, sladka chut, bez zapachu
nie je toxicky, v rpirodnych tukoch a olejoch
pouzitie: kozmetika, celofán, liečiva, potravinarstvo (zmakcovadlo, sladidlo), dynamit
glyceroltrinitrat
vznika reakciou glycerolu a kyseliny dusicnej
nebepzecne vybusny uz pri anraze
napusteny do hliny vybuchuje az pomocou robušky = zakald dynamitu
jedovaty, v malych mnozstvach ako liecivo
fenol
biela krystalicka latka, na vzduchu scervenie
toxicky lepta pokozku
farbiva, plasty, pesticidy
etery
kyslikate OZ v molekulach ktorých sa ku kyslikovemu atomu navizu 2 jednovazbove uhlovodikove zvysky
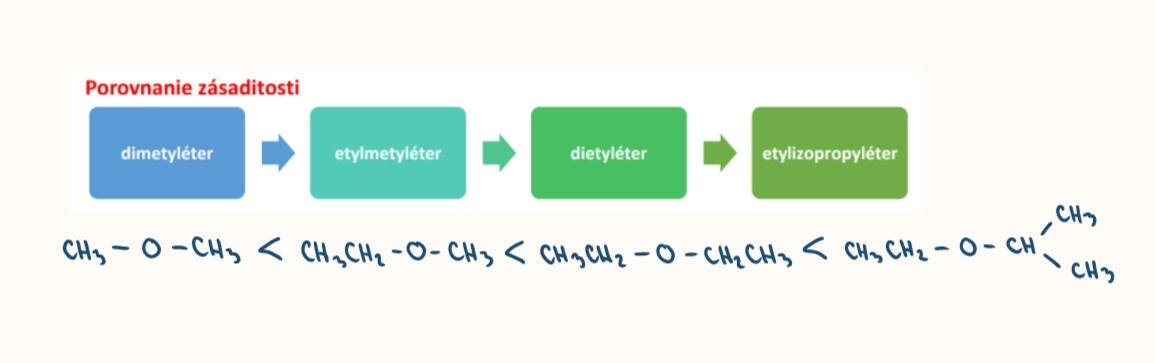
rozdelenie eterov
jednoduche - symetricke
zmiešane - asymetricke, aromaticke
cyklicke - sucastou nasyteneho kruhu
fyzikalne vlastnosti eterov
dimetyleter je plyn, ostatne su kvapaliny
charakteristicka vona
nemaju VV - nižšie Tv ako alkohol, nemiesaju so vo vode
rozpustne v nepolar. rozp., dobré rozpustadlá OZ
narkoticke ucinky
horlave a vybusne (uchovavanie v tmavych flasiach)
na svetle s kyslikom dochadza k oxidacii a vzniku vybusniny
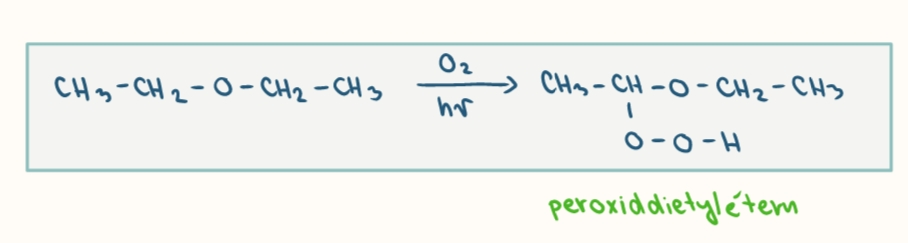
chemicke vlastnosti eterov
zasadite latky
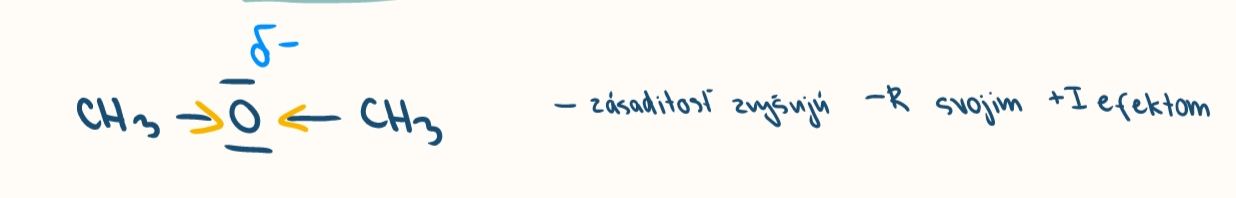
porovnanie zasaditosti eterov
rekaci eteru s kyselinami
vznika oxoniova sol
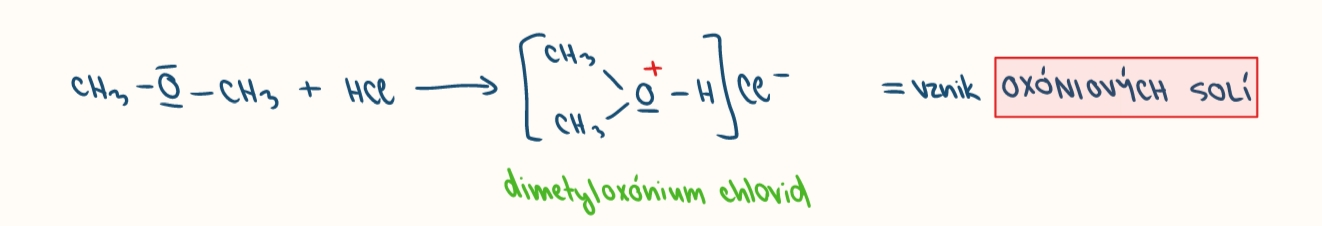
dietyleter
bezfarebna prchava kvapalina
vyborne rozpustadlo OZ, nemiesa sa s vodou
extrahovadlo
so vzduchom vybusna zmes
narkoticke ucinky
etylenoxid
bezfarebny plyn, prijemny zapach
vysokoreaktivny - nižšia pevnost vazieb v kruhu
podozrenie na karcinogenne ucinky, jedovaty
vyroba etandiolu, sterilizacia lekarskeho materalu