les amines
1/9
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
10 Terms
Température d’ébullition des amines
Teb plus importante que alcanes car peut former des liaisons H mais plus faibles que les alcools car les liaisons H sont plus faibles entre N-H et O-H. Donc besoin de - énergie pour rompre les molécules alors Teb plus basse que alcools.
Un amine tertiaire ne peut pas former de H bond donc Teb comme les alcanes.
la basicité d’un amine
Elle repose sur la disponibilité de son doublet libre, les inductions donneurs des autres groupes accumulent les électrons vers le doublet facilitant l’attachement d’un H+.
La mésomérie rend l’amine + faible car le doublet liant est délocalisé sur tout le cycle.
est-ce qu’un sel avec plus de 5C se dissout dans l’eau
Oui car un sel a des liaisons électromagnétiques, la règle des 5C est pour les liaisons H
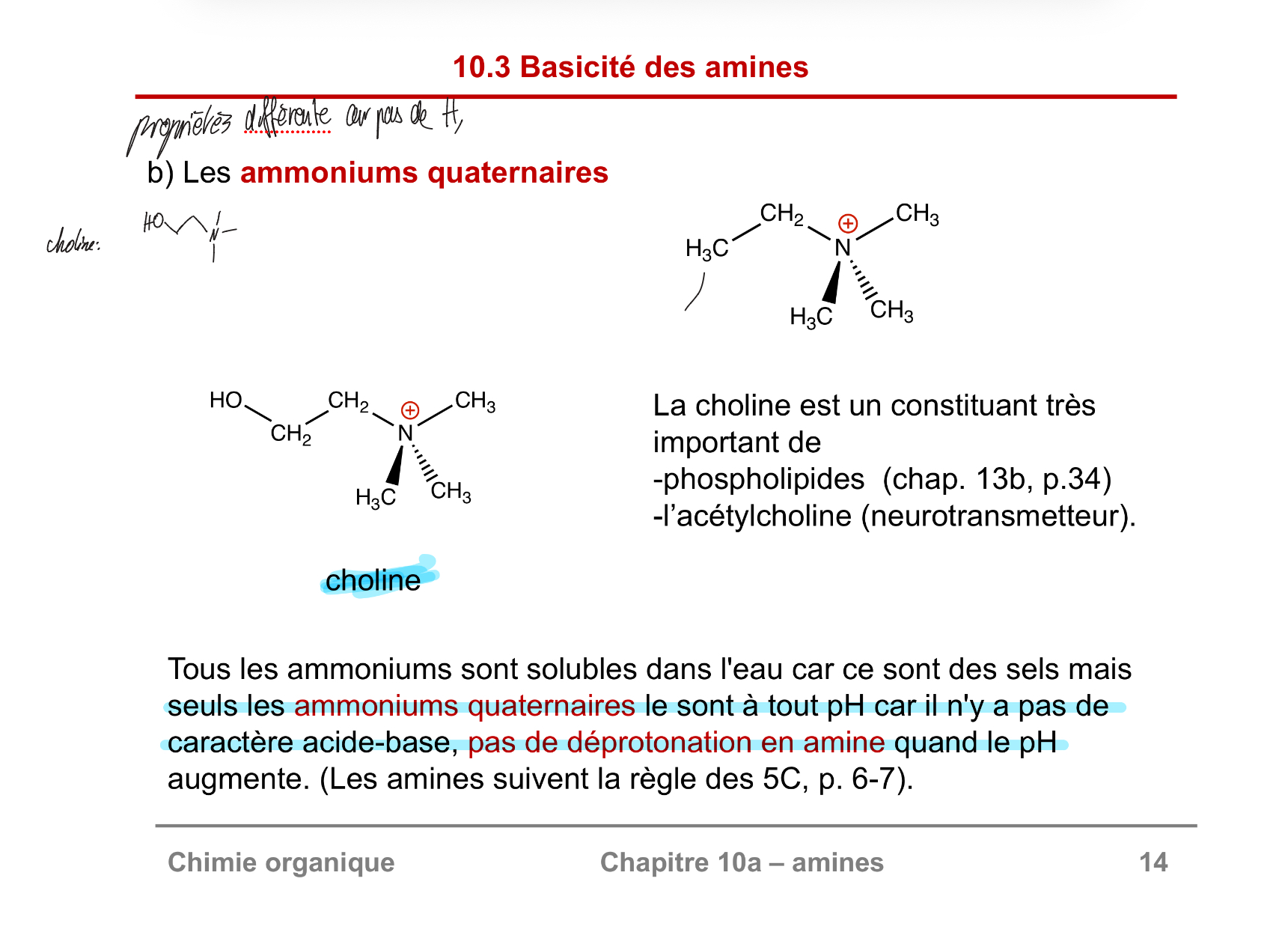
ammonium quaternaires
soluble car la charge positive sur N va attirer les pôles négatives de H2O encerclant le groupe.
A tout pH car il devient chargé positivement grâce a 4 groupes méthyles, n’a pas besoin d’être protonée par un H+ comme l’aurait été les primaires, secondaires, et tertiaires.
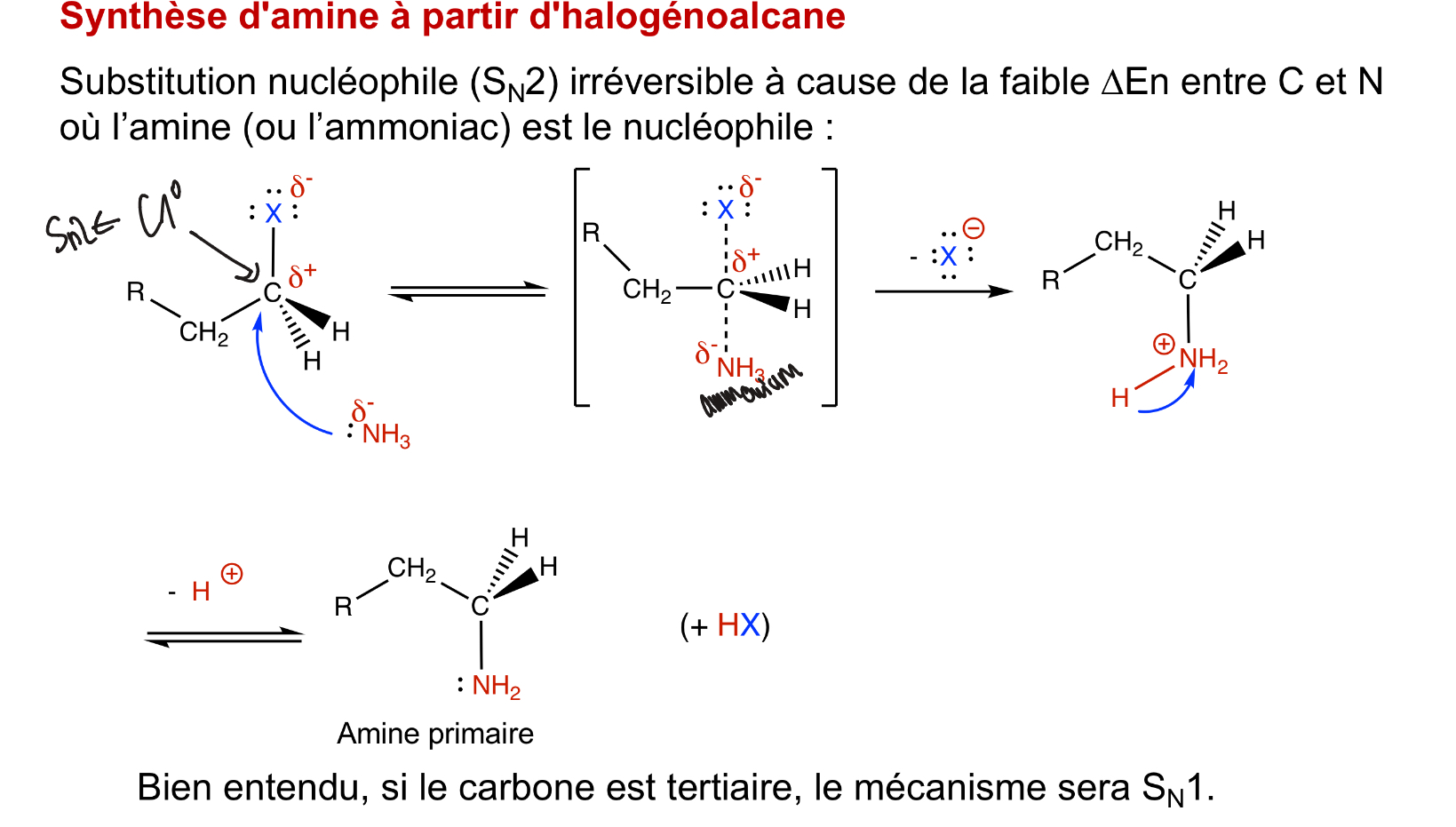
est-ce qu’une substitution nucléophile est possible ?
Non, car la base conjuguée (amidure) est plus faible que l’eau, (pKa = 33) est ne pourra pas réagir.
élimination dans les amines quaternaires.
Création d’amine quartenaire, impossible en protonnant car pas de H+ vu que l’élimination est avec une base.
Elimination de Hofmann
Création de sel d’ammonium
Elimination d’une base forte (OH-)
Produit : un alcène et un triméthylamine avec un H en bet. Attention : Ici dans l’elimination de Hofmann c’est le H en fin de chaine qui va être éliminer car on parle de base et pas d’acide.
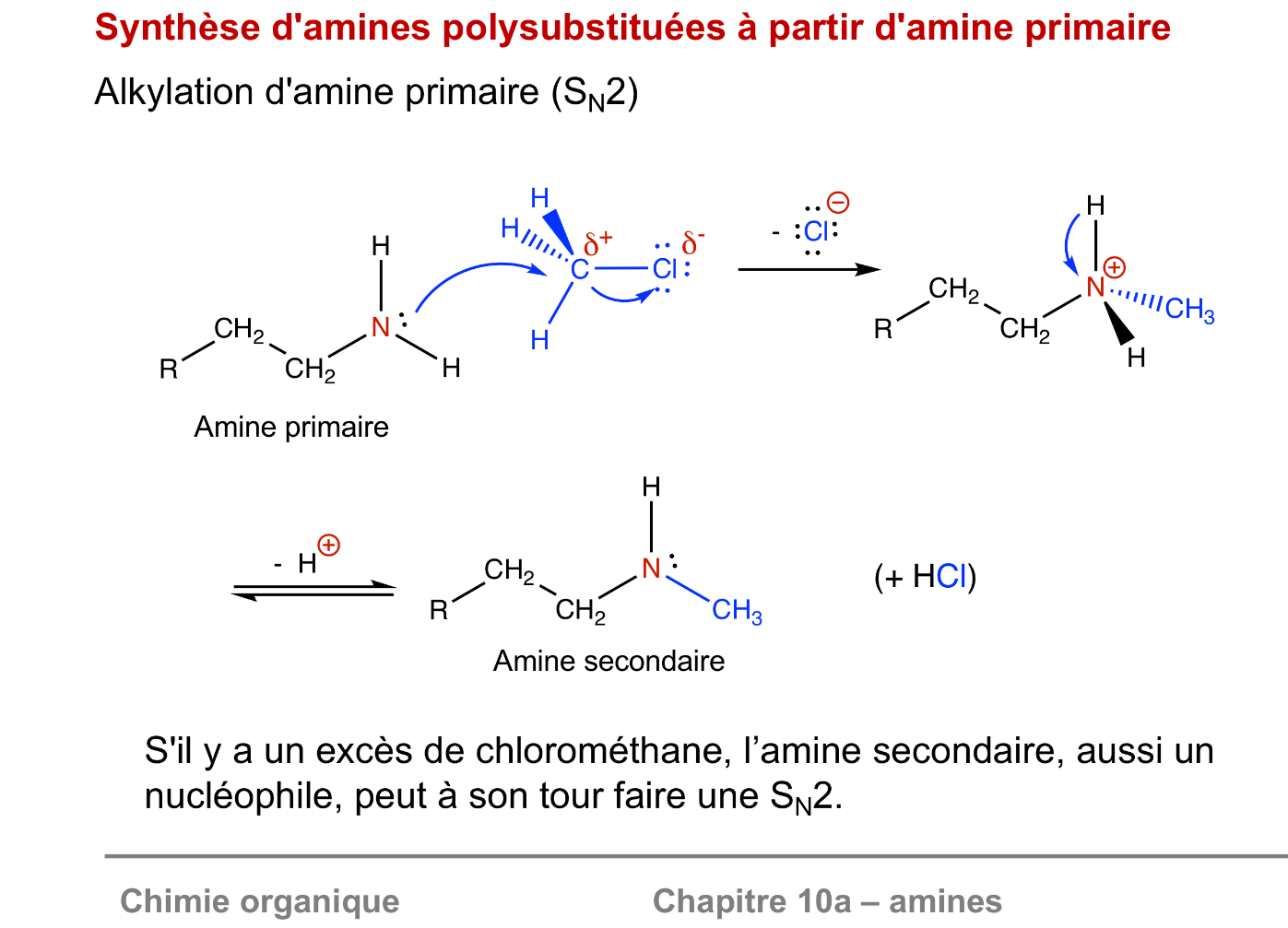
Synthèse d’amine avec un halogènoalcane
effet parapluie avec la liaison d’ammonium par le dessous.
la basicité des amines
+d’induction donneur permet de stabiliser la charge + → plus basique
la mésomérie délocalise le doublet d’électrons rendant plus dure la protonation de l’amine. donc → base faible.
Formation de sels d’ammonium
tant qu’un doublet d’électrons est présent, on peut faire une substitution nucléophile