11) patologie buňky
1/65
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
66 Terms
Jaké jsou fyziologické podmínky pro život biologické soustavy?
= rozmezí hodnot fyzikálních a chemických faktorů,které je kompatibilní pro život biologické soustavy (buňka, organismus...)
Co je buněčný stres?
Situace, kdy je buňka vystavena nekompatibilnímu okolí.
- stresové faktory (fyzikální, chemické, biologické)
- buněčná patologie
- molekulární patologie
Jaké typy stresových faktorů existují?
nespecifické a specifické
Nespecifické:
výrazné zvýšení teploty, těžké kovy, aldehydy → denaturace proteinů
specifické:
- záření o určité vlnové délce → absorpce cílovými molekulami nebo specifická reakce na buněčné úrovni
- specifické inhibitory (antibiotika, cytoskeletální toxiny) → inhibice konkrétního děje v buňce
Stresová reakce buňky:
- naprogramovaný proces, který buňku chrání před nepříznivými důsledky působení stresového faktoru
- změna genové exprese → syntéza stresových proteinů a dalších proteinů, které buňce pomáhají kompenzovat stres
FYZIKÁLNÍ STRES
vysoká teplota, nízká teplota, světlo, UV, ionizující záření, mechanický stres
Jaké jsou důsledky vysoké teploty pro buňky?
- ireverzibilní poškození buněk při teplotním šoku v rozmezí 40-50oC
- změna terciární konformace proteinů → narušení funkce proteinů
- poruchy koordinace metabolických drah (teplotní optimum pro jednotlivé enzymy)
- dezorganizace struktury biomembrán
- depolymerace cytoskeletálních struktur (mikrotubuly)
Termofilní bakterie (archebakterie)?
tolerance k extrémně vysokým teplotám (~90oC)
Jaké změny způsobuje nízká teplota?
- reverzibilní poškození při teplotách kolem 0oC
- mechanické poškození biomembrán krystaly vody (ledu)
- poruchy struktury a funkce cytoplazmatických mikrotubulů
- přežití buněk závisí na obsahu vody v buňce
odolnost vůči nízkým teplotám
- nejodolnější: semena, spory, psychrofilní bakterie
- nejméně odolné: živočišné buňky
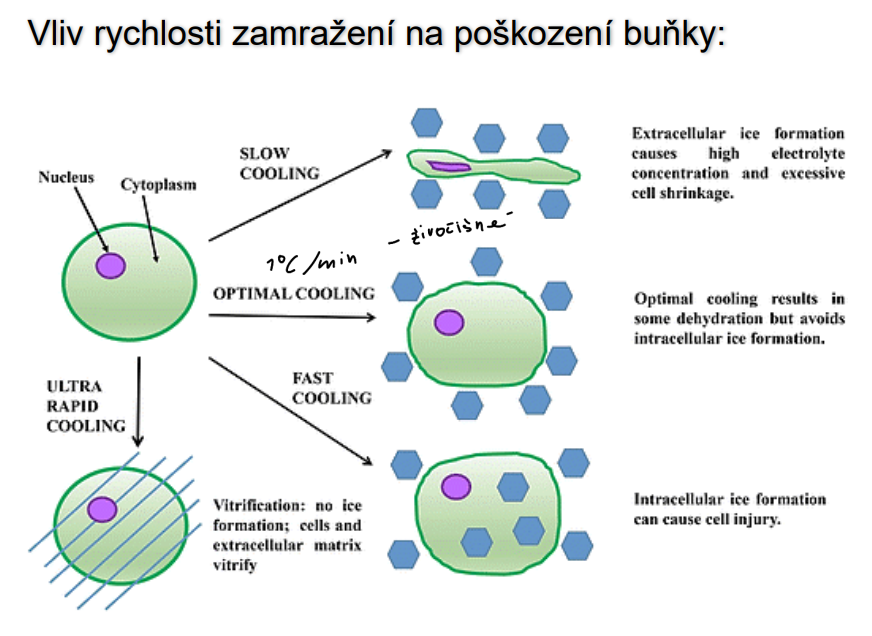
Vliv rychlosti zamražení na poškození buňky:
Rychlost zamražení ovlivňuje tvorbu ledových krystalů, což může způsobit mechanické poškození buněčných struktur a narušení jejich funkce.
Viditelné světlo:
- jako stres působí velmi silná intenzita osvětlení nebo laserový paprsek
- relativně malá absorpce cytoplazmou
- zvýšení efektu v případě pigmentů v buňce
- Fotodynamická barviva: sloučeniny zvyšující citlivost buněk na světlo
- aktivace fotodynamického barviva → oxidační stres (eosin, fluorescein, akridin, chlorofyl, porfyriny...)
Jaké účinky má ultrafialové záření na buňky?
přímý a nepřímý efetk
Přímý efekt UV:
UVC: tvorba pyrimidinových a cyklobutanových dimerů v DNA
Nepřímý efekt UV
tvorba kyslíkových radikálů (ROS) → oxidativní poškození cílových molekul (DNA, proteiny, lipidy) a buněčných struktur
Ionizující záření:
- účinek závisí na dávce a druhu záření, na době ozařování a na senzitivitě buňky, resp. tkáně
- větší rychlost částice → menší ionizační hustota → menší poškození buňky
- přímý účinek: poškození cílové molekuly (DNA)
- nepřímý účinek: tvorba ROS
Co je radiosenzitivita buněk?
Citlivost buněk na ionizující záření v závislosti na obsahu DNA a proliferaci.
- buňky vyšších organismů
- buňky s vyšším obsahem DNA a gamety
- proliferující buňky (kostní dřeň, lymfatické uzliny, zárodečné buňky - spermatogeneze, epitely, embryonální buňky)
Mechanický stres (mikromanipulace):
vysoká odolnost buněk s buněčnou stěnou, kritické je poškození biomembrány
základní ochrana živočišné buňky před mechanickou manipulací
intermediární filamenta (odolnost vůči mechanickým vlivům)
Kompenzace lokálních mechanických vlivů
)mikromanipulace, mikroaspirace):
aktinová filamenta
Xenobiotika (jedy):
- sloučeniny, které v buňce vyvolávají toxický šok
- principem interakce s cílovou molekulou
- nespecifický a specifický účinek
Třídění xenobiotik:
- chemické složení (těžké kovy, kyseliny, alkaloidy...)
- původ (chemické toxiny, biologické toxiny...)
- mechanismus působení (poškození DNA, cytoskeletu, inhibice proteosyntézy, respiračního řetězce...)
na co mohou působit specifické inhibitory
syntézu biopolymerů, funkci biomembrán, energetický metabolismus, dynamiku cytoskeletu
biologický stres
skrze intracelulární parazitismus
Intracelulární parazitismus:
- virusy (lýze buňky nebo integrace do genomu)
- bakterie (mykoplazmata, rickettsie, chlamydia, Listeria monocytogenes)
- prvoci (Plasmodium malariae, Toxoplasma gondii)
Změny napadených buněk:
- změny metabolismu (využití proteosyntetického aparátu)
- změny buněčné morfologie (cytoskeletální struktury, cytoplazmatická membrána)
- změny chování napadené buňky, resp. organismu
Původní dělení způsobů buněčné smrti:
- smrt v důsledku působení škodlivého vnějšího faktoru:
- náhodná / katastrofická (accidental) buněčná smrt = nekróza
- smrt jako indukovaná sebevražda:
- programovaná / fyziologická (programmed) buněčná smrt = apoptóza
Jaké jsou hlavní typy buněčné smrti?
Nekróza, nekroptóza, apoptóza, autofagie, anoikis.
Nekróza
katastrofická smrt buňky indukovaná nespecifickým zásahem
Nekroptóza
nekróza indukovaná specifickým faktorem
Apoptóza
programovaná smrt buňky za účasti proteolytických enzymů (kaspázy, příp. další…)
Autofagie
degradace buněčných komponent / organel pomocí lysozomů
Anoikis
smrt v důsledku poruch buněčných interakcí
Indukce nekrózy:
- rozsáhlé poškození, při němž už nemohou být aktivovány mechanismy apoptózy
- působení nespecifických stresových faktorů:
- změny koncentrace iontů, pH...
- vyčerpání zdrojů energie
- změny teploty
- poškození buňky nebo jejích organel
příznaky a průběh nekrózy?
- poškození mitochondriální membrány
- pronikání iontů Ca2+ do mitochondrií
- zakulacení a prasknutí mitochondrií
- ztráta regulace transportu iontů
- zakulacení buňky (swelling)
- lýze buňky
nekrózana na úrovni tkáně
vznik nekrotického ložiska → invaze makrofágů → zánětlivá reakce
průběh autofagie
indukce
vytvoření autofagosomu (nejasný původ = ER?)
dokování autofagosomu, fúze s lysosomem
rozpad autofagosomálního veziklu
Typy autofagie:
- makroautofagie (vznik autofagosomu)
- mikroautofagie (transfer do lysosomu přímou invaginací)
- chaperon-mediated autofagie (CMA) – selektivní
Příčiny apoptózy:
Apoptóza nezbytná pro řádný vývoj organismu a apoptóza nezbytná pro likvidaci buněk, které představují ohrožení integrity organismu
Apoptóza nezbytná pro řádný vývoj organismu
- resorpce ocásku během metamorfózy pulce v žábu
- odstranění tkáně mezi prsty během embryogeneze
- odstranění nadbytečných neuronů při vytváření synapsí v mozku
- uvolňování endometria na počátku menstruace
Apoptóza nezbytná pro likvidaci buněk, které představují ohrožení integrity organismu
- buňky infikované viry
- efectorové buňky imunitního systému po odeznění imunitní odpovědi
- buňky s poškozením DNA = zvýšená produkce proteinu p53 (induktor apoptózy)
- nádorově transformované buňky
Indukce a průběh apoptózy:
Odstranění pozitivního signálu, Přijetí negativního signálu, Fáze iniciační, Fáze exekutivní:
Odstranění pozitivního signálu
- růstové faktory - neurony
- interleukin 2 (IL-2) - lymfocyty
Přijetí negativního signálu
- zvýšení hladiny oxidačních látek v buňce
- poškození DNA (volné radikály, UVR, gama záření, chemoterapeutika)
- molekuly (death activators), které se napojují na specifické receptory (death receptors)
Fáze iniciační:
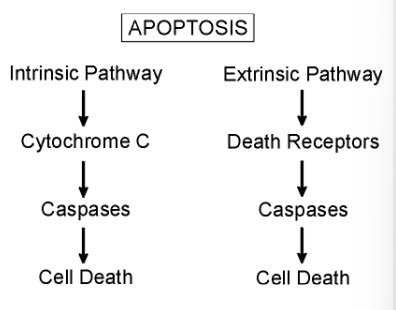
- poruchy mitochondrií a uvolnění cytochromu C, resp. napojení ligandu na death receptors
- aktivace kaspáz
Fáze exekutivní:
- zmenšení (smrštění) buňky
- blebbing plazmatické membrány
- změny ve složení plazmatické membrány
- kolaps jádra (degradace chromatinu)
- proteolytické štěpení intracelulárních proteinů
- rozpad buňky na apoptotická tělíska
- fagocytóza apoptotických tělísek
Aktivace proteolytického štěpení:
- cysteinové proteázy, štěpící na karboxyskupině kyseliny asparagové
- caspases = cysteinyl-aspartic-acid-proteases
- 14 druhů kaspáz (u člověka):
- iniciační (8, 9, 10 a 12)
- efektorové (3, 6 a 7)
- Další typy proteáz:
- katepsiny, kalpainy, granzymy
Apoptóza vyvolaná vnitřními signály:
- zdravá buňka exprimuje na vnější membráně mitochondrií protein Bcl-2, vázaný k Apaf-1
- při vnitřním poškození buňky protein Bcl-2:
- vzniká apoptosom:
- vzniká aktivní kaspáza 9 (iniciační), která štěpením aktivuje další kaspázy (efektorové)
co dělá Bcl-2
- uvolní Apaf-1
- přestane zadržovat cytochrom C v mitochondriích
Co je to apoptosom?
Komplex vytvořený při uvolnění cytochromu C, který aktivuje kaspázy.
- Apaf-1
- Cytochrom C (Apaf-2)
- prokaspáza 9 (dATP)
Apoptóza vyvolaná vnějšími signály:
- aktivační molekuly (death activators) se napojují na specifické receptory v plazmatické membráně (death receptors):
- Tumor necrosis factor α (TNF-α) - TNF receptor
- Lymphotoxin (TNF-β) - TNF receptor
- Fas-ligand (FasL) - Fas receptor (CD95)
- přenos signálu do cytoplazmy aktivuje prokaspázu 8
- aktivovaná kaspáza 8 štěpením dalších prokaspáz spouští proteolytickou kaskádu
Porovnání vnější a vnitřní dráhy aktivace apoptózy:
Blebbing:
Proces, při kterém se na povrchu buňky vytvářejí výběžky (bleb), což je známka apoptózy. Tento jev je důsledkem ztráty integrity cytoskeletu a změn v buněčné membráně.
poruchy kortikálního skeletu
Změny v plazmatické membráně:
externalizace fosfatidylserinu
Kolaps jádra (degradace chromatinu):
- kondenzace chromatinu na periferních oblastech jádra
- internukleosomální štěpení DNA - žebříček (ladder)
- fragmentace jádra
Rozpad buňky na apoptotická tělíska:
- účast nově formované aktinové 3D struktury a nesvalového myosinu
- apoptotická tělíska obsahují zbytky jádra, organely a části cytoplazmy
Fagocytóza apoptotických tělísek:
- pohlcení apoptotických tělísek okolními buňkami (makrofágy, dendritické buňky)
- fagocytující buňky vylučují cytokiny, které zabraňují zánětu ve tkáni
Jaká je role oxidačního stresu v apoptóze?
Vyvolává poškození DNA a aktivaci apoptotických signálů.
Kdo získal Nobelovu cenu 2016 za výzkum autofagie?
Yoshinori Ohsumi.
Jakou roli mají kaspázy v apoptóze?
Štěpí intracelulární proteiny a iniciují apoptózu.
Jaké jsou hlavní znaky blebbing?
Změna plazmatické membrány a poruchy kortikálního skeletu.
Co se děje s jádrem během apoptózy?
Degradace chromatinu a fragmentace jádra.
Jaké signály aktivují dráhu apoptózy?
Aktivační molekuly se napojují na death receptory.
Co se stane s apoptotickými tělísky?
Jsou fagocytovány okolními buňkami.
Jaké specifické inhibitory účinkují na energetický metabolismus?
Kyanidy a další blokující látky pro cytochromy.