BIM vizsga
1/342
Earn XP
Description and Tags
BME Biomérki műveletek és folyamatok 2024/2025 tavaszi félév.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
343 Terms
Biotechnológia előnyei
Enyhe reakciókörülmények
Megújuló alapanyagok
Olcsóbb és könnyen beszerezhető alapanyagok
Kevésbé veszélyes
Kisebb környezeti ártalom
Biokatalizátorok specifikussága
Sokoldalú, többcélú, de egyszerűbb készülékek (olcsóbb)
Kisebb energiaigény, de nagyobb hozam
rDNS technológiák lehetőségei
Biotechnológia
Természet tudományok alkalmazása az élő szervezetek technológiai felhasználásának céljából
Ereky Károly (1917) használta először a kifejezést
Biotechnológia használata
Komplex molekulák előállítása
Célzott előállítás izomereknél
Tenyészet több reakcióra is képes egyszerre
Nagyobb hozamot ígér
Biotechnológia hátrányai
Alacsony produktivitás kémiaival szemben
Híg oldatos termékek kinyerése drága és bonyolult
Magas BOI szennyvíz (de könnyen tisztítható)
Fertőzés veszély
Kétoldali változékonyság: alapanyagok minősége és a mikrobák
Idegenkedés, elutasítás (pl. GMO, mikrobák)
Enzimek funkciója
Csökkentik az aktiválási energiát
Aktiválási energia
Legkisebb szükséges energiamennyiség a reakció végbemeneteléhez
Biokatalízis
Nukleinsav világ
Ribozimek —» katalizáló RNS; önkatalizációra is képes lehetett
Lassan kifejlődtek a fehérjék
Maradtak: ATP, NAD+, CoA, tRNS, UDP templát, RNaseP
Szubsztrát
Az enzimes reakcióban átalakuló molekula
Szelektív a megkötődés
Kötőhely
Az enzimnek az a felülete ahová a szubsztrát megkötődik (több hely is lehet)
Enzim és Szubsztrát közötti kölcsönhatások
Másodlagos kölcsönhatások lépnek fel a kettő között
Ionpár, Hidrogén híd, van der Waals (hidrofób)
Aktív centrum
Az átalakításért felelős régió az enzimen
Enzimes reakciók
Csak termodinmikailag lehetséges reakciókat gyorsítanak
Reverzibilis
Egyensúlyra vezet, de az egyensúly eltolható
Specifikus: szubsztrát, csoport, sztereo, régió, reakció
Szubsztrátspecifitás
Adott enzim csak adott szubsztrátot alakít át
Csoportspecifitás
Az enzim olyan szubsztrátokat alakít át, amelyek adott típusú kémiai funkciós csoportot tartalmaznak vagy adott típusú csoportot hoznak létre
Reakcióspecifitás
Az enzimek csak bizonyos típusú kémiai reakciókat tudnak katalizálni
Sztereospecifitás
Az enzim csak egy adott térbeli formájú szubsztrátot tud felismerni és átalakítani
Régióspecifitás
Az enzim csak bizonyos helyzetben lévő funkciós csoportokat alakít át
Enzimek elnevezése
Szubsztrát szerint - pl. ureáz
Szubsztrát és reakció után - pl. alkohol-dehidrogenáz
Triviális - pl. pepszin, tripszin, rennin (fehérjebontók, -in végződés)
Szisztematikus - katalógus
Királis centrum
Olyan C-atom, amelyhez négy eltérő csoport kapcsolódik
Holoenzim
A teljes enzim
Apoenzim és kofaktor együttese
Apoenzim
Az enzim fehérje része
Kofaktor
Az apoenzimhez kapcsolódó nem fehérje molekula
Típusai:
fémion
szerves molekula=koenzim
Koenzim
Kofaktor szerves molekula
Típusai:
prosztetikus csoport - kovalensen kötődik a fehérjéhez (pl. FADH2)
koszubsztrátok - pl. NAD(H), ATP
Enzimes reakciók sémája
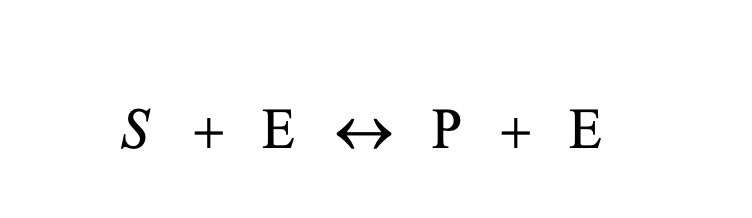
Enzimek mennyisége
Enzimpreparátum sohasem tiszta —» Mennyiséget hatásuk alapján kapjuk
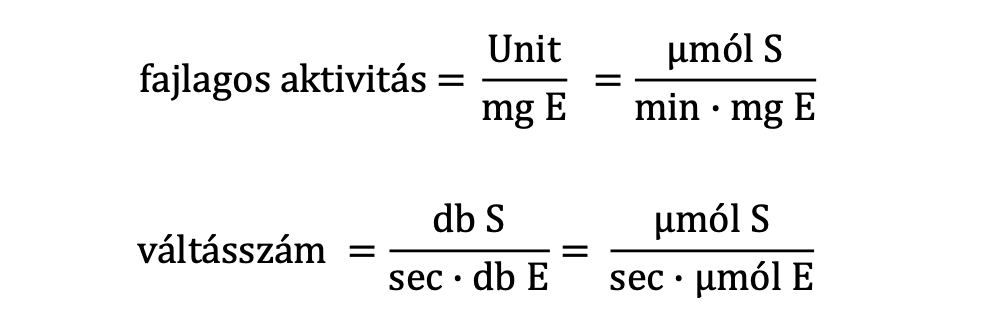
Unit [U]= az az enzim mennyiség, amely 1 µmol szubsztrátot alakít át 1 perc alatt adott reakciókörülmények között
Katal (SI)= 1 katal 1 mol szubsztrátot alakít át 1 perc alatt
nanoKatal praktikusabb: 1 U=16,67 nK (1 nK=10-9 Kat)
Rapid ekvilibrium
k1SE=k-1(ES)
Michaelis-Menten séma
Feltételezések:
k-2=0 (második lépés irreverzibilis)
rapid ekvilibrium
egy aktív centrum, egy szubsztrát
aktivitás helyett koncentráció használható
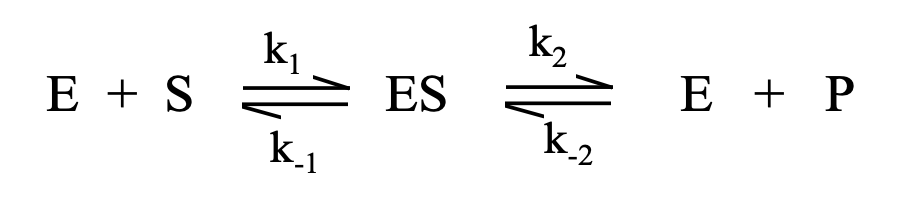
Enzim-szubsztrátum disszociációs állandója
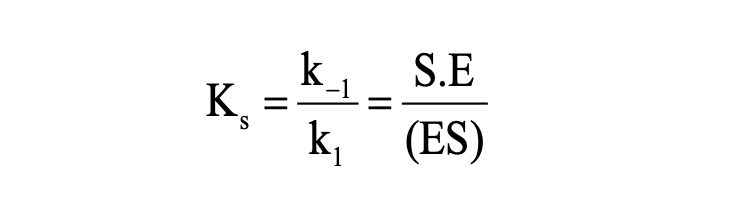
Michaelis-Menten sebesség egyenlet
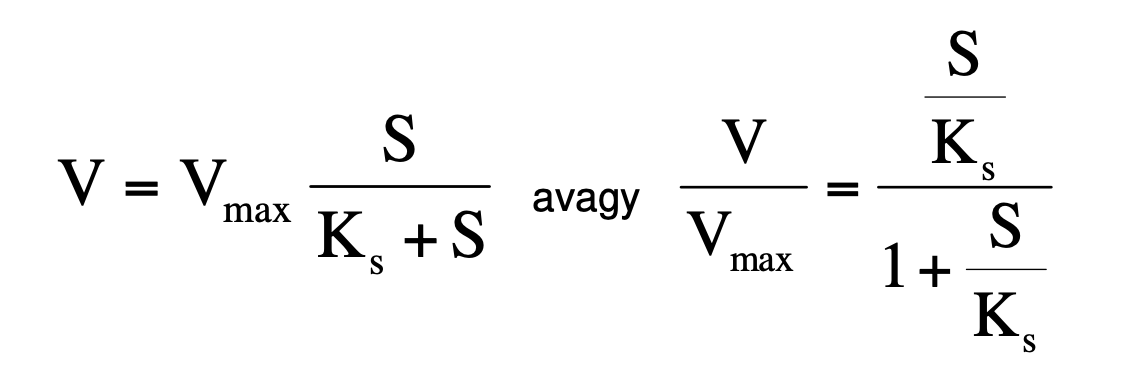
Briggs-Haldane kinetika
Ugyanazok a differenciálegyenletek, de a feltételezés: Kvázi állandósult állapot
Rövid átmeneti szakasz —» Nagyon lassú változás
(Pre-steady state) (Kvázi-steady state)
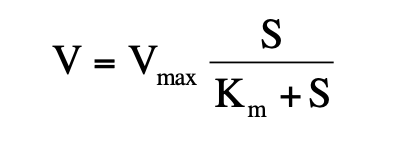
Michaelis állandó
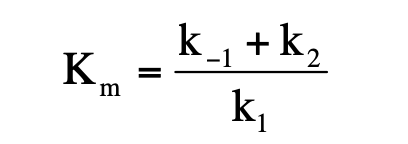
Diszkusszió

Paraméterbecslés
Lineweaver-Burk linearizálás
Hanes-Langmuir linearizálás
Eady-Hofstee linearizálás
Kinetikai paraméterek
vmax —» határsebesség
k2 —» váltásszám
kcat —» S-telítés esetén E-molekula átalakítási frekvenciája
Ks, Km —» enzim affinitása a szubsztráthoz
Fajlagos aktivitás és Váltásszám
Haldane-féle összefüggés
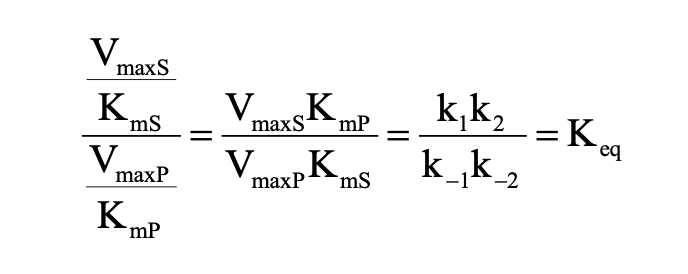
Michaelis-Menten reverzibilis egyenlet
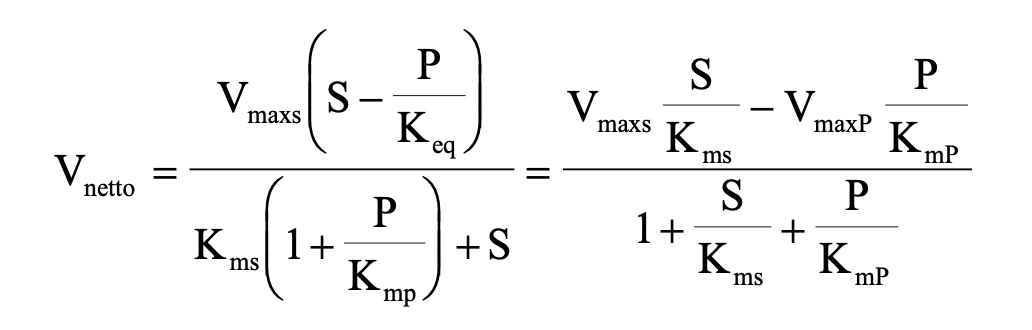
Enzim aktivitást befolyásoló tényezők
További kötőhelyek
Fehérje kovalens módosítása
További kötőhelyek
Fémionok - ionos és kelát forma
Modulátor molekulák - inhibitor, aktivátor
Fehérje kovalens módosítása
Foszforilezés, Glikolizálás, Proteolízis
Komplett inhibíció
Az enzim elveszíti az aktivitását
Lineáris inhibíció
Részleges inhibíció
Az aktivitás csak csökken, egy része megmarad
Hiperbolikus inhibíció
Inhibíció - Aktiválás mértéke

Irreverzibilis inhibitorok
Jelentősen csökkentik vagy teljesen gátolják az enzim aktivitását.
Visszafordíthatatlan
pl. nehézfémek, cianid, idegmérgek - enzimmérgek
Reverzibilis inhibitorok
Dinamikus komplexet képeznek az enzimmel
Katalitikus hatása eltér a nem komplexálódott enzimekétől
Km és vmax-ra kifejtett hatása alpján csoportosítjuk őket.
Kompetitív - növeli a Km értékét, a vmax nem változik
Nemkompetitív - csökkenti a vmax értékét, a Km nem változik
Unkompetitív - vmax és Km arányosan csökken
Kevert - előbbiek keveréke
Kompetitív inhibíció
S és I kölcsönösen kizárják egymást az enzimről
pl. alternatív szubsztrát, szubsztrát analóg, termék
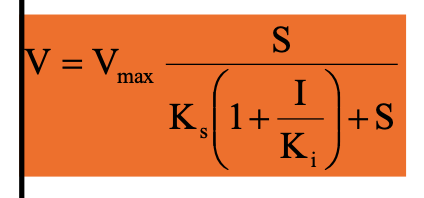
Klasszikus gátlás
A S és I versengenek az aktív centrumért
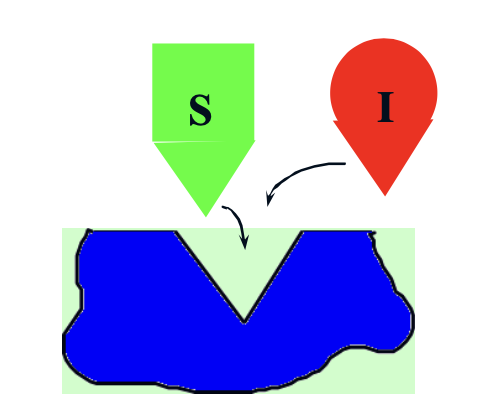
Sztérikus gátlás A
I kötődése másik kötőhelyhez térbelileg gátolja a S kötődését
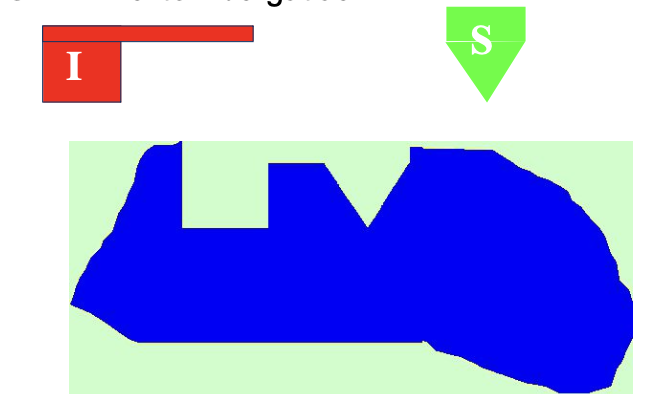
Sztérikus gátlás B
I és S analóg része verseng egy közös kötőhelyért
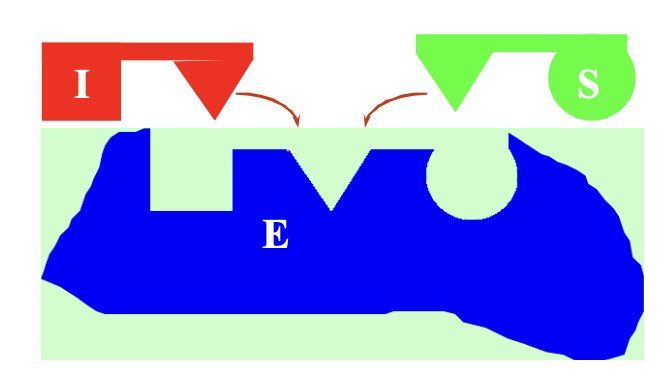
Átlapoló gátlás
Kizárják a másikat a kötőhelyéről, ha kötődnek a sajátjukhoz
Közvetett gátlás
I kötődése az enzimhez konformáció változáshoz vezet, ami miatt a S nem tud kötődni
pl. végtermék gátlás
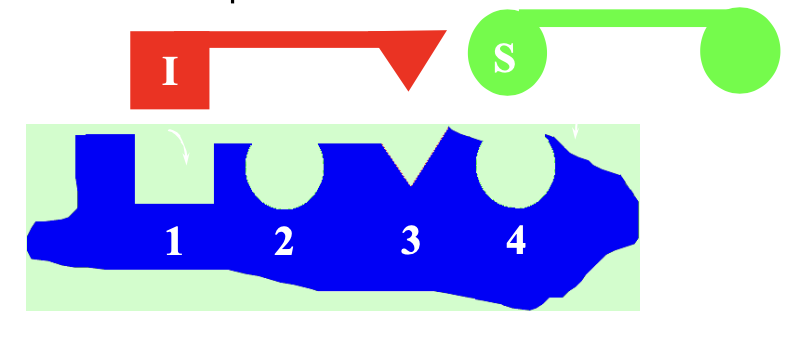
NemKompetitív inhibíció
Az I egy másik kötőhelyhez kapcsolódik, csak térben gátolja a szubsztrát kötődését, egymástól függetlenek
Nincs affinitás vagy térszerkezet változás
Rapid ekvilibrium - Ks=Km
pl. H-ionok, (nehéz fémek, cianidok)
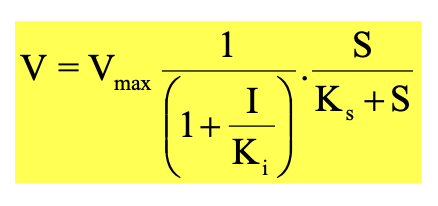
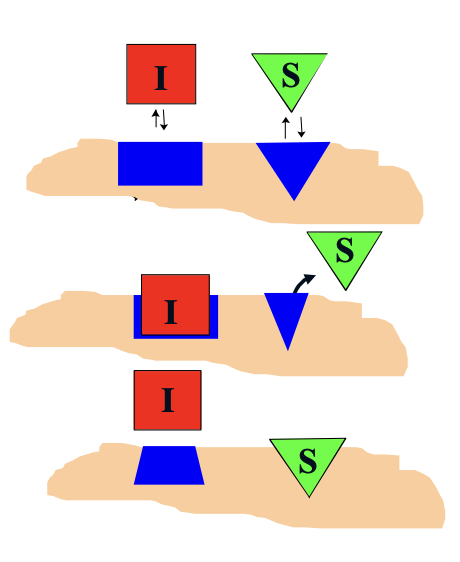
Unkompetitív inhibíció
Az I a már létrejött ES komplexhez kötődik —» kötőhely eltorzul
inaktív ESI komplex —» nincs termék
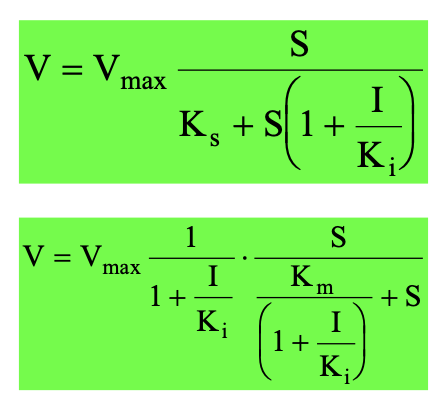
Kevert típusú inhibíció
Kinetikai levezetése megegyezik a nemkompetitívval, de az I változtathat az affinitáson
[ESI]⍺ - új alpha tényező
![<p>Kinetikai levezetése megegyezik a nemkompetitívval, de az I változtathat az affinitáson</p><p>[ESI]⍺ - új alpha tényező</p>](https://knowt-user-attachments.s3.amazonaws.com/5f0c78bc-763f-40ba-bf0a-24f13e34c067.png)
Szubsztrát inhibíció
S-nek két vagy több helyen kellhet a E-hez kötődni termékképzéshez
nagy [S] esetén a S nem az AC-hoz kapcsolódik - nemkomp v. un
S elvonja az aktivátor molekulát
Több S reakcióknál az egyik feleslege leköti a másik kötőhelyeit
Aspecifikus módok - pl. ionerősség növekedése
DIXON linearizálás
Azonos S értékekhez tartozó sebesség értékeket vizsgáljuk
egyenest adnak = reakció lineáris; elhelyezkedésükből beazonosíthatjuk az I típusát és kinetikai konstansait
Többszubsztrátos reakciók típusai
Egyszerre több különböző S kell a P képzéshez - pl. hexokináz
Több hasonló, alternatív S van jelen - pl. amiláz, celluláz, proteináz
Bi-Bi reakciók
=mind S min P oldalról bimolekuláris
Típusai: random, határozott, ping-pong mechanizmus
Random bi-bi reakciók
Hasonlít a lineáris kevert inhibícióra, a komplexet EAB-nek nevezzük
Határozott sorrendű bi-bi reakciók
Hasonlít az unkompetitív inhibícióhoz, néha a B csak az A után tud kapcsolódni
EAB —» EPQ lépés sebessége a meghatározó tényező
Ping-pong mechanizmus
Az enzim két stabil módosulat között oszcillál
EA «—» EP
P leválik
AB «—» EQ
Q leválik
Alternatív szubsztrátok
Sok enzim több S-t is képes átalakítani —» kompetíció
Polimerek monomerjeit összekapcsoló kötések úgy viselkednek, mit egy-egy szubsztrát
Különböző lánchosszúságú polimerek keverékei
Hidrolitikus enzimek
exo-hidroláz - láncvégi kötéseket bont
endo-hidroláz - láncon belüli kötéseket bont
pH hatása enzimaktivitásra
az oldalláncok + és - töltésűek «— a töltés disszociáción keresztül függ
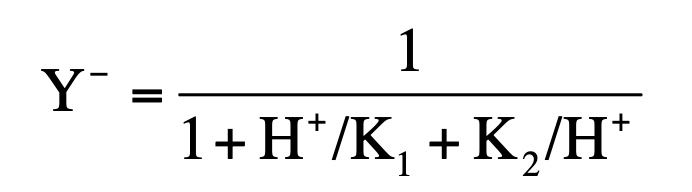
Hőmérséklet hatása enzimaktivitásra
Pozitív - reakciósebesség nő
Negatív - denaturálódás
irreverzibilis
reverzibilis
Egyéb hatások enzimaktivitásra
ionerősség, nyírás, hidrosztatikai nyomás, felületi feszültség, vegyszerek, fény, hang, ionizáló sugárzások
Heterogén fázisú enzimreakciók előnyei
Homogén rendszer
Nem igényel előkészítést
Heterogén fázisú enzimreakciók hátrányai
Enzimek drágák
Egyszeri felhasználás
Kinyerésük bonyolult és drága
Szennyezik a terméket, tisztítását nehezítik
Immobilizáció története
Nelson és Griffin - élesztő invertáza aktív szénen abszorbeálódott és nem vesztette el az aktivitását
Grubhofer és Schleith - egy sor enzimet rögzítettek poli-aminosztirol gyantára
Chibata - aminoacilázt DEAE Sephadexre rögzítette és L-aminosav rezolválására használták
Enzim rögzítés módszerei
Fizikai - Kémiai
Hordozóhoz - Önmagához - Bezárás
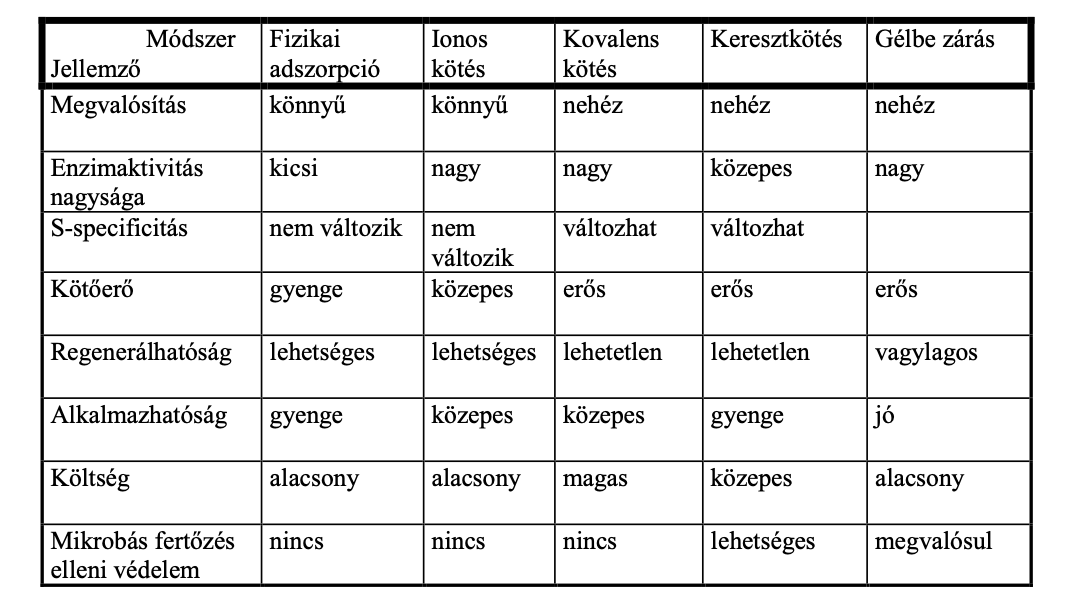
Adszorpció
Fizikai módszer
pl. Ioncserélők
Egyszerű, regenerálható
Az enzim könnyen leválhat
Egyéb anyagokat is adszorbeálhat; nem specifikus
Alginát gélbe zárás
Fizikai módszer
Enzim tartalmú pufferoldatot Na-algináttal keverik össze
Az oldatot lassan, kis cseppekben Ca2+-ionokat tartalmazó pufferbe csepegtetik
A Ca2+ és Na+ ionok kicserélődnek
Ca-alginát golyók körbezárják az enzimet, vízben nem oldható —» fenn kell tartani a Ca-koncentrációt vagy feloldódnak (frissen kell készíteni)
Gasztronómia - szájban olvadó kaviár tetszőleges folyadékkel töltve
Ehhez hasonló: kitozán, karragén
Akrilamid gélbe zárás
Fizikai módszer
A monomert az enzim, K2S2O8 polimerizáció-iniciátor és β-dimetilamino-propionitril gyorsító jelenlétében polimerizálják
100-400 nm pórusátmérőjű polimerszemcsék keletkeznek
Élelmiszeriparban nem lehet használni - mérgező
Mikrokapszulázás
Fizikai módszer
300µm, féligáteresztő membránú kapszulákba zárják az enzimeket
Állandó polimer membránú mikrokapszula
Fizikai módszer
Enzim jelenlétében két monomert polimerizálnak - egyik nem vízoldható, a másik igen és a szerves fázisban is oldódik
Az oldatot keveréssel diszpergálják a szerves fázisban
Potenciálkülönbség miatt diffúzió indul meg, a diffundáló monomerek a cseppek határfelületén találkoznak —» kopolimerizáció
Vékony polimer héj alakul ki az enzim körül
Nem állandó membrános koacervátum
Fizikai módszer
Vizes enzimoldat emulgeálása felület aktív anyag jelenlétében
Hatalmas felület képződik
Több enzim is bezárható egy kapszulába
A membrán diffúziós gátat jelent a terméknek és a szubsztrátnak
Nagy reakciósebesség érhető el
Ultraszűrő membránba zárás
Fizikai módszer
Makro-módszer
Egy féligáteresztő membránnal elválasztjuk az enzimoldatot és a szubsztrátot
Hollow fibre/Üreges szálú szűrőelemeket kedvelik az enzimes technológiákban
Hordozóhoz rögzítés
Egy vízoldhatatlan hordozót és funkciós csoportjainak aktiválása
Kovalens kötés kialakítása az enzim és a hordozó között
Hordozó lehet:
természetes polimer: pl. agar, agaróz, kitin, cellulóz, kollagén
szintetikus polimer: pl. poliuretán, polisztirol, nylon
szervetlen: pl. üveg, alumínium, szilikagél, magnetit
Diazotálás
A hordozó primer aminocsoportokat tartalmaz (-NH2)
Aktiválás során az aminocsoport nitrózus savval (HNO2) reagál, így diazóniumsó keletkezik
Ezután a mátrix reagál az enzimmel kovalens kötést kialakítva
Hordozók: p-NH2-benzil-cellulóz, p-NH2-benzoil-cellulóz, amino-benzoil-SEPHADEX, polisztirol és akrilamid származékok
Keresztkötések
Kötés kialakítása kettő enzim között
Többfunkciós vegyületeket használnak (pl. glutaráldehid)
Molekula méret megnő
Vízoldhatatlan, géles részecskéket hoznak létre
Ipari felhasználásra nem alkalmasak, ezért gyakran adszorbeáltatják az enzimeket, és csak ezután hoznak létre keresztkötéseket
Bifunkciós molekulák
Két reaktív csoporttal rendelkező molekulák
Hordozóhoz kötésnél és Keresztkötésnél használatosak
CLEC
=crosslinked enzyme crystals
Kristályosítható enzimek rögzítése
Jó katalitikus tulajdonságok
CLEA
=crosslinked enzyme aggregates
Az enzimeket (NH4)2SO4-tal vagy butanollal kicsapatunk, és e közben történik a glutáraldehides keresztkötés
Előny: tisztított és nem tisztított enzimekkel is végrehajtható, az enzimaggregátum hőstabilitása nagy, ellenálló, nem oldódnak vízben vagy szerves bázisban
Combi CLEA - több enzim együttes immobilizálása —» vegyes katalizátorok
Sejt immobilizálás
Enzim preparálás nem mindig szükséges
Költség kímélő
Az enzim természetes környezetben működik, védettebb
Természetes koenzim regenerálás lehetséges
Ugyanazok a rögzítési módszerek használtak
Típusai:
élő sejt rögzítése - koenzimes átalakítások
nem élő sejt preparátum (permeabilizálás) - egyszerű átalakítások
MAXAFERM eljárás
Többféle enzim és/vagy sejt rögzítése egy preparátumban
Amiloglikozidáz enzim és élesztősejteket rögzítenek
A S dextrin ⍺-amiláz-zal elfolyósíttott keményítő
Az enzim glükózt hidrolizál, amit az élesztő alkohollá erjeszt
Rögzített enzimek kinetikája
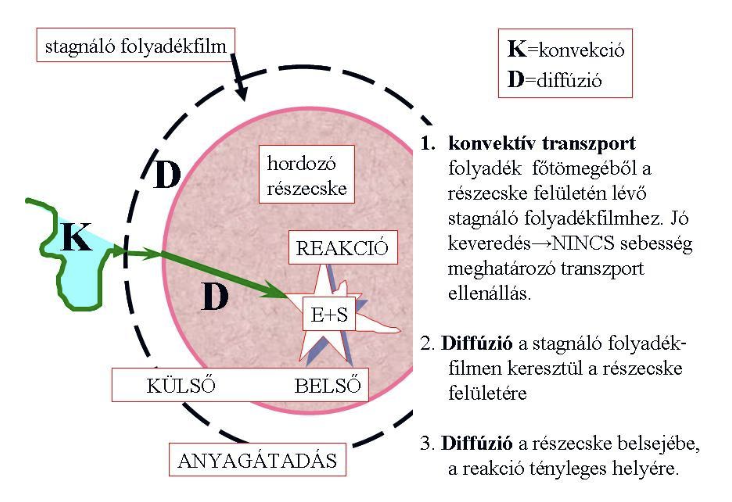
Külső anyagátadás
Enzim a hordozó felületére van rögzítve —» Konvektív transzporti és membránon keresztüli diffúziós ellenállás lép fel (1. és 2.)
Paraméterek: ks, a, S0, vmax, Km
Dimenzió mentes paraméterek:
x= S/S0
k= Ks/S0
Da (Damköhler-szám)

Belső anyagátadás
Homogén enzim eloszlás az részecske belsejében
Gátolt diffúzió a pórusokban
Külső határréteg transzportja elhanyagolható
Gömbszimmetrikus részecske
Diffúziós állandó:
Dso - diffúziós állandó a szabad folyadék fázisban
εp - porozitás
𝛕 - pórusok kacskaringóssága
H - hindrance/diffúziógátlás
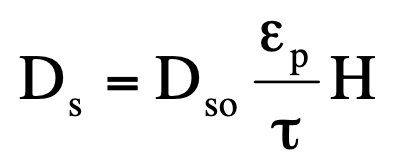
Oldott enzimek előnyei
Homogén rendszer
Előkészítés nem szükséges
Csak reakció-rezsim van
Oldott enzimek hátrányai
Drágák
Elveszhetnek
Szennyezik a terméket
Csak szakaszos technológia lehetséges
Rögzített enzimek előnyei
Nem szennyezik a terméket
Könnyen elválasztás
Újra felhasználhatóak
Folytonos technológia is lehetséges - könnyű terminálás, stabilabb
Rögzített enzimek hátrányai
Rögzítés költséges
Előkészítés szükséges
Csökken az enzim aktivitása
Diffúziós gát és transzport-rezsim is van
Rögzített enzimek felhasználása
Élelmiszeripar (tejcukor, zsírok, stb.)
Amperometriás oldott oxigén mérő elektród - oxigén termelő/elnyelő enzim
Potenciómetriás pH-mérő - H+ termelő/fogyasztó enzim
Bioszenzor
S és/vagy I meghatározása
Marker - pl. ELISA
Hozam számítása

De novo szintézisek
A megfelelő tápoldatban elszaporítva a mikrobák egyszerű tápanyagok segítségével változatos anyagcseretermékeket képesek előállítani
Mivel: mikrobák, növényi sejttenyészet, állati szövettenyészet
pl. fermentációs eljárások
Biotranszformáció
Egy kipreparált enzim katalizátorként alakít át egy vegyületet egy másikká
Enzimekkel - oldott, rögzített
Sejtekkel - növekedő, nyugvó, rögzített, tisztított enzimekkel, fázisrendszerekben, szerves fázisban
Jellemzői:
általános enzimes reakciók jellemzői (szubsztrát-, reakció-, régió-, sztereospecifikusság )
enyhe reakciókörülmények
kirotechnológia
Kirotechnológia
Csökkentik a gyógyszerkémiai szintézisekben keletkező nem hasznos, környezet-szennyező sztereoizomerek mennyiségét
Oxidáció oxigénnel
O2 - végső elektronakceptor vagy beépül szerves molekulába
Típusai: oxigenáz, monooxigenáz, dioxigenáz
Oxidáció dehidrogénezéssel
Dehidrogenázok végzik
A hidrogéneket redukált koenzimek viszik át
Koenzim szükséglet: NADH, NADPH,FADH2, Ubikinon, PQQ
Termékek: primer alkoholok, szekunder alkoholok, aldehidek
Ecetsav képződés biokémiája
Primer alkohol
Az enzimek a citoplazma membránba épülnek és itt adják át az ubikinonnak a H+-kat.
Az ubikinon visszaoldódik, víz képződik és proton exportálódik a periplazmatikus térbe.
A protonok visszaáramlásával ATP termelődik.
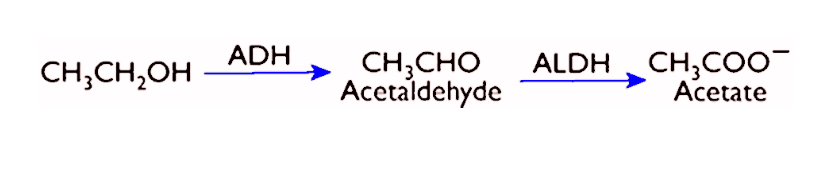
Ipari ecetsav gyártás
Primer alkohol
Törzs: Acetobacter aceti
Orleans-i eljárás - generátor eljárás —» bükkfaforgács felületén biofilm
Frings acetátor - szubmerz eljárás —» O2, S és P szint kritikus, etanolrátáplálás, erős hőfejlődés