anorganische chemie 2: elektronen in schillen en orbitalen
1/38
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
39 Terms
bij welke soort elementen komen de atomen los van elkaar voor
bij de edelgassan zoals heluim, neon, argon, krypton, xenon en radon
welke twee belangrijke principes gelden er bij de chemische reacties
de atoomsoort blijven behouden
de aantal atomen van elke soort blijven behouden
geef voor elk cijfer de romeinse sufix en een voorbeeld
1 = mono- bv koolstofmonoxide (CO)
2= di- bv koolstofdioxide (CO2)
3= tri- bv zwaveltrioxide (SO3)
4= tetra- bv stikstoftetraoxide (N2O4)
5= penta- bv fosfopentachloride (PCL5)
6= hexa- bv zwavelhexafluoride (SF6)
7= hepta- bv di-joodheptaodxide (I2O7)
8= octa- bv xenonoctafluoride (XeO4)
9= nona- (komt zelden voor)
10= deca- (zeer zeldzaam)
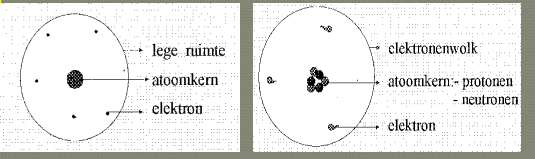
hoe noemt dit atoommodel
dit is het atoommodel van rutherford


hoe noemt dit atoommodel
dit is het atoommodel van Bohr

welke belangrijke informatie over elektronen halen we uit de theorien van rutherford en bohr
de elektronen hebben in een atoom een bepaalde energie-inhoud die zonder invloed van buitenaf nooit verandert
nier alle energie-inhouden kunnen in een elektron opgeslagen worden, maar slechts wel bepaalde waarden
een elektron kan van een bepaalde energieniveau overgaan naar een hoger energieniveau door het opslorpen van de overeenkomstige energiehoeveelheid
bij het terugvallen op een lager energie niveau straalt het elektron het energieverschil uit
wat is een orbitaal
een orbitaal is een functie waaruit de kans om een elektron op een bepaalde plaats aan te treffen kan berekend worden
welke 4 kwantum getallen zijn er
- n = het hoofdkwantumgetal
n = 1,2,3,4…..
- I = het nevenkwantumgetal
I = 0,1……..,n-1
- m (kleine i onderaan) = het magnetischkwantumgetal
m (kleine i onderaan) = -1,…..0,…..,1
- m (kleine s onderaan) = het spinkwantumgetal
m (kleine s onderaan) = -1/2, +1/2
wat bedoelen we met het onzekerheidbeginsel van Heisenberg
hij toonde aan dat het onmogelijk is om gelijktijdig de plaats en de snelheid van een elektron te kenne
wat is een orbitaal
dit is de grafische voorstelling van een waarscheindlijkheid (probalitie) noemt men een orbitaal
een orbitaal is dan een ruimteijk gebied waarin het elektron 90% van zijn tijd doorbrengt
geef weer wat de 4 kwantum getallen uit drukken
4 kwantumgetallen → toestand van het elektron in het atoom
n = hoofdkwantumgetal → energie niveau van het elektron en zijn gemiddelde afstand tot de kern
l = nevenkwantumgetal → vorm van de orbitaal van het elektron
m (met kleine i onderaan) = magnetisch kwantumgetal → de bewegingsrichting van het elektron
m (met kleine s onderaan) = spinkwantumgetal → de draaizin van het elektron rond zijn eigen as
leg meer uit over het hoofdkwantum getal n
het hoofdkwantumgetal n bepaalt de enrgie-inhoud van het elektron en zijn gemiddelde afstand tot de kern, dit komt overeen met de schillen van Bohr
n kan alleen gehele waarden aanemen dit wil zeggen alleen waarde groter dan 0
de kleinste waarde van n stemt overeen met het laagste energie-niveau, het elektron bevind zich dan het dichtse bij de kern
een elektron met een groter hoofdkwantumgetal heeft een grotere energie-inhoud en hoort dus thuis verder van de kern gelegen
leg meer uit over het nevenkwantumgetal I
I kan alle gehele waarden aannemen begrepen tussen 0 en n -1
het nevenkwantumgetal bepaalt de vorm van de orbitaal
een orbitaal waarvoor I = 0 is bolvormig en symetrisch verdeeld rond de centraal gelegen kern
zoon bolvormig orbitaal word ook wel een s-orbitaal genoemd
wanneer I = 1 kan de vorm van het orbitaal vergeleken worden met een 8, dit noemt men een haltervormige orbitaal of de p-orbitaal
wanneer I = 2 of 3 stemmen de orbitalen overeen met een meer ingewikkelde structuur, deze noemen we de d-orbitalen en de f-orbitalen
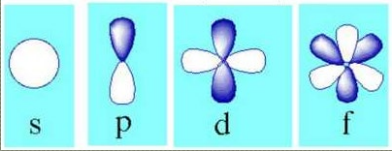
leg meer uit over het megnetisch kwantumgetal m (met een kleine i onderaan)
het magnetisch kwantumgetal bepaalt de orientering van de orbitaal tegen over een willekeurige richting
het kan alle gehele waarden aannemen begrepen tussen +I en -I
wanneer I = 0 is er maar 1 mogelijke waarden voor m namelijk 0 → de s-orbitaak kan slechts op één mogelijke manier in de ruimte georienteerd zijn
wanneer I = 1 zijn er drie orientatiemogelijkheden er bestaan dus op 1 schil drie p-orbitalen
wanneer I = 2 heeft men 5 d-orbitalen
wanneer I = 3 heeft men 7 f-orbitalen
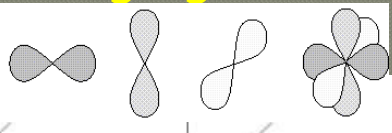
leg meer uit over het spinkwantum getal m (met een kleine s onderaan)
het spinkwantumgetal is onafhankelijk van de andere kwantumgetallen
dit getal kan slechts twee verschillende waarden aannemen: + 0,5 of - 0,5
de spin rond zijn eigen as kan slechts in twee verschillende (tegengestelde richtingen) gebeuren
wanneer twee elektronen hetzelfde spinkwantumgetal hebben word er gezegd dat ze dezefde spin hebben (twee pijltjes naar boven)
twee elektronen met een tegengestelde spin duid men aan met een pijl naar boven gevolgd door een pijl naar onder
wanneer elektronen dezelfde spin hebben stoten de magnetische velden elkaar af, elektronen met een tegengestelde spin trekken elkaar aan
wat bepalen de 4 kwantumgetallen
de toestand van een elektron in een atoom is volledig bepaald door de 4 kwantumgetallen n, l, m i, ms
wat stelt het uitsluitingsprincipe of de verbodsregel van pauli
hij zegt dat er in eenzelfde atoom nooit twee elektronen kunnen voorkomen met dezelfde waarden van de vier kwantumgetallen
welke belangrijk besluit kan pauli concluderen
hij kan concludere dat eenzelfde orbitaal maximum twee elektronen kan bevatten, deze elektronen hebben bovendien een tegengestelde spin
wat is een elektronenpaar of doublet
dat is wanneer twee elektronen in een zelfde orbitaal (of ladingswolk) liggen
wat is een ongepaard elektron
dat is wanneer een elektron alleen de ruimte van de orbitaal in beslag neemt
wat geeft het uitsluitingsprincipe van pauli
het uitsluitingsprincipe van pauli geeft een beperking voor het aantal elektronen op elk energieniveau
wat verstaan we onder de elektronenconfiguratie
onder elektronenconfiguratie van een atoom verstaat men de wijze waarop alle elektronen in een atoom verdeeld zijn
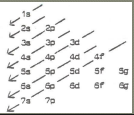
wat word er bedoeld met de regel van de minimale energie
deze regel stelt dat elk atoom streeft naar een zo laag mogelijke energie toestand dat wil zeggen de toestand met een zo laag mogelijke energie-inhoud
de elektronen plaatsen zich zo dicht mogelijk bij de kern
de orbitalen zullen dus volgens stijgende energie worden opgevuld
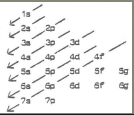
wat word er bedoeld met de diagonaal regel
de regel stelt dat we ons aan het volgende kunnen verwachten: eerst wordt de eerste schil volledig opgevuld met elektronen, dan de tweede en vervolgens de derde….
in eenzelfde schil worden de orbitalen bezet in de volgende volgordes: s,p,d en f
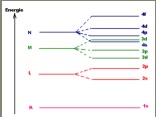
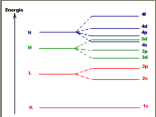
wat is de regel van hund
dat stelt dat in het laatste bezettten subniveau treft men steeds een maximaal aantal ongepaarde elektronen aan, gepaarde elektronen zijn elektronen in hetzelfde orbitaal
de elektronen die zich in gelijksoortoge orbitalen van eenzelfde energieniveau bevinden, hebben zoveel mogelijk dezelfde spin
in eenzelfde reeks van orbitalen van een bepaald niveau zijn de elektronen dus zoveel mogelijk ongepaard en met dezelfde spin
hoe word de elektronenconfiguratie weergegeven
de elektronenconfiguratie van een atoom wordt weergegeven door na elkaar de symbolen van de bezette orbitalen te schrijven
bv 2p tot de 3de → 2 = hoofdkwantum getal
→ 3 = totaal aantal elektronen in de p-orbitale
wat is het opvullingdiagram
het opvullingdiagram is geen energiediagram, het geeft geen inlichting over de energieniveaus na opvulling wel ervoor
wat bedoelen we met stijgende hoofdkwantumgetallen
hierme bedoelen we dat in de vereenvoudigde schrijfwijze van de elektronenconfiguratie na het symbool van het edelgas, de overige orbitalen aanduiden volgens stijgende hoofkwantum getallen
bv kwik (Z = 80)
4d tot 10, 5p tot 6, 6s tot 2, 4f tot 14, 5d tot 10 → (xe) 4f tot 14, 5d tot 10 en 6s tot 2
wat word er bedoeld met inversie
daarm word bedoeld dat in bepaalde gevallen tonen experimenten aan dat de elektronenconfiguratie anders is dan theoretisch verwacht
deze speciale elektronenconfiguratie zijn het gevolg van een extra verlaging van de potentiele energie waarbij een half of een volledig gevuld d- of f- niveau bekomen wordt
inversie komt bij de volgende elementen voor:
Cr
Mo
Cu
Ag
Au
beschrijf welke groepen welke orbitalen krijgen via het periodiek systeem
groep 1 en 2 ( Ia = alkalimetalen en IIa = aardalkalimetalen)
zij behoren tot de s- blok en krijgen het s- orbitaal
groep 3, 4, 5, 6, 7, 8, 9, 10, 11, 12
zij behoren tot de d-blok en krijgen het d-obritaal
groep 13, 14, 15, 16, 17, 18
zij behoren tot de p- blok en krijgen het p-orbitaal
de overblijvende in de aparte blok onderaan de tabel
zij behoren tot de f- blok en krijgen het f- orbitaal
omschrijf hoe het periodiek systeem is ingedeeld
in het algemeen bestaat het uit horizontale perioden en verticale groepen
het groepsnummer komt overeen met het aantal valentie elektronen
het periodiek nummer komt overeen met het aantal schillen waarover de elektronen verspreid zijn (atoomnummer)
de groep waarin een element zich bevind komt overeen met het aantal elektronen op de buitenste schil
de horizontale perioden komen overeen met het aantal schillen
groep 1, 2, 3 zijn positief geladen de rest is negatief geladen
groep 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 zijn altijd metalen
wat zijn valentie elektronen
dat zijn de elektronen in de buitenste opgevulde schil, zij bepalen de chemische eigenschappen van het element
benoem al de groepen die onderscheiden worden in het periodiek systeem
Ia = alkalimetalen
IIa = aardalkalimetalen
IIIa = boorgroep
IVa = koolstofgroep
Va = stikstofgroep
VIa = zuurstofgroep (chalcogenen)
VIIa = halogenen
O = edelgassen
wat word er bedoeld met de stabiele octetconfiguratie
dat is wanneer er 8 elektronen in de buitenste schil zich bevinden
wat betekend inert
dat wil zeggen dat de atomen van een element moeilijk bindingen aangaan met andere atomen
geef voor elk orbitaal het aantal elektronen die er zich op kunne bevinden weer
s- orbitaal bol: 2 elektronen
p- orbitaal halter: 6 elektronen
d -orbitaal: 10 elektronen
f -orbitaal: 14 elektronen
met welke regels moet je allemaal rekening houden bij de elektronenconfiguratie
diagonaal regel
minimale energie
maximale zelfde spin
verbod pauli
inversie
omschrijf de opbouw van een atoom
kern:
neutronen en protonen
mantel:
elektronen en schillen
kijk goed de elektroneconfiguratie na en maak veel oefeingen !!!!!!!