Általános kémia
1/505
Earn XP
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
506 Terms
Mik azok a halmazállapotok?
Egy anyag makroszkopikus és mikroszkopikus tulajdonságaiból adódó állapot.
Szilárd, folyékony, gáz a leggyakoribb.
Milyen mozgásformák jellemzőek az atomokra?
Rezgőmozgás - atomok egymás felé vagy ellentétes irányba mozdulnak
Forgómozgás - atomok egyirányba mozdulnak
Mik a szilárd halmazállapot makroszkopikus tulajdonságai?
Kemény, sűrű (kg/dm3, g/cm3), alaktartó, térfogata állandó, összenyomhatatlan.
Mik a szilárd halmazállapot mikroszkopikus jellemzői?
A rácspontokban részecskék vannak, amelyek nem mozdulnak el, csak rezgőmozgást végeznek.
Mi az elemi cella?
A kristályrács legkisebb jellemző része, amelyet a tér 3 irányába eltolva megkapjuk az egész rácsot.
Mi a koordinációs szám?
A központi atom/ion ligandumjainak száma; minél kisebb, annál keményebb az anyag.
Hány elemi kristályrendszer fordulhat elő a természetben?
7
Mi a kristályhibák szerepe?
Megváltoztatják az anyag mechanikai, elektromos, optikai és kémiai tulajdonságait. Fontosak, például a vas kovácsolásánál.
Hogyan határozható meg a molekula térszerkezete?
Röntgendiffrakcióval.
Mi a polimorf anyag?
Azonos összetételű, de eltérő kristályszerkezetű anyag.
Mi az izomorf anyag?
Eltérő összetételű, de azonos kristályszerkezetű anyag.
Mik a kristályrács típusok növekvő térkitöltés szerint?
Egyszerű köbös
Térben centrált köbös
Lapcentrált köbös
Hexagonális.
Mi az adszorbció?
A molekula felületén megkötődnek a gáz/folyadékrészecskék.
Mik a kristályrács módosulatok?
Molekularács (P4, Ne), atomrács (SiO2, grafén), ionrács (NaCl, CaSO4), fémes rács (Fe, Zn).
Mik a molekularács jellemzői?
Rácspontokban molekulák ülnek, gyenge kölcsönhatás, puha, alacsony olvadáspont, nem vezeti az áramot.
Mik az atomrácsos anyagok?
Rácspontokban atomok, kovalens kötések, kemények, magas olvadáspont, nem vezetik az áramot.
Mik az ionrácsos anyagok?
Rácspontokban ionok ülnek, magas olvadáspont, poláris oldószerekben oldódnak, olvadékuk vezeti az áramot.
Mi a szuperionos rács?
Olyan kristályos szilárd anyag, amelyben az egyik iontípus (általában a kisebb kation) nagy mozgékonyságú, és így az anyag jó ionvezetővé válik, miközben megőrzi szilárd halmazállapotát.
pl.: ezüst-jodid, szilárd test lítium-akkumulátorokban, Na-ionos akkumulátorokban
Mik a fémes rács jellemzői?
Rácspontokban kationok, fémes kötés tartja össze, vezetik az áramot, keménység változó.
Mik a folyadékállapot makroszkopikus jellemzői?
Puhák, nagy sűrűség, összenyomhatatlanok, nem alaktartók.
Mik a folyadékok mikroszkopikus jellemzői?
A részecskék közel vannak egymáshoz, de el tudnak mozdulni egymáson.
Mik a folyadékok jellemzői?
Felületi feszültség, viszkozitás, párolgás.
Mi a felületi feszültség?
Az a kényszerítő erő, amely a folyadék felszínét összehúzza, mivel a felszíni molekulákra a belső molekulák nagyobb vonzóerőt gyakorolnak, mint a külsők.
Mi a felület létrehozásához szükséges munka képlete?
W = γ * A
W - munka
A - felület területe
γ - felületi feszültség
Milyen hatással van a növekvő felületi feszültség a folyékony anyagcseppekre egy szilárd felületen?
Gömb alakot eredményez a folyadékcseppeknek a szilárd felületeken.
Mi a viszkozitás és hogyan változik a hőmérséklettel?
A folyadékrészecskék közötti súrlódás; általában csökken a hőmérséklet növekedésével.
Mi a tixotrópia?
Bizonyos nem-newtoni folyadékok tulajdonsága, ahol a viszkozitás függ az alkalmazott deformáció mértékétől.
Mit mond ki a Clausius-Clapeyron egyenlet?
Azt írja le, hogy a hőmérséklet és a gőznyomás hogyan függ össze a fázisátalakulások során.
Mitől függ egy folyadék forráspontja?
A folyadék gőznyomása megegyezik a külső nyomással
Mi az a túlhevítés a folyadékok esetén?
Akkor fordul elő, amikor egy folyadékot a forráspontja fölé melegítenek forrás nélkül, ami egy metastabil állapotot eredményez.
Mely négy paraméter jellemzi a gázokat?
Nyomás (p), térfogat (V), hőmérséklet (T), és anyagmennyiség (n).
Mi a különbség a gáz és a gőz között?
A gáz szobahőmérsékleten is gáz halmazállapotú anyag. A kritikus hőmérséklet fölött van, így nem cseppfolyósítható, bármilyen nagy is a nyomás.
A gőz olyan anyag légnemű formája, amely szobahőmérsékleten folyékony vagy szilárd. A kritikus hőmérséklet alatt van, így még cseppfolyósítható nyomás hatására.
Endotermikus halmazállapot változások
Olvadás, forrás, szublimáció
Exotermikus halmazállapot vátltozások
Fagyás, kondenzáció, lecsapódás
Mi történik olvadás alatt?
A részecskék rezgésének frekvenciája addig növekszik, amíg a kristályrács egy adott hőmérsékleten fel nem bomlik.
Mi történik forrás közben?
A folyadékot addig melegítjük, amíg a részecskék elegendő energiát nem nyernek ahhoz, hogy gázfázisba kerüljenek.
Mi a szublimáció?
Halmazállapot változás szilárdból gázzá.
Mi az elfogadott jelentése a felületi feszültségnek?
Az egységnyi felület létrehozásához szükséges energia
Mik az intenzív és extenzív állapothatározók?
Az extenzív változók az anyag mennyiségétől függnek (pl. tömeg, térfogat).
Az intenzív változók a környezet adottságaitól (pl. hőmérséklet, nyomás).
Mi különbözteti meg a nyitott és zárt rendszereket a termodinamikában?
A nyitott rendszerek lehetővé teszik az anyag- és energiacserét a környezettel, míg a zárt rendszerek csak az energiacserét.
Mi az egyensúlyi rendszer?
Olyan rendszer, amely egy olyan stabil állapot elérésére törekszik, amelyben a tulajdonságok idővel állandóak maradnak.
Mi a metastabil állapot?
Olyan állapot, amelyben egy rendszer többletenergiát tartalmaz az egyensúlyi állapothoz képest, és viszonylag instabil, könnyen megzavarható.
Mi az állapotegyenlet?
Egy rendszer állapotváltozói közötti kapcsolatot írja le.
Mi a peremfeltételek jelentősége egy rendszer meghatározásában?
Meghatározzák a rendszer határait és kölcsönhatásait a környezetével, ami elengedhetetlen a rendszer jellemzéséhez.
Mi a környezet szerepe termodinamikában?
Minden a rendszeren kívül, ami kölcsönhatásba léphet vele, befolyásolva a rendszer tulajdonságait és viselkedését.
Milyen típusú állapotváltozók léteznek a termodinamikában?
Intenzív és extenzív állapotváltozók
Hogyan definiálják a nyomást a termodinamikában?
Egységnyi területre kifejtett erő.
Milyen eszközöket használunk nyomásmérésre?
Barométert és higany manométert
Hogyan mérik általában a hőmérsékletet?
Hőtáguláson alapuló hőmérők használatával.
Mivel mérhetünk sűrűséget?
Aerométerrel, Mohr-Westphal mérleggel, piknométerrel
Mi az entrópia termodinamikában?
Egy rendszer rendezetlenségének a mértéke
Mi a kötési erők két csoportja?
Elsődleges és másodlagos kötési erők
Mondj példákat az elsődleges kötési erőkre!
Kovalens kötés, ionos kötés, fémes kötés
Mi jellemzi a kovalens kötéseket?
Az atomok kötő elektronpárokat alkotnak egymás között
Mi jellemzi az ionos kötéseket?
Az ellentétes töltésű ionok közötti elektrosztatikus vonzással járnak.
Mi jellemzi a fémes kötéseket?
Delokalizált elektronokat tartalmaznak, amelyek a fématomok rácsán osztoznak.
Mondj példákat a másodlagos kötési erőkre!
Hidrogén kötés és a Van der Waals erő
Mi a hidrogén kötés?
Erős dipólus-dipólus kölcsönhatás, amelyben egy erősen elektronegatív atomhoz kötött hidrogén vesz részt.
Mi a Van der Waals erő?
Molekulák közötti gyenge kölcsönhatások, beleértve a dipólus-dipólus kölcsönhatásokat és a diszperziós erőket.
Mi a termodinamika első törvénye?
Az energiát nem lehet létrehozni se megsemmisíteni, csak átalakítani
Mi a termodinamika második törvénye?
Egy rendszer általában a maximum entrópia felé halad
Mi a termodinamika harmadik főtétele?
Abszolút nulla hőmérsékleten (0 K) egy tökéletes kristály entrópiája nulla.
Mi a fázisdiagram?
Egy anyag fizikai állapotának grafikus ábrázolása változó hőmérsékleti és nyomásviszonyok mellett.

Mit jelez a fázisváltozás egy rendszerben?
A részecskék mozgási lehetőségeinek változása a hőmérséklet változása nélkül.
Mi a jelentősége a szublimációs görbének a fázisdiagramban?
A szilárd és gázfázis közötti egyensúlyt jelképezi.
Mit ábrázol a forráspontgörbe a fázisdiagramon?
A folyadék- és gázfázisok közötti egyensúlyt mutatja.
Mi a gőztenzió?
A folyadékkal egyensúlyban lévő gőz nyomása, amely csak a hőmérséklettől (T) függ, a térfogattól (V) nem.
Mi a metastabil állapot egy rendszerben?
Metastabil állapot akkor áll elő, ha a rendszer nem felel meg a diagram által jelzett fázisnak, mint például a túlhűtött vagy túlhevített folyadékok.
Mi a jelentősége a hármaspontnak a fázisdiagramban?
A hármas pont az, ahol mindhárom fázis (szilárd, folyékony, gáz) egyensúlyban van, és a rendszer szabadságfoka (Sz) 0.
Mi történik egy anyag kritikus pontjánál?
A kritikus ponton a fázishatár eltűnik, ami szuperfolyékony állapotot eredményez, amelyet különböző extrakciós folyamatokban használnak.
Milyen kapcsolat van a hőmérséklet és a fázisállapot között a kritikus pont felett?
A kritikus hőmérséklet felett az anyag nem létezhet folyadékként, a kritikus nyomás felett pedig nem létezhet gázként.
Mi a Gibbs-fázisszabály?
Sz = K - F + 2
Sz - szabadsági fokok
K - komponensek száma
F - fázisok száma
Mi a szuperkritikus folyadékkromatográfia (SFC)?
Az SFC mozgófázisként szuperkritikus CO2-t használ, amely könnyen beállítható tulajdonságokkal rendelkezik, így hatékony elválasztási módszer.
Mi a liofilizáció és mik a tulajdonságai?
Fagyasztva szárítási eljárás, amely megőrzi a biológiai anyagok szerkezetét és lehetővé teszi azok oldhatóságának megőrzését.
Mi az egyedi a 4He fázisdiagramjában?
A 4He fázisdiagramja különleges, mert nincs hármaspontja, és hűtéskor kvantumfolyékony állapotba megy át.
Hogyan viselkednek az ideális gázok a térfogatuk és a részecske-kölcsönhatásaik tekintetében?
Nincs saját térfogatuk; pontszerűek
A részecskék között nincs kölcsönhatás
Mi Avogadro-törvénye?
Azonos hőmérsékleten és nyomáson azonos térfogatú gázok azonos számú részecskét tartalmaznak.
Mi az a négy paraméter, amely az ideális gázokat jellemzi?
Térfogat (V), az anyag mennyisége (n), a hőmérséklet (T) és a nyomás (p).
Mi Boyle-törvénye?
Adott tömegű gáz esetében állandó hőmérsékleten a nyomás és a térfogat szorzata állandó (p1V1 = p2V2).
Mi Gay-Lussac első törvénye?
Adott tömegű, állandó térfogatú gáz esetében a nyomás egyenesen arányos a hőmérséklettel (p1/T1 = p2/T2).
Mi Gay-Lussac második törvénye?
Adott tömegű gáz térfogata állandó nyomáson egyenesen arányos a hőmérséklettel (V1/T1 = V2/T2).
Mi az általános gáz törvény?
pV/T = állandó.
Mi az egyetemes gáztörvény?
pV = nRT, az R az ideális gázállandó
Mi a gázállandó értéke és mértékegysége?
R=8,314 J/(K*mol)
Milyen körülmények között érvénytelenek a gáztörvények?
Alacsony hőmérsékleten és nagy nyomáson érvénytelenné válnak, mert a gázok inkább folyadékként viselkednek.
Mi Dalton-törvénye?
Egy gázkeverék össznyomása egyenlő az egyes gázok parciális nyomásának összegével (P = ΣPi).
Mi az Amagat-szabály?
Egy gázkeverék teljes térfogata egyenlő az egyes gázok térfogatának összegével (V = ΣVi).
Mi a Ramsey kísérlet?
Hidrogén- és nitrogéngázokat azonos nyomáson és hőmérsékleten egy palládiumfal segítségével választják szét, amely a hőmérséklet emelkedésekor átengedi a hidrogénmolekulákat.
Mi történik a molekulákkal, amíg a hidrogén parciális nyomása mindkét oldalon egyenlő nem lesz a Ramsey-kísérlet alatt?
Addig mozognak oda-vissza, amíg el nem érik az egyensúlyt.
Mi az NH3 és a HCl közötti diffúziós kísérlet eredménye?
Ammónium-klorid (NH4Cl) gőzfázisban képződik.
Hogyan határozható meg a diffúziós sebesség a diffúziós kísérletben?
Azzal, hogy megfigyeljük, hol megy végbe a reakció egy adott méretű csőben, ahol a reaktánsok egymástól egyenlő távolságra vannak elhelyezve.
Mi a gáz térfogattágulásának képlete?
V = V0(1 + βΔT), ahol β minden gáz esetében azonos.
Mit határoz meg a β változó a hőmérséklettel kapcsolatban?
Az abszolút nullpontot -273,15°C-ban határozza meg.
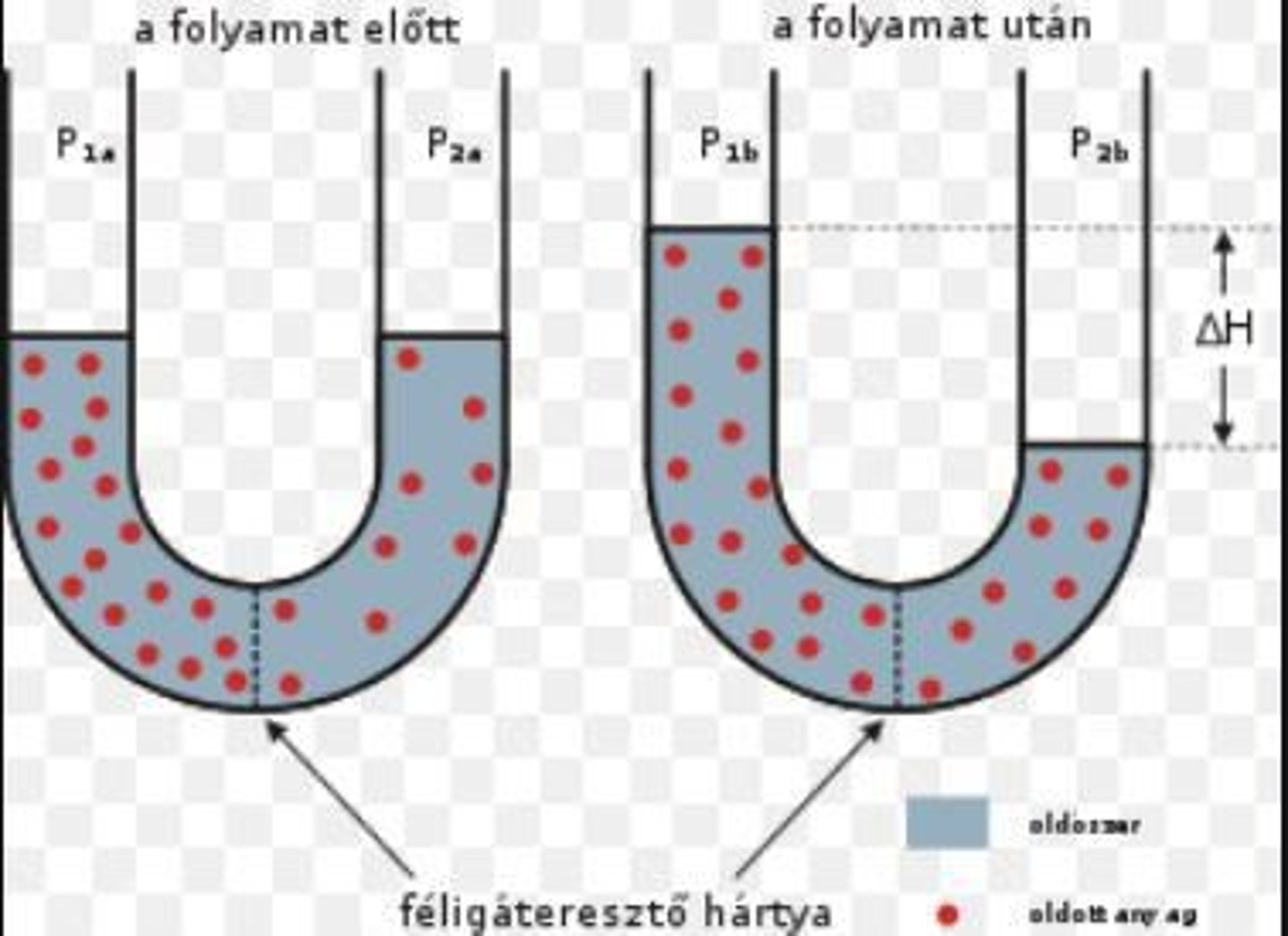
Mekkora egy komponens parciális nyomása egy gázelegyben?
Az a nyomás, amelyet akomponens gyakorolna, ha egyedül foglalná el a teljes térfogatot.
Mi a parciális nyomás definíciója?
Az a térfogat, amelyet egy komponens egy adott nyomáson és hőmérsékleten önmagában elfoglalna.
Mi a Gibbs-féle fázisszabály kétkomponensű keverékekre?
Sz = 4 - F
Sz - szabadságfokok száma
F - fázisok száma.
Milyen típusú fázisai lehetnek a folyékony keverékeknek?
Lehetnek egyfázisúak vagy kétfázisúak, az alkatrészek polaritásától függően.
Mikor tekinthető egy keverék oldatnak?
Amikor az oldószer sokkal nagyobb mennyiségben van jelen, mint az oldott anyag.
Mi a Raoult-törvény?
p(kev) = p1x1 + p2x2,
amely a komponensek gőznyomását a móltöredékükhöz viszonyítja.
Mit jelent a gőznyomás kifejezés a Raoult-törvényben?
A gőz által a folyékony vagy szilárd fázisával egyensúlyban lévő gőz által kifejtett nyomásra utal.