terapi-GABA, glutamat og eplepsi
1/34
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
35 Terms
Hva er GABA?
Signalstoff i CNS som reduserer aktiviteten til nerveceller
Når GABA binder sine reseptorer, åpnes ionekanaler som slipper inn kloridioner eller slipper ut kalium. Det gjør at det blir mindre sannsynlig å sende et aksjonspotensial
→ demper dermed hjernens aktivitet og virker beroliggende
Hva er glutamat
Aminosyrebasert signalstoff som øker aktiviteten til nerveceller i CNS
Når glutamat frigjøres og binder reseptorer, åpnes ionekanaler som slipper inn Na+ og kalsium som gjør at nervecellen lettere fyrer et aksjonspotensial
→ aktiverer signaler
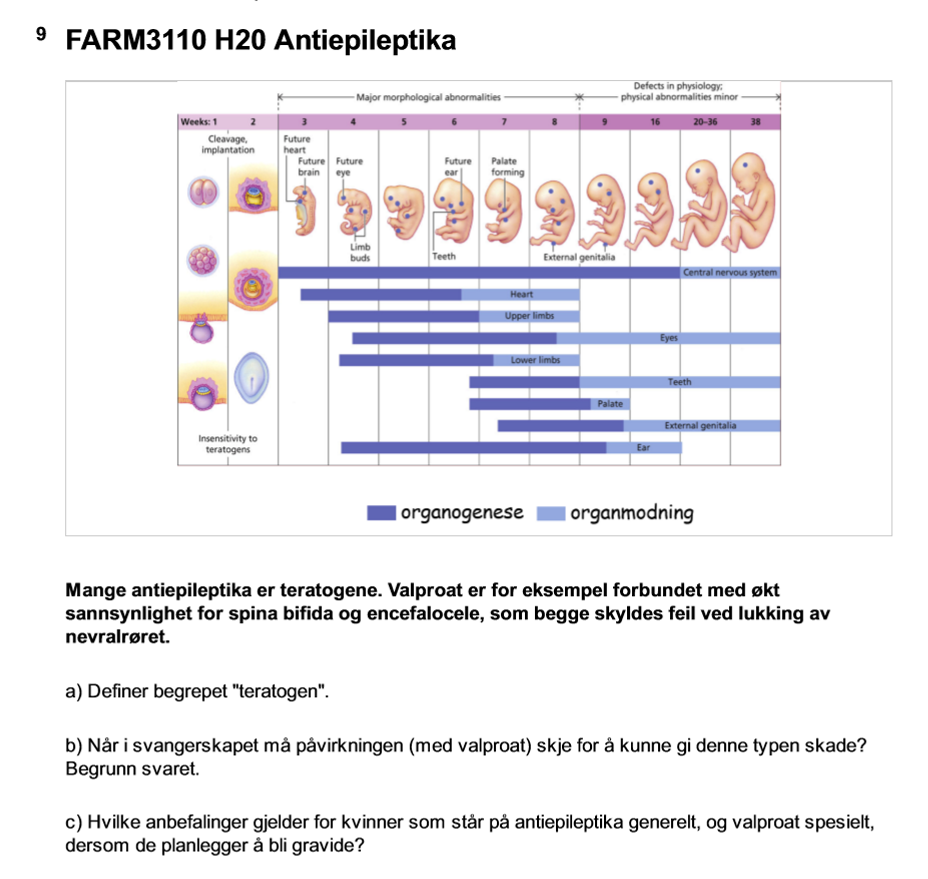
a) En teratogen er et legemiddel, kjemikalie eller annen påvirkning som kan forårsake struktur- eller funksjonsfeil hos fosteret når eksponering skjer under svangerskapet. Teratogene effekter oppstår særlig når organer er i utvikling, og kan føre til misdannelser, veksthemming eller nevrologiske skader
b)
Valproat kan føre til feil lukking av nevralrøret. Nevralrøret lukkes i uke 3–4 av embryoutviklingen. Dermed må eksponeringen skje svært tidlig i svangerskapet, ofte før kvinnen vet at hun er gravid. Dette skyldes at organogenesen, spesielt CNS utvikling, skjer i første trimester og er svært sensitiv for teratogene påvirkninger. Det betyr at bruken av valproat ved første trimester gir disse skadene
c)
Generelle anbefalinger for alle antiepileptika
Planlegging av graviditet bør skje i samråd med neurolog ca 3 måneder før planlagt graviditet
Vurdering av om kvinnen kan bruke et mindre teratogent alternativ (eks. lamotrigin eller levetiracetam)→ følge evt seponeringsprosesser
Monoterapi bør tilstrebes (én medisin fremfor kombinasjon).
Bruke lavest mulig effektive dose.
Tilskudd av folat (≥ 4 mg/dag) før og under tidlig graviditet for å redusere risiko for nevralrørsdefekter.
Tett oppfølging med blodprøver og ultralyd.
Spesifikke anbefalinger for valproat: Valproat bør unngås hos kvinner i fertil alder, og brukes kun dersom ingen andre alternativer gir tilstrekkelig anfallskontroll.
Dersom kvinnen må bruke valproat:
Hun må få informasjon om høy teratogen risiko (opptil 10 % misdannelser, 30–40 % utviklingsforstyrrelser).
Det kreves et pregnancy prevention programme, inkludert sikker prevensjon.
Ved graviditetsønske skal det gjøres snarlig overgang til sikrere alternativ hvis mulig.
Høydose folsyretilskudd anbefales→ 10x vanlig døgndose
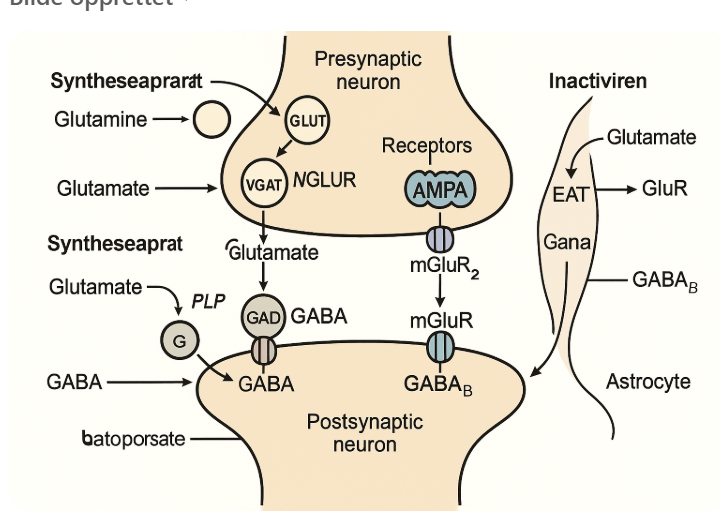
Hvordan er syntesen av glutamat?
Glutamin blir til glutamat presynaptisk i cytosol
Pakkes inni vesikler (VGLUT) som er vesikulære glutamattransportører
Postynaptiske reseptorer:
Ionotrope reseptorer- rask signaloverføring
AMPA- Slipper inn Na+→ rask depolarisering
NMDA- Slipper inn Ca2+ og Na+. Har en Mg+ blokk som må fjernes ved depolarisering (sammen med AMPA-aptivitet)
Kainatreseptorer- mindre vanlige
Metabotrope mGlu:
G- Proteinkoblede
1 og 5 er aktiverende
Presynaptiske:
MGlu 2/3→ autoreseptorer som registrerer når det er for mye glutamat som gjør at det binder tilbake presynaptisk→ mindre vesikkelfrigjøring
GABA syntese?
Glutamat blir til GABA men det er behov for vitamin B6
GABA pakkes i VGAT vesikler
Postsynaptiske reseptorer:
GABA_A: ionotrope Cl- kanaler. Når disse aktiveres strømmer klorid inni cellen og gir en rask hyperpolariserende og dermed hemmende effekt
GABA_B: Gi koblet. Aktivering av denne fører til åpning av K+ kanaler og hemming av Ca2+ kanaler som gir en mer langsom inhibisjon
Presynaptiske: GABA_B autoreseptorer. GABA binder disse som reduserer Ca2+ innstrømmning i nerveterminalen som videre hemmer GABA frisetting.
Samspillet mellom AMPA og NMDA reseptorer?
Begge er ionotriope glutamatreseptorer som sitter postsynaptisk
Glutamat binder AMPA: ionekanalen åpnes og Na+ strømmer inn→ rask depolarisering postsynpatisk
Glutamat binder NMDA samtidig: Kanalen er blokkert av Mg2+ ion som stopper ionekanalen→ glutamat alene er ikke nok for å åpne NMDA
AMPA åpner og depolariserer membranen→ positiv spenning skyver mg2+ bort fra NMDA kanalen
NMDA åpnes siden glutamat er bundet→ slipper inn Ca2+ og Na+
Vi pleier å si at NMDA er voltage dependent mens AMPA er ligand dependent
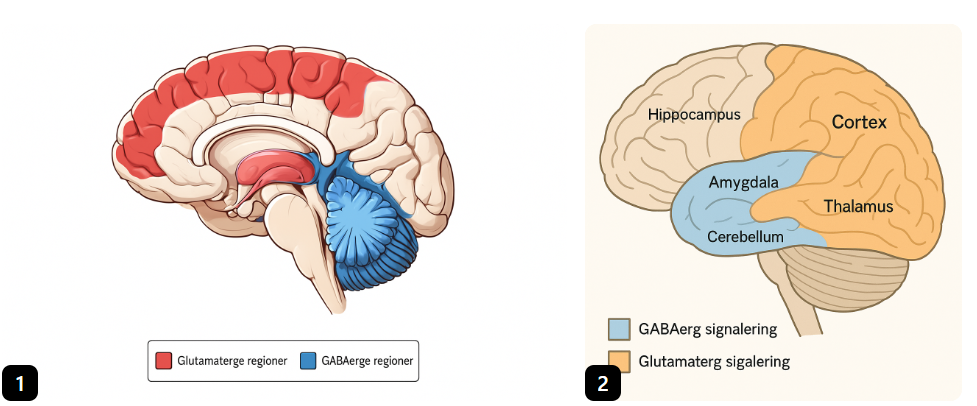
Hvor i hjernen har vi GABAerg og glutamaterg signalering
Glutaminerg signalering finnes over hele hjernen
Dominant i cortex, hippocampus, thalamus og amygdala
GABA: utbredt i hele hjernen som interferoner (lokale hemmede nevroner)
Dominant i cortex, hippocampus, amygdala
Hva er eplepsi
En nevrologisk tilstand der hjernen er overaktiv slik at nerveceller fyrer av i store grupper samtidig
Forstyrret signalisering i hjernen via glutamat/GABA
patiofysiologi eplepsi
Ved epilepsi oppstår det en ubalanse mellom hjernens eksitatoriske og inhibitoriske signaler som gjør nevronene unormalt lett aktiverbare.
På den eksitatoriske siden blir glutamatreseptorene, særlig AMPA- og NMDA-reseptorene, overaktive. Dette fører til økt influks av natrium- og kalsiumioner inn i nevronet, noe som senker terskelen for depolarisering og gjør cellene lettere til å fyre aksjonspotensialer. Dette karakteristiske mønsteret kalles en paroksysmal depolariseringsskift (PDS) og regnes som kjennetegnet på epileptisk aktivitet.
Samtidig er den inhibitoriske GABA-aktiviteten redusert, enten fordi det produseres mindre GABA, fordi GABA-reseptorene fungerer dårligere, eller fordi inhibitoriske internevroner er skadet. Resultatet er at hjernen får mindre «brems» på signaloverføringen, slik at hemmingen av nevronal aktivitet svekkes.
I tillegg kan feil i spenningsstyrte ionekanaler bidra til hypereksitabiliteten. Overaktive natriumkanaler eller langsom inaktivering gjør at nevronene depolariseres for lett og fyrer flere impulser enn normalt, mens underaktive kaliumkanaler fører til forsinket repolarisering, slik at nevronet forblir i en eksitabel tilstand lenger
Hva kan gi eplepsi?
Hjernesvulster
Hjerneskade/arr
Genetikk
Traumer
Diagnostikk av eplepsi
Anamnese- ser på symptomsforholdene og familiehistorikk
EEG- måler hjernens elektriske aktivitet ved hjelp av elektroder plassert på hodebunnen
MR av hjernen- ser etter skader på hjernen
Hva er fokale anfall?
Enkle fokale anfall:
Anfall fra ett avgrenset område i hjernen
Bevisstheten er bevart
Symptomer kan være motoriske (rykninger i én kroppsdel), sensoriske fenomener (prikking, synsfenomener), autonome symptomer eller psykiske opplevelser (f.eks. déjà vu)
Komplekse fokale anfall:
Symptomene varierer med lokasjonen
Bevisstheten er ikke bevart- pasient er borte
Vanlig med automatismer som leppe-smatting, plukking med hendende, stirrende blikk→ etterfulgt av forvirring eller tretthet
Fokale anfall med sekundær generalisering:
Fokalt anfall som sprer seg til begge hemisfærer
Starter fokalt, men ender med bevissthetstap og kramper som ved GTK
Hva er generaliserte anfall?
Starter i begge hemisfærer og bevissthet er alltid påvirket
Absencer- korte episoder med plutselig bevissthetstap i 5-20 sekunder. Pasienten stopper opp, stirrer og mister kontakt. Dette er mest vanlig his barn. De kommer ofte tilbake til normal funksjon som om det ikke har skjedd
Myoklone anfall- Kortvarige, raske rykninger i muskler ofte i skuldre og armer
Atoniske anfall- Plutselig tap av muskeltonus, pasienten kan klappe sammen og bare falle
Generaliserte-toniske-kloniske anfall (GTK)- Starter med bevissthetstap og fall. Starter med en tonisk fase etterfulgt av en klonisk fase
hva er forskjellen på generaliserte og fokale anfall
Fokale:
Starter i et avgrenset område i hjernen, og kan spre seg videre
Bevisstheten kan være bevart eller gå tapt, avhengig på hvor anfallet starter
→ starter i ett sted på hjernen
Generealiserte:
Har ingen lokal start og bevisstheten påvirkes alltid
Kan oppstå i flere typer
Kan ikke beskrives med en "start i høyre/venstre" eller en bestemt kroppsdel – hele nettverket aktiveres samtidig
→ starter overalt samtidig
Hva er generaliserte-toniske-kloniske anfall (GTK)
Anfall som starter samtidig i begge hjernedeler→ gir et forløp med en tonisk fase etterfulgt av en klonisk fase. Pasienten mister alltid bevisstheten i starten av anfallet
Tonisk fase: Hele kroppen blir stiv og musklene kontraherer kraftig. Fører til spontan bevisstløshet og ofte kortvarig pustestopp fordi respiratoriske muskler låser seg. Pasient blir blek og får blå lepper og hud pga manglende oksygentilførsel. Pupillene blir store, og både puls og blodtrykk stiger som følge av et kraftig sympatikusaktivering. Varer i ca 10-20 sekunder
Klonisk fase: Rytmiske, symmetriske rykninger i armer og bein. Pusten kommer gradvis tilbake og pasienten får ofte rød hudfarge pga økt blodgjennomstrømmning når pust kommer tilbake. Varer lenger enn tonisk fase
Når rykningene opphører, går pasienten inn i en postiktal fase med tretthet, forvirring, hodepine og behov for søvn.
Hvordan håndterer man et GTK anfall?
Hovedmål: ivareta sikkerhet og forhindre skade. Være rolig og observere
Man tar tiden, samtidig som man sørger for at personen ikke skader seg. Det kan være greit å beskytte hode mot støt. Man skal aldri holde pasienten fast eller putte noe i munnen. Anfallet må gå sin naturlige gang uten å gripe inn unødvendig. Hvis det varer mer enn 5 minutter eller flere anfall som kommer tett uten at pasienten får bevisstheten imellom kan det spre seg til status eplepticus og da må 113 ringes
Etter krampene er stoppet→ sikre for frie luftveier. Pasienten legges i sideleie for å hindre aspirasjon av spytt og oppkast. Vanlig med tung tretthet, hodepine, forvirring
Hva er status eplepticus?
Akutt livstruende tilstand der epleptisk anfall varer for lenge eller at anfallene kommer så tett at personen ikke rekker å gjenvinne bevisstheten mellom dem.
Det skjer når:
Anfall varer lenger enn 5 minutter
Flere anfall etter hverandre uten at pasienten våkner mellom dem
→redusert oksygen til hjernen, kan være dødlig
Hvilke behandlinger har vi for eplepsi?
Rådgivning og tilrettelegging
Legemiddelbehandling: Anfallsforebyggende og anfallsskuperende
I tillegg:
Kirurgisk ved fokale
Psykologisk/psykiatrisk
Andre/nyere som eks vagus stimulering
Virkningsmekanismer for antiepleptika?
Demper epleptiske anfall ved å redusere neurones eksitabilitet eller øke den inhibitoriske signaliseringen i hjernen:
Hemme eksitasjon ved å påvirke glutamatsystemet. Blokkere postsynaptisk AMPA- eller NMDA-reseptorer, som normalt fomidler glutamat.
Hemme spenningstyrte Ca2+ kanaler, som reduserer glutamatfrisetting
Aktivere presynaptiske glutamatreseptorer som hemmer videre glutamatfrigjøring
Stabilisere nevronmembranen: forlenge spenningstyrte Na+ kanaler slik at nevronet ikke kan fyre repetivt i raske serier→ demper spredningen av epleptisk aktivitet
Styrke GABA ved å øke syntesen, hemme nedbrytningen, hemme reopptaket eller forsterke effekt på reseptorene→ Økt GABA-aktivitet fører til økt Cl⁻-innstrømning og dermed hyperpolarisering av nevroner, som gjør dem mindre tilbøyelige til å fyre aksjonspotensialer.
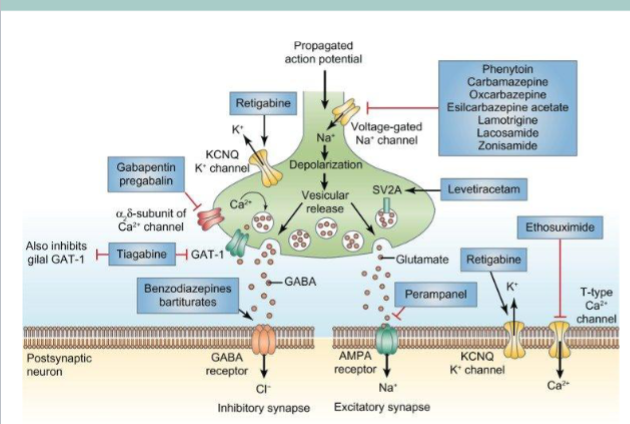
Hvilke førstegenerasjons antiepleptika har vi?
Fenobarbital- Binder barbituratsetet på GABA_A reseptoren→ forlenger åpningstiden til Cl- kanalen
Fenytoin-Hemmer spenningstyrte Na+ kanaler→ stabililserer nevronmembranen
Karbamazepin-Hemmer spenningstyrte Na+ kanaler→ reduserer repetitiv aksjonspotensialfyring
Valproat- Har flere virkningsmekanismer
Hva er valproat
Bredtspektret og har flere mekanismer:
Øker GABA ved å øke syntesen og hemme degraderingen
Hemmer spenningstyrte Na+ kanaler
Hemmer Ca2+ kanaler
indikasjoner: fokale, generaliserte, bipolar lidelse
konsekvens: Levertoksistet, Svært teratogent og kontraindisert for fertile kvinner
Andregenerasjons antiepeleptika
Lamotrigin- Hemmer Na+ kanaler og forlenger inaktiveringsprosessen.
Hemmer spenningstyrte Na+ preterminalt som er nødvendig for Ca2+ innstrømmnin→ hemmer frisetting av glutamat
Indikasjoner: Fokale og generaliserte, bipolar lidelse
Bivirkninger: mild seditasjon, svimmelhet
Gabapentin- binder Ca2+ kanaler → reduserer glutamatfrisetting
Indikasjoner: fokale
Vigabatrin- Irreversibel hemming av GABA transaminase→ fører til mer GABA
Okskarbazepin- Hemmer spenningstyrte Na+ kanaler
Fokale
Perampanel- AMPA antagonist
Indikasjoner: fokale og generaliserte
Hvordan velge det riktige antiepleptikum?
Vil få fullstendig anfallfrihet→ ser om man er preet av fokalt eller generalisert anfall
Må ikke bare være ett LM, selvom det er anbefalt
De fleste oppnår anfallsfrihet ved passende behandling med anfallsforebyggende legemidler, men 30% av pasientene har refraktær eplepsi
Alle antiepleptika er klassifisert som spesielt trafikkfarlig
Første valg ved generaliserte anfall
GTK- valproat, lamotrigin
Absenser- valproat
Myoklonier- valproat, levetriacetamin
Atoniske- valproat
2 valg ved generaliserte anfall
GTK- levetiracetamin
Absenser- lamotrigin
Myoklonier- lamotrigin
Atoniske- lamotrigin
Førstevalg ved fokale anfall
lamotrigin, levetiracetamin, oxkarbamezepin
Karbamazepin, valproat
Hva er refraktær eplepsi
Tolerer mer enn 2 LM
Blir ikke anfallsfri
Kontroll ved eplepsi
Blodprøver→ for å finne riktig dosering
Effekt og bivirkninger
Kontroll 1-2 ganger i året
Hvilke forhold må tas til gravide damer?
Medfødte misdannelser (inkludert nevralrøsdefekter)
Svangerskap bør planlegges nøye
Monoterapi i lavest mulig effektive dose
Valproat er kontraindisert → gir effekt i første trimester fordi periden er mest sårbar for fosteret
Anbefales folsyre i høy dose 10x anbefalt døgndose→ anbefales tilskudd av vitamin D og K
Psykososiale konsekvenser av eplepsi
Førerkort- anfallsfri i 1 år
Fare for avisning/stigma
Restriksjoner

GTK- Valproat→ Øker GABA-aktivitet (hemmer GABA-nedbrytning + øker GABA-syntese) og hemmer spenningsstyrte Na⁺-kanaler → reduserer nevronal eksitabilitet
Fokale- Lamotrigin→ Hemming av spenningsstyrte Na⁺-kanaler → stabiliserer nevroner og hindrer repetitiv firing
Absencer- Etosuksimid→ Hemming av T-type Ca²⁺-kanaler i thalamus → stopper de rytmiske utslagene som gir absensanfall
Myoklone- levetiracetam→ Binder til synaptisk vesikkelprotein SV2A → reduserer glutamatfrigjøring og stabiliserer synaptisk aktivitet
Status eplepticum- Diazepam → Forsterker GABA_A-reseptor-aktivitet ved å øke frekvensen av Cl⁻-kanalåpning → rask og kraftig antiepileptisk effekt

a)
Forbedring av GABA
Hemming av Na+
Hemming av Ca2+
b)
Forbedring av GABA- Benzodiazepiner, vigabatrin
Hemming av Na+→ lamotrigin, karbamazepin
Hemming av Ca2+→ Valproat, gabapentin
c)
Valproat virker ved å øke konsentrasjoner av GABA ved både å hemme metabolismen og øke syntesen. Valproat kan også blokkerer nevroal eksitabilitet, spesielt høy aksjonspotensialfrekvens, ved å hemme spenningsavhenige natriumkanaler. Hemming av natriumstrømmer foresaker repolarisering av membranen. Et annet eks på et antiepleptika som virker for å øke GABA aktiviteten og også hemmer natriumkanaler er Fenobarbital
Et annet antiepleptikum med flere virkningsmekanismer er lamotrigin som er med på å forlenge inaktiveringsprosesen i natriumkanaler samt hemme utskillelsen av glutamat ved å hemme natrium
d)
Eks:
Vigabatrin- sedasjon, humørsvingninger, av og til psykose
Valproat- kvalme, hårtap, vektøkning, fostermisdannelser
Karbamazepin- sedasjon

De viktigste nevrotransmitterne som er involvert i epilepsi er glutamat og GABA. Glutamat er den fremste eksitatoriske transmitteren i CNS og aktiverer reseptorer som NMDA, AMPA og kainat. Overaktiv glutamatsignalering fører til økt nevronal fyring og kan utløse epileptiske anfall. GABA er den viktigste inhibitoriske transmitteren. Nedsatt GABA-erg hemming (f.eks. redusert GABA-syntese, frigjøring eller reseptorfølsomhet) gjør nevronene mer eksitable og øker risikoen for anfall.
Farmakologisk behandling av epilepsi retter seg derfor mot å hemme eksitasjon eller styrke inhibisjon i CNS. De viktigste angrepspunktene er:
Hemming av spenningsstyrte Na⁺-kanaler
→ stabiliserer nevronmembranen og reduserer repeterende aksjonspotensialer.
Eksempler: karbamazepin, lamotrigin, fenytoin.Hemming av spenningsstyrte Ca²⁺-kanaler
→ spesielt T-type Ca²⁺-kanaler i thalamus ved absensanfall.
Eksempel: etosuksimid.Forsterkning av GABA-erg nevrotransmisjon
Økt GABA_A-reseptoraktivitet (benzodiazepiner, barbiturater)
Økt GABA-konsentrasjon ved hemming av nedbrytning eller økt syntese (valproat)
→ fører til økt inhibitorisk signalering.
Reduksjon av glutamatfrigjøring / synaptisk eksitasjon
→ stabilisering av synaptisk overføring.
Eksempel: levetiracetam (binder SV2A), topiramat (AMPA-hemming).
Samlet reduserer disse mekanismene nevronal hyperaktivitet og hindrer synkronisert firing som ligger til grunn for epileptiske anfall.
Terpianbehandling ved fokale anfall? Fremgangsmåten for å bytte fra det ene til det andre?
Førstevalg og andrevalg ved fokale anfall
Fremgangsmåten: Nedtrappningsplan i det du skal bytte og opptrappningsplan i det nye du skal starte på
Antiepleptika med andre indikasjoner
Lamotrigin: Bipolar lidelse og eplepsi
Gabapentin: Nevropatisk smerte og eplepsi
Diazepam: Antiepleptisk og Angst/uro