Exam chimie 1
1/44
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
45 Terms
Comment savoir si une substance se sépare en ions dans l’eau ou autre molécule polaire
si c un métaux+non métaux ou une de c deux composantes suivantes est un ion polyatomique
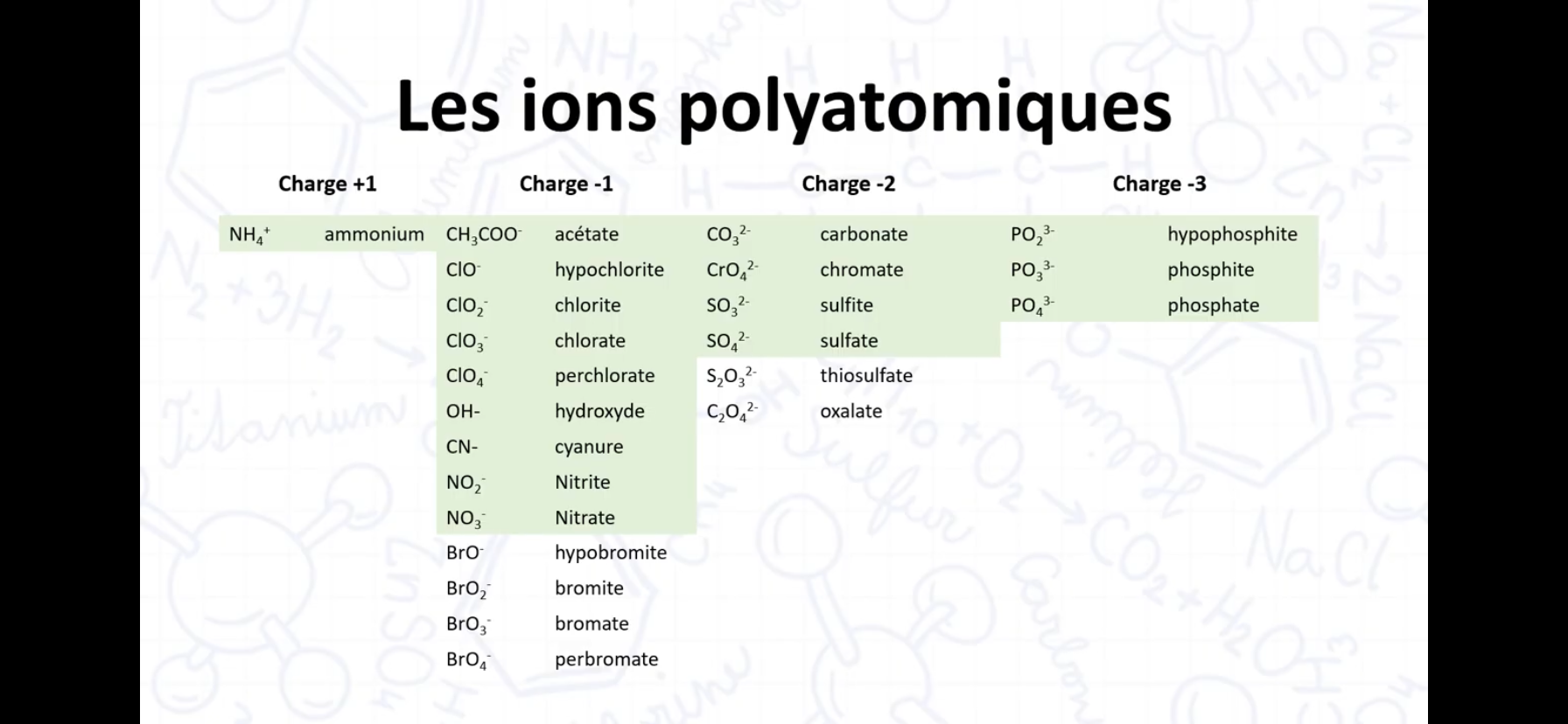
Donne tout les ion polyatomique et leurs noms
Quel type de soluté donner des électrolyte
Les sels
Est ce que une substance doit être dissociée pour être soluble
Non
Une substance devient aqueuse quand ?
Quand elle est en dissolution avec de l’eau
Dissolution vs dissociation
La dissolution est le processus par lequel une substance (le soluté) se disperse uniformément dans une autre substance (le solvant) pour former une solution homogène. ;
La dissociation est la séparation d’une substance en ions lorsqu’elle se dissout dans un solvant (souvent l’eau).
Vrai ou faux: Toute dissociation est une dissolution, mais toute dissolution n’est pas une dissociation.
Vrai
Définition de miscible
Deux liquide sont miscibles lorsqu’elles peuvent se mélanger complètement en toute proportion pour former une seule phase homogène.
Comment savoir si deux substance sont miscible?
Molécule polaire avec une autre polaire
molécule non polaire avec une autre non polaire
Quelle sont les 2 conditions pour avoir des pont H
une des molécules doit avoir au moins un H liée à un atome: F, O ou N
L’autre molécules doit avoir un doublet libre sur F, O ou N
Quelle type de molécule peuvent faire des pont H
Molécule polaire avec une autre polaire
Comment savoir si une molécule est polaire
1- Les liaisons ont une différence d’électronégativité
et
2- Molécule asymétrique → les dipôles s’additionnent
Comment savoir si les liaisons dans une molécule ont une différence d'électronégativité
Plus qu’un élément est en haut à droite du tableau périodique, plus il est électronégatif
Comment savoir si une molécule est symétrique ou asymétrique
Si le centre géométrique des charges partielle + et - sont à la même place, alors c’est symétrique. L'inverse si il ne sont pas à la même place. Ce centre géométrique est trouvé selon la géométrie de la molécule
Comment déterminer la géométrie d’une molécule
se fier au schéma de Lewis pour trouver la forme de répulsion et ensuite enlevé les doublet non liant si il y en a pour trouver la géométrie de la molécule
Comment savoir quelle est l’atome au milieu dans une molécule
L’atome le moins électronégatif, sauf les H qui sont toujours à l’extérieur
Quelle est la méthode pour le schéma de Lewis
Savoir le nombre d’électron de valence pour chaque atome
Trouver l’atome central
Répartir les électrons de valence
Faire les liasons
C’est quoi un hydrocarbure
Un hydrocarbure est une molécule composée seulement de :
👉 carbone (C)
👉 hydrogène (H)
solvant polaire dissout substances —— ou ——
solvant apolaire dissout substances ——
solvant polaire dissout substances polaires ou ioniques
solvant apolaire dissout substances apolaires
Y’a t’il un différence de 0,4 ou plus entre C et S et qu’est-ce que sa change
Non, il n’y à pas de charge partielle si ils sont liés
Faut t’il qu’une molécule soit polaire pour faire des pont H
Oui
Pourquoi CH3OH est plus soluble dans l’eau que CH3CH2CH2CH2OH
Car les les liaisons sont C-H sont hydrophobes et la deuxième en a plus, donc interagit moins bien avec l’eau
C’est quoi un composé covalent vs ionique
Composé covalent: Non métaux + Non métaux
Composé ionique: métaux + Non métaux
Comment fonctionne la nomenclature pour les composé covalent
On nomme toujours le dernier atome suivi du préfixe “ure” pour les allogène (pour les autres il y a une nomenclature spéciale), ensuite on dit le premier atome normalement avec un de avant. Il faut rajouter un préfixe si il y a plus qu’un atome par élément.
Donne la nomenclature se P2S5
Pentasulfure de diphosphore
C’est quoi les allogènes
L’avant dernière colonne dans le tableau périodique
Donne la nomenclature de chaque atome suivant si ils sont dernier dans la molécule: Carbone, azote, soufre, hydrogène, phosphore, sélénium, oxygène
Carbure, Nitrure, sulfure, hydrure, phosphure, séléniure, oxyde
Quelle sont les préfixe si il y a plus qu’un atome par élément (1 à 10)
1-Mono ou rien, 2-Di, 3-Tri, 4-Tetra, 5-Penta, 6-Hexa, 7-Hepta, 8-Octa, 9-Nona, 10-Deca
Comment fonctionne la nomenclature pour les composé ionique
On nomme toujours le dernier atome suivi du préfixe “ure” pour les allogène (pour les autres il y a une nomenclature spéciale), ensuite on dit le premier atome normalement avec un de avant. Il faut pas mettre de préfixe si il y a plus qu’un atome par élément. Cependant, si il y a plusieurs degrés d’oxydation pour un atome, on distingue avec les chiffres romains.
Donne les chiffres romains de 1 à 10
I, II, III, IV, V, VI, VII, VIII, IX, X
Comment fonctionne la nomenclature pour les ion polyatomique
De façon générale, on dit le premier atome avec le suffixe “ate” si il y a un oxygène à la fin (Les autres sont uniques et doit être appris par cœur). Ensuite pour un même ion polyatomique, mais avec un ou des oxygène de plus ou de moins sa change de cette façon: -2= Hypo__ite, -1=__ite, ate, +1= Per__ate
Comment fonctionne la nomenclature pour les ion polyatomique + Hydrogène
Préfixe de nombre de H+ Hydrogéno +ion polyatomique.
C’est cette forme juste quand il y a une charge, sinon sa devient un acide
Comment fonctionne la nomenclature pour les acides binaires
Un acide binaire est un H + un non métaux sauf O. Il suffit de dire: Acide + racine du non métaux + hydrique
Donne la nomenclature de HF
Acide fluorhydrique
Comment fonctionne la nomenclature pour les acides d’ion polyatomique
un acide D’ion polyatomique est H + ion polyatomique. On dit : Acide +ion polyatomique, sauf que “ate” devient “ique” et “ite” devient “eux”
Donne la nomenclature de HClO
Acide hypochloreux
Qu’est-ce qui rend une molécule plus soluble qu’une autre, la dissociation en ion ou la formation de pont H?
La dissociation en ion
Quand est-ce qu’une dissolution est exothermique
Les interactions soluté-solvant (ex : eau-ions) formées libèrent plus d’énergie que celle nécessaire pour séparer les particules.
Quand est-ce qu’une dissolution est endothermique
Il faut plus d’énergie pour séparer les particules que celle libérée en formant les nouvelles interactions.
C’est quoi l’énergie de réseau
C’est l’énergie nécessaires lors de la dissolution pour séparer les deux ion, on doit donc fournir de l’énergie, elle est donc associée à une étape endothermique
C’est quoi l’énergie d’hydratation
C’est l’énergie libérée quand les molécules d’eau entourent et stabilisent les ions. Elle est donc toujours exothermique.
Comment savoir si une réaction est endothermique ou exothermique
Regarder qu’elle énergie est plus importante, l’énergie de réseau ou l’énergie d’hydratation.
Comment savoir si une solution est idéale
quand l’énergie de réseau et d’hydratation est égale
De façon générale, les composé ionique sont de quelle forme
Solide
Que peut on garantir quand un composé qui commence avec un métaux et fini par hydrogéno…..
composé ionique