Isomeria
1/30
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
31 Terms
O que é isomeria?
É o fenômeno em que duas ou mais substâncias têm a mesma fórmula molecular, mas estruturas diferentes (e, por isso, propriedades diferentes).
Quais são os dois grandes tipos de isomeria?
Plana (ou constitucional) e Espacial (ou estereoisomeria)
Isomeria plana - principais tipos
Cadeia, Posição, Função, Metameria, Tautomeria
O que é isomeria espacial?
É quando os isômeros têm a mesma fórmula molecular e plana, mas os átomos ou grupos estão organizados diferente no espaço.
Isomeria geométrica (cis-trans ou E/Z): quando ocorre?
Dupla ligação entre carbonos (C=C) sem rotação.
Grupos diferentes ligados a cada carbono da dupla.
Diferença entre cis e trans:
Cis: grupos iguais no mesmo lado da dupla.
Trans: grupos iguais em lados opostos.
Como funciona o sistema E/Z?
E (entgegen) = grupos prioritários em lados opostos.
Z (zusammen) = grupos prioritários no mesmo lado.
Isomeria óptica - o que é?
Quando uma molécula pode desviar a luz polarizada. Isso ocorre se ela for assimétrica (sem plano de simetria).
Quando uma molécula apresenta isomeria óptica?
Quando tem carbono quiral (ligado a 4 grupos diferentes).
Forma enantiômeros (imagem especular não sobreponível).
Isomeria de Cadeia
Acontece quando a estrutura da cadeia carbônica muda. Pode ser normal, ramificada, aberta ou fechada.
Exemplo: butano (cadeia normal) e 2-metilpropano (cadeia ramificada).
Isomeria de Posição
A função química é a mesma, mas muda o lugar da insaturação (dupla ou tripla), de um grupo funcional ou de uma ramificação.
Exemplo: propan-1-ol e propan-2-ol (o grupo OH está em lugares diferentes).
Isomeria de Função
Mesma fórmula molecular, mas os compostos pertencem a funções químicas diferentes.
Exemplo: C₂H₆O → pode ser etanol (álcool) ou dimetiléter (éter).
Isomeria de Metameria
Ocorre quando a posição do heteroátomo (como O, N ou S) muda na cadeia.
Exemplo: etoxietano e metoxipropano (a posição do oxigênio muda).
Isomeria de Tautomeria
É um tipo especial de isomeria de função. Os compostos ficam em equilíbrio entre si, mudando de forma com facilidade.
Exemplo: enol ↔ aldeído ou cetona.
Isomeria Cis
Os grupos iguais ou mais importantes estão do mesmo lado da dupla ligação (C=C).
Isso deixa a molécula mais polar e com ponto de ebulição mais alto.
Isomeria Trans
Os grupos iguais ou mais importantes ficam em lados opostos da dupla ligação.
A molécula fica mais simétrica, geralmente menos polar e com ponto de ebulição menor.
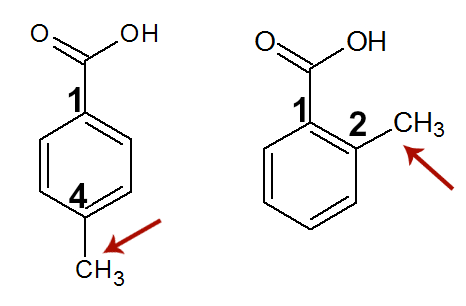
Que Isômero é esse?
Isomeria de posição
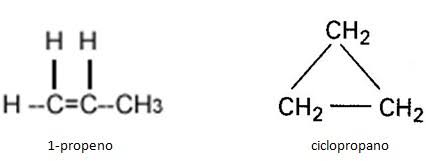
Que Isômero é esse?
Isomeria de Cadeia
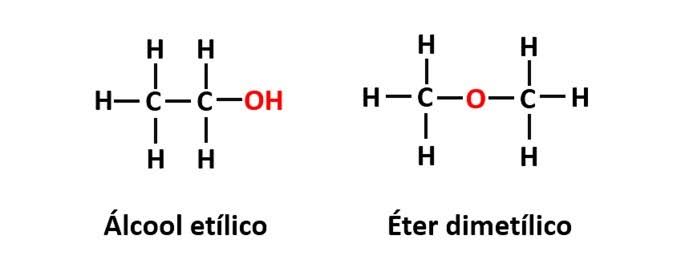
Que isômero é esse?
Isomeria de Função
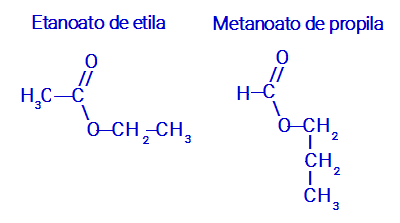
Que isômero é esse?
Isomeria de Metameria
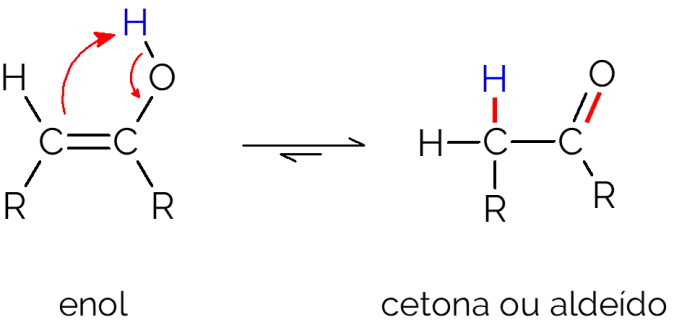
Que isômero é esse?
Isomeria de Tautomeria
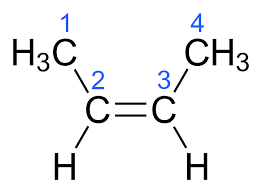
Que isômero é esse?
Isomeria Cis
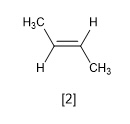
Que isômero é esse?
Isomeria Trans
Carbono quiral
É o carbono ligado a 4 grupos diferentes.
Esse tipo de carbono pode gerar isômeros ópticos (moléculas que desviam a luz de forma diferente).
Isomeria óptica em cadeias cíclicas
Pode ocorrer quando o ciclo tem um carbono quiral ou quando a estrutura não é simétrica.
Ácido segundo Arrhenius
É toda substância que, em água, libera íons H⁺ (ou H₃O⁺).
Exemplo: HCl → H⁺ + Cl⁻
Base segundo Arrhenius
É toda substância que, em água, libera íons OH⁻.
Exemplo: NaOH → Na⁺ + OH⁻
Ácido e base segundo Brønsted-Lowry
Ácido: doa próton (H⁺)
Base: recebe próton (H⁺)
Ácido e base segundo Lewis
Ácido: aceita um par de elétrons
Base: doa um par de elétrons
Aminas de acordo com a basicidade
Elas se comportam como bases fracas, pois o N tem um par de elétrons disponível para aceitar H⁺.
Quanto mais disponível o par de elétrons, mais básica é a amina.
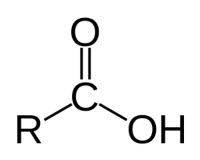
Que grupo funcional é esse?
Ácido carboxílico