Module 1 - Biopharmacie
1/79
Earn XP
Description and Tags
Intro aux sciences biopharmaceutiques
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
80 Terms
Médicaments
substances chimiques utilisées pour le traitement, la prévention ou le diagnostic d’une maladie
augmente la qualité de vie
Molécules Biologiques
vaccine, protéines, anticorps, acide nucléique
masse molaire élevée (plus que 2000g/mol)
manufacturée avec l’aide d’êtres vivants
Petites molécules
masse moléculaire petite (sous 2000g/mol)
manufacturées avec l’aide d’êtres vivants
manufacturées avec l’aide de synthèse chimique
L’industrie pharmaceutique
marché dans l’ordre de multi-milliard
hautement régulé : Santé Canada, FDA
recherche intensive
haut risque
haut profit
Compagnies pharmaceutiques
investissent énormément au niveau de la recherche
découvrent et développent des Nouvelles entités moléculaires
compagnies multinationales à grande échelle
Novartis, Merck, Pfizer, GlaxoSmithKline (GSK), Sanofi, AstraZeneca, Johnson and Johnson, Bristol-Myers Squibb
Compagnies pharmaceutiques génériques
investissement en recherche limité
ne découvrent pas de nouvelles entités moléculaires
manufacturent des produits non protégés par des brevets
très large-moyenne échelle
Teva, Mylan, Sandoz (Novartis), Viatris (Pfizer), Allergan, Apotex, Bausch Health (Valeant)
Compagnies de biotechnologies
établies pour prendre avantage de découvertes académiques récentes
souvent à plus petite échelle
spécialisent en peu de produits spécifiques
Moderna, Amgen, Genentech, Gilead, Vertex, BioNTech, AbCellera
Sociétés de recherche contractuelle (CRO)
fournissent des services spécialisés pour l’industrie pharmaceutique (tests biologiques, synthèse chimique spécialisée, manifacture spécialisée, essais cliniques)
échelle petite-moyenne
IQVIA, Parexel, Convance, WuXi, Albany Molecular, Paraza Pharma, Altasciences
Vente de médicaments au Canada
milliers de produits sont sous licence pour la vente
base de données sur les produits pharmaceutiques (Santé Canada)
Compendium des produits et spécialités pharmaceutiques
Environ 40 nouvelles entités moléculaires (médicaments innovateurs) sont approuvées par année
Entité moléculaire
ingrédient pure
acétaminophène
Produit
matériel contenant l’entité moléculaire
tylenol, sinutab
Coût de développement par nouveau médicament
budget total R et D au dessus de $50 milliards par année
En 2018 - 40% biologiques, 60% petites molécules
Progression de projet
Idée ou découverte
Initiation et étude de faisabilité
Découverte de médicament (1-3 années)
Développement (1-2 années)
Essais cliniques (1-5 années)
Approbation par Santé Canada (6 mois - 1.5 ans)
Mise au Marché/Post-Marché
Médicament candidat
entité moléculaire
identifié après 1-3 années de recherche avec synthèse et évaluation de plus de 5000 nouveaux composés
structures confidentielles
données confidentielles
aucune approbation nécessaire pour la plupart des tests (évaluation d’éthique pour les tests chez les animaux)
aucune approbation externe pour passer au développement
Drogue Nouvelle de Recherche (DNR)
(développement)
applicatio auprès de Santé Canada/FDA pour procéder aux essais cliniques
Données sur la pharmacologie et la toxicité chez les animaux
Informations sur le processus de manufacture
Protocoles cliniques et informations sur les investigateurs (prévient les risques non nécessaires)
Présentation de Drogue Nouvelle (PDN)
application auprès de Santé Canada/FDA pour entrer au march
sécurité du médicament
efficacité du médicament (avantages vs risques)
étiquetage approprié
méthodes de manufacture (reproductible)
Présentation abrégée de drogue nouvelle (PADN)
Application auprès de Santé Canada pour la mise au marché de médicaments génériques
données sur la sécurité et l’efficacité chez les animaux et les humains non requises
Initiation de Projet
compagnies visent des marchés et non les maladies (récupération des coûts R et D importants)
Analyse de marché (quels types de patient)
Évaluation du marché compétitif (premiers = super!, non? faut trouver qque chose pour se démarquer)
Analyse de recherche initiale
Analyse de marché
nombre de clients potentiels
type de clients potentiels
nature de la maladie (aïgue vs chronique)
traitements actuels (coûts, efficacité, sécurité, aise d’utilisation)
Évaluation du marché compétitif
que font les autres compagnies
1er médicament au marché=plus de revenu
2ième médicament au marché= moins de revenu total, moins de dépenses R et D
3ième médicament au marché = moins de profits
4ième médicament au marché= difficulté de récupération des coûts de dév.
avantages et désavantages (eff. des trait.s actuels, coûts actuelles, aise d’utilisation)
Étude de faisabilité
biochimie
peut on résoudre la problématique?
la maladie est elle bien comprise?
mécanismes de la maladie? cibles?
outils biochimiques disponibles (méthodes in vitro vs in vivo)
existe-t-il des traitements?
Études biochimiques
preuve de principe
méthodes d’évaluation du médicament
développement de modèles animaux
Chimie médicinale
petites molécules
modèle candidat
évaluation de l’activité
degré de spécificité
propriétés d’un ‘‘médicament’’ (est il possible d’entrer dans le corps/circulation)
opportunité de brevet (protéger nos données)
chimie possible
Identification d’un composé tête-de-série
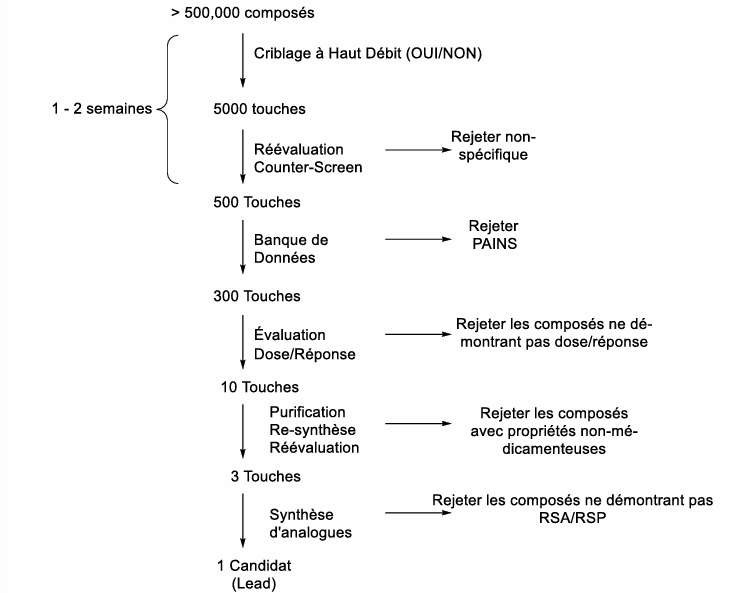
Criblage à haut débit
Conception rationnelle d’un médicament
Produits naturels
Outils (chimie combinatoire, conception de-novo)
Criblage à Haut Débit
milliers de composés sont évalués
compagnies maintiennent de larges collections
requiert des tests biologiques facilement automatisés
robots modernes examinent plus de 200,000 composés par semaine (criblage robotique)
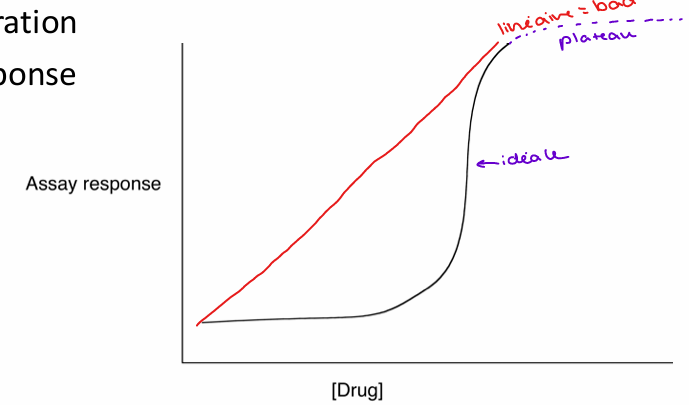
Évaluation du Criblage à Haut Débit
tous les composés sont testés à la même dose (30 microM, évaluation rapide oui/non)
composés évalués un à la fois (résultats clairs par composé)
bonne ronde de criblage génère environ 500 ‘‘hits’’
Hit
touches
composé testant positif dans une ronde de criblage
réagit avec la cible
Les faux positifs
la plupart des ‘‘hits’’ sont faux (impureté, décomposition, réactivité, interférence avec test)
doit éliminer les fausses-touches rapidement
Pan-Assay Interference Compounds (PAINS)
composés bioactifs (multi-cibles, démontrent de l’activité dans la plupart des tests biologiques)
certaines réagissent non spécifiquement avec des cibles biologiques (interférence avec les méthodes de l’analyse
Réévaluation des hits/touches
réévaluation utilisant des échantillons purifiés
évaluation à multiple concentrations (dose-réponse)
évaluation avec dMautres tests disponibles
rejeter les composés multi-cibles (PAINS)
Confirmation de la structure
spectroscopie et synthèse indépendante
plusieurs composés dans les collections sont très vieux (décomposition, incorrectement identifié)
synthétiser, purifier, confirmer la structure et ré-évaluer
évaluer une série de composés avec des structures similaires
Touche-à-Candidat
3 à 6 mois
Médicaments développés via Criblage à Haut Débit
Nevirapine
Gleevec
Quinolones
Avantages: bas coûts à long terms, aléatoire (haute variété structurelle), moins de temps
Désavantafes: haut cout initial, petites molécules (limité pour mol. bio), plus de faux positifs
Produits naturels comme composé tête-de-série
Produits chimiques isolés de plantes, animaux, microbes
Métabolites secondaires
métabolites non directement requis pour la vie
produits par l’organisme pour un rôle secondaire (poison, couleurs, fragrances, hormones, phérémones, modifient l’environnement de l’organisme)
Recherche de Produits Naturels
accumuler un large montant d’un organisme source (plante, micro-organisme, bactéries, fungi)
isoler et purifier les substances démontrant de l’activité biologique
déterminer la structure chimique
confirmer l’activité biologique
utiliser l’information à propos de l’organisme source pour aider la découverte (connaissances des populations locales)
Produits Naturels Candidats
isolés d’êtres vivants (tonnes de matériel brut)
souvent difficile d’entreprendre la modification de structure (RSP)
récemment, laboratoires académiques mènent la recherche
Structures de Produits Naturels
MM élevée
stéréochimiquement spécifique
haute complexit
fragments naturels
Pénicilline, Taxol, Digoxine
Avantages de Produits Naturels
structure adaptée (haute activité et haute spécificité)
bon point de départ (conception rationelle)
connaissances traditionnelles
haute complexité (limite souvent les interactions non spécifiques et par conséquent les effets secondaires)
Désavantages de Produits Naturels
haute complexité (synthèse difficile, difficulté de RSP)
approvisionnement
Médicament produits à l’échelle industrielle
plus de 20,000 tonnes de pénicilline par année
doit être cultivable ou produit avec des méthodes compatibles à l’échelle industrielle
Spongistatine
400kg d’éponge = 13.8mg de spongistatine
un des inhibiteurs de croissance de tumeurs les plus puissants découverts
essais de réisoler le composé échouent
problèmes d’approvisionnement
Conception rationnelle de médicament
conception d’un candidat tête-de-série à partir d’une structure chimique connue (substrat d’enzyme, inhibiteur naturel, ligand pour un récepteur biologique, médicament connu)
mécanisme d’action ou structure de cible connu
conception pour des propriétés améliorées
structures similaires à des substrats naturels, mais moins de complexité et MM plus basse
Avantages de la Conception rationnelle
point de départ
coûts moins élevés (moins de candidats à tester)
plus de spécificité / meilleure activité
Désavantages de la Conception rationnelle
besoin d’un point de départ
nécessite beaucoup de computation (modèles à l’ordinateur)
limité par la cible /structure chimique
peut prendre plus de temps
Chimie combinatoire
synthèse semi-aléatoire de grandes collections de composés similaires (analogues)
test mixtures (académique)
test produits individuel impure (industrie)
sélection Darwinienne
Recherche combinatoire
produire une grande collection de molécules
structures contiennent un motif central commun et des modifications aléatoires (‘‘membres’’)
tester les composés en tant que mixture
‘‘déconvoluer’’ le résultat provenant de la mixture pour identifier les molécules démontrant les propriétés désirables
peu de médicaments découverts via cette méthode
Conception De-novo
utiliser un modèle computationnel (ordinateurs) pour concevoir d’un candidat
requiert la structure 3D d’une cible biologique (structure crystalline par diffusion de rayons X, structure RMN)
commence avec la structure d’une protéine
concevoir d’un modèle du site de liaison
concevoir d’une molécule qui se lie fortement à cette cavité
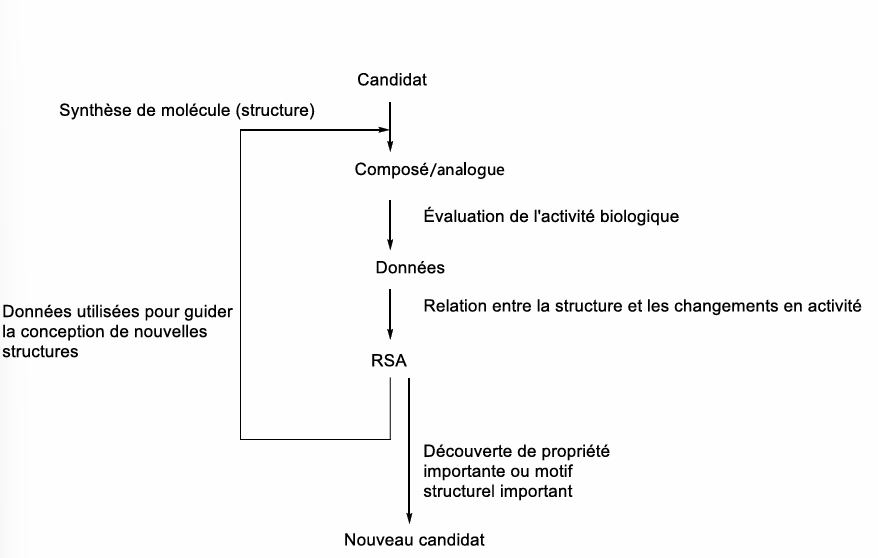
RSA
Relation Structure-Activité
conception d’une nouvelle molécule basé sur la structure du candidat
chimistes: synthèse de la molécule (structure)
biochimistes: évaluation de la molécule (activité)
utilise les résultats pour déterminer la relation entre les modifications à la structure et le changement en activité
nouvelle ronde de conception
RSP
Relation Structure-Propriétés
optimiser plusieurs propriétés simultanément
puissance (concentration/degré de la réponse)
sélectivité (autres cibles?)
solubilité (corps est grandement composé d’eau)
lipophilie (faut pouvoir traverser les membranes)
stabilité chimique (problèmes de distribution)
réactivité acido-basique (estomac acide, autre cibles basique)
susceptibilité au métabolisme (éviter des problèmes d’effet secondaire, susceptibilité aux enzymes métaboliques du foie)
toxicité
aise de la synthèse
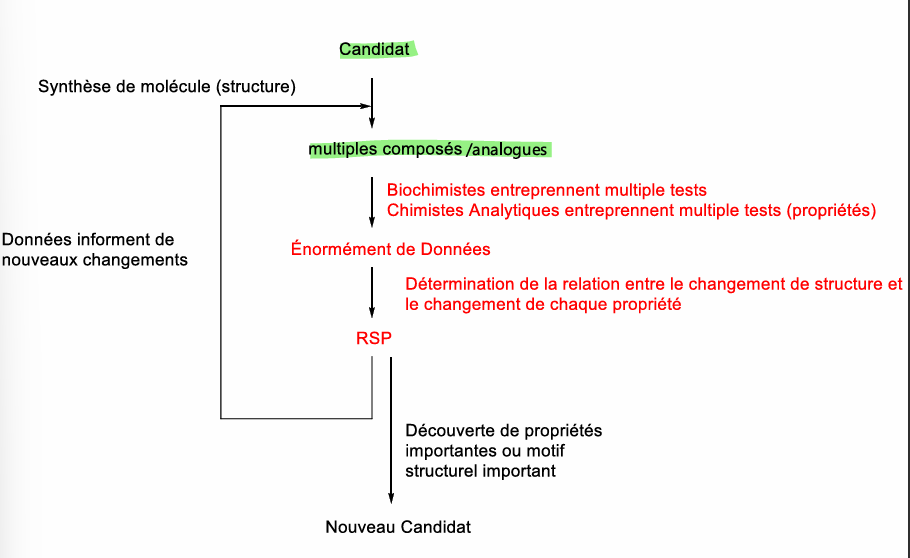
Optimisation de médicament candidat
chimie médicinale
RSA, RSP
effectuer des petits changements à la structure et évaluer l’effet sur l’activité
Le plus grand obstacle
médicament entre dans le corps
focus sur les molécules qui peuvent entrer dans le corps/circulation
Médicament Candidat
résultat final d’une phase de découverte
processus nécessite 1 à 3 ans
compagnies identifient souvent 3 ou 4 composés ‘‘back-up’’
Développement de médicament
développer un candidat en produit
documentation
détermination de sécurité (in vitro et in vivo)
confirmation de l’activité
manufacture à grande échelle
formulation (produit est un mélange de multiples ingrédients pour facilité d’administration et autre)
Documentation et Brevets
domaine de recherche est régulé (risque d’erreurs et de conséquences trop élevé)
toutes les données receuillies sont envoyées à Santé Canada/FDA (système d’entreposage de dossiers et discipline de cahiers de laboratoire)
couverture des brevets (protéger la structure du candidat)
Les Brevets
sont de la propriété intellectuelle
donne le droit de prévenir d’autres entités d’utiliser une idée originale (20 ans au Canada)
processus, machine, produit manufacturé, composition de matière, composé, méthode d’utilisation d’un composé peuvent tous être breveté
lois de la Nature, phénomènes physiques, idées abstraites et algorithmes ne peuvent pas être brevetés
Exigences pour un Brevet
Nouveauté (produit ou découvert pour la première fois)
Utilité (doit être utilisable pour un objectif spécifique)
Non-évidence (personne ‘‘experte’’ ne reconnaît pas immédiatement l’idée)
structure moléculaire, processus de manufacture, mode d’utilisation et nouvelles formulations du médicament peuvent être brevetés
Chimie de procédés
établir une méthode pour la synthèse à grande échelle
transfert de chaleur est le problème majeur
méthodes de purification limitées (cristallisation, distillation)
processus gouverné par Bonnes Pratiques de Laboratoire (BPL/GLP)
Buts de la chimie des procédés
optimiser la synthèse pour le plus bas coût
souvent annoncé comme but respectueux de l’environnement
coûts:
des produits bruts
énergétiques
de l’équipement
de la main d’oeuvre
des déchets
de la sécurité
de transport
Exigences pour la synthèse à grande échelle
fiabilité
rendement, pureté, et profil d’impuretés constant
Évaluation de Sécurité I (in-vitro)
recherche préclinique
utiliser le plus de tests biochimiques possibles
recherche d’un profil ‘‘clean/propre’’ (nombre minimum de résultats positifs)
recherche de ‘‘problèmes majeurs’’ (cancérigène, interférence importante chez le fonctionnement d’un organe)
Évaluation de Sécurité II (in-vivo)
animaux le plus petit possible (requiert moins de médicament)
le moins d’animaux nécessaire (moins d’argent/ressources)
deux espèces, au moins un primate (rats, chiens, primate)
Food and Drug Administration (FDA)
1938
assurer la sécurité de médicaments
essais précliniques chez les animaux maintenant nécessaires
tests de sécurité chez les humains
étiquetage clair et information nécessaire
tests effectués par les compagnies et vérifiés par la FDA
inspections de qualité de manufacture
résultat de la tragédie Sulfanilamide
Méthodes Alternatives
tests in vitro utilisant des cellules humaines/échantillons de tissu humain
modelage 3D computationnel/Tests in silico
imprimerie ‘‘Bio’’
essais cliniques ‘‘phase 0’’ utilisant des microdoses
Formulation
forme du produit final (pilule, liquide, patch, etc.)
Ingrédient Pharmaceutique Actif (IPA) (médicament candidat)
excipients (ingrédients non-médicinaux, empruntés de l’industrie alimentaire, IPA+Excipients = Produit)
Excipients communs
stabiliseurs
préservatifs
remplisseurs
désintégrant
liants
saveurs
couleurs (sécurité)
lubrifiants
Types de formulation
pilules
capsules
liquides
crèmes
patch
liquide injectable (IV)
spray/vaporisateur nasal
gouttes ophtalmiques
suppositoires
Drogue Nouvelle de Recherche (DNR)
composés qui survivent le processus de développement deviennent une DNR
rapport soumis à Santé Canada/FDA pour pouvoir débuter les essais cliniques
beaucoup de documentation nécessaire
Essais cliniques
médicament évalué chez les humains
requiert des milliers de kg
60 à 70% du coût d’un nouveau médicament
3 phrases principales
Essai Clinique à Double Insu
comparer deux groupes de patients (un avec le médicament, un avec un placebo)
placebos ne sont pas utilisé dans des cas de maladies dangereuses ou dans certaines conditions
individu ne connaît pas son groupe
les docteurs ne doivent pas connaître quel traitement qu’un patient reçoit
Code de Nuremberg
1947
participation doit être volontaire
consentement informé
réalisation préalable d’études chez les animaux
avantages l’emporte sur les riques
aucune souffrance
expériences arrêtées si un danger se présente
Régulation Gouvernementale
médicaments, procédures chirurgicales, équipement médical, soin en milieu clinique
régulation de l’expérimentation chez les animax et les humains
FDA et Santé Canada
Phase I
petit nombre de personnes en santé (moins que 100)
sécurité seulement (pas l’efficacité du médicament, identifier les effets secondaires)
trouver la dose maximale sécuritaire
30% des DNR’s échouent à cette étape
requiert moins d’un an
Phase II
petit nombre de patients (200-300)
sécurité et efficacité
établir une dose efficace
70% des DNR’s qui atteignent cette phase sont un échec
requiert moins d’un an ou jusqu’à 2 ans
Phase III
grand nombre de patients (milliers)
sécurité et efficacité«
détermination d’effets secondaires rares
70% des DNR’s qui atteignent cette phase sont un échec
requiert 1 à 4 ans (haut coût)
Présentation de Drogue Nouvelle (PDN)
documents soumis à Santé Canada/FDA pour l’approbation de mise en marché
contient les données d’essais précliniques et cliniques, information concernant la manufacture et le contrôle de qualité et l’information de sécurité (étiquetage)
révision nécessite environ 6 mois à 1.5 années
Mise en Marché
produit de centaines de tonnes par année
continuation de l’évaluation de sécurité (Phase IV) (effets secondaires très rares ou à long terme)
recherche de Nouvelles indications
un petit pourcentage de médicaments existants sont retirés du marché
Médicaments Orphelins
agent pharmaceutique pour une condition rare (moins de 200,000 patients)
présentement plus de 600 entités moléculaires
essais cliniques plus petits
7 années d’exclusivité au marché
crédits d’impôt jusqu’à 25% des coûts de recherche
Santé Canada
tout l’évaluation est effectuée par les compagnies
fournissent toutes leurs données à l’agence régulatoire
inspecteurs vérifient que les données sont à la hauteur des lignes directrices
après l’analyse des données, le médicament est approuvé pour la mise en marché
les compagnies doivent effectuer la surveillance de leurs médicaments
annoncer les problèmes
agence régulatoire effectue des inspections périodiques pour assurer les bonnes pratiques de manufacture
Effets de la Régulation
assure des produits sécuritaires
assure des produits efficaces
fournisse la protection du consommateur
contrôle l’accès
peut augmenter les coûts
peut augmenter les impôts
peut limiter l’accès